https://www.sciencedirect.com/science/article/pii/S0092867411001279
암의 특징은 인간 종양의 다단계 발달 동안 획득한 6가지 생물학적 능력으로 구성됩니다. 특징은 종양성 질환의 복잡성을 합리화하기 위한 조직 원칙을 구성합니다.
여기에는 증식 신호 유지,
성장 억제제 회피,
세포 사멸 저항,
복제 불멸성 활성화,
혈관 신생 유도 ,
침습 및 전이 활성화가 포함됩니다.
이러한 특징의 기저에는 유전자의 획득을 촉진하는 유전적 다양성을 생성하는 게놈 불안정성과 다중 특징 기능을 촉진하는 염증이 있습니다.
지난 10년 동안의 개념적 발전은 이 목록에 잠재적인 일반성의 두 가지 새로운 특징,
즉 에너지 대사 재프로그래밍과
면역 파괴 회피를 추가했습니다.
암 세포 외에도 종양은 또 다른 차원의 복잡성을 나타냅니다.
종양에는 "종양 미세 환경"을 생성하여 특징적인 특성을 획득하는 데 기여하는 표면상 정상인 모집된 세포의 레퍼토리가 포함되어 있습니다.
이러한 개념의 광범위한 적용 가능성에 대한 인식은 인간 암을 치료하는 새로운 수단의 개발에 점점 더 영향을 미칠 것입니다.
본문
소개
우리는 암의 6가지 특징이 함께 종양성 질환의 현저한 다양성을 이해하기 위한 논리적 틀을 제공하는 조직 원리를 구성한다고 제안했습니다( Hanahan and Weinberg, 2000 ).
우리는 종양 관련 기질을 형성하는 모집된 정상 세포를 수동적 방관자보다는 종양 형성의 능동적 참가자로 묘사했습니다.
이후 10년 동안 이 개념은 확고해지고 확장되어 종양의 생물학이 더 이상 단순히 암세포의 특성을 열거하는 것으로는 이해될 수 없으며 대신 "종양 미세 환경"이 종양 형성에 기여하는 바를 포함해야 함을 보여줍니다.
특징적인 기능 - 개념적 발전
암의 6가지 특징(종양 성장 및 전이성 전파를 가능하게 하는 독특하고 보완적인 기능)은 암의 생물학을 이해하기 위한 견고한 기초를 계속 제공하고 있습니다( 그림 1 , 보충 정보 ).
이어지는 섹션에서 우리는 개념화의 범위를 확장하는 새로운 개발에 대해 설명하고 6가지 특징, 두 가지 새로운 특징, 암 표현형에 중요한 종양 미세 환경의 구성 및 신호 상호 작용을 획득하는 데 중요한 두 가지 활성화 특성을 차례로 설명합니다. ,
그리고 우리는 마지막으로 이러한 개념의 치료적 적용의 새로운 영역에 대해 논의합니다.

그림 1 . 암의 특징
이 그림에는 2000년 관점에서 원래 제안된 6가지 특징적인 기능이 포함되어 있습니다.
증식 신호 유지Sustaining Proliferative Signaling
암세포의 가장 기본적인 특성은 만성 증식을 지속하는 능력과 관련이 있습니다.
정상 조직은 세포 성장 및 분열 주기로 진입 및 진행하도록 지시하는 성장 촉진 신호의 생성 및 방출을 신중하게 제어하여 세포 수 의 항상성 을 보장 하고 따라서 정상 조직 구조 및 기능을 유지합니다.
암세포는 이러한 신호를 완화함으로써 자신의 운명의 주인이 됩니다.
활성화 신호는 일반적으로 세포 내 티로신 키나제 도메인을 포함하는 세포 표면 수용체에 결합하는 성장 인자에 의해 대부분 전달됩니다 .
후자는 분지된 세포 내 신호 전달 경로 를 통해 신호를 방출 합니다.
세포 성장뿐만 아니라 세포 주기를 통한 진행을 조절하는 것(즉, 세포 크기의 증가);
종종 이러한 신호는 세포 생존 및 에너지 대사와 같은 다른 세포 생물학적 특성에 영향을 미칩니다.
놀랍게도, 정상 조직 내에서 작동하는 증식 신호의 정확한 정체와 출처는 10년 전에 제대로 이해되지 않았고 일반적으로 그렇게 남아 있습니다.
더욱이, 우리는 이러한 유사분열 신호의 방출을 제어하는 메커니즘에 대해 상대적으로 거의 알지 못합니다.
부분적으로, 이러한 메커니즘에 대한 이해는 세포 수와 조직 내 위치를 제어하는 성장 인자 신호가 한 세포에서 이웃 세포로 시간적, 공간적으로 조절되는 방식으로 전달되는 것으로 생각된다는 사실 때문에 복잡합니다.
이러한 측 분비 신호 paracrine signaling 는 실험적으로 접근하기 어렵습니다.
또한, 성장 인자의 생체이용률은 세포주위 공간과 세포외 기질에서의 격리, 그리고 프로테아제, 설파타제 및 이를 유리시키고 활성화시키는 다른 효소의 복잡한 네트워크의 작용에 의해 분명히 매우 구체적이고 지역화 된 방식으로 조절됩니다.
대조적으로 암세포의 유사분열 신호전달은 더 잘 이해되고 있습니다.
암세포는 여러 가지 대안적인 방법으로 증식 신호를 유지하는 능력을 획득할 수 있습니다.
암세포는 성장 인자 리간드 자체를 생성할 수 있으며, 이에 cognate receptors동족 수용체의 발현을 통해 반응하여 자가분비 증식 자극을 유발할 수 있습니다.
다르게는, 암세포는 다양한 성장 인자를 암세포에 공급함으로써 상호작용하는 종양 관련 기질 내의 정상 세포를 자극하는 신호를 보낼 수 있습니다( Cheng et al., 2008 , Bhowmick et al., 2004).
수용체 신호전달은 또한 암 세포 표면에 표시되는 수용체 단백질 의 수준을 상승시켜 조절을 완화할 수 있으며 , 이러한 세포는 그렇지 않으면 제한적인 양의 성장 인자 리간드에 과민 반응을 보이게 됩니다.
리간드 독립적인 발화를 촉진하는 수용체 분자의 구조적 변경으로 인해 동일한 결과가 발생할 수 있습니다.
성장 인자 독립성은 또한 리간드-매개 수용체 활성화에 의해 이러한 경로를 자극할 필요성을 없애면서 이들 수용체의 하류에서 작동하는 신호 전달 경로의 구성요소의 구성적 활성화로부터 유도될 수 있다.
Somatic Mutations Activate Additional Downstream Pathways
인간 흑색종의 약 40%가 B-Raf 단백질의 구조에 영향을 미치는 활성화 돌연변이를 포함하여 Raf를 통해 미토겐 활성화 단백질(MAP)-키나제 경로로의 구성적 신호 전달을 초래한다는 것을 알고 있습니다
유사하게, 포스포이노시티드 3-키나제(PI3-키나제) 이소폼의 촉매 소단위의 돌연변이가 주요 Akt/PKB 신호 변환기를 포함하여 PI3-키나제 신호 회로를 과활성화하는 역할을 하는 다양한 종양 유형에서 감지되고 있습니다.
Disruptions of Negative-Feedback Mechanisms that Attenuate Proliferative Signaling
최근 결과는 일반적으로 다양한 유형의 신호 전달을 약화시키고 세포 내 회로를 통과하는 신호 흐름의 항상성 조절을 보장하도록 작동하는 음성 피드백 루프의 중요성을 강조했습니다.
이러한 피드백 메커니즘의 결함은 증식 신호를 향상시킬 수 있습니다.
이러한 유형의 조절의 원형은 Ras 종양단백질을 포함합니다.
Ras 의 발암 효과는 신호 전달 능력의 과활성화로 인한 것이 아닙니다.
대신, ras 유전자에 영향을 미치는 발암성 돌연변이는 Ras GTPase 활성을 손상시키며, 이는 일반적으로 활성 신호 전달이 일시적임을 보장하는 본질적인 음성 피드백 메커니즘으로 작동합니다.
유사한 네거티브 피드백 메커니즘은 증식 신호 회로 내의 여러 노드에서 작동합니다.
대표적인 예로 PTEN 인산분해효소가 있는데, 이 인산분해효소는 포스파티딜이노시톨(3,4,5) 삼인산(PIP3)이라는 산물을 해하여 PI3-키나아제에 대항합니다.
PTEN의 기능 상실 돌연변이 는 다양한 암 실험 모델에서 PI3K 신호 전달을 증폭하고 종양 형성을 촉진합니다.
인간 종양에서 PTEN 발현은 종종 프로모터 메틸화에 의해 손실됩니다 ( Jiang and Liu, 2009 , Yuan and Cantley, 2008 ).
또 다른 예는 PI3K 경로의 상류와 하류 모두에 있는 세포 성장 및 대사의 조정자인 mTOR 키나아제 를 포함합니다 .
일부 암세포의 회로에서 mTOR 활성화는 음성 피드백을 통해 PI3K 신호 전달을 억제합니다.
따라서 mTOR가 이러한 암세포에서 약리학적으로 억제되면(예: 약물 라파마이신에 의해) 음성 피드백의 관련 손실로 인해 PI3K 및 이펙터 Akt/PKB의 활성이 증가 하여 mTOR 억제 의 항증식 효과 가 둔해집니다 ( Sudarsanam 및 Johnson, 2010 , O'Reilly et al., 2006).
이 신호 경로와 다른 신호 경로에서 손상된 음성 피드백 루프는 인간 암 세포 사이에 널리 퍼져 있으며 이러한 세포가 증식 독립성을 달성할 수 있는 중요한 수단으로 작용할 가능성이 높습니다.
더욱이, 이러한 자가 감쇠 신호전달의 중단은 유사분열 신호전달을 표적으로 하는 약물에 대한 적응 내성의 발달에 기여할 수 있습니다.
Excessive Proliferative Signaling Can Trigger Cell Senescence
과도한 증식 신호는 세포 노화를 유발할 수 있습니다
발암유전자 작용에 대한 초기 연구는 그러한 유전자의 발현이 계속 증가하고 their protein products단백질 제품에서 나타나는 신호가 그에 따라 증가된 암 세포 증식 및 그에 따른 종양 성장을 초래할 것이라는 개념을 장려했습니다 .
보다 최근의 연구는 RAS, MYC 및 RAF와 같은 종양단백질에 의한 과도하게 상승된 신호전달이 세포로부터 반작용 반응, 특히 세포 노화 및/또는 세포자멸사 유도를 유발할 수 있다는 점에서 이러한 개념을 약화시켰습니다.
예를 들어, 높은 수준의 Ras 종양단백질을 발현하는 배양된 세포는 노화라고 하는 비증식적이지만 생존 가능한 상태로 들어갈 수 있습니다. 대조적으로, 이 단백질의 낮은 수준을 발현하는 세포는 노화를 방지하고 증식할 수 있습니다.
이러한 표면상 역설적인 반응은 본질적인 세포 방어 를 반영하는 것으로 보입니다.
특정 유형의 신호 전달 수준이 지나치게 높은 세포를 제거하도록 설계된 메커니즘. 따라서, 암세포에서 발암성 신호전달의 상대적 강도는 최대 유사분열 자극과 이러한 항증식성 방어의 회피 사이의 절충을 나타낼 수 있습니다 .
또는 일부 암세포는 노화 또는 세포자멸사 유도 회로를 비활성화하여 높은 수준의 발암성 신호 전달에 적응할 수 있습니다.
Evading Growth Suppressors성장 억제제 피하기
긍정적으로 작용하는 성장 자극 신호를 유도하고 유지하는 특징적인 능력 외에도
암세포는 세포 증식을 부정적으로 조절하는 강력한 프로그램을 우회해야 합니다.
이러한 프로그램의 대부분은 종양 억제 유전자 의 작용에 의존합니다 .
세포 성장과 증식을 제한하기 위해 다양한 방식으로 작동하는 수십 가지 종양 억제제가 동물 또는 인간 암의 한 형태 또는 다른 형태에서 특징적인 비활성화를 통해 발견되었습니다.
두 가지 원형 종양 억제제는 RB(망막모세포종 관련) 및 TP53 단백질을 암호화합니다; 그들은 증식하거나 대안적으로 노화 및 세포 사멸 프로그램을 활성화하는 세포의 결정을 제어하는 두 가지 주요 보완 세포 조절 회로 내에서 중앙 제어 노드로 작동합니다.
RB 단백질은 다양한 세포외 및 세포내 소스의 신호를 통합하고 이에 대한 응답으로 세포가 성장 및 분열 주기를 거쳐야 하는지 여부를 결정합니다
따라서 RB 경로 기능에 결함이 있는 암세포 는 지속적인 세포 증식을 허용하는 세포 주기 진행 의 중요한 게이트키퍼의 서비스를 놓치고 있습니다.
RB가 주로 세포 외부에서 발생하는 성장 억제 신호를 변환하는 반면, TP53은 세포의 세포 내 운영 체제 내에서 기능하는 스트레스 및 이상 센서로부터 입력을 수신합니다.
뉴클레오티드 풀, 성장 촉진 신호, 포도당 또는 산소 공급 이 최적이 아닌 경우 TP53은 이러한 조건이 정상화될 때까지 추가 세포 주기 진행을 중단할 수 있습니다.
대안적으로, 그러한 세포 하위 시스템에 압도적이거나 회복할 수 없는 손상을 나타내는 경보 신호에 직면하여 TP53은 세포자멸사를 유발할 수 있습니다.
특히, 활성화된 TP53의 다양한 효과는 복잡하고 상황에 따라 크게 달라지며, 세포 유형 및 세포 스트레스 및 게놈 손상 조건의 심각성과 지속성에 따라 다릅니다.
두 가지 표준 증식 억제제인 TP53과 RB가 세포 증식을 조절하는 데 탁월한 중요성을 갖고 있지만 다양한 증거에 따르면 각각이 기능 중복을 위해 연결된 더 큰 네트워크의 일부로 작동한다는 것이 나타납니다.
TP53 널 마우스 는 정상적으로 발달하고, 대체로 적절한 세포 및 조직 항상성을 보여주며, 나중에 백혈병 및 육종의 형태로 다시 이상을 발생시킨다
Mechanisms of Contact Inhibition and Its Evasion접촉 억제 메커니즘과 회피
40년에 걸친 연구를 통해 2차원 배양에서 증식된 조밀한 정상 세포 집단에 의해 형성된 세포 간 접촉이 작동하여 추가 세포 증식을 억제하여 융합 세포 단층을 생성한다는 것이 입증되었습니다.
중요하게도, 이러한 "접촉 억제"는 배양 중인 다양한 유형의 암세포에서 사라지며, 이는 접촉 억제가 정상 조직 항상성을 보장하기 위해 생체 내에서 작동하는 메커니즘이며, 이는 종양 형성 과정에서 사라짐을 시사합니다.
한 가지 메커니즘은 NF2 유전자 의 산물과 관련이 있습니다.
NF2 유전자의 손실은 인간 신경섬유종증의 한 형태를 촉발하기 때문에 오랫동안 종양 억제인자로 연루되어 있었습니다.
접촉 억제의 두 번째 메커니즘은 상피 구조를 구성하고 조직 무결성을 유지하는 데 도움이 되는 LKB1 상피 극성 단백질과 관련됩니다.
예를 들어 LKB1은 조직화되고 정지된 상피 구조에서 상향조절된 강력한 Myc 종양유전자의 유사분열 효과를 무효화할 수 있습니다 .
대조적으로, LKB1 발현이 억제되면 상피 완전성이 불안정해지고 상피 세포는 Myc- 유도 형질전환에 민감해진다
LKB1 은 또한 특정 인간 악성종양에서 소실되는 종양 억제 유전자로 확인되었습니다( Shaw, 2009),
아마도 부적절한 증식의 억제인자로서의 정상적인 기능을 반영할 수 있습니다.
접촉 매개 성장 억제의 이 두 가지 메커니즘이 인간 암에서 얼마나 자주 손상되는지는 두고 봐야 합니다.
다른 접촉 유발 증식 장벽은 아직 발견되지 않았습니다. 세포가 구조적으로 복잡한 조직을 구성하고 유지할 수 있도록 하는 이와 같은 메커니즘은 부적절한 증식 신호를 억제하고 균형을 맞추는 중요한 수단을 나타냅니다.
Corruption of the TGF-β Pathway Promotes Malignancy-TGF-β 경로의 손상은 악성 종양을 촉진합니다
TGF-β는 항증식 효과로 가장 잘 알려져 있으며, 암세포가 이러한 효과를 회피하는 것은 이제 신호 회로의 단순한 차단보다 훨씬 더 정교한 것으로 평가되고 있습니다.
많은 말기 종양에서 TGF-β 신호전달은 세포 증식 억제에서 벗어나 상피에서 중간엽으로의 전이(EMT)라고 하는 세포 프로그램을 활성화하는 대신 발견됩니다.
이는 아래에서 더 자세히 논의되는 바와 같이 고등급 악성종양과 관련된 암세포 특성을 부여합니다.
Resisting Cell Death세포 사멸 저항
세포 사멸을 유도하는 스트레스 중에서 주목할만한 것은 앞서 언급한 바와 같이 종양 유전자 신호 수준의 상승으로 인한 신호 불균형과 과증식과 관련된 DNA 손상입니다.
그러나 다른 연구에서는 고등급 악성 종양 및 치료 내성 상태로 진행하는 데 성공한 종양에서 세포자멸사를 약화시키는 방법을 밝혀냈습니다.
세포 사멸 기구는 상류 조절기와 하류 이펙터 구성 요소로 구성됩니다( Adams and Cory, 2007 ).
조절기는 차례로 두 개의 주요 회로로 나뉩니다.
하나는 세포외 사멸 유도 신호(예: Fas 리간드/Fas 수용체를 포함하는 외부 세포자멸사 프로그램)를 수신 및 처리하고 다른 하나는 세포 내 기원(내재 프로그램)으로서 다양한 신호를 감지하고 통합합니다. .
각각은 정상적으로 잠복한 프로테아제(각각 카스파아제 8 및 9)의 활성화로 절정에 이르며, 이는 이펙터 카스파아제를 포함하는 단백질 분해 의 캐스케이드를 시작하도록 진행됩니다.
세포가 점진적으로 분해된 다음 이웃과 전문적인 식세포에 의해 소비되는 세포자멸사의 실행 단계를 담당합니다 .
현재, 내재적 세포자멸사 프로그램은 암 발병기전에 대한 장벽으로 더 광범위하게 연루되어 있습니다.
조절자와 효과기 사이에 신호를 전달하는 "세포자멸사 유발" 은 조절 단백질 의 Bcl-2 계열의 pro- 및 anti - apoptotic 구성원의 균형을 조정함으로써 제어됩니다
원형인 Bcl-2는 가장 closest relatives가까운 친척(Bcl-xL, Bcl-w, Mcl-1, A1)과 함께 세포사멸의 억제제이며, 두 가지 proapoptotic 유발 단백질(Bax 및 Bak)에 결합하여 억제함으로써 대부분 작용합니다.;
후자는 미토콘드리아 외막에 묻혀있다..
Bax와 Bak은 antiapoptotic relatives에 의한 억제가 완화되면 미토콘드리아 외부 막의 완전성을 파괴하여 세포사멸 촉진 신호 단백질의 방출을 유발하며, 그 중 가장 중요한 것은 사이토크롬 c입니다.
방출된 시토크롬c는 차례로 단백질 분해 활성을 통해 작용하여 세포자멸사 프로그램과 관련된 여러 세포 변화를 유도하는 카스파제 캐스케이드를 활성화합니다.
아폽토시스를 유발하는 세포 조건은 완전히 열거되어야 하지만 종양 발달에 중요한 역할을 하는 몇 가지 이상 센서가 확인되었습니다( Adams and Cory, 2007 , Lowe et al., 2004 ).
가장 주목할만한 것은 TP53 종양 억제인자를 통해 기능하는 DNA 손상 센서입니다( Junttila and Evan, 2009 ).
TP53은 상당한 수준의 DNA 파손 및 기타 염색체 이상 에 반응하여 Noxa 및 Puma BH3 전용 단백질의 발현을 상향 조절함으로써 세포자멸사를 유도 합니다.
또는 불충분한 생존 인자 신호 전달(예: interleukin-3 in lymphocytes or of insulin-like growth factor 1/2 [Igf1/2] in epithelial cells의 부적절한 수준)은 Bim이라고 하는 BH3 전용 단백질을 통해 세포자멸사를 유발할 수 있습니다
세포 사멸을 초래하는 또 다른 상태는 항세포사멸 인자에 의해 균형이 맞지 않아서 세포사멸을 유발하는 Myc와 같은 특정 종양단백질에 의한 과활성 신호전달과 관련이 있습니다( Junttila and Evan, 2009 , Lowe et al., 2004 ).
종양 세포는 세포 사멸을 제한하거나 회피하기 위해 다양한 전략을 발전시킵니다.
가장 흔한 것은 TP53 종양 억제 기능의 상실이며, 이는 세포자멸사 유도 회로에서 이 중요한 손상 센서를 제거합니다. .
대안적으로, 종양은 항아폽토시스 조절인자(Bcl-2, Bcl-x L ) 또는 생존 신호(Igf1/2)의 발현을 증가 시키거나,
프로아폽토시스 인자(Bax, Bim, Puma)를 하향 조절하거나,
by short-circuiting the extrinsic ligand-induced death pathway를 통해 유사한 목적을 달성할 수 있습니다.
세포자멸사 회피 메커니즘의 다양성은 아마도 암세포 집단이 악성 상태로 진화하는 동안 만나는 세포자멸사 유도 신호의 다양성을 반영하는 것 같습니다.
Autophagy Mediates Both Tumor Cell Survival and Death
자가포식은 종양 세포의 생존과 죽음을 매개합니다
Autophagy는 apoptosis와 같이 일반적으로 세포의 낮은 기초 수준에서 작동하지만 세포 스트레스의 특정 상태에서 강하게 유도될 수 있는 중요한 세포 생리학적 반응을 나타내며, 그 중 가장 명백한 것은 영양 결핍입니다
autophagic 프로그램은 세포가 리보솜 및 미토콘드리아와 같은 세포 소기관을 분해할 수 있게 하여 생성된 이화 산물 이 재활용되어 생합성 및 에너지 대사에 사용될 수 있도록 합니다 .
이 프로그램의 일부로 자가포식소체라고 하는 세포내 소포는 세포내 소기관을 둘러싸고 분해가 일어나는 리소좀과 융합합니다.
이러한 방식으로 많은 암세포가 경험하는 스트레스를 받고 영양이 제한된 환경에서 생존을 지원하는 저분자량 대사 산물이 생성됩니다.
세포 사멸과 마찬가지로 autophagy 기계에는 조절 및 효과기 구성 요소가 있습니다.
후자 중에는 자가포식소체 형성 및 리소좀으로의 전달을 매개하는 단백질이 있습니다.
참고로, 최근 연구에서는 자가포식, 세포자멸사 및 세포 항상성을 관장하는 조절 회로 간의 교차점이 밝혀졌습니다.
예를 들어, 생존 신호에 의해 자극되어 세포자멸사를 차단하는 PI3-키나제, AKT 및 mTOR 키나제와 관련된 신호 전달 경로는 유사하게 자가포식을 억제합니다.
생존 신호가 불충분하면 PI3K 신호 전달 경로가 하향 조절되어 자가포식 및/또는 세포자멸사가 유도될 수 있습니다.
이 두 프로그램 사이의 또 다른 상호 연결은 Beclin-1 단백질 에 있으며, 이는 유전 연구에 의해 자가포식 유도에 필요한 것으로 나타났습니다
해방된 Beclin-1이 자가포식을 촉발할 수 있도록 하며, 이는 세포자멸사를 유발하는 Bax 및 Bak을 방출할 수 있는 것과 같습니다.
따라서 스트레스 전달 BH3 단백질(예: Bid, Bad, Puma 등)은 세포의 생리학적 상태에 따라 세포자멸사 및/또는 자가포식을 유도할 수 있습니다.
결과는 autophagy의 유도가 apoptosis와 독립적으로 또는 함께 작동할 수 있는 종양 형성에 대한 장벽 역할을 할 수 있음을 시사합니다.
따라서 자가포식은 종양 발달 동안 우회해야 하는 또 다른 장벽을 나타내는 것으로 보입니다.
아마도 역설적이게도 영양 결핍, 방사선 요법 및 특정 세포 독성 약물은 암 세포에 대해 명백히 세포 보호적인 자가포식의 상승된 수준을 유도하여 이러한 스트레스 유발 상황의 사멸 작용을 강조하기보다는 손상시킬 수 있습니다.
더욱이, 심하게 스트레스를 받은 암세포는 자가포식을 통해 가역적 휴면 상태로 축소되는 것으로 나타났습니다.
이러한 생존 반응은 강력한 항암제로 치료한 후 일부 말기 종양의 지속 및 궁극적인 재성장을 가능하게 할 수 있습니다.
따라서, 종양 형성의 초기 단계에서 종양을 억제하고 나중에 종양을 촉진할 수 있는 TGF-β 신호 전달과 유사하게, 자가포식은 종양 세포 및 이에 따른 종양 진행에 상충되는 효과를 갖는 것으로 보입니다.
Necrosis Has Proinflammatory and Tumor-Promoting Potential
괴사는 전염증 및 종양 촉진 가능성이 있습니다
죽어가는 세포가 거의 보이지 않는 시체로 수축하여 이웃에 의해 곧 소비되는 세포 사멸과 달리 괴사 세포는 부풀어 오르고 폭발하여 내용물을 국소 조직 미세 환경으로 방출합니다.
괴사는 역사적으로 유기체적 죽음과 매우 유사하게 여겨져 왔지만, 시스템 전반에 걸친 고갈과 붕괴의 한 형태로서 개념적 지형이 바뀌고 있습니다.
괴사에 의한 세포 죽음은 무작위적이고 지시되지 않은 과정이 아니라 어떤 상황에서는 분명히 유전적 통제하에 있습니다.
아마도 더 중요한 것은 괴사 세포 사멸은 그렇지 않은 세포 사멸 및 자가 포식과 대조적으로 주변 조직 미세 환경으로 전염증 신호를 방출한다는 것입니다. .
결과적으로 괴사 세포는 면역계의 염증 세포를 모집할 수 있으며, 그의 전용 기능은 조직 손상 정도를 조사하고 관련 조직을 제거하는 것입니다.
괴사 파편. 그러나 신생물의 맥락에서, 면역 염증 세포가 혈관 신생 을 촉진할 수 있다는 점을 고려할 때 면역 염증 세포가 적극적으로 종양을 촉진할 수 있음을 나타내는 여러 증거가 있습니다.,
암세포 증식 및 침습성(아래 참조). 또한 괴사 세포는 IL-1α와 같은 생리 활성 조절 인자를 방출할 수 있으며, 이는 인접 생존 세포가 증식하도록 직접 자극할 수 있으며, 다시 한 번 잠재적으로 신생물 진행을 촉진할 수 있습니다( Grivennikov et al., 2010 ).
결과적으로 괴사 세포 사멸은 암 관련 과증식의 균형을 맞추는 데 도움이 되는 것처럼 보이지만 궁극적으로 득보다 실이 더 많을 수 있습니다.
따라서, 초기 신생물 및 잠재적으로 침습성 및 전이성 종양은 어느 정도의 괴사성 세포 사멸을 용인함으로써 이점을 얻을 수 있으며, 이는 이러한 성장 내의 생존 세포에 성장 자극 인자 를 가져오는 종양 촉진 염증 세포를 모집하기 위해 그렇게 할 수 있습니다.
Enabling Replicative Immortality복제 불멸 활성화
2000년까지 암세포는 거시적인 종양을 생성하기 위해 무한한 복제 가능성이 필요하다는 것이 널리 받아들여졌습니다.
이 능력은 대부분의 정상 세포 계통 에서 세포의 행동과 현저한 대조를 이룹니다.
이 능력은 제한된 수의 연속적인 세포 성장 및 분열 주기만 통과할 수 있는 신체의 대부분의 정상 세포 계통에서 세포의 행동과 현저한 대조를 이룹니다..
노화는 일반적으로 비가역적이지만 생존 가능한 상태로 들어가는 돌이킬 수 없는 진입이며, 위기는 세포 사멸을 수반합니다.
따라서 세포가 배양물에서 증식할 때 반복되는 세포 분열 주기는 먼저 노화의 유도를 유도한 다음 이 장벽을 우회하는 데 성공한 세포의 경우 집단 내 대다수의 세포가 죽는 위기 단계에 이르게 합니다.
드문 경우지만 세포는 위기에 처한 개체군에서 나타나 무한한 복제 가능성을 나타냅니다.
이러한 전환을 불멸화(immortalization)라고 하며, 대부분의 확립된 세포주가 노화 또는 위기의 증거 없이 배양물에서 증식할 수 있는 능력 덕분에 소유하는 특성입니다.
여러 증거 라인은 염색체 말단을 보호 하는 텔로미어 가 무제한 증식 능력에 중심적으로 관여 한다는 것을 나타냅니다
다중 직렬 헥사뉴클레오타이드 반복으로 구성된 텔로미어는 배양에서 증식되는 불멸화되지 않은 세포에서 점진적으로 짧아지며 결국에는 말단 간 융합으로부터 염색체 DNA의 말단을 보호하는 능력을 상실합니다. 이러한 융합은 세포 생존 을 위협하는 핵형의 뒤섞임( scrambling)을 초래 하는 불안정한 이심 염색체 를 생성합니다..
따라서 세포에서 텔로미어 DNA의 길이는 텔로미어가 크게 침식되어 결과적으로 보호 기능을 잃어 위기에 빠지기 전에 자손이 통과할 수 있는 연속적인 세포 세대를 결정합니다.
텔로머 DNA의 끝에 텔로미어 반복 부분을 추가 하는 특수화된 DNA 중합효소인 텔로머라제 는 불멸화되지 않은 세포에서는 거의 존재하지 않지만 인간 암세포를 포함하여 자발적으로 불멸화된 세포의 대다수(~90%)에서 기능적으로 유의한 수준으로 발현됩니다.
텔로머라아제는 텔로미어 DNA를 확장함으로써 텔로미어가 없을 때 발생하는 점진적인 텔로미어 침식을 막을 수 있습니다.
자발적으로 불멸화된 세포 또는 효소를 발현하도록 조작된 세포의 맥락에서 텔로머라제 활성의 존재는 노화 및 위기/아폽토시스 유도에 대한 내성과 상관관계가 있습니다.
반대로, 텔로머라제 활성의 억제는 텔로미어 단축을 유도하고 이러한 증식 장벽 중 하나 또는 다른 하나의 활성화를 유도합니다.
증식에 대한 두 가지 장벽인 노화와 위기/아폽토시스는 우리 세포에 고정되어 있는 중요한 항암 방어로 합리화되어 전종양 세포와 솔직히 신생물 세포의 클론의 성장을 방해하기 위해 배치됩니다.
이 생각에 따르면, 대부분의 초기 신생물은 복제 배가의 능력을 소진하고 이러한 장벽 중 하나에 의해 경로에서 중단됩니다.
종양을 형성하는 희귀 변이 세포의 궁극적인 불멸화는 노화 또는 세포 사멸을 촉발하는 것을 피하기에 충분한 길이로 텔로머 DNA를 유지하는 능력에 기인합니다.
이는텔로머라제의 발현을 상향 조절함으로써 가장 일반적으로 달성되거나, 덜 빈번하게는 대체 재조합 기반 텔로미어 유지 메커니즘을 통해 달성된다.
따라서 텔로미어 shortening단축은 정상 세포의 제한된 복제 잠재력을 결정하고 암세포가 극복해야 하는 클로킹 장치로 간주되게 되었습니다.
Reassessing Replicative Senescence복제 노화 재평가
텔로미어 유지가 신생물 상태에 중요한 조건으로 점점 더 입증되고 있는 반면, 복제 유발 노화를 일반적인 장벽으로 생각하려면 개선과 재구성이 필요합니다.
최근 실험에 따르면 특정 배양 세포에서 노화 유도가 지연되고 제거될 수 있음이 밝혀졌습니다.
개선된 세포 배양 조건의 결과, 최근에 이식된 1차 세포가 위기의 지점까지 배양에서 방해받지 않고 증식할 수 있으며, 결정적으로 단축된 텔로미어에 의해 유발되는 관련 세포자멸사 유도가 가능함을 시사합니다.
참고로, 앞서 논의한 바와 같이 과도하거나 불균형한 종양 유전자 신호 전달에 의해 유도된 형태학적으로 유사한 형태의 세포 노화는 이제 신생물에 대한 보호 메커니즘으로 잘 문서화되어 있습니다.
이러한 형태의 노화와 텔로머라제 및 텔로미어의 상호 연결 가능성은 아직 확인되지 않았습니다.
따라서 세포 노화는 높은 수준의 발암성 신호 전달 및 명백히 subcritical shortening of telomeres아임계적 텔로미어 단축을 포함하여 다양한 증식 관련 이상에 의해 촉발될 수 있는 신생물 확장에 대한 보호 장벽으로 개념적으로 부상하고 있습니다.
Delayed Activation of Telomerase May Both Limit and Foster Neoplastic Progression
Telomerase의 지연된 활성화는 종양 진행을 제한하고 촉진할 수 있습니다
초기 암 세포의 클론은 상당한 수준의 텔로머라제를 발현할 수 없기 때문에 다단계 종양 진행 과정에서 비교적 초기에 텔로미어 손실 유발 위기를 종종 경험한다는 증거가 있습니다.
이러한 결과는 또한 그러한 세포가 완전히 정상적인 기원의 세포에서 진화하는 동안 상당한 수의 연속적인 텔로미어 단축 세포 분열을 거쳤음을 시사합니다.
따라서 일부 인간 신생물의 발달은 거시적이고 확실한 신생물 성장이 되기 훨씬 전에 텔로미어 유발 위기에 의해 중단될 수 있습니다.
대조적으로, 게놈 무결성에 대한 TP53 매개 감시의 부재는 다른 초기 신생물이 초기 텔로미어 침식 및 수반되는 염색체 파손-융합-다리(BFB) 주기에서 생존하도록 허용할 수 있습니다.
명백한 암종은 더 긴 텔로미어의 재건 및 텔로미어 실패 후 텔로머라제 활성의 획득 전에 획득된 것으로 보이는 비정상적인 핵형의 고정(클론 증식을 통해)과 일치하게 텔로머라제 발현을 나타냈다.
이러한 방식으로 묘사될 때 텔로머라제 기능의 지연된 획득은 종양 촉진 돌연변이를 생성하는 역할을 하는 반면, 후속 활성화는 돌연변이 게놈을 안정화하고 암세포가 임상적으로 명백한 종양을 생성하기 위해 요구하는 무제한 복제 능력을 부여합니다.
New Functions of Telomerase텔로머라제의 새로운 기능
텔로머라아제는 텔로머 DNA를 연장하고 유지하는 능력 때문에 발견되었으며 거의 모든 텔로머라아제 연구는 그 기능이 이 중요한 기능에 국한된다는 개념에 입각해 있습니다.
그러나 최근에는 텔로머라제가 세포 증식과 관련이 있지만 텔로미어 유지와 관련이 없는 기능을 발휘한다는 것이 분명해졌습니다.
TERT/텔로머라제의 텔로미어 독립적 기능의 증가 목록 중에는 β-카테닌/LEF 전사 인자 복합체의 보조인자 역할을 함으로써 Wnt 경로 에 의해 신호를 증폭하는 TERT의 능력이 있습니다
Inducing Angiogenesis혈관신생 유도
정상 조직과 마찬가지로 종양은 영양소와 산소의 형태로 필요한 영양과 대사 폐기물 과 이산화탄소 를 배출하는 능력이 필요합니다 .
혈관 신생 과정에 의해 생성된 종양 관련 신 혈관 구조 는 이러한 요구를 해결합니다.
성인의 경우 상처 치유 및 여성의 생식 주기와 같은 생리학적 과정의 일부로 혈관신생이 활성화되지만 일시적으로만 활성화됩니다.
대조적으로, 종양이 진행되는 동안 "혈관신생 스위치"는 거의 항상 활성화되고 계속 켜져 있어 정상적으로 작동하지 않는 혈관계가 확장되는 신생물 성장을 유지하는 데 도움이 되는 새로운 혈관을 지속적으로 싹트게 합니다.
이러한 혈관신생 조절인자 중 일부는 혈관 내피 세포에 의해 형성되는 자극 또는 억제 세포 표면 수용체에 결합하는 신호 전달 단백질입니다 .
혈관신생 유도제 및 억제제의 잘 알려진 원형은 각각 혈관 내피 성장 인자-A(VEGF-A) 및 트롬보스폰딘-1 (TSP-1)입니다.
VEGF-A 유전자는 배아 및 출생 후 발달 동안 새로운 혈관 성장을 조정하고 내피 세포의 항상성 생존뿐만 아니라 성인의 생리학적 및 병리학적 상황을 조정하는 데 관여하는 리간드를 암호화합니다.
VEGF 유전자 발현은 저산소증 및 종양유전자 신호전달 둘 다에 의해 상향조절될 수 있다.
혈관신생 스위치의 핵심 균형인 TSP-1은 또한 내피 세포에 의해 표시되는 transmembrane receptors에 결합하여 혈관신생 자극에 대응할 수 있는 억제 신호를 유발합니다.
역사적으로, 혈관신생은 빠르게 성장하는 거시적 종양이 형성된 경우에만 중요하다고 생각되었지만, 보다 최근의 데이터에 따르면 혈관신생은 종양 진행의 미시적 전악성 단계에도 기여하여 암의 통합적 특징으로서의 위상을 더욱 공고히 하고 있습니다.
Gradations of the Angiogenic Switch혈관신생 스위치의 그라데이션
일단 혈관신생이 활성화되면 종양은 다양한 패턴의 신생혈관을 나타냅니다 .
참고로, 스위칭 메커니즘은 최종 결과가 공통 유도 신호(예: VEGF)인 경우에도 형태가 다양할 수 있습니다.
일부 종양에서는 Ras 및 Myc 와 같은 종양 세포 내에서 작동하는 우세한 종양 유전자 가 혈관신생 인자의 발현을 상향조절할 수 있습니다,
반면에 다른 곳에서는 이러한 유도 신호가 아래에서 논의되는 바와 같이 면역 염증 세포에 의해 간접적으로 생성됩니다.
Endogenous Angiogenesis Inhibitors Present Natural Barriers to Tumor Angiogenesis
내인성 혈관신생 억제제는 종양 혈관신생에 대한 자연적 장벽을 제시합니다
데이터는 그러한 내인성 혈관신생 억제제가 정상적인 상황에서 조직 리모델링 및 상처 치유 동안 일시적인 혈관신생을 조절하는 생리학적 조절자로서 작용한다는 것을 시사하고; 그들은 또한 초기 신생물에 의한 혈관신생의 유도 및/또는 지속에 대한 내재적 장벽으로 작용할 수 있습니다.
Pericytes Are Important Components of the Tumor Neovasculature
혈관주위세포는 종양 신혈관구조의 중요한 구성요소입니다
Pericytes 는 정상 조직 혈관계에서 내피 튜브의 외부 표면에 밀접하게 인접한 지지 세포로 오랫동안 알려져 있으며, 여기서 내피 세포에 중요한 기계적 및 생리학적 지원을 제공합니다.
최근 몇 년 동안 수행된 주의 깊은 현미경 연구에 따르면 혈관 주위 세포가 느슨하긴 하지만 모든 종양은 아닐지라도 대부분의 신생혈관 구조와 연관되어 있음이 밝혀졌습니다
A Variety of Bone Marrow-Derived Cells Contribute to Tumor Angiogenesis
다양한 골수 유래 세포가 종양 혈관신생에 기여합니다
여기에는 선천 면역계의 세포, 특히 대식세포, 호중구, 비만 세포 및 골수 전구 세포가 포함됩니다. - 전암성 병변 및 진행성 종양에 침윤하여 이러한 병변의 변연에서 모이는 것; 종양 주위 염증 세포는 아래에 언급된 바와 같이 이전에 정지된 조직에서 혈관신생 스위치를 트립하고 종양 성장과 관련된 지속적인 혈관신생을 유지하는 데 도움이 될 뿐만 아니라 국소 침습을 촉진합니다.
또한 내피 세포 신호 전달을 표적으로 하는 약물의 영향으로부터 혈관계를 보호하는 데 도움이 될 수 있습니다( Ferrara, 2010 ).
또한 골수에서 유래한 여러 유형의 "혈관 전구 세포"가 특정 경우에 신생물 병변으로 이동하여 혈관주위 세포 또는 내피 세포로 신혈관 구조에 삽입되는 것으로 관찰되었습니다.
Activating Invasion and Metastasis침습 및 전이 활성화
2000년에는 침습과 전이의 기본 메커니즘이 대체로 수수께끼였습니다.
상피 조직에서 발생하는 암종이 국소 침습 및 원격 전이에 반영되는 더 높은 병리학적 등급의 악성으로 진행됨에 따라 관련 암 세포는 일반적으로 모양의 변화뿐만 아니라 다른 세포 및 세포외 기질에 대한 부착에도 변화가 있음이 분명했습니다. (ECM).
가장 특징적인 변화는 암종 세포에 의한 E-cadherin 의 주요 세포 간 접착 분자 의 손실과 관련이 있습니다 .
접착 접합 을 형성하여인접한 상피 세포와 함께 E-cadherin은 상피 세포 시트를 조립하고 이러한 시트 내에서 세포의 정지를 유지하는 데 도움이 됩니다.
E-cadherin의 증가된 발현은 침습 및 전이의 길항제로서 잘 확립된 반면, 그 발현의 감소는 이러한 표현형을 강화시키는 것으로 알려져 있습니다.
인간 암종에서 E-cadherin의 빈번하게 관찰되는 하향 조절 및 간헐적인 돌연변이 비활성화는 이 특징적인 능력의 주요 억제인자로서의 역할에 대한 강력한 지원을 제공했습니다.
침습 및 전이의 다단계 과정은 종종 침습-전이 캐스케이드라고 하는 일련의 개별 단계로 도식화되었습니다. .
이 묘사는 국소 침습에서 시작하여 암세포가 근처의 혈액과 림프관 으로 침투하고 , 림프계와 혈행계를 통해 암세포가 이동하고, 그 다음 그러한 조직의 루미나에서 암세포가 탈출 하는 일련의 세포 생물학적 변화를 상상합니다.
원거리 조직의 실질로의 혈관 확장(extravasation), 암세포의 작은 결절 형성(micrometastases), 마지막으로 미세전이 병변이 육안으로 보이는 종양으로의 성장, 이 마지막 단계를 "집락화(colonization)"라고 합니다.
The EMT Program Broadly Regulates Invasion and Metastasis
EMT 프로그램은 침입 및 전이를 광범위하게 규제합니다.
epithelial-mesenchymal transition” (EMT)
"상피-중간엽 전환"(EMT)이라고 하는 발달 조절 프로그램은 형질전환된 상피 세포가 침입하고, 세포자멸사에 저항하고, 퍼뜨리는 능력을 획득할 수 있는 수단으로 두드러지게 관련되어 있습니다.
이 다면적 EMT 프로그램은 침습 및 전이 과정에서 암종 세포에 의해 일시적으로 또는 안정적으로 활성화될 수 있습니다.
이러한 전사 조절자는 여러 악성 종양 유형에서 다양한 조합으로 발현되며 암종 형성의 실험 모델에서 프로그래밍 침입에 인과적으로 중요한 것으로 나타났습니다.
일부는 ectopically(이소성으로) 과발현될 때 전이를 유발하는 것으로 밝혀졌습니다.
이러한 전사 인자에 의해 유발되는 세포 생물학적 특성에는 부착 접합의 손실 및 다각형 / 상피에서 가시 / 섬유모세포 형태 로의 관련 전환 , 기질 분해 효소의 발현, 증가된 운동성 및 세포자멸사에 대한 증가된 저항성이 포함됩니다.
침습 및 전이 과정에 연루되어 있습니다.
이러한 전사 인자 중 일부는 E-카드헤린 유전자 발현을 직접 억제할 수 있으므로 신생물 상피 세포에서 운동성과 침습성의 주요 억제인자를 박탈할 수 있습니다
특정 암종의 침습적 변연에 있는 암세포는 EMT를 겪은 것으로 볼 수 있으며, 이는 이러한 암 세포가 이러한 병변의 코어에 위치한 암세포가 받는 것과 구별되는 미세환경 자극에 영향을 받는다는 것을 시사합니다.
EMT-유도 전사 인자의 발현이 육종 및 신경외배엽 종양과 같은 특정 비상피 종양 유형에서 관찰되었지만, 이러한 종양에서 악성 특성을 프로그래밍하는 데 있어 이들의 역할은 현재 제대로 문서화되지 않았습니다.
Heterotypic Contributions of Stromal Cells to Invasion and Metastasis
침습 및 전이에 대한 기질 세포의 이형 기여
암 세포와 신생물 기질 세포 사이의 상호간섭이 침습적 성장 및 전이를 위한 획득 능력에 관여한다는 것이 점점 더 명백해지고 있습니다.
이러한 신호는 암종 세포에 영향을 미치고 위에서 제안한 바와 같이 그들의 특징적인 능력을 변경하는 작용을 할 수 있습니다.
예를 들어, 종양 기질에 존재하는 중간엽 줄기 세포 (MSC)는 암세포가 방출하는 신호에 반응하여 CCL5/RANTES를 분비하는 것으로 밝혀졌습니다. 그런 다음 CCL5 는 암세포에 상호 작용하여 침습적 행동을 자극합니다.
종양 주변부의 대식세포는 metalloproteinases and cysteine cathepsin proteases 와 같은 기질 분해 효소를 공급하여 국소 침습을 촉진할 수 있습니다.
한 모델 시스템에서 침입 촉진 대식세포는 암세포에 의해 생성된 IL-4에 의해 활성화됩니다
그리고 전이성 유방암의 실험 모델에서 유방암 세포에 종양 관련 대식세포 (TAM)는 표피 성장 인자를 공급합니다(EGF) ,
반면에 암세포는 CSF-1로 대식세포를 상호 자극하고; 이들의 조화된 상호작용은 순환계 로의 혈관내 침투 및 암세포의 전이성 전파를 촉진합니다.
Plasticity in the Invasive Growth Program
침습적 성장 프로그램의 가소성
침습적 성장 능력(종종 EMT를 통해)을 유도하는 맥락적 신호의 역할은 원발성 종양에서 더 먼 조직 부위로 퍼진 암세포가 활성화된 기질 및 침습으로부터 더 이상 혜택을 받지 못할 수 있다는 점에서 가역성의 가능성을 의미합니다
원발성 종양에 거주하는 동안 경험한 EMT-유도 신호; 이러한 신호에 지속적으로 노출되지 않으면 암종 세포는 새 집에서 비침습적 상태로 되돌아갈 수 있습니다.
따라서 초기 침습 및 전이성 전파 동안 EMT를 겪은 암종 세포는 중간엽-상피 전이(MET)라고 하는 역과정을 통과할 수 있습니다.
이 가소성은 조직 병리학을 나타내는 암종 세포의 새로운 종양 집락의 형성을 초래할 수 있습니다
Distinct Forms of Invasion May Underlie Different Cancer Types
다른 암 유형의 기초가 될 수 있는 고유한 형태의 침습
EMT 프로그램은 "중간엽"이라고 불리는 특정 유형의 침습성을 조절합니다.
또한, 두 가지 다른 침습 모드가 확인되었으며 암세포 침범과 관련이 있습니다
"집단 침습"은 인접 조직으로 대량으로 진행하는 암세포의 결절을 포함하며, 예를 들어 편평 세포 암종의 특징입니다.
흥미롭게도, 그러한 암은 거의 전이되지 않으며, 이는 이러한 형태의 침윤이 전이를 촉진하는 특정 기능적 특성이 부족함을 시사합니다. "아메 보이드 " 형태의 침입이 널리 퍼져 있다는 것은 덜 분명합니다.
개별 암세포가 형태학적 가소성을 나타내어 중간엽 및 집단 침습 형태 모두에서 발생하는 것처럼 스스로 경로를 청소하지 않고 세포외 기질의 기존 간극을 통해 미끄러질 수 있습니다.
위에서 언급한 또 다른 새로운 개념은 종양 경계에서 조립되는 염증 세포에 의한 암세포 침범의 촉진을 포함하여 세포외 기질 분해 효소 및 침습적 성장을 가능하게 하는 기타 요인을 생성합니다.
이러한 기능은 EMT 프로그램의 활성화를 통해 이러한 단백질을 생산하는 암세포의 필요성을 제거할 수 있습니다.
따라서 암세포 는 기질 분해 효소 자체를 생산하기보다는 침습성 염증 세포를 모집 하는 화학 유인 물질 을 분비할 수 있습니다.
The Daunting Complexity of Metastatic Colonization
전이성 집락화의 엄청난 복잡성
전이는 두 가지 주요 단계로 나눌 수 있습니다.
즉, 원발성 종양에서 먼 조직으로 암세포가 물리적으로 전파되는 단계와 이러한 세포가 외부 조직 미세 환경에 적응하여 성공적인 집락화, 즉 미세 전이가 거시적 종양으로 성장하는 것입니다.
dissemination의 여러 단계는 EMT 및 유사하게 작동하는 이주 프로그램의 범위에 있는 것으로 보입니다.
그러나 성공적으로 전파되었지만 거시적인 전이성 종양으로 절대 진행되지 않는 수많은 미세전이 환자의 존재에 의해 입증된 바와 같이 집락화는 물리적 전파와 엄격하게 결합되지 않습니다.
일부 유형의 암에서, 원발 종양은 원발 성장의 절제 직후 폭발적인 전이 성장에 의해 임상적으로 밝혀진 바와 같이 이러한 미세전이를 휴면 상태로 만드는 전신 억제 인자 를 방출할 수 있습니다.
그러나 유방암 및 흑색종과 같은 다른 경우에는 원발성 종양이 외과적으로 제거되거나 약리학적으로 파괴된 후 수십 년 후에 육안으로 보이는 전이가 발생할 수 있습니다.
이러한 전이성 종양 성장은 많은 시행착오 끝에 조직 식민지화의 복잡한 문제를 해결한 휴면 미세전이를 분명히 반영합니다.
그러한 자연사 natural histories로부터 미세전이는 혈관신생을 활성화하는 능력과 같은 활발한 성장에 필요한 다른 특징적인 능력이 부족할 수 있다고 추론할 수 있습니다.
실제로 실험적으로 생성된 특정 휴면 미세전이가 거시적 종양을 형성할 수 없는 것은 종양 혈관신생을 활성화하지 못하기 때문입니다.
또한 최근 실험에 따르면 영양 결핍이 강력한 자가포식을 유도하여 암세포를 수축시키고 가역적인 휴면 상태를 채택할 수 있습니다.
그러한 세포는 더 많은 영양소에 대한 접근과 같은 조직 미세 환경의 변화가 허용될 때 이 상태를 벗어나 활발한 성장과 증식을 재개할 수 있습니다.
미세전이 휴면의 다른 메커니즘은 정상 조직 세포외 기질에 내장된 항성장 신호 및 면역계의 종양 억제 작용을 포함할 수 있습니다.
대부분의 파종된 암세포는 적어도 처음에는 그들이 착륙한 조직의 미세 환경에 제대로 적응하지 못할 가능성이 높습니다.
따라서 각 유형의 파종 암 세포는 하나 또는 다른 외부 조직의 미세 환경에서 번성하는 문제에 대한 자체적인 임시 솔루션 세트를 개발해야 할 수 있습니다.
이러한 적응에는 수백 가지의 뚜렷한 집락 프로그램이 필요할 수 있으며, 각 프로그램은 전파되는 암세포의 유형과 집락이 진행되는 조직 미세 환경의 특성에 따라 결정됩니다.
그러나 아래에서 추가로 논의되는 바와 같이 특정 조직 미세 환경은 본질적으로 파종성 암 세포에 호의적일 수 있습니다
확산 시기 외에도 암세포가 언제 어디서 외부 조직을 거시적 종양으로 집락화하는 능력을 발달시키는지는 불분명합니다.
이 능력은 어떤 전파 이전에 종양의 특정 발달 경로의 결과로 원발성 종양이 형성되는 동안 발생할 수 있으며, 따라서 순환계에 진입하는 원발성 종양 세포는 우연히 특정 원거리 조직 부위에 집락화 할 수 있는 능력을 부여 받게 됩니다.
대안적으로, 특정 조직을 집락화하는 능력은 외부 조직 미세 환경에서의 성장에 적응하기 위해 이미 퍼진 암세포에 대한 선택적 압력에 대한 반응으로만 개발될 수 있습니다.
이러한 조직 특이적 집락화 능력을 발달시킨 전이성 집락의 세포는 신체의 새로운 부위뿐만 아니라 조상이 발생한 원발성 종양으로 더 전파될 수 있습니다.
따라서, 원발성 종양 내의 세포 사이에서 명백한 조직 특이적 집락화 프로그램은 원발성 병변 내에서 발생하는 고전적 종양 진행이 아니라 집으로 돌아온 이민자로부터 기인할 수 있습니다.
이러한 재파종은 앞서 언급한 인간 췌장암 전이 연구와 일치합니다.
다르게 말하면, 원발성 종양 내 암세포 (및 아래에서 논의 되는 암 줄기 세포 ) 집단의 표현형과 기본 유전자 발현 프로그램은 원격 전이성 자손의 역이동에 의해 크게 수정될 수 있습니다.
이 자가 파종 과정에는 또 다른 개념이 내포되어 있습니다. 원발성 종양에서 발생하고 악성 형질의 획득에 기여하는 지지 기질은 본질적으로 전이성 병변에서 나오는 순환 암 세포에 의해 재파종 및 집락화를 위한 호의적인 위치를 제공할 수 있습니다.
Programming of Hallmark Capabilities by Intracellular Circuitry
세포내 회로에 의한 홀마크 기능 프로그래밍
2000년에 우리는 암세포에 영향을 미치는 수많은 신호 분자가 정상 세포에서 작동하는 회로의 재프로그래밍된 파생물인 정교한 집적 회로의 노드 및 분기로 작동한다는 은유를 제시했습니다.
이후 10년 동안 이러한 회로의 원래 묘사가 확고해졌고 신호 카탈로그와 신호 경로의 상호 연결이 확장되었습니다.
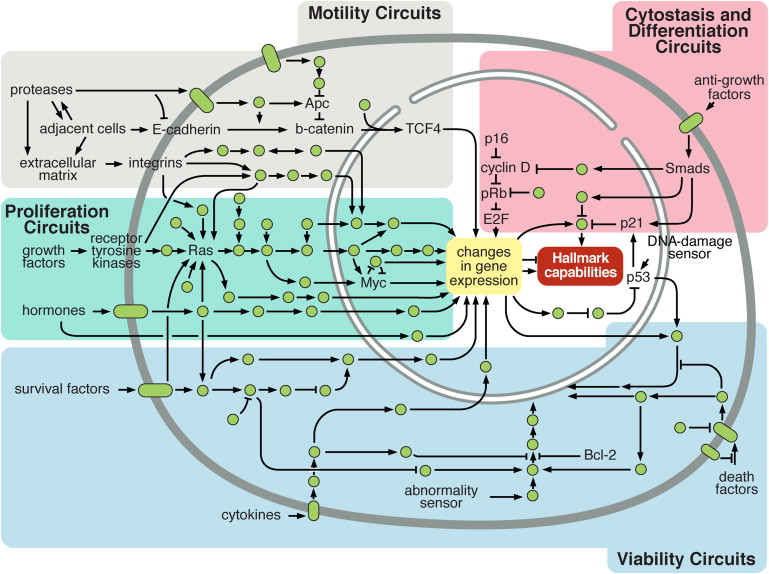
그림 2 . 세포 내 신호 전달 네트워크는 암세포의 작동을 조절합니다
Enabling Characteristics and Emerging Hallmarks특성 및 새로운 특징 활성화
우리는 암의 특징을 암 세포가 생존, 증식 및 전파할 수 있도록 하는 획득된 기능적 능력으로 정의했습니다.
이러한 기능은 별개의 메커니즘을 통해 그리고 다단계 종양 형성 과정 동안 다양한 시간에 다양한 종양 유형에서 획득됩니다.
이들의 획득은 두 가지 활성화 특성에 의해 가능합니다 .
가장 두드러진 것은 염색체 재배열을 포함한 무작위 돌연변이를 생성하는 암 세포 의 게놈 불안정성 의 발달입니다 .
이들 중에는 특징적인 능력을 조정할 수 있는 드문 유전적 변화가 있습니다.
두 번째 가능하게 하는 특성은 면역계의 세포에 의해 유도되는 전악성 및 확실한 악성 병변의 염증 상태를 포함하며, 그 중 일부는 다양한 수단을 통해 종양 진행을 촉진하는 역할을 합니다.
암 세포의 다른 뚜렷한 속성은 기능적으로 암 발병에 중요한 것으로 제안되었으며 따라서 핵심 특징 목록에 추가될 수 있습니다
이러한 두 가지 속성은 특히 매력적입니다.
첫 번째는 지속적인 세포 성장과 증식을 지원하기 위해 세포 에너지 대사의 주요 재프로그래밍을 포함하며, 대부분의 정상 조직에서 작동하고 관련 세포의 생리학적 작동에 연료를 공급하는 대사 프로그램을 대체합니다.
두 번째는 면역 세포에 의한 공격과 제거로부터 암세포에 의한 능동적 회피를 포함합니다. 이 기능은 종양 발달 및 진행을 길항하고 향상시키는 면역계의 이분법적인 역할을 강조합니다.
이러한 두 가지 능력은 다양한 형태의 인간 암의 발달 및 진행을 촉진하는 것으로 잘 증명될 수 있으며 따라서 암의 새로운 특징으로 간주될 수 있습니다.
이러한 가능하게 하는 특성과 새로운 특징은 에 묘사되어 있습니다.도 3 은 아래에서 개별적으로 논의된다.

그림 3 . 새로운 특징 및 활성화 특성
증가하는 연구에 따르면 암의 두 가지 추가 특징이 일부 및 아마도 모든 암의 발병기전에 관련되어 있습니다.
하나는 종양 증식을 가장 효과적으로 지원하기 위해 세포 대사를 수정하거나 재프로그래밍하는 능력을 포함합니다.
두 번째는 암세포가 특히 T 및 B 림프구 , 대식세포 및 자연 살해 세포에 의한 면역학적 파괴를 피할 수 있도록 합니다 .
두 기능 모두 아직 일반화되고 완전히 검증되지 않았기 때문에 신흥 특징으로 분류됩니다.
또한, 신생물의 두 가지 결과적인 특성은 핵심 및 새로운 특징의 획득을 촉진합니다.
게놈 불안정성 및 그에 따른 돌연변이는 암 세포에 종양 진행을 유도하는 유전적 변경을 부여합니다.
감염과 싸우고 상처를 치유하도록 설계된 타고난 면역 세포에 의한 염증은 대신 여러 특징적인 기능을 부주의하게 지원하여 염증 반응의 현재 널리 인정되는 종양 촉진 결과를 나타낼 수 있습니다.
An Enabling Characteristic: Genome Instability and Mutation
위에 열거된 여러 특징의 획득은 대부분 신생물 세포의 게놈의 연속적인 변경에 달려 있습니다.
간단히 설명하면, 특정 돌연변이 유전자형은 세포의 서브클론에 선택적 이점을 부여하여 국소 조직 환경에서 세포의 파생물과 궁극적인 우성을 가능하게 합니다.
따라서, 다단계 종양 진행은 각각 가능한 돌연변이 유전자형의 우연한 획득에 의해 촉발되는 일련의 클론 확장으로 묘사될 수 있습니다.
유전성 표현형, 예를 들어 종양 억제 유전자의 비활성화는 DNA 메틸화 및 히스톤 변형DNA methylation and histone modifications 과 같은 epigenetic후성 유전적 메커니즘을 통해 획득될 수도 있기 때문에, 일부 클론 확장은 유전자 발현 조절에 영향을 미치는 비돌연변이 변화에 의해 촉발될 수 있습니다.
DNA의 결함을 감지하고 해결하는 게놈 유지 시스템의 탁월한 능력은 각 세포 생성 동안 자발적 돌연변이 비율 이 일반적으로 매우 낮다 는 것을 보장합니다 .
종양 형성을 조정하는 데 필요한 돌연변이 유전자의 명단을 획득하는 과정에서 암세포는 종종 돌연변이 비율을 증가시킵니다( Negrini et al., 2010 , Salk et al., 2010 ).
이 돌연변이는 돌연변이 유발 인자에 대한 민감도 증가, 게놈 유지 장치의 하나 또는 여러 구성 요소의 고장, 또는 둘 모두를 통해 달성됩니다.
또한 일반적으로 게놈 무결성을 모니터링하고 유전적으로 손상된 세포를 노화 또는 세포 사멸시키는 감시 시스템을 손상시켜 돌연변이 축적을 가속화할 수 있습니다..
TP53의 역할은 여기에서 중심적이며 "게놈의 수호자"라고 불립니다
DNA 유지 장치의 다양한 구성 요소에 영향을 미치는 다양한 결함(종종 게놈의 "관리인"이라고도 함 )이 문서화되었습니다
이러한 관리인 유전자 의 결함 목록 에는
(1) DNA 손상 감지 및 복구 기계 활성화,
(2) 손상된 DNA 직접 복구,
(3) 돌연변이 유발 분자가 DNA를 손상시키기 전에 비활성화 또는 차단에 관련된 제품이 포함됩니다.
유전적 관점에서 볼 때, 이러한 관리 유전자는 종양 억제 유전자와 매우 유사하게 행동하는데, 그 기능은 종양 진행 과정에서 손실될 수 있으며, 이러한 손실은 돌연변이 비활성화 또는 후성 유전적 억제 를 통해 달성됩니다 .
암 특징을 처음 열거한 이후 10년 동안 종양 관련 게놈 불안정성의 또 다른 주요 원인이 밝혀졌습니다.
앞서 설명한 바와 같이 많은 종양에서 텔로미어 DNA의 손실은 핵형 불안정을 생성하고 염색체 분절의 관련 증폭 및 결실을 생성합니다( Artandi 및 데피뉴, 2010 ).
이러한 관점에서 볼 때 텔로머라제는 무한한 복제 가능성을 위한 특징적인 기능을 가능하게 하는 것 이상이며 게놈 무결성을 유지하는 책임이 있는 중요한 관리인 목록에도 추가되어야 합니다.
중요하게도, 게놈의 특정 부위에서 특정 이상(증폭 및 결실 모두)의 재발은 그러한 부위가 종양 진행에 유리한 유전자를 보유할 가능성이 있음을 나타냅니다( Korkola and Gray, 2010 ).
게놈 변경의 세부 사항은 종양 유형에 따라 크게 다르지만 인간 종양에서 이미 문서화 된 많은 수의 게놈 유지 및 복구 결함과 유전자 복제 수 및 뉴클레오티드 서열 의 광범위한 불안정화에 대한 풍부한 증거, 게놈의 불안정성은 대부분의 인간 암세포에 내재되어 있음을 설득합니다.
이것은 차례로 진화하는 전악성 세포가 유리한 유전자형을 축적할 수 있는 속도를 가속화하기 때문에 게놈 유지 및 복구의 결함이 선택적으로 유리하고 따라서 종양 진행에 중요하다는 결론으로 이어집니다.
이와 같이, 게놈 불안정성은 분명히 특징적인 능력의 획득과 인과적으로 연관된 가능하게 하는 특성입니다.
An Enabling Characteristic: Tumor-Promoting Inflammation
활성화 특성: 종양 촉진 염증
병리학자들은 일부 종양이 면역계의 선천성 및 적응성 암 모두의 세포에 의해 조밀하게 침윤되어 비종양 조직에서 발생하는 염증 상태를 반영한다는 것을 오랫동안 인식해 왔습니다( Dvorak, 1986 ).
면역 체계의 구별되는 세포 유형을 정확하게 식별하기 위한 더 나은 마커의 출현으로 이제 거의 모든 종양 병변에는 세포 유형 특이적 항체로만 감지할 수 있는 미묘한 침윤에서부터 전신 염증에 이르기까지 다양한 밀도로 존재하는 면역 세포가 포함되어 있다는 것이 분명해졌습니다.
염증은 증식 신호를 유지하는 성장 인자, 세포 사멸을 제한하는 생존 인자, 혈관신생 인자, 혈관신생, 침습 및 전이를 촉진하는 세포외 기질-수정 효소 및 유도성을 포함하는 생리활성 분자, EMT 및 기타 hallmark-facilitating programs의 활성화로 이어지는 신호를 종양 미세환경에 공급함으로써 다양한 특징에 기여할 수 있습니다.
중요하게도, 염증은 어떤 경우에는 신생물 진행의 초기 단계에서 명백하며 초기 신생물이 완전한 암으로 발전하도록 촉진할 수 있음을 입증할 수 있습니다.
또한 염증 세포는 주변 암세포에 적극적으로 돌연변이를 일으키는 화학물질, 특히 반응성 산소종을 방출 하여 악성 종양 상태로의 유전적 진화를 가속화할 수 있습니다.
따라서 염증은 핵심적인 특징을 획득하는 데 기여하는 특성을 가능하게 하는 것으로 간주될 수 있습니다.
이 활성화 특성을 담당하는 세포는 종양 미세 환경에 대한 아래 섹션에 설명되어 있습니다.
An Emerging Hallmark: Reprogramming Energy Metabolism
새로운 특징: 에너지 대사 재프로그래밍
신생물성 질환의 본질을 나타내는 만성적이고 종종 통제되지 않는 세포 증식은 세포 증식의 탈조절된 제어뿐만 아니라 세포 성장 및 분열을 촉진하기 위한 에너지 대사의 상응하는 조정을 포함한다.
호기성 조건에서 정상 세포는 포도당을 처리합니다.
먼저 세포질에서 해당과정 을 통해 피루브산을 생성 하고 미토콘드리아에서 이산화탄소로 전환합니다.
혐기성 조건에서 해당 작용이 선호되고 상대적으로 적은 양의 피루브산이 산소를 소비하는 미토콘드리아로 보내집니다.
Otto Warburg는 처음으로 암세포 에너지 대사의 변칙적 특성을 관찰했습니다.
산소가 있는 경우에도 암세포 는 에너지 대사를 해당 작용으로 제한함으로써 포도당 대사 및 에너지 생산을 재프로그래밍하여 "호기성 해당 작용"이라고 하는 상태로 이어질 수 있습니다.
에너지 대사의 이러한 재프로그래밍은 암 세포가 미토콘드리아 산화적 인산화에 비해 해당 작용에 의해 제공되는 ATP 생산의 약 18배 낮은 효율을 보상해야 한다는 점에서 직관에 어긋나는 것처럼 보입니다 .
그들은 부분적으로 포도당 수송체, 특히 GLUT1 을 상향 조절함으로써 그렇게 하며 , 이는 세포질로의 포도당 유입을 실질적으로 증가시킵니다.
실제로, 포도당의 현저하게 증가된 흡수 및 이용은 많은 인간 종양 유형에서 문서화되었으며, 가장 쉽게 비침습적으로 시각화합니다.
해당 작용 연료 공급은 활성화된 종양 유전자(예: RAS , MYC ) 및 돌연변이 종양 억제인자(예: TP53 )와 관련이 있는 것으로 나타 났으며 ,
이들의 종양 세포의 변경은 주로 세포 증식의 특징적인 능력을 부여하고, 세포 증식 억제 조절을 회피하고, 세포자멸사를 약화시키는 이점을 위해 선택되었습니다.
해당 작용에 대한 이러한 의존은 많은 종양 내에서 작동하는 저산소 상태에서 더욱 강조될 수 있습니다.
저산소증 반응 시스템은 해당 경로의 포도당 수송체 및 다중 효소를 상향 조절하기 위해 다면적으로 작용합니다.
따라서 Ras 종양 단백질과 저산소증은 HIF1α 및 HIF2α 전사 인자의 수준을 독립적으로 증가시킬 수 있으며, 이는 차례로 해당 작용을 상향 조절합니다
암세포의 해당 스위치에 대한 기능적 근거는 미토콘드리아 산화적 인산화에 비해 해당과정에 의해 ATP를 생성하는 효율이 상대적으로 낮기 때문에 파악하기 어렵습니다.
최근에 부활되고 개선된 가설에 따르면, 증가된 해당과정은 해당과정 중간체를 뉴클레오사이드 와 아미노산을 생성하는 경로를 포함한 다양한 생합성 경로로 전환할 수 있게 합니다 .
이것은 차례로 거대 분자 의 생합성을 촉진합니다.
새로운 세포를 조립하는 데 필요한 세포 소기관. 더욱이, Warburg와 같은 대사는 빠르게 분열하는 많은 배아 조직에 존재하는 것으로 보이며, 이는 활발한 세포 증식에 필요한 대규모 생합성 프로그램을 지원하는 역할을 다시 한 번 시사합니다.
흥미롭게도 일부 종양에는 에너지 생성 경로가 다른 두 개의 암 세포 소집단이 포함되어 있는 것으로 밝혀졌습니다.
한 하위 집단은 젖산을 분비하는 포도당 의존성("Warburg 효과") 세포로 구성되는 반면,
두 번째 하위 집단의 세포는 이웃이 생산한 젖산염을 주요 에너지원으로 우선적으로 가져오고 활용하여 구연산 회로의 일부를 사용하여 다음 을 수행합니다.
그래서 이 두 개체군은 분명히 공생적으로 기능합니다. 저산소성 암세포는 연료로 포도당에 의존하고 젖산을 폐기물로 분비합니다.
종양 내 공생의 이러한 도발적인 방식이 아직 일반화되지는 않았지만, 종양 성장을 촉진하기 위한 젖산 분비 세포와 젖산염 활용 세포 간의 협력은 사실 종양의 발명이 아니라 정상 생리학적 메커니즘의 채택을(이 경우 하나는 근육에서 작동) 다시 반영합니다.
또한 정상산소에서 저산소증에 이르는 산소 공급이 종양에서 반드시 정적일 필요는 없고 대신 시간적으로나 지역적으로 변동한다는 것이 분명해지고 있습니다. 이는 종양 관련 신혈관 구조의 불안정성과 혼란스러운 조직의 결과일 가능성이 있습니다.
변경된 에너지 대사는 암의 특징으로 받아들여진 다른 많은 암 관련 특성만큼 암세포에서 널리 퍼져 있음이 입증되었습니다.
이러한 인식은 세포 에너지 대사 조절을 완화하는 것이 6개의 잘 정립된 핵심 특징만큼 근본적인 암세포의 핵심 특징인지에 대한 질문을 제기합니다.
사실, 에너지 대사의 방향 전환은 암의 핵심 특징을 프로그래밍하는 데 어떤 식으로든 관련된 단백질에 의해 크게 조정됩니다.
이러한 방식으로 볼 때, 호기성 해당 작용은 단순히 증식 유도 종양 유전자에 의해 프로그래밍되는 또 다른 표현형입니다.
An emerging Hallmark: Evading Immune Destruction
새로운 특징: 면역 파괴 회피
종양 형성을 둘러싼 아직 해결되지 않은 두 번째 문제는 초기 신생물, 말기 종양 및 미세전이의 형성 및 진행에 저항하거나 근절하는 데 면역계가 하는 역할과 관련이 있습니다.
면역 감시에 대한 오랜 이론은 세포와 조직이 항상 경계하는 면역 체계에 의해 지속적으로 모니터링되며 이러한 면역 감시가 대다수의 초기 암세포와 이에 따른 초기 종양을 인식하고 제거하는 책임이 있다고 제안합니다.
이 논리에 따르면, 나타나는 고형 종양은 어떻게든 면역계의 다양한 팔에 의한 탐지를 피하거나 면역학적 사멸의 범위를 제한할 수 있어 근절을 피할 수 있었습니다.
특히, CD8 + 세포독성 T 림프구(CTL), CD4 + T h 1 보조 T 세포 또는 자연 살해(NK) 세포 의 발달 또는 기능의 결핍은 각각 종양 발병률의 입증할 수 있는 증가를 초래했습니다; 또한, 두 T 세포에 결합된 면역결핍증이 있는 마우스NK 세포는 암 발병에 훨씬 더 취약했습니다.
결과는 적어도 특정 실험 모델에서 면역계의 선천적 및 후천적 세포 팔이 모두 면역 감시 및 종양 근절에 크게 기여할 수 있음을 나타냅니다.
이러한 행동은 다음과 같이 해석됩니다. 면역원성이 높은 암세포 클론은 면역적격 숙주에서 일상적으로 제거되며, 이 과정을 "면역편집"이라고 합니다.
그러한 약한 면역원성 세포는 이후에 면역결핍 및 면역적격 숙주 모두에서 집락화될 수 있다.
역으로, 면역결핍 숙주에서 발생하는 경우, 면역원성 암세포는 선택적으로 고갈되지 않고 대신 약한 면역원성 대응물과 함께 번영할 수 있습니다.
또한 일부 면역억제된 장기 이식 수혜자는 기증자 유래 암으로 발전하는 것으로 관찰되었으며, 이는 표면상 종양이 없는 기증자에서 암세포가 휴면 상태에서 완전히 기능하는 면역 체계에 의해 억제되었음을 시사합니다
그러나 우리는 HIV 및 약리학적으로 면역 억제된 환자가 T 및 B 세포 구획에서 주로 면역 결핍이므로 NK 세포와 CTL이 모두 결여된 유전자 조작 돌연변이 마우스에서 생성된 다성분 면역학적 결핍을 나타내지 않는다는 점에 주목합니다.
이것은 그러한 환자가 NK 및 기타 선천 면역 세포에 의해 탑재된 암에 대한 면역학적 방어를 위한 잔여 능력을 여전히 갖고 있을 가능성을 열어줍니다.
사실, 암 면역학에 대한 위의 논의는 종양-숙주 면역학적 상호작용을 단순화하는데, 이는 면역원성이 높은 암세포가 이를 제거하기 위해 파견된 면역 체계의 구성 요소를 비활성화함으로써 면역 파괴를 잘 피할 수 있기 때문입니다.
예를 들어, 암세포는 TGF-β 또는 기타 면역억제 인자 를 분비하여 침투하는 CTL 및 NK 세포를 마비시킬 수 있습니다.
보다 미묘한 메커니즘은 조절 T 세포(Treg) 및 골수 유래 억제 세포 (MDSC)를 포함하여 능동적으로 면역억제하는 염증 세포의 모집을 통해 작동합니다 .
둘 다 세포독성 림프구 의 작용을 억제할 수 있습니다.
The Tumor Microenvironment종양 미세 환경
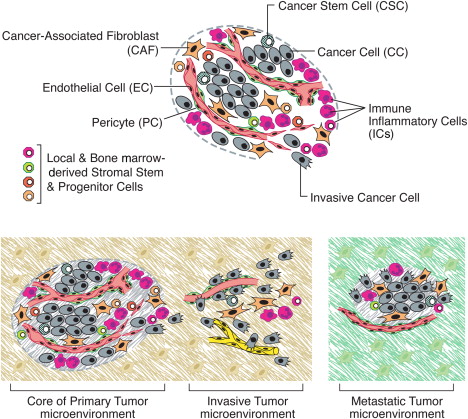
그림 4 . 종양 미세 환경의 세포
(위) 구별되는 세포 유형의 집합체는 대부분의 고형 종양을 구성합니다.
종양의 실질과 기질은 모두 종양 성장과 진행을 총괄적으로 가능하게 하는 별개의 세포 유형 및 하위 유형을 포함합니다.
특히, 종양에 존재하는 면역 염증 세포는 종양 촉진 및 종양 사멸 서브클래스를 모두 포함할 수 있습니다.
(아래) 종양의 독특한 미세 환경. 여러 기질 세포 유형은 종양이 정상 조직을 침범하고 그 후 원거리 조직을 파종하고 식민지화함에 따라 변화하는 일련의 종양 미세 환경을 생성합니다.
기질 세포 유형 및 세포외 기질 의 풍부함, 조직학적 조직 및 표현형 특성(해칭된 배경), 진행 중에 진화하여 원발성, 침습성 및 전이성 성장을 가능하게 합니다.
도식적으로만 나타낸 원발성 및 전이 부위의 주변 정상 세포는 다양한 신생물 미세 환경의 특성에도 영향을 미칠 가능성이 있습니다. (조립된 세포의 풍부함과 특성에 의해 생성되는 독특한 미세 환경을 갖는 종양 형성의 전암성 단계는 표시되지 않습니다.)
Cancer Cells and Cancer Stem Cells암세포와 암줄기세포
그들은 암을 유전 질환으로 정의하는 발암성 및 종양 억제 돌연변이를 수반하여 종양을 시작하고 종양 진행을 진행시킵니다.
전통적으로, 종양 내의 암세포는 증가된 유전적 불안정성과 결합된 과증식으로 인해 별개의 클론 하위 집단이 생성되는 종양 진행 과정의 비교적 늦은 시점까지 합리적으로 균질한 세포 집단으로 묘사되었습니다.
이러한 클론 이질성을 반영하여, 많은 인간 종양은 다양한 분화 정도, 증식, 혈관성, 염증 및/또는 침습성으로 구분되는 영역을 포함하는 조직병리학적으로 다양합니다.
그러나 최근 몇 년 동안 증거는 여전히 단편적이지만 CSC는 광범위하게 다양한 풍부로 존재하지만 대부분의 종양은 아닐지라도 많은 종양의 공통 구성요소임이 입증될 수 있습니다.
이 흔하지 않은 종양 개시 세포는 특정 정상 조직 줄기 세포 집단과 전사 프로필을 공유하는 것으로 입증되어 줄기 유사 세포로 지정되었습니다.
고형 종양 내 CSC의 기원은 명확하지 않으며 실제로 종양 유형마다 다를 수 있습니다.
일부 종양에서 정상 조직 줄기 세포는 CSC를 생성하기 위해 발암성 형질전환을 겪는 기원 세포의 역할을 할 수 있습니다.
다른 경우에는 부분적으로 분화된 전이 증폭 세포( 전구 세포 라고도 함), 더 많은 줄기와 유사한 특성을 가정한 후 초기 발암성 변형을 겪을 수 있습니다.
활성화된 염증 기질에 의해 방출되는 것과 같은 EMT를 유발하는 이형 신호도 CSC를 생성하고 유지하는 데 중요할 수 있습니다.
다양한 종양 유형에서 증가하는 증거는 CSC의 특성을 가진 세포가 일반적으로 사용되는 다양한 화학 요법 치료에 더 내성이 있음을 시사합니다.
그들의 지속성은 방사선과 다양한 형태의 화학 요법에 의해 인간 고형 종양의 명백한 성공적인 축소 후에 거의 불가피한 질병 재발을 설명하는 데 도움이 될 수 있습니다.
실제로, CSC는 외과적 절제 또는 방사선/화학 요법 후 잠복 암 세포가 수년 또는 수십 년 동안 지속되어 갑자기 분화하여 생명을 위협하는 질병을 유발하는 특정 형태의 종양 휴면의 기초가 될 수 있습니다.
따라서 CSC는 치료적 살해에 대한 내성이 더 강하고 동시에 치료가 중단되면 종양을 재생하는 능력이 부여된다는 점에서 이중 위협을 나타낼 수 있습니다.
CSC 상태에 내재된 이 표현형 가소성은 또한 다양한 방식으로 전반적인 종양 성장을 지원하는 종양 내에서 기능적으로 구별되는 하위 집단의 형성을 가능하게 할 수 있습니다.
예를 들어, EMT는 상피 암종 세포를 일부 종양에서 암 관련 섬유아세포 (CAF) 의 역할을 맡을 수 있는 중간엽, 섬유아세포 유사 암 세포로 전환할 수 있습니다 .
놀랍게도, 몇몇 최근 보고서는 종양 관련 신생혈관 형성에서 진정한 숙주 유래 내피 세포를 대체할 수 있는 내피 유사 세포로 전환분화하는 교모세포종 세포(또는 관련 CSC 하위 집단)의 능력을 문서화했습니다.
이와 같은 관찰은 특정 종양이 기능을 제공하기 위해 모집된 숙주 세포에 의존하기 보다는 자신의 암세포 중 일부가 다양한 유형의 변태를 거쳐 기질 세포 유형을 생성하도록 유도함으로써 기질 지원을 획득할 수 있음을 나타냅니다.
유전적 다양화는 기능적 전문화를 가능하게 하여, 뚜렷하고 상보적인 능력에 기여하는 암 세포의 부분집단을 생성할 수 있으며, 그 다음 위에서 설명한 바와 같이 전반적인 종양 성장의 공통된 이점을 얻게 됩니다.
Endothelial Cells내피 세포
종양 내 세포 이질성의 대부분은 기질 구획에서 발견됩니다.
기질 구성요소 중 두드러진 것은 종양 관련 혈관구조를 형성하는 세포입니다.
지난 10년 동안 내피 세포(예: Notch, Neuropilin , Robo 및 Eph-A/B)에 의해 표시되는 신호 전달 수용체의 리간드를 포함하는 상호 연결된 신호 전달 경로의 네트워크가 이미 눈에 띄는 VEGF, 안지오포이에틴 및 FGF 신호에 추가되었습니다..
이러한 새롭게 특성화된 경로는 발달 및 종양 관련 혈관신생에 기능적으로 연루되어 있으며 내피 세포 표현형의 복잡한 조절을 설명합니다.
일반 순환계의 내피 세포와 밀접하게 관련된 것은 림프관을 형성하는 세포입니다.
특히 종양 성장을 지원하는 종양 관련 기질에서의 역할은 잘 알려져 있지 않습니다.
실제로, 고형 종양 내의 높은 간질 압력으로 인해 종양 내 림프관은 일반적으로 붕괴되고 기능하지 않습니다.
그러나 이와 대조적으로 종양의 주변부와 암세포가 침범하는 인접한 정상 조직에는 종종 기능적이고 활발하게 성장하는("림프관형성") 림프관이 있습니다.
이러한 관련 림프관 은 다수의 암 유형에서 일반적으로 관찰 되는 배수 림프절 에서 전이의 파종을 위한 채널 역할을 할 수 있습니다.
Pericytes혈관주위세포
앞서 언급한 바와 같이, 혈관주위세포는 혈관의 내피관을 감싸는 손가락 모양의 돌출부가 있는 특수한 중간엽 세포 유형(평활근 세포와 관련됨)을 나타냅니다.
정상 조직에서 혈관주위세포는 정상적으로 정지한 내피에 측 분비 지지 신호를 제공하는 것으로 알려져 있습니다.
예를 들어, 혈관주위세포에서 분비되는 Ang-1 은 내피 세포 표면에 발현된 Tie2 수용체에 의해 수신되는 항증식 안정화 신호를 전달 합니다.
일부 혈관주위세포는 또한 내피 항상성에서 영양 기능을 수행하는 낮은 수준의 VEGF를 생성합니다.
또한 혈관주위세포는 혈관주위세포와 내피세포를 고정하고 혈관벽이 혈류의 정수압을 견디도록 돕는 혈관 기저막을 합성하기 위해 내피 세포와 협력합니다.
혈관주위세포의 모집 및 연합의 유전적 및 약리학적 교란은 종양 내피를 지원하는 데 있어 이러한 세포의 기능적 중요성을 입증했습니다.
예를 들어, 종양 혈관주위세포 및 골수 유래 혈관주위세포 전구체에 의해 발현되는 PDGF 수용체를 통한 신호전달의 약리학적 억제는 종양 혈관의 혈관주위세포 범위를 감소시키고, 이는 차례로 혈관 무결성 및 기능을 불안정하게 만듭니다 ;
흥미롭게도, 대조적으로, 정상 혈관의 혈관주위세포는 이러한 약리학적 붕괴를 일으키지 않아 정상 정지 및 종양 혈관계의 조절 차이의 또 다른 예를 제공 합니다.
Immune Inflammatory Cells면역 염증 세포
또한 위에서 논의한 바와 같이, 면역계의 침윤 세포는 종양의 일반적인 구성요소로 점점 더 많이 받아들여지고 있습니다.
이러한 염증 세포는 상충되는 방식으로 작동합니다.
종양 길항 백혈구와 종양 촉진 백혈구 모두 모든 종양 병변은 아니지만 대부분에서 다양한 비율로 발견될 수 있습니다.
이러한 연구의 개념적 뿌리는 만성 염증 부위와 종양 형성의 연관성으로 거슬러 올라갑니다.
정상적인 상처 치유 및 감염과 싸우는 과정에서 면역 염증 세포는 일시적으로 나타났다가 사라집니다.
반면에 만성 염증 부위에는 존재가 섬유증, 비정상적인 혈관 신생 및 신생물을 비롯한 다양한 조직 병리와 관련되어 있습니다.
종양 촉진 염증 세포의 명단에는 이제 대식세포 아형, 비만 세포, 호중구, T 및 B 림프구가 포함됩니다.
이러한 연구는 종양 촉진 작용의 효과기 역할을 하는 염증 세포에 의해 방출되는 신호 분자의 목록을 증가시키고 있습니다.
여기에는 종양 성장 인자 EGF, 혈관신생 성장 인자 VEGF, 염증 상태를 증폭시키는 FGF2 , 케모카인 및 사이토카인과 같은 기타 혈관신생 인자 ; 또한, 이들 세포는 MMP-9 및 기타 기질 금속단백분해효소 , 시스테인 카텝신 프로테아제 및 헤파라나 제를 비롯한 혈관신생 및/또는 침습성 기질 분해 효소를 생성할 수 있습니다.
이러한 다양한 이펙터의 발현과 일관되게, 종양 침윤 염증 세포는 종양 혈관신생을 유도 및 유지하고, 암세포 증식을 자극하고, 종양 가장자리에 존재함으로써, 조직 침범을 촉진하고, 조직 침범을 지원하는 것으로 나타났습니다.
이는 암 세포의 전이성 전파 및 파종을 지원합니다.
종양 기질에 존재하는 완전히 분화된 면역 세포 외에도, 다양한 부분적으로 분화된 골수 전구 세포가 종양에서 확인되었습니다( Murdoch et al., 2008 ).
이러한 세포는 골수 기원의 순환 세포와 정상 및 염증 조직에서 일반적으로 발견되는 분화된 면역 세포 사이의 매개체를 나타냅니다.
중요하게도, 이들 전구체는 더 분화된 유도체와 마찬가지로 입증 가능한 종양 촉진 활성을 가지고 있습니다.
특히 흥미롭게도, 종양 침윤 골수 세포 부류(대식세포 마커 CD11b와 호중구 마커 Gr1을 공동 발현하는 것으로 정의됨)는 독립적으로 MDSC로 확인된 CTL 및 NK 세포 활성을 억제하는 것으로 나타났습니다.
이 속성은 특정 골수 세포의 동원이 직접적으로 혈관신생과 종양 진행을 촉진하는 동시에 면역 파괴를 피할 수 있는 수단을 제공함으로써 발달 중인 종양에 두 배로 유익할 수 있는 가능성을 높입니다.
Cancer-Associated Fibroblasts암 관련 섬유아세포
섬유아세포는 암종 스펙트럼에 걸쳐 다양한 비율로 발견되며, 많은 경우에 종양 기질의 우세한 세포 집단을 구성합니다.
"암 관련 섬유아세포"라는 용어는
(1) 대부분의 정상 상피 조직을 지지하는 구조적 기초를 생성하는 섬유아세포와 유사한 세포 및
(2) 생물학적 역할 및 특성이 다른 세포와 현저하게 다른 근섬유아세포의 두 가지 별개의 세포 유형 을 포함합니다.
근섬유모세포는 상처에서 일시적으로 풍부하게 증가하고 만성 염증 부위에서도 발견됩니다.
근섬유아세포는 조직 복구에 유익하지만 만성 염증에 문제가 있어 폐, 신장 및 간과 같은 조직에서 관찰되는 병리학적 섬유증에 기여합니다.
모집된 근섬유아세포 및 정상 조직 유래 섬유아세포의 재프로그래밍된 변이체는 종양 표현형, 특히 암세포 증식, 혈관신생 및 침습 및 전이를 향상시키는 것으로 입증되었습니다.
Stem and Progenitor Cells of the Tumor Stroma종양 기질의 줄기 세포와 전구 세포
종양 미세 환경을 구성하는 다양한 기질 세포 유형은 인접한 정상 조직(이러한 세포 유형의 가장 명백한 저장소)에서 모집될 수 있습니다.
그러나 최근 몇 년 동안 골수는 종양 관련 기질 세포의 핵심 소스로 점점 더 연루되어 있습니다.
중간엽 줄기 세포와 전구 세포는 골수에서 종양으로 전이되는 것으로 밝혀졌으며, 골수에서 잘 특성화된 다양한 기질 세포 유형으로 분화할 수 있습니다.
종합하면, 이러한 다양한 증거는 인접 정상 조직에서 기원하는 국소 줄기/전구 세포의 제자리 분화 또는 골수 유래 줄기/전구 세포의 모집을 통해 종양 관련 기질 세포가 기존 기질 세포의 증식에 의해 성장하는 종양에 공급될 수 있음을 나타냅니다.
Heterotypic Signaling Orchestrates the Cells of the Tumor Microenvironment
이형 신호는 종양 미세 환경의 세포를 조정합니다
암세포 생물학을 관장하는 세포내 회로의 묘사(예: 그림 2 )는 종양 내의 신생물 및 기질 세포와 이들이 집합적으로 세우고 리모델링하는 동적 세포외 기질 사이의 복잡한 상호작용을 도표화한 유사한 다이어그램으로 보완되어야 합니다.
대다수의 신호 분자와 경로가 확인되어야 하기 때문에 미세 환경 신호 상호 작용의 네트워크에 대한 합리적으로 완전하고 그래픽적인 묘사는 여전히 우리가 도달할 수 있는 범위를 훨씬 벗어납니다.
대신 그림 5 에서 이러한 상호 작용에 대한 힌트를 제공합니다., upper.
이 잘 확립된 몇 가지 예는 종양 발병에 결정적으로 중요한 현저한 복잡성의 신호 네트워크를 예시하기 위한 것입니다.
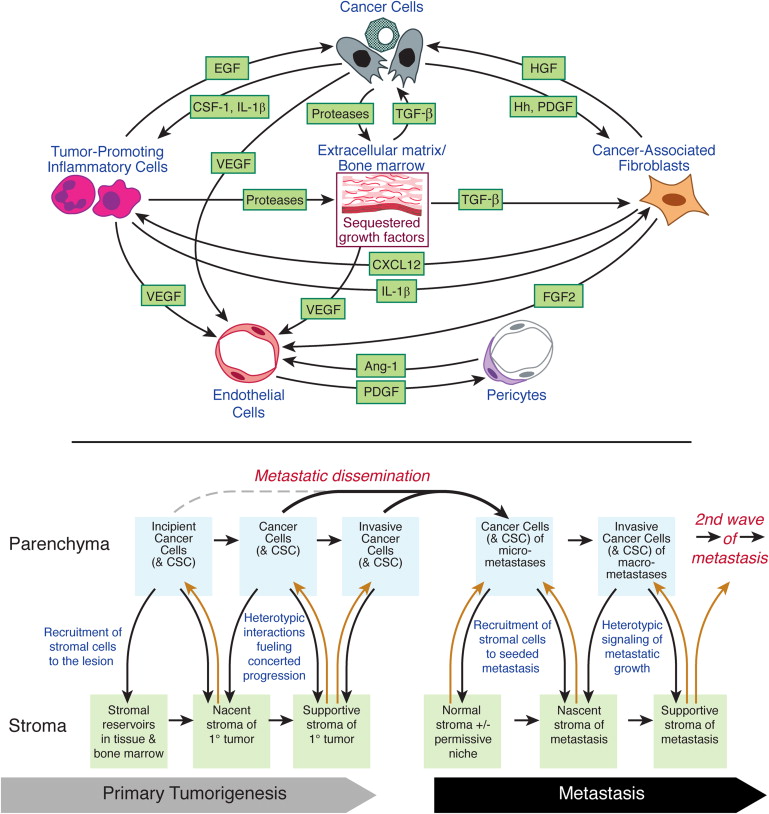
그림 5 . 악성 진행 중 종양 미세 환경에서 신호 상호 작용
(위) 종양 미세 환경을 구성하는 다양한 세포 유형의 조립 및 집합적 기여는 상호 이형 신호 상호 작용에 의해 조정되고 유지되며, 그 중 일부만 예시되어 있습니다.
(아래) 종양 미세 환경 내 상단 패널에 표시된 세포 내 신호 전달 은 정적이 아닌 대신 실질의 암세포와 기질 세포 간의 상호 신호 상호 작용의 결과로 종양 진행 중에 변화합니다.
성장, 침입 및 전이성 전파의 기초가 되는 점점 더 공격적인 표현형을 전달합니다.
중요하게, 전이성 병변을 생성하는 소인은 정상 기원 세포의 분화 프로그램 또는 발암성 병변의 개시에 의해 영향을 받아 조기에 시작될 수 있습니다.
정상 조직에 고유하거나 원발성 종양의 전신 작용에 의해 멀리서 유도되는 국부적 특성의 결과로 인하여 혹은 원발성 종양의 전신 작용에 의해 원거리에서 유도에 의하여, 특정 장기 부위(때때로 "비옥한 토양" 또는 "전이성 틈새"라고도 함)는 특정 유형의 암세포에 의한 전이성 파종 및 집락화에 특히 허용될 수 있습니다.
암 줄기 세포 는 원발성 종양 형성 및 전이의 다른 단계의 일부 또는 전부에 다양하게 관여할 수 있습니다.
초기 신생물은 초기 신생물전 기질로 모이는 기질 세포 유형을 모집하고 활성화함으로써 상호작용을 시작하고, 이는 차례로 주변 암세포의 신생물 표현형을 향상시켜 상호 반응합니다.
유전적으로 더 진화할 수 있는 암세포는 다시 기질로 신호를 공급하여 정상 기질 세포의 재프로그래밍을 계속하여 신진 신생물을 제공합니다.
궁극적으로 종양 기질에서 발생하는 신호는 암세포가 정상적인 인접 조직을 침범하여 퍼질 수 있도록 합니다.
상호 이형 신호 전달의 이 모델은 다단계 종양 진행의 최종 단계인 전이를 포함하도록 확장되어야 합니다( 그림 5, 오른쪽 아래).
원발성 종양에서 방출된 순환하는 암세포는 그러한 종양의 지지 기질에 의해 생성된 미세 환경을 남깁니다.
그러나 멀리 떨어진 장기에 착륙하면 이 암세포는 순진하고 완전히 정상적인 조직 미세 환경과 마주하게 됩니다.
결과적으로, 원발성 종양 내에 존재하는 동안 표현형을 형성하는 이형 신호의 대부분은 파종된 암 세포의 성장에 대한 장벽을 구성하는 전파 부위에 없을 수 있습니다.
따라서, 원발성 종양에서 다단계 진행을 정의하는 간질 세포 상호작용에 대한 상호 암 세포의 연속은 이제 파종된 암세포가 새로 발견된 기관 부위에 집락화를 진행함에 따라 먼 조직에서 다시 반복되어야 합니다.
이 논리가 전이의 일부 경우에 적용되지만 다른 경우에는 앞서 언급한 바와 같이 특정 조직 미세 환경이 여러 가지 이유로 이미 새로 시드된 암세포를 지원할 수 있습니다.
치료 타겟팅

그림 6 . 암의 특징에 대한 치료적 표적화
종양 성장 및 진행에 필요한 획득 능력 각각을 방해하는 약물이 개발되어 임상 시험 중이거나 특정 형태의 인간 암 치료에 임상 사용이 승인된 경우도 있습니다.
또한, 연구 약물은 그림 3에 묘사된 각각의 활성화 특성과 새로운 특징을 표적으로 하기 위해 개발되고 있으며 , 이는 암 치료제로도 유망합니다.
나열된 약물은 예시에 불과합니다.
이러한 특징의 대부분에 대해 개발 중인 다양한 분자 표적 및 작용 모드를 가진 후보 약물의 심층 파이프라인이 있습니다.
결과적으로, 종양에서 하나의 주요 경로를 억제하는 표적 치료제는 특징적인 능력을 완전히 차단하지 못할 수 있으며, 일부 암세포가 적용되는 요법에 의해 부과된 선택적 압력에 결국 적응할 때까지 일부 암세포가 잔류 기능을 유지하면서 생존할 수 있습니다.
돌연변이, 후성유전학적 재프로그래밍 또는 기질 미세환경의 리모델링에 의해 달성될 수 있는 그러한 적응은 기능적 능력을 재확립하여 새로운 종양 성장 및 임상적 재발을 허용할 수 있다.
'정보' 카테고리의 다른 글
| ⚡암의 전신 특징 (The systemic hallmarks of cancer)-링크 (0) | 2021.08.09 |
|---|---|
| Hanahan D와 Weinberg RA는 암 특징 (0) | 2021.07.17 |
| 암치료의 결과 (0) | 2021.07.15 |
| 산화스트레스 by James Watson (0) | 2021.07.12 |
| 꿈많은 사람님의 위대한 업적 (0) | 2021.07.06 |