https://jissn.biomedcentral.com/articles/10.1186/s12970-020-00377-2#Tab1
L-카르니틴 보충제의 밝은 면과 어두운 면: 체계적인 검토
L-카르니틴(LC)의 주요 기능은 β-산화 과정을 통해 에너지로 전환하기 위해 장쇄 지방산을 미토콘드리아 기질로 수송하는 것입니다[ 1 ].
또한, 아세틸-CoA와의 반응에 의한 LC 및 세포 내 아세틸-CoA/CoA 비율 유지는 피루브산 탈수소효소 활성을 조절한다[ 2 ].
LC는 또한 골격근 단백질 균형과 관련된 대사 경로(단백질 분해 및 단백질 합성) 조절에 중요한 역할을 합니다[ 3 ].
또한 LC는 항산화 및 항염증 화합물로 작용합니다[ 3 ].
따라서 운동으로 인한 근육 손상을 약화시킬 수 있습니다.
증가된 단백질 합성 및 감쇠된 단백질 분해가 근육 비대 동안 관찰됩니다
증가된 순환 IGF-1은 IGF-1-PI3K-Akt 신호 전달 경로의 활성화를 유도하여 mTOR 인산화를 증가시키고 LC 보충 쥐의 골격근에서 더 높은 phospho-FoxO/총 FoxO 비율을 유발합니다
저항 훈련과 함께 LC를 9주간 보충하면 순환하는 총 항산화 능력과 글루타티온 퍼옥시다제 활성이 유의하게 증가
===>암치료에 손해일 가능성 있음
https://www.nature.com/articles/s41419-018-0313-7#Tab1
요약
대사 유연성은 적대적인 조건에서 빠른 증식, 지속적인 성장 및 생존을 지원하고 가능하게 하기 위해 대사에 반응하거나 적응하는 세포의 능력을 설명합니다.
세포 대사 네트워크의 이러한 동적 특성은 적응 표현형을 증가시키고 생존력과 통제되지 않은 증식을 모두 유지하기 위해 암세포에서 강화된 것으로 보입니다.
암세포는 에너지와 생합성 중간체 요구를 충족시키고 가혹하고 저산소 환경에서 온전함을 보존하기 위해 신진대사를 재프로그래밍할 수 있습니다.
현재 여러 연구에서 이러한 재프로그래밍된 활동을 암의 특징으로 인식하고 있지만 대사 가소성을 조절하는 데 어떤 경로가 관여하는지 불분명합니다.
최근 연구 결과에 따르면 카르니틴 시스템(CS)은 암세포의 대사 유연성을 미세하게 촉발하는 교착 상태로 간주될 수 있습니다.
실제로, 이 시스템의 구성 요소는 세포질에서 미토콘드리아로 또는 그 반대로 아실 부분의 양방향 수송에 관여하므로 포도당과 지방산 대사 사이의 전환을 조정하는 데 근본적인 역할을 합니다.
따라서, 효소 및 후성유전학적 수준 모두에서 CS 조절은 종양에서 중추적인 역할을 하여 인간 암의 예방 및 치료를 위한 새로운 약물 사용 경로를 제안합니다.
Facts
- 악성 세포는 성장과 생존을 유지하기 위해 에너지와 대사 중간체 합성을 생산하고 소비하는 것 사이에서 평형을 이룰 수 있습니다.
- 대사 가소성은 암세포를 더 공격적으로 만들고 전이할 수 있게 합니다. 발암 경로, 영양소 가용성 및 미세 환경은 세포 대사에 영향을 미칩니다.
- 카르니틴 시스템은 암 대사 가소성의 중추적 매개체이며, 암세포에 대한 에너지 및 생합성 수요를 공급하는 주요 경로, 인자 및 대사산물을 서로 얽혀 있습니다.
- MiRnas와 대사 효소는 카르니틴 시스템을 통해 대사 가소성을 조절하여 새로운 치료 전략을 개발하는 데 사용됩니다.
열린 질문
- 암 대사 재배선에서 카르니틴 시스템의 역할은 무엇입니까?
- 카르니틴 시스템이 암 발생에서 조절되지 않습니까?
- 카르니틴 시스템에 속하는 단백질의 발현 조절에서 후성유전학의 목적은 무엇입니까?
- 카르니틴 시스템의 성분을 표적으로 하는 새로운 항암 치료를 탐색하는 것이 가능합니까?
암세포는 복제를 겪기 위해 높은 생체 에너지 요구를 계속 충족해야 하는 열악한 미세 환경을 포함하여 광범위한 조건에서 대사 항상성을 유지해야 합니다 1.
이 세포는 미세 환경에 존재하는 영양소의 역학과 암세포가 에너지를 생산하고 거대 분자를 합성하는 데 활용하는 능력을 조절함으로써 대사 항상성을 달성합니다.
다른 환경에서 대체 영양소를 사용하는 암세포의 능력은 생존을 지원하고 영향을 미치는 데 중요합니다.
그러나 종양 세포 대사 가소성은 암세포의 미세 환경 및 연료 선택에 의해 유도된 대사 동적 영향 변화의 결과만은 아닙니다.
대신, 암세포가 변화하는 세포내 및 세포외 대사 조건에 지속적으로 적응할 수 있도록 진화한 내장 기능으로 대체 대사 기질의 흡수 및 대사 재배선 촉진과 관련된 대사 가소성을 구상하는 것이 더 적절합니다.2.
세포 내 대사 산물 농도는 영양소의 가용성과 영양소를 효과적으로 사용하는 세포 용량 간의 균형을 보장하기 위해 환경과 독립적으로 대사 경로를 제어하는 신호 전달 네트워크를 미세 조정해야 합니다.
대사 성 단백질의 번역 후 변형 (즉, 아세틸 화, 메틸화 또는 글리코 실화가) 세포의 대사 상태에 대한 정보를 형질 도입하고, 시그널링 단백질, 효소, 및 전사 조절기의 활성 조절을 통해 대사 3.
따라서 다양한 내적 및 외적 요인이 통합되어 대사 유연성을 생성하고 발암성 신호에 의해 지시되는 대사 의존성을 줄이는 방법을 이해하는 것이 필요합니다.
이 검토에서 우리는 암세포의 대사 가소성을 미세하게 유발하는 교착 상태로 카르니틴 시스템(CS)을 식별합니다.
이러한 맥락에서 효소와 유전자 수준에서의 CS 조절은 종양의 대사 플럭스 조절에서 중추적인 역할을 하며 과학자들은 치료 목적으로 이들을 표적으로 삼을 수 있습니다.
암세포 대사에서 영양소와 에너지 획득 전략
암세포는 1차 연료로 호기성 해당과정(Warburg 효과)을 우선시하고 산소 가용성과 독립적으로 과량의 피루브산을 젖산으로 전환합니다 4.
또한 포도당은 암세포에서 미토콘드리아 시트르산 생성에 기여하는 주요 탄소원으로 간주됩니다.
미토콘드리아 요구량을 초과하는 시트레이트는 세포질로 내보내지고 ATP-시트레이트 리아제(ACLY)에 의해 아세틸-CoA로 전환되고 단백질 아세틸화 및 지방 생성에 사용됩니다.
암세포에서 포도당 의존성을 조절하는 원리가 광범위하게 검토되었지만, 우리는 여전히 암세포가 포도당과 다른 영양소가 있는 상태에서 핵심 대사 기능에 기여하기 위해 많은 대사 전략을 사용하는 방법을 완전히 이해하지 못합니다.
실제로, 해당 작용 외에도 암세포는 지방산 산화(FAO) 2 , 5 와 같은 다양한 대사 전략을 수행할 수 있습니다..
최근 연구에 따르면 인접 지방 조직의 지질, 지단백질, 리소인지질 및 세포내 저장 지방이 암세포의 생존과 성장을 유지하는 잠재력이 있다고 보고했습니다 6 , 7 , 8 , 9 .
미토콘드리아 FAO는 포도당이나 아미노산과 같은 다른 영양소의 산화보다 몰당 훨씬 더 많은 ATP를 생성하기 때문에 지방산은 암세포에 만족스럽게 연료를 공급할 수 있습니다.
예를 들어, 전립선암과 B 세포 림프종은 FAO를 에너지 생산의 주요 공급원으로 촉진하고 영양이 풍부한 조건에서도 FAO 효소를 높은 수준으로 발현합니다 10 , 11 .
다시 말하지만, 자가포식 및 관련 과정은 산화적 인산화를 유지함으로써 종양 성장을 가능하게 합니다 12. 흥미롭게도, 자가포식 및 지방산(FA) 이화 과정에 대한 미토콘드리아 β-산화의 강한 의존성은 일부 종양이 영양 결핍 및 환경 스트레스 요인에 더 저항하도록 만듭니다 .
여러 종양의 특징은 지방산 생합성 및 FAO("무익한 순환")와 같이 반대 방향으로 동시에 두 가지 대사 경로를 나타내는 것입니다. 이 역설적인 조건은 두 가지 기본 작업을 수행합니다.
(a) 암 전파에 중요한 FA의 생합성을 제공하는 동시에 FA 과잉의 이화작용에 의해 ATP 및 NADH(니코틴아미드 아데닌 디뉴클레오티드)의 중요한 공급원을 보장합니다. (
b) 세포 에너지 항상성을 유지하는 대사 스트레스를 극복할 수 있는 신호 전달 경로(들)를 유발하는 데 유용한 동적 전환 행동을 유도할 수 있습니다(즉, AMP 활성화 단백질 키나제, AMPK) 14 , 15 .
그러나 헥소키나아제 2 및 FAS와 같은 특정 대사 효소가 종양 유전자(들) 또는 종양 억제인자의 비활성화에 의해 조절 해제되는 것으로 알려진 해당 경로 및 지방 생성 경로와 달리 암 관련 비정상적인 발현 또는 활성에 대한 증거는 제한적입니다.
FAO 경로에 직접 관여하는 효소. 발현 및 활성과 관련하여 암세포에서 β-산화를 조절하는 운반체 및 효소의 조절에 대한 지식은 보상 대사 경로가 있는 경우에도 억제가 종양 형성 가능성에 상당한 영향을 미칠 수 있기 때문에 매우 중요합니다.
카르니틴 시스템과 암세포 대사 가소성에 미치는 영향
식이 유래 또는 지방 조직 방출 장쇄 지방산을 에너지 기질로 사용하려면 약 25가지 다른 효소와 수송 단백질이 필요합니다.
이 효소는 지방산을 수행하고, 미토콘드리아로 가져와서 β-산화 단계를 촉진합니다.
특히, 미토콘드리아 내막 따라서, 전문 CS가 미토콘드리아 막에 걸쳐 지방산 수송 진화, 지방산 아실 티오 에스테르 된 CoA에 불 투과성이고, (18).
CS의 구성요소는 둘 다 아실-CoA + 카르니틴 ↔ CoA + 아실카르니틴 반응을 촉매할 수 있는 효소와 세포질에서 미토콘드리아로 또는 그 반대로 아실 부분의 양방향 수송에 관여하는 운반체입니다. 이 수송 시스템을 구성하는 4가지 구성요소: 카르니틴 팔미토일트랜스퍼라제 1(CPT1) 및 2(CPT2), 카르니틴-아실카르니틴 트랜스로카제(CACT), 카르니틴 회로를 닫는 카르니틴 아세틸트랜스퍼라제(CrAT), FAO 생산 아세틸-카르니틴으로서의 아세틸-CoA(도 1 ).
그림 1: 카르니틴 시스템의 개략도.
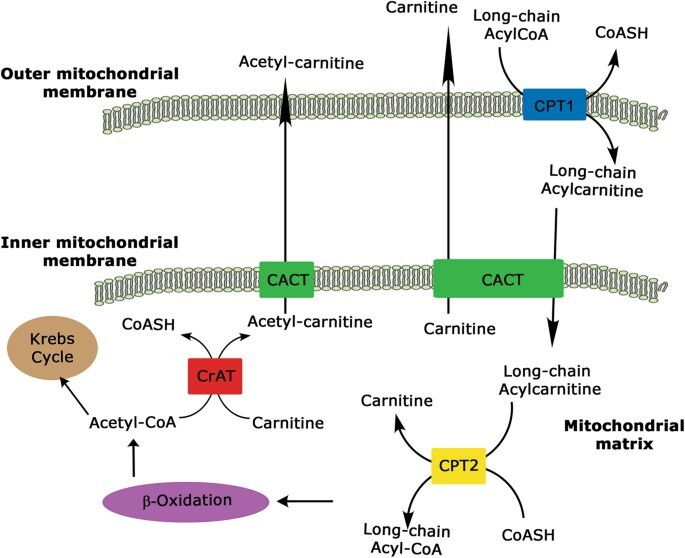
장쇄 지방산-CoA는 접촉 부위의 외부 미토콘드리아 막에 위치한 CPT1에 의해 카르니틴 유도체로 전환됩니다.
특정 카르니틴-아실카르니틴 트랜스로카제(CACT)는 카르니틴/아세틸카르니틴 및 아실카르니틴의 몰 대 몰 교환을 촉매하여 미토콘드리아 막을 통한 아실카르니틴의 수입을 촉진합니다.
미토콘드리아 기질에서 장쇄 아실카르니틴은 카르니틴-팔미토일트랜스퍼라제-2(CPT2)에 의해 각각의 장쇄 아실-CoA로 재전환되고 β-산화를 거쳐 아세틸-CoA를 생성합니다.
마지막으로 CrAT는 단쇄 아세틸-CoA를 막 투과성 아세틸카르니틴 대응물로 전환하여 CACT가 미토콘드리아에서 세포질로 내보낼 수 있도록 합니다.
카르니틴 팔미토일 트랜스퍼라제 계열
카르니틴 팔미토일트랜스퍼라제 1A
CPT1A의 과발현은 종종 유방암, 위암, 전립선암, 림프종, 백혈병, 난소암, 폐 및 골수종과 같은 여러 암의 종양 진행과 관련이 있습니다 20 , 21 , 22 , 23 .
여러 연구에 따르면 CPT1의 억제/고갈은 세포자멸사 및 암세포 증식, 내화학성 및 신생혈관의 억제로 이어진다고 보고했습니다. 24 , 25 , 26 , 27 , 28.
CPT1A는 FAO 29 를 증가 시킬 뿐만 아니라 핵 30 에서 히스톤 아세틸라제 활성을 자극 함으로써 세포 생존에 기여한다고 제안되었습니다 .
CPT1A는 또한 팔미토일-CoA와 같은 세포질 장쇄 지방 아실-CoA를 제거하여 세포사멸로부터 세포를 보호할 수 있으며, 따라서 세포사멸 경로 활성화 31에 관여하는 "팔미테이트/팔미토일-CoA/세라마이드"의 생산을 방해할 수 있습니다.
CPT1A의 약리학적 억제는 급성 골수성 백혈병에서 손상된 암세포 증식과 버킷 림프종에서 집중적인 세포독성을 초래합니다 23 , 32.
흥미롭게도 CPT1 억제는 β-산화를 감소시켜 c-myc 매개 림프종 생성을 현저하게 약화시킵니다.
이것은 c-myc 유발 암의 발병기전에서 CPT1의 잠재적인 역할을 시사합니다.
카르니틴 팔미토일트랜스퍼라제 1B
카르니틴 팔미토일트랜스퍼라제 1B(CPT1B)는 주로 근육 및 갈색 지방 조직과 같은 높은 비율의 FAO를 특징으로 하는 조직에서 발현됩니다.
CPT1B는 또한 고환, 비장, 십이지장, 림프절 및 위에서 소량으로 발현됩니다.
결장직장암의 임상 조직 표본에서 CPT1B의 과발현을 밝혀 결장직장암에 기여하는 잠재적인 대사 메커니즘을 보여줍니다.
더욱이 최근 Kim 등은 CPT1B와 같은 일부 카르니틴-아실카르니틴 대사 경로 관련 유전자의 규제 완화가 근육 침윤성 방광암 환자의 사망률을 증가시킨다는 것을 입증했습니다 42 .
카르니틴 팔미토일트랜스퍼라제 1C
뇌 특이적
CPT1C는 세포 에너지 감지 경로에 관여하며 에너지 항상성 44 의 시상하부 조절에 중요한 역할을 합니다 .
CPT1C isoform은 신경모세포종, 연조직 및 폐의 여러 육종, 악성 말초 신경초 종양과 같은 인간 종양 세포에서 과발현되는 것으로 보고되었습니다(신경섬유종증 유형 1과 관련됨) 45.
CPT1C가 상향 조절되면 FA 소비와 ATP 생산이 증가하여 종양 성장과 생존이 촉진됩니다 43 .
최근 연구에 따르면 퍼옥시좀 증식자 활성화 수용체 알파(PPARα)가 p-53 독립적인 방식으로 CPT1C의 발현을 상향 조절하여 종양 세포의 증식과 노화를 조절한다는 것이 밝혀졌습니다 49.
이러한 발견은 CPT1C가 암세포에서 FA 항상성의 조절자이며 세포 말로닐-CoA 수준을 낮추어 CPT1A 활성의 조절에 간접적으로 관여할 수 있음을 시사합니다.
카르니틴 팔미토일트랜스퍼라제 2
CPT1 isoform과 비교하여 암에서 CPT2 규제 완화에 대해 알려진 바가 적습니다.
그럼에도 불구하고 최근 연구에서는 이 효소가 대장암 환자에서 독립적인 예후 인자로 간주될 수 있다고 보고했습니다 52 .
만성 림프 구성 백혈병 세포가 드 노보 FA 합성뿐만 아니라 FA 이화 작용에 매우 활성했다
대사 중간체 및 카르니틴 시스템
대사 경로는 특정 생화학적 반응을 촉매하는 효소의 알로스테릭 또는 번역 후 조절에 의해 모니터링되고 제어됩니다.
그 후, 대체 접합, mRNA 안정성, 번역 및 단백질 분해가 효소의 풍부함을 조절합니다(“장기 조절”) 69.
이러한 관점에서 포도당이나 유리지방산과 같은 영양소는 대사 과정의 속도 제한 단계를 지배하는 효소(대사 센서)와 직접 상호작용하는 능력을 중간 대사산물에 제공하여 기질 선호도를 조절합니다.
적절한 사례는 세포 항상성을 유지하고 미토콘드리아 과부하를 피하기 위해 지질과 포도당 산화의 기계적 상호 조절을 제공하는 밀접하게 조정된 세포 에너지 대사의 대표적인 예인 소위 "포도당-지방산 순환"입니다.
흥미롭게도 베타 산화와 호기성 해당 작용은 교차 신호를 통해 서로 연결되어 베타 산화가 진행 중인 호기성 해당 작용과 호환 될 뿐만 아니라 Warburg 효과를 촉진 합니다.
실제로 PDH 복합체, 해당 작용으로 유도된 피루브산을 아세틸 조효소 A로 탈탄산시키고 세포질 해당 작용을 미토콘드리아 트리카르복실산(TCA) 회로에 연결하는 이 효소는 PDH 키나제(PDK)에 의한 가역적 인산화에 의해 조절됩니다.
FAO 과정에서 생성되는 두 가지 대사 중간체인 니코틴아미드 아데닌 디뉴클레오티드(NADH)와 아세틸-CoA는 PDK의 활성화를 유도하고, 이는 PDH 복합체의 E1α 서브유닛을 인산 불활성화시켜 포도당 산화 속도를 낮추고 속도를 높입니다. 젖산 방출70 .
흥미롭게도 Myc, Wnt 및 저산소증 유도 인자와 같은 다중 전사 인자는 암세포에서 하나 이상의 PDK 동형의 전사 증가를 유발할 수 있습니다.
호기성 해당과정에 의해 생성되는 대사 중간체와 카르니틴 회로에 속하는 효소 간의 Crosstalk는 암세포에도 존재합니다.
젖산과 암 성장 사이의 관계는 암세포의 대사 표현형에 영향을 줄 수 있는 이 분자의 다면적 작용을 반영합니다.
최근 연구에 따르면 몇 주에 걸친 미세 환경의 젖산 유도 산성화가 종양 세포 집단의 대사 적응을 유도하여 대사 전략으로 베타 산화를 촉진한다는 것이 입증되었습니다(Corbet-Feron Effect) 71.
또한, 산성 pH에 만성적으로 노출된 암세포는 말로닐-CoA 합성에 의해 CPT1 활성을 조절하는 효소인 미토콘드리아 ACC2 동형의 하향 조절을 나타냅니다.
따라서 산증이 있는 종양 세포에서는 ACC1 isoform만이 발현되어 FA 합성의 기질로 malonyl-CoA를 생성합니다.
흥미롭게도, ACC2의 하향 발현은 향상된 FAO 및 감소된 포도당 대사와 관련된 높은 세포질 NAD + 수준에 의해 활성화되는 Sirtuin 1/6에 의한 ACACB 프로모터의 히스톤 탈아세틸화와 연결된 후성적 과정에서 비롯됩니다 .
미토콘드리아 아세틸-CoA의 가용성 증가에 의해 유도된 비효소적 미토콘드리아 단백질 과아세틸화는 미토콘드리아 과식과 관련된 위험을 피하고 호흡 복합체 I의 활성을 억제하고 CACT 활성을 조절합니다.
실제로, 아세틸화가 장쇄 아실-CoA 탈수소효소와 함께 β-산화 조절에 기여하는 CACT 기능의 제어에서 핵심 역할을 한다는 것이 입증되었습니다.
CACT 아세틸화는 활성을 손상시켜 수송 기능을 감소시킵니다.
이 메커니즘은 말로닐-CoA에 의해 미세하게 조절되는 CPT1 메커니즘에 추가하여 미토콘드리아 내 아세틸-CoA 수준에 대한 반응으로 미토콘드리아로 지방 아실 단위 유입의 제어를 나타냅니다.57.
최근에, FA-유도된 아세틸-CoA는 심지어 포도당이 존재하는 경우에도 특정 히스톤 라이신의 아세틸화를 위한 탄소의 중요한 글꼴인 것으로 밝혀졌습니다 72 .
다시 말하지만, CS는 아세틸-CoA를 생산할 뿐만 아니라 히스톤 아세틸화를 위한 아세틸-CoA를 공급하기 위해 미토콘드리아에서 핵으로 아세틸-CoA를 수송하는 데 기본적일 수 있습니다.
CrAT에 의해 미토콘드리아에서 합성된 아세틸-카르니틴은 CACT에 의해 미토콘드리아 밖으로 수송되고 핵에 존재하는 CrAT에 의해 아세틸-CoA로 다시 변환됩니다. 이 모델에서 CS는 FA가 인식되고 후성유전체에 통합되는 기계적 역할을 가정합니다.
이러한 모든 고려 사항은 그림 2에 도식화되어 있습니다. 2 및 3 .
그림 2: 후성유전학적 ACC2 컨트롤은 암세포에서 지방산 대사의 재프로그래밍을 조절합니다.
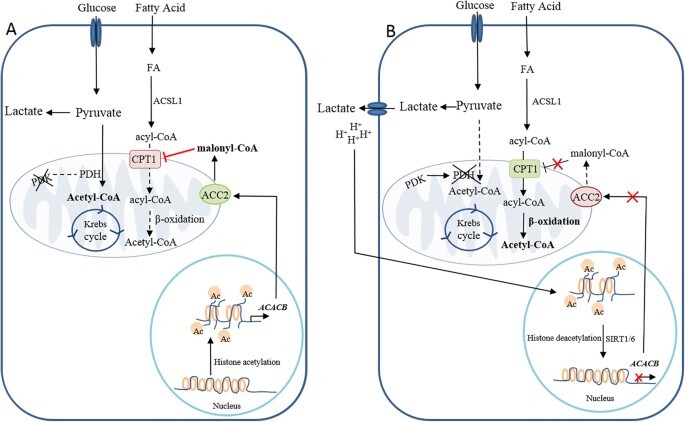
a 히스톤 아세틸화에 의한 ACACB 의 후성적 조절은 ACC2와 그 촉매 산물인 말로닐-CoA의 발현 증가를 유도하여 CPT1A 활성을 억제합니다. 반대로, 시르투인(SIRT1/6)에 의한 b 히스톤 탈아세틸화(SIRT1/6)는 젖산에 의해 유도된 미세 환경 산성화에 의해 촉진되어 ACACB의 발현을 감소 시키고 결과적으로 CPT1A 활성을 향상시킵니다. FAO 과정에서 생성되는 두 가지 대사 중간체인 NADH와 아세틸-CoA는 PDK의 활성화를 촉진하고, 이는 PDH 복합체의 E1α 소단위체를 인산 불활성화시켜 포도당 산화 속도를 낮추고 젖산 방출 속도를 높입니다.
그림 3: 암세포 대사에서 카르니틴 주기의 관련.

암 대사에서 호기성 해당 작용은 피루브산(해당 작용의 최종 산물)을 젖산(오렌지색으로 표시)으로 전환하여 미세 환경의 산성화를 유도합니다.
증가된 산증(파란색으로 표시)은 후생적 기전(들)과 관련하여 미토콘드리아 ACC2 이소형의 하향 조절을 촉진하여 CPT1A 상향 조절을 통해 FAO(빨간색으로 표시)를 증가시킵니다.
FAO 동안 과량으로 생성되는 NADH와 아세틸-CoA는 PDK(랜들 효과)에 의한 PDH 억제를 통해 피루브산을 젖산으로 전환하는 것을 촉진합니다.
미토콘드리아 아세틸-CoA의 가용성 증가는 Kreb 주기와 카르니틴 주기 모두에서 단백질의 미토콘드리아 내 비효소적 아세틸화를 향상시켜 미토콘드리아 과식과 관련된 위험을 방지합니다.
또한 과량의 아세틸-CoA는 시트르산 또는 아세틸 L-카르니틴(ALCAR)으로 세포질로 내보내집니다..
구연산염은 베타 산화를 위해 미토콘드리아로 다시 수입될 수 있는 지방산 합성을 위해 ACLY에 의해 아세틸-CoA로 전환됩니다(무익한 순환).
핵으로 이동하는 ALCAR(보라색으로 표시)은 히스톤 아세틸화를 위한 아세틸기의 공급원으로 사용될 수 있으며, 아마도 지질 대사 특이적 유전자 발현에 기여할 수 있습니다
카르니틴 시스템 조절자로서의 소형 비암호화 RNA(miRNA)
그림 5: MiRNA는 카르니틴 시스템 구성 요소에 영향을 미칩니다.
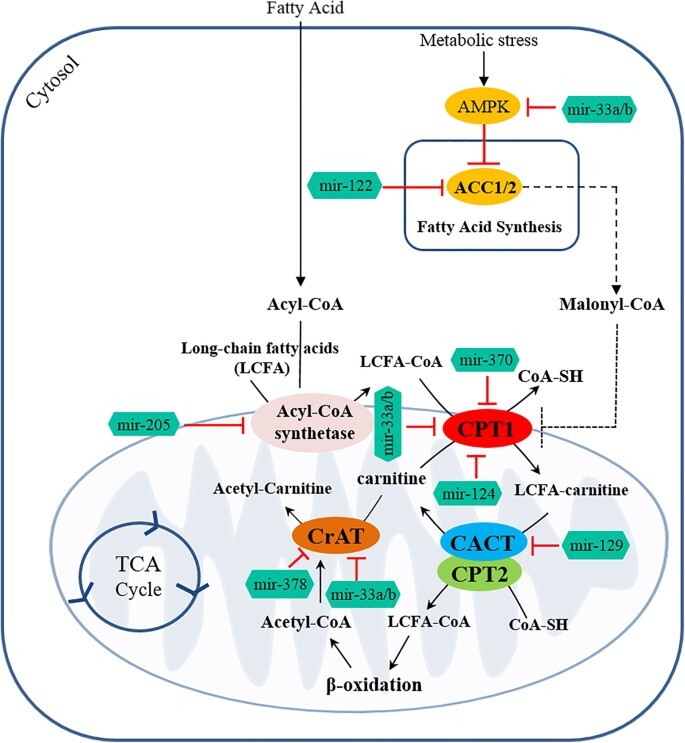
MiRNA는 여러 대사 경로에 관여하는 효소의 발현을 조절하여 세포 대사 가소성을 조절합니다.
MiRNA는 카르니틴 시스템 구성 요소에 직간접적으로 영향을 미칩니다.
Mir-33a/b 및 miR-122는 각각 AMPK(대사 스트레스에 의해 활성화됨) 및 ACC1/2를 표적으로 하는 반면, miR-205는 acyl-CoA 합성효소를 표적으로 하여 카르니틴 시스템의 구성요소를 간접적으로 조절합니다.
또한 카르니틴 시스템 구성 요소는 miR-370, miR-124(CPT1A), miR-129(CACT), miR-33a/b(CPT1A 및 CrAT) 및 miR-378(CrAT)에 의해 직접 조절됩니다.
---------------------------------------------------------------------------------------------------------------------------------
Carnitine Traffic in Cells. Link With Cancer
Metabolic flexibility is a peculiar hallmark of cancer cells. A growing number of observations reveal that tumors can utilize a wide range of substrates to sustain cell survival and proliferation. The diversity of carbon sources is indicative of metabolic
www.frontiersin.org
Carnitine Traffic in Cells. Link With Cancer
대사 유연성은 암세포의 독특한 특징입니다. 점점 더 많은 관찰이 종양이 세포 생존과 증식을 유지하기 위해 광범위한 기질을 활용할 수 있음을 보여줍니다. 탄소 공급원의 다양성은 다양한 유형의 암뿐만 아니라 공통 기원을 공유하는 암 내에서도 대사 이질성을 나타냅니다. 포도당 및 아미노산 대사의 잘 평가된 변경 외에도 암세포가 지질 대사의 변경도 표시한다는 증거가 있습니다.
실제로 일부 종양은 지방산 산화(FAO)를 주요 에너지원으로 사용하고 높은 수준의 FAO 효소를 발현합니다.
이 대사 경로에서 보조인자 카르니틴은 지방산 아실 부분이 β-산화 경로를 통해 산화되는 미토콘드리아 기질로 들어갈 수 있도록 하는 "셔틀 분자" 역할을 하기 때문에 중요합니다.
이 역할은 세포 대사에서 카르니틴이 수행하는 다른 역할과 함께 서로 다른 조직 간, 그리고 세포 내에서 서로 다른 세포 내 구획 간의 카르니틴 이동량의 미세 조절의 기초가 됩니다. 특정 막 수송체는 세포막을 가로지르는 카르니틴 및 카르니틴 유도체 플럭스를 매개합니다.
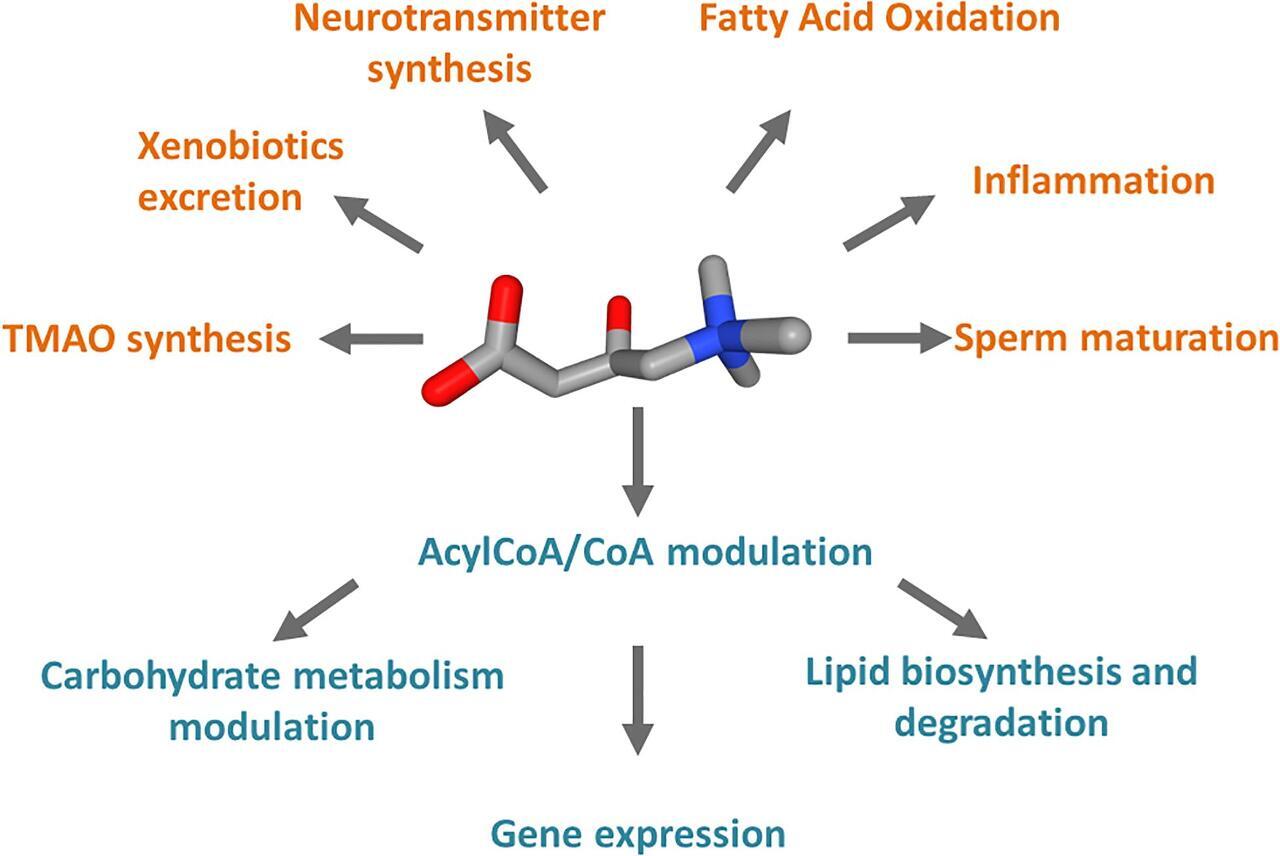
카르니틴과 연결된 세포 과정의 도식적 표현.
카르니틴은 빨간색의 산소 원자와 파란색의 암모늄 원자와 함께 3D 컨포머로 표시됩니다.
주황색은 카르니틴이 관여하는 경로와 카르니틴 대사에서 합성되는 화합물입니다.
청록색에서는 미토콘드리아의 카르니틴 기능에서 파생된 Acyl-CoA/CoA 비율에 의해 조절되는 과정이 있습니다.
Introduction
카르니틴은 인간 대사에서 다면발현성 역할을 하는 중요한 보조인자입니다( 그림 1 ).
주로 간, 신장, 뇌에서 어느 정도 일어나는 내인성 생합성은 인체에 필요한 카르니틴의 25%만 충족하는 반면, 나머지 75%는 규칙적인 식이 요법 하에서 식이에서 얻습니다. ,
육류, 생선, 유제품 및 야채 섭취( Longo et al., 2006 ; Almannai et al., 2019 ).
따라서 카르니틴 항상성은 장 흡수, 내인성 합성 및 신장 재흡수 사이의 균형에 의해 유지됩니다( Pochini et al., 2013 ; Almannai et al., 2019).
특히, 신장은 소변의 카르니틴 배설을 조절하는 데 매우 효율적이어야 합니다. 엄격한 채식주의 식단의 경우, 신장 재흡수는 생합성 증가와 함께 부적절한 카르니틴 섭취를 적어도 부분적으로 보상합니다 .
카르니틴 항상성은 일정한 카르니틴 농도의 단순한 유지로 구성되지 않습니다.
다양한 조직의 세포는 생존을 위해 서로 다른 양의 카르니틴이 필요합니다.
예를 들어, 정자 성숙에 카르니틴이 필요한 고환에서 인체에서 가장 높은 카르니틴 수준에 도달합니다( Bresolin et al., 1982 ; Rebouche and Seim, 1998 ;Pochini et al., 2019 ).
카르니틴 항상성의 동적 균형의 증거는 규칙적인 식이 요법에서 카르니틴 생합성 효소의 결함을 지닌 환자가 카르니틴 결핍을 분명히 나타내지 않는다는 관찰에서 파생됩니다. 왜냐하면 감소된 합성은 카르니틴 식이 섭취와 증가된 신장 재흡수에 의해 보상되기 때문입니다 El-Hattab 및 Scaglia, 2015 ). 반대로, 주로 카르니틴의 흡수 및 신장 재흡수를 매개하는 수송 단백질의 결함은 일차 카르니틴 결핍이라는 증후군을 유발합니다.
카르니틴 항상성의 유지는 지방산 산화(FAO)를 위한 아실 그룹의 셔틀로서 카르니틴의 주요 역할로 인해 세포 대사에서 중요합니다.
실제로, 카르니틴은 다양한 세포내 구획에 존재하는 아실트랜스퍼라제 동종효소에 의해 아실카르니틴으로 전환될 수 있습니다.
예를 들어, 심장에서 아실카르니틴은 FAO를 통해 즉각적인 에너지원을 제공하기 위해 CoA로 전달될 수 있는 활성화된 아실기의 저장소로 작용할 수 있습니다. 몇 가지 특징이 카르니틴을 아실 그룹을 이동시키기 위한 최적의 매개체로 만든다는 점을 강조해야 합니다.
처음에는 카르니틴 유도체가 아실-CoA에 대해 더 안정적이고 덜 반응성입니다( Ramsay and Arduini, 1993);
또한, 아실카르니틴은 특정 수송체에 의해 세포내 막 뿐만 아니라 혈장을 가로질러 이동할 수 있으며, 대사 요구를 충족시키기 위해 다양한 세포내 구획 사이에서 아실 그룹을 이동시킵니다( Indiveri et al., 2010 ).
예를 들어, 미토콘드리아 "셔틀 시스템"은 아실카르니틴과 같은 지방산을 세포질에서 미토콘드리아 기질로 수송하여 이러한 영양소가 ATP 생산을 위해 산화되도록 합니다. 유사한 셔틀이 과산화소체 또는 소포체(ER)에서 제안되었지만 그 존재에 대한 확실한 증명은 아직 부족합니다( 2019년).
카르니틴은 탄수화물 대사, 지질 생합성 및 분해, 유전자 발현의 조절에 중요한 결과를 가져오는 아실-CoA/CoA 균형 조절에 관여합니다( 그림 1 ; Pietrocola et al., 2015 ).
예를 들어, 미토콘드리아 기질의 높은 아세틸-CoA/CoA 비율은 피루브산의 아세틸-CoA로의 산화적 탈카르복실화를 촉매하는 피루브산 탈수소효소(PDH)를 억제합니다( Pietrocola et al., 2015).
주목할만한 점은 PDH가 해당과정과 트리카르복실산(TCA) 회로 사이의 연결을 나타냅니다.
그러면 아세틸-CoA/CoA 비율의 감소는 PDH의 억제를 완화하여 포도당 산화에 영향을 줄 수 있습니다.
반대로 Acetyl-CoA는 pyruvate carboxylase의 활성화제로서 TCA 플럭스 또는 gluconeogenesis를 촉진합니다( Pietrocola et al., 2015 ).
이러한 알로스테릭 효과는 아세틸-CoA에서 카르니틴으로 아세틸기를 전달하여 아세틸카르니틴을 형성하는 미토콘드리아 동위효소인 카르니틴 아세틸트랜스퍼라제(CAT)의 작용을 통해 조절될 수 있습니다.
위에서 설명한 과정과 잘 일치하여 카르니틴은 인슐린 감수성에도 관여하는 것으로 보입니다( 그림 1):
지방 아실-CoA 유도체 또는 아실 대사 산물의 근육 축적이 인슐린 신호 전달과 포도당 산화를 모두 억제하는 것으로 관찰되었습니다( Pietrocola et al., 2015 ; Console et al., 2018 ).
카르니틴과 CoA 유도체를 연결하는 또 다른 대사 관련 화합물은 지방산 생합성에 필요한 말로닐-CoA입니다.
그러나 미토콘드리아 카르니틴 셔틀의 첫 번째 구성 요소인 카르니틴 팔미토일트랜스퍼라제 1(CPT1)과 같은 세포질 기질을 사용하여 카르니틴 아실트랜스퍼라제의 강력한 억제제로 작용합니다
따라서 malonyl-CoA 농도가 증가하면 지방산 합성은 증가하지만 acylcarnitine의 미토콘드리아 기질 및 β-산화 경로로의 흐름은 감소합니다.
또한 카르니틴에서 유래한 아세틸-CoA는 히스톤 아세틸화에 영향을 주어 유전자 발현을 조절하는 것으로 보고되었습니다( Madiraju et al., 2009 ).
카르니틴의 새로운 역할은 최근 인체 건강과 잠재적으로 관련이 있는 것으로 밝혀졌습니다.
카르니틴은 장내 미생물총이 트리메틸아민(TMA)을 방출하는 식이 전구체인 것으로 보고되었습니다.
트리메틸아민(TMA)은 인간 세포 대사를 거쳐 간 플라빈 모노옥시게나제(FMO; Phillips and Shephard, 2020 )에 의해 트리메틸아민 N-옥사이드(TMAO)로 전환됩니다.).
인간 건강과의 관련성 측면에서 카르니틴은 항염 및 항산화 특성을 나타냅니다( Bene et al., 2018 ; Wang et al., 2020 ; 그림 1 ).
뇌에서 아세틸카르니틴은 신경전달물질의 합성을 지원합니다( Pochini et al., 2019 ; 그림 1 ).
마지막으로, 카르니틴은 부분적으로 대사된 아실 그룹에서 파생된 화합물의 독성과 카르니틴 에스테르 형태의 배설을 촉진함으로써 생체이물 분해를 줄이는 데에도 사용됩니다( Duran et al., 1990 ; Bene et al., 2018 ; 그림 1).).
위에서 설명한 광범위한 기능 모음은 인체의 카르니틴 수송을 조절하는 전용 막 수송기가 제공하는 조직 및 세포 하위 구획을 가로지르는 적절한 상호 연결 없이는 충족될 수 없습니다.
이러한 점에서 암과 같은 병리학적 조건에서 이 트래픽이 변경되는 것은 놀라운 일이 아닙니다.
카르니틴 트래픽의 변화와 암세포의 전형적인 대사 전환 사이의 관계에 대한 개요가 현재 검토의 대상이 될 것입니다.
카르니틴 트래픽
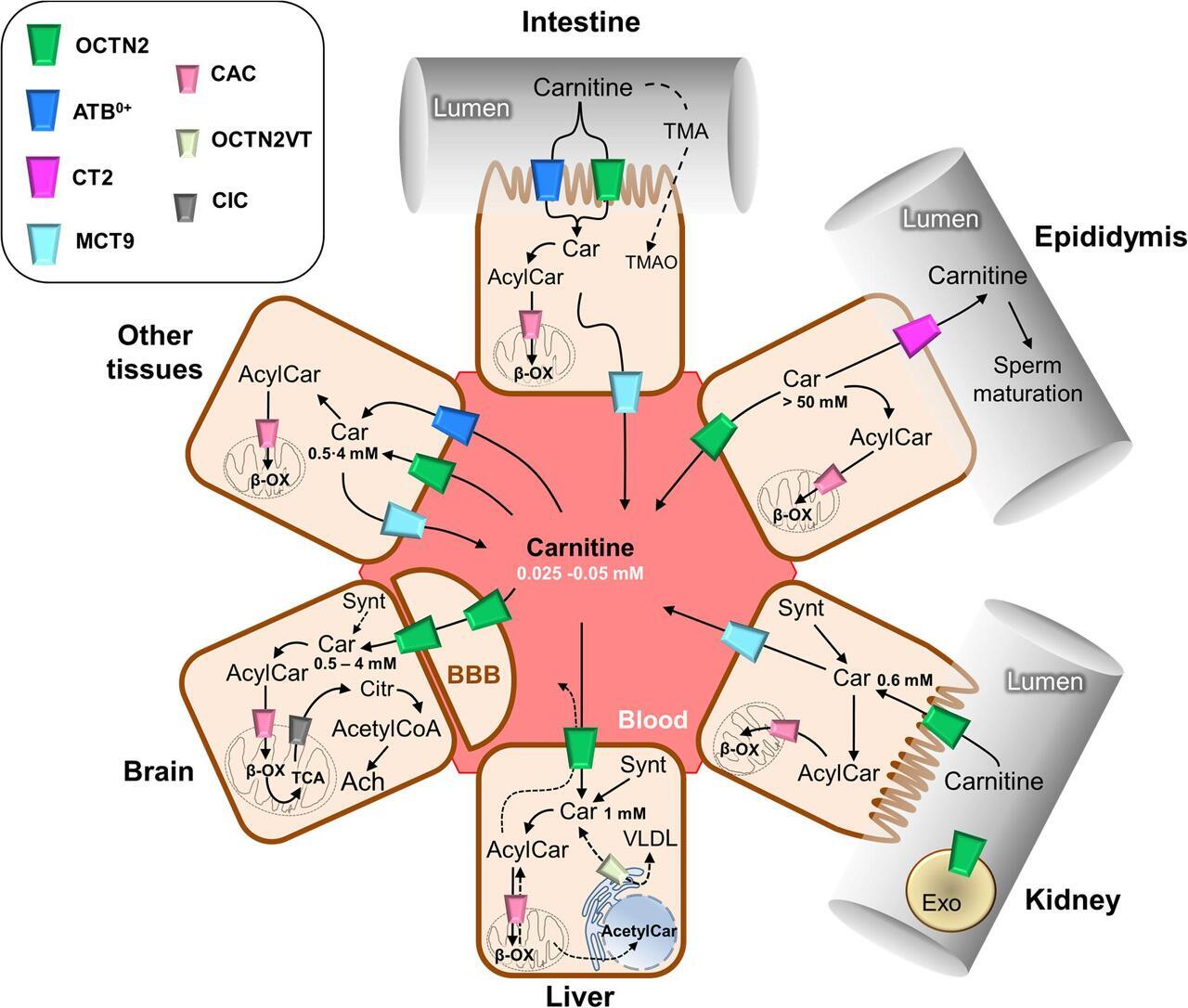
카르니틴 트래픽의 도식적 표현.
Carnitine(Car) 트래픽은 연속 화살표로 설명됩니다.
점선 화살표는 카르니틴 수송에 간접적으로 관여하는 카르니틴 유도체 및 트리메틸아민(TMA)과 같은 일부 다른 기질의 수송을 나타냅니다.
OCTN2(organic cation transporter novel 2)는 나트륨 의존 메커니즘에 의해 카르니틴 수송을 매개하는데, 명확성을 위해 보고되지 않았습니다.
ATB0,+는 명확성을 위해 보고되지 않은 나트륨 및 염화물 의존성 수송을 매개합니다.
미토콘드리아 카르니틴 운반체인 카르니틴/아실카르니틴 운반체(CAC)는 β-산화(β-ox)의 완료를 허용하고 미토콘드리아에서 아실카르니틴/카르니틴 항포트를 매개합니다.
이는 그림 3에 자세히 보고되어 있습니다. OCTN2의 가장 긴 동형, OCTN2VT는 소포체(ER)에 표시됩니다. 다른 수송체는 발현되는 세포 유형에 표시됩니다.
신경 전달 물질인 아세틸콜린(Ach) 합성에서 카르니틴의 역할은 뇌 조직을 나타내는 스케치에 보고되어 있습니다.
혈액 뇌 장벽은 BBB로 표시됩니다.
다른 조직의 카르니틴 농도가 보고됩니다.
Synt, 카르니틴 합성;
CIC, 시트레이트 수송체;
Citr, 시트르산염;
Exo, 엑소좀;
VLDL, 초저밀도 지단백질;
BBB, 혈액뇌장벽.
카르니틴의 장 흡수 및 신장 재흡수는 주로 카르니틴 처리 수송체 중에서 카르니틴에 대한 가장 높은 친화도를 나타내는 원형질막 유기 양이온 수송체 소설 2(OCTN2 – SLC22A5)에 의해 매개됩니다.
OCTN2에 의해 매개되는 카르니틴 수송은 Na + 의존적입니다.
이 기능은 세포 내 카르니틴 축적을 허용하여 세포 내 공간과 혈액 사이의 농도 구배를 발생시킵니다. 카르니틴의 세포내 농도는 1~5mM인 반면 혈장 농도는 25~50μM입니다( Bene et al., 2018). 카르니틴 흡수 및 조직 분포에서 OCTN2의 주요 역할은 OCTN2 유전자, 즉 PCD의 선천적 결함으로 인한 인간 질병의 존재에 의해 입증됩니다( Magoulas and El-Hattab, 2012 ). 이 질병은 FAO에서 카르니틴의 중요한 역할에 따라 일반적인 대사 이상, 심근병증, 고암모니아혈증, 저혈당, 근력 약화 및 근육병을 특징으로 합니다( Nezu et al., 1999 ). 흥미롭게도, 이 장애의 임상 증상은 고용량의 카르니틴을 보충함으로써 개선될 수 있습니다. 위에서 설명한 증상의 부분적인 구조는 ATB 0,+ 와 같은 다른 수송체의 활동에 기인할 수 있습니다.(SLC6A14), MCT9 및 아마도 OCTN1(SLC22A4)은 OCTN2에 비해 훨씬 낮은 친화도로 카르니틴을 수용합니다.
ATB 0,+ 는 폐( Sloan et al., 2003 ), 눈( Ganapathy and Ganapathy, 2005 ), 유선( Nakanishi et al., 2001 )에서도 발현됩니다 .) 이러한 조직에서 카르니틴 분포를 허용합니다.
원형질막 수송체 MCT9와 관련하여, 그 수송 특징은 여전히 잘 특성화되지 않습니다.
MCT9는 신장과 부신에서 가장 높은 발현 수준으로 어디에나 존재합니다.
실제로, MCT9 발현은 전염증성 종양 괴사 인자-α(TNF-α)에 의해 증가됩니다. 이는 결과적으로 염증 반응을 유지하기 위해 FAO를 통한 에너지 생산에 기여하는 내피 세포의 카르니틴 축적을 유도합니다( Knyazev et al., 2018 ).
고환과 부고환에서 카르니틴 농도는 부고환 내강에서 최대 60mM까지 신체의 최고 수준에 도달합니다. 부고환 내강과 혈장 사이의 훌륭한 카르니틴 농도 구배는 혈액 측에 OCTN2의 존재와 상피의 내강 측에 있는 CT2(SLC22A16)와 같은 또 다른 카르니틴 특이적 수송체의 존재에 의해 허용됩니다( Gong et al., 2002 ).
놀랍게도 CT2는 그 기능이 극적으로 확장되면서 인간 암에서 거의 도처에 존재하게 됩니다( Koepsell, 2013).
세포에 들어간 후 세포질과 세포 내 구획 사이의 카르니틴 트래픽이 필요합니다.
따라서 세포 소기관 막에 위치한 수송체는 카르니틴 및 그 유도체의 세포 내 이동을 충족시키기 위해 작동해야 합니다.
세포내막의 가장 잘 연구된 수송체는 미토콘드리아 카르니틴 셔틀의 중심 구성요소인 미토콘드리아 카르니틴/아실카르니틴 운반체(CAC; SLC25A20)입니다( 그림 3).
이 시스템에는 미토콘드리아 외막을 잡고 아실-CoA를 아실카르니틴으로 변환하는 CPT1이 포함됩니다.
이들은 CAC를 통해 내부 미토콘드리아 막을 통과합니다.
일단 미토콘드리아 기질에 들어가면 카르니틴 팔미토일트랜스퍼라제 2(CPT2)는 산화 및 에너지 생산을 위해 아실카르니틴을 다시 아실-CoA로 전환합니다( 그림 3 , Indiveri et al., 2011 ).
유전자 발현 조절에서 카르니틴의 역할과 관련된 아직 해결되지 않은 문제( 그림 1 )는 미토콘드리아와 핵 사이의 연결입니다.
미토콘드리아에서 생성된 아세틸카르니틴은 아세틸 단위를 제공하는 핵에 도달합니다( 그림 2).
카르니틴 트래픽에서 이 추가 단계는 아세틸카르니틴에서 아세틸-CoA를 재생하기 위해 CAT의 핵 동형이 존재하는 경우 가능할 수 있습니다.
또한, TMAO 합성을 매개하는 카르니틴의 역할은 인간의 건강과 관련이 있습니다. 실제로 TMAO는 죽상동맥경화증을 촉진하고 심혈관 위험을 증가시키는 요인 중 하나로 제안되었습니다( Koeth et al., 2013 ; Gao et al., 2017 ; Roncal et al., 2019 ).
마지막으로, 세포내 기원의 소포, 즉 엑소좀과 연결된 카르니틴 트래픽의 새로운 분기가 제안되었습니다. 이와 관련하여 원형질막 수송체 OCTN2가 탑재된 엑소좀은 카르니틴을 흡수하는 능력을 한 세포에서 다른 세포로 전달할 수 있습니다.
이는 카르니틴이 염증 반응에 관여하고 상피에서 OCTN2의 발현이 INF-γ 및 TNF-α와 같은 염증성 사이토카인에 의해 조절될 수 있다는 제안과 잘 관련됩니다

미토콘드리아 β-산화 경로에서 카르니틴의 역할.
유기 양이온 수송체 Novel 2(OCTN2)는 세포에서 카르니틴의 흡수를 매개합니다.
지방산(FA)은 CD36을 통해 원형질막을 통과합니다.
세포질에서 FA는 아세틸-CoA 합성 효소(ACS)에 의해 아실-CoA로 전환된 다음 카르니틴 셔틀에 의해 미토콘드리아 기질에서 전위됩니다.
셔틀은 카르니틴 팔미토일트랜스퍼라제 1(CPT1), 카르니틴/아실카르니틴 운반체(CAC) 및 카르니틴 팔미토일트랜스퍼라제 2(CPT2)로 구성됩니다.
일단 매트릭스에 들어가면 아실-CoA는 β-산화(β-ox)를 겪으며 아세틸-CoA가 생성되어 트리카르복실산 회로(TCA)에 진입합니다.
NADH와 FADH2는 β-산화와 TCA에 의해 생성된다.
지방산 대사, 카르니틴 및 암
카르니틴 공급은 미토콘드리아에 의한 지방산의 베타 산화를 수행하기 위한 필수 조건입니다.
이것은 세포에서 가장 효율적인 에너지 생산 경로 중 하나이므로 심장 및 신장과 같은 고에너지 요구 조직은 주로 지방산 이용에 의존합니다(Console et al., 2020). 우리가 인간의 질병을 고려한다면, 높은 에너지 요구를 특징으로 하는 병리학적 상태는 암입니다.
암세포는 높은 증식 속도를 유지하기 위해 에너지가 필요하며 악성 종양의 등급에 따라 더 많은 에너지가 필요합니다(Hanahan and Weinberg, 2011).
FAO 교란과 암의 연관성은 1952년부터 연구되어 왔습니다(Waterman et al., 1952).
그러나 암 세포의 대사 적응 분야에서 현재 가장 큰 증거는 글루타민과 포도당을 주요 에너지원으로 유연하게 활용하는 방법을 다루고 있습니다. 에너지 기질인 포도당과 글루타민은 암세포의 특징으로 간주되며 사실상 혐기성 조건에서 사용할 수 있도록 하는 대사 스위치는 Warburg 효과로 알려져 있습니다
Warburg 효과에 대한 표준 해석은 세포가 적절한 산소 공급이 있는 경우에도 ATP 합성을 위해 미토콘드리아 호흡 사슬을 우회한다는 것을 의미합니다(Ganapathy et al., 2009). 그러나 오늘날에는 ATP 수율 측면에서 이러한 기질의 효율성에 따라 지방산의 활용도 포함하는 보다 일반적인 대사 맥락에서 Warburg 효과를 고려해야 한다는 것이 분명합니다.
이러한 관점에서 암의 미토콘드리아 기능은 완전히 손상되지 않고 TCA와 산화적 인산화 경로가 작동하고 있습니다(Currie et al., 2013).
이에 따라 해당작용과 산소 소모 대사에 이중 능력을 가진 일부 암이 존재한다는 것이 점점 더 분명해집니다.
설명된 대사 유연성은 다른 유형의 암에서, 그리고 동일한 암 유형 내에서 다른 진행 단계에서 관찰되는 관련 현상입니다. 지질 대사와 관련하여 일부 암 유형에서는 지방산 이용이 증가하는 반면 다른 유형에서는 이 경로가 하향 조절된다는 강력한 증거가 있습니다.
언급된 모든 경우에 FAO에서의 역할을 고려할 때 카르니틴 수준 및/또는 트래픽을 조절하는 데 적절한 개입이 필요하다는 점은 주목할 만합니다. FAO의 변경은 막 구조 지질의 가용성, 신호 전달 기능이 있는 지질의 풍부함, 에너지 생산 및 활용을 위한 지질의 합성 및 분해에 영향을 미칠 수 있습니다
예를 들어, 전립선암 및 미만성 거대 B 세포 림프종은 FAO를 주요 에너지원으로 사용하고 FAO 효소를 높은 수준으로 발현합니다(Liu, 2006; Svensson et al., 2016; Yamamoto et al., 2020).
FAO 기질은 CD36과 같은 지방산 흡수를 매개할 수 있는 특정 수송체를 통해 외부 환경에서 파생됩니다(그림 3). 이것은 지방 조직에 지방산을 저장하고 ATP를 생성하기 위해 세포에서 지방산을 흡수하도록 하는 막 수송체입니다. CD36은 머리핀 형태를 가진 무거운 글리코실화된 단백질입니다. 실제로 이는 기질 결합 후 CD36 기능에 필요한 2개의 막횡단 도메인, 큰 세포외 도메인 및 2개의 짧은 세포내 도메인으로 구성됩니다(Su and Abumrad, 2009).
지질 대사에 의존하는 암에서는 CD36 및 기타 지방산 결합 단백질(FABP)이 과발현되어 주변 지방 세포에 저장된 지방산을 포착합니다(Koundouros and Poulogiannis, 2020). CD36은 소수성 지방산 분자를 그대로 처리하여 카르니틴 네트워크에 직접 참여하지 않기 때문에 카르니틴 및 아실카르니틴의 트래픽을 조절하는 수송체와 구별됩니다.
FAO에 대한 또 다른 지질 공급원은 일반적으로 암세포에서 형성되는 지질 방울입니다.
지방산에서 합성된 ATP의 직접적인 이점 외에도 FAO는 전자 수송 사슬 활동에서 파생된 산화 스트레스 관리와도 관련이 있습니다.
실제로, FAO의 최종 산물인 아세틸-CoA는 TCA에 들어가고 이소시트레이트로 주기를 남길 수 있습니다. 그런 다음 이것은 세포질 isocitrate dehydrogenase 1(IDH1)에 의해 활성 산소종으로부터 해독에 필요한 NADPH의 생성과 함께 α-ketoglutarate로 산화됩니다(ROS; Jeon et al., 2012; Qu et al., 2016). 그런 다음 α-케토글루타레이트는 주기를 완료하기 위해 TCA로 다시 들어갈 수 있습니다. NADPH에 대한 강력한 요구 사항은 암 세포에서 활성화되어 필요를 충족시키는 다양한 경로의 존재로 입증됩니다.
NADPH는 또한 말산 효소 및 5탄당 인산 경로의 활성에서 유래할 수 있습니다. 이들 효소를 암호화하는 유전자는 전사 인자 Nrf2의 상류에서 작용하는 종양유전자 AKT에 의해 긍정적으로 조절됩니다.
또한 AKT는 NADK(nicotinamide adenine nucleotide kinase)를 직접 활성화할 수 있습니다.
암에서 CAC의 의미
현재까지 CAC와 암 사이의 상관관계는 거의 주목을 받지 못했으며, CAC의 발현 변화와 암 사이의 연관성을 보고한 연구는 소수에 불과합니다( 표 1 ).
이전에 설명된 바와 같이, 전립선암 세포는 정상 전립선 세포보다 FA 이용률이 더 높습니다.
FAO 규제 완화에 대한 큰 기여는 CPT1A, CAC 및 CAT를 표적으로 하는 동일한 microRNA의 하향 조절 때문입니다.
CAC가 미토콘드리아 기질로의 아실 부분의 전위 속도에 주로 영향을 미친다는 것은 그럴듯합니다. 실제로, CAC의 활성과 β-산화율 사이의 직접적인 연관성이 제안되었습니다( Indiveri et al., 2011 ; Tonazzi et al., 2015 ).
결론
카르니틴 항상성의 유지는 FAO가 높은 비율로 발생하는 생리학적 및 병리학적 조건에서 세포 수명에 매우 중요합니다.
실제로 카르니틴은 FAO의 세포내 막을 통해 아실 그룹을 이동시키는 핵심 역할을 합니다.
몇몇 인간 암은 악성 종양으로의 진행 및 발달을 위해 FAO에 의존합니다.
또한 카르니틴은 아실-CoA/CoA 균형 조절에 중요하며, 이는 탄수화물과 지질 대사를 조절합니다.
카르니틴과 아실카르니틴 트래픽은 세포 표면과 세포 내 소기관에 국한된 전용 막 수송체의 협력 활동 없이는 발생할 수 없습니다.
묘사된 시나리오에 따라, 카르니틴 수송을 조절하는 수송체의 이상과 그에 따른 카르니틴 항상성이 여러 인간 암에서 발견되었습니다.
특히, OCTN2 및 CT2의 발현/기능의 변화가 인간 암에서 관찰되어 카르니틴의 세포 공급이 암 발달 동안 엄격하게 조절되고 이들 단백질의 화학적 KO가 FAO로부터의 에너지 생산을 손상시키는 전략으로 작용할 수 있음을 나타냅니다.
흥미롭게도 정상 조건에서 매우 좁고 특정한 조직 분포를 갖는 CT2는 CT2가 정상적으로 존재하지 않는 조직에서 유래한 암에서도 널리 발현되어 인간 암에서 카르니틴의 역할을 더욱 강조합니다.Scalise et al., 2018 ).
주목할만한 점은, 이 두 개의 막 수송체는 또한 세포에서 약물 흡수를 담당하며, 새로운 항암 접근법을 개발하고/하거나 이미 존재하는 접근법을 개선하는 역할을 더욱 강조합니다.
실제로, CT2 및 OCTN2는 각각 독소루비신 및 옥살리플라틴과 같은 여러 항암제의 흡수를 매개합니다. 그런 다음, 발현이나 활성의 변화는 일부 치료법의 비효과를 설명할 수 있으며 카르니틴 유도체 형태의 약물 전달을 개선하는 데 이용될 수 있습니다
'대사' 카테고리의 다른 글
| ⚡해당과정과 미토콘드리아와 항산화시스템을 타깃으로 한 암 치료-란야 (0) | 2021.08.09 |
|---|---|
| ⚡암세포의 에너지생산 특징을 이용한 암치료-란야 (0) | 2021.08.09 |
| 케톤체 이용은 종양 성장 및 전이를 유도 (0) | 2021.07.19 |
| ⚡*대사-암치료(蘭野芳에서 인용)* (0) | 2021.07.12 |
| 오탄당 인산염 경로-Pentose Phosphate Pathway(PPP) (0) | 2021.07.09 |