https://cafe.naver.com/cancertreatment/223
삶 프로토콜
대한민국 모임의 시작, 네이버 카페
cafe.naver.com
https://link.springer.com/article/10.1007/s00109-015-1307-x
<Hypoxia, cancer metabolism and the therapeutic benefit of targeting lactate/H+ symporters>
포도당 수송체와 다운스트림 해당 효소는 암의 70% 이상에서 과발현됩니다[ 23 , 24 ].
이 상향 조절은 주로 저산소증 유발 전사 인자 HIF-1과 Myc에 의해 단독으로 또는 협력하여 주도됩니다.
성장과 신진대사를 악화시키는 추가 요인에는 종양 유전자(Akt, PI3K, mTOR, Ras, Raf) 및 종양 억제 유전자(VHL, PTEN, p53)의 손실이 있습니다.22 , 25 ].
종양유전자와 종양 억제인자는 또한 HIF-1α의 중요한 활성제이며, O2 와는 독립적인 방식으로 HIF의 번역(PI3K, PTEN) 및 안정화(VHL)를 증가시킵니다..
결과적으로 광범위한 유전자의 전사가 발생하며 그 중 일부는 대사 재프로그래밍과 관련이 있습니다..
배아 및 종양과 같이 빠르게 성장하는 세포에서 HIF-1α 수치가 상승하면 해당 작용을 자극할 뿐만 아니라 미토콘드리아 피루브산 탈수소효소(PDH)의 억제를 통해 미토콘드리아 호흡을 제한하여 트리카르복실산(TCA) 회로로의 피루브산 유입을 감소시킵니다[ 29 , 30].
포도당 플럭스를 재프로그래밍하는 PDH의 이러한 HIF-1 매개 억제는 바르부르크 효과의 주요 기반입니다.
대부분의 암세포에서 포도당은 해당과정을 수행하는 데 사용될 뿐만 아니라 오탄당 인산 경로(PPP)와 같은 대체 경로에 의해 대사될 수도 있습니다(그림 1 ).
NADPH와 리불로스-5-포스페이트를 생성함으로써 PPP는 글루타티온 생성, 지방산, 스테롤 및 핵산 합성을 촉진하여 세포가 산화 스트레스에 대응하도록 돕고 DNA 손상 복구를 촉진하며 화학요법 및 방사선에 대한 내성을 부여합니다.
따라서 뉴클레오티드 및 생합성 전구체에 대한 지속적인 요구를 충족시키기 위해 악성 및 증식성 종양은 종종 다른 메커니즘을 통해 PPP를 상향 조절합니다.
그림 1

암세포에서 포도당과 글루타민 대사의 도식적 표현.
특정 수송체(GLUT)를 통해 세포에 들어간 후 포도당은 피루브산으로 대사됩니다.
암세포에서 피루브산은 주로 젖산 탈수소효소 A(LDHA)에 의해 젖산으로 전환되는 반면 HIF-1에 의해 유도된 피루브산 탈수소효소 1(PDK1)에 의한 미토콘드리아 피루브산 탈수소효소(PDH)의 억제를 통해 트리카르복실산(TCA) 주기의 이화작용이 제한됩니다.
해당 과정( 굵은 화살표 )은 5탄당 인산 경로( 파란색 화살표 )에 의해 대사되는 또 다른 중요한 중간체인 포도당-6-인산(포도당-6-P)을 생성하며, 이는 글루타티온 및 핵산을 위한 NADPH 및 리보스-5-인산을 생성합니다.
합성. 글루타민분해( 보라색 화살표)는 암세포의 대체 에너지원입니다.
먼저 세포질에서 글루타미나제(GLS)에 의해 글루타메이트로 전환된 글루타민은 글루타메이트에서 α-케토글루타레이트(α-KG)로의 전환을 통해 트리카르복실산(TCA) 주기(아나플러시스)를 보충합니다.
글루타민분해는 또한 지질, 아미노산, 뉴클레오티드의 합성 및 유비쿼터스 모노카르복실레이트 수송체 1(MCT1) 및 저산소증 유도성 MCT4에 의해 세포 밖으로 수송되는 젖산 생성에 기여합니다.
저산소증 유발 인자(HIF), 포도당-6-인산 탈수소효소(G6PD), 미토콘드리아 피루브산 운반체(MPC), 옥살로아세테이트(OAA), L 형 아미노산 운반체 1(LAT1), Asc형 아미노산 운반체 2(ASCT2) )

종양 성장 및 전이 촉진에 있어서 암 생성 젖산의 다양한 역할.
강화된 해당작용과 글루타민분해는 모노카르복실레이트 수송체(MCT) 1과 4에 의해 내보내지는 다량의 젖산을 생성합니다.
세포외 환경에서 젖산의 축적은 세포외 pH(pHe)의 저하, 종양 미세환경의 산성화를 유도하고 여러 암 과정을 촉진합니다
세포 생존, 종양 성장 및 전이로 이어집니다.
젖산은 종양 및 내피 세포에 의한 혈관 내피 성장 인자(VEGF) 및 수용체 VEGFR2의 생성을 증가시켜 혈관신생을 자극합니다.
젖산은 또한 저산소증 유발 인자 1(HIF-1), N-Myc 다운스트림 조절 유전자 3(NDRG3) 단백질의 활성화 및 인터루킨 8(IL8) 생성의 자극을 통해 혈관신생을 유도합니다.
증가된 세포외 젖산 수치는 CD44와의 상호작용을 통해 섬유아세포 및 암세포 세포골격에 작용하는 히알루로난 생성을 촉진하여 암세포 운동성에 영향을 미칩니다.
더 중요한 것은 변경된 암 대사에 의해 생성된 젖산이 주로 인간 T 림프구(T 세포) 및 자연 살해(NK) 세포.의 세포독성 활성 감소를 통해 면역 감시를 피하는 데 중요한 역할을 한다는 것입니다.75 , 76 ]
또한 젖산은 수지상 세포 성숙을 감소시키고 골수 유래 억제 세포의 축적을 유도하며 종양 관련 대식세포의 M2 유사 분극화를 촉진합니다

암의 종양 미세 환경 및 젖산 셔틀 모델.
관류된 혈관에서 멀리 떨어진 세포는 빠르게 저산소 상태가 되고 증식을 위해 해당 작용에 의존합니다.
따라서 이들은 모노카르복실레이트 수송체 4(MCT4)에 의해 압출되는 다량의 젖산을 생성합니다.
젖산은 이후 모노카르복실레이트 수송체 1(MCT1)을 통해 내피 세포에 의해 흡수되고, "혈관 내피 젖산 셔틀"이라고 하는 현상인 젖산 탈수소효소 B(LDHB)에 의해 피루브산으로 전환됩니다.
Pyruvate는 hypoxia-inducible factor 1α(HIF-1α)를 안정화시켜 종양의 혈관신생을 유도합니다.
MCT1을 고도로 발현하는 정상산소 암세포는 또한 산화적 인산화(OXPHOS)를 수행하기 위해 저산소 암세포에서 생성된 젖산을 우선적으로 흡수합니다.
이 "대사 공생"은 종양의 저산소 영역이 높은 수준의 포도당을 획득하고 그 결과 젖산을 생성하도록 합니다.
또한, 고도로 해당 작용을 하고 MCT4를 발현하는 암 관련 섬유아세포도 산화성 암세포에 젖산을 공급합니다.
다른 젖산 셔틀에 추가하여 "역 Warburg 효과"라고 하는 이 종양-기질 협력은 종양 내에서 젖산 및 포도당 소비 구배의 설정을 초래합니다
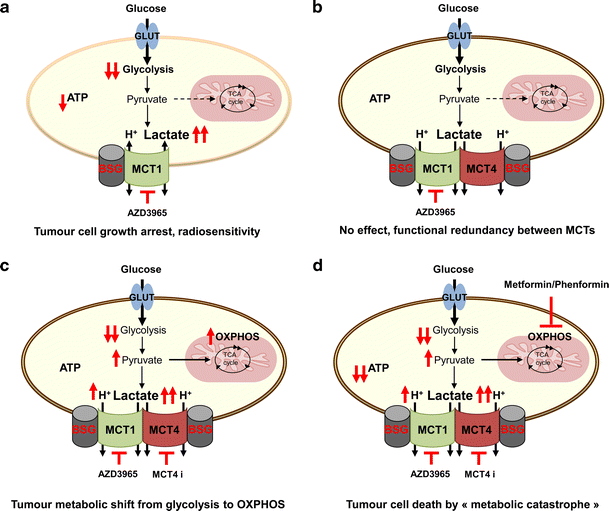
항암 치료를 위한 젖산/H+ 심포터 표적의 효율성.
a 몇몇 산화성 암세포는 젖산을 사용하여 ATP를 생성할 수 있으므로 AstraZeneca의 특정 억제제 AZD3965로 모노카르복실레이트 수송체 1(MCT1)을 억제하면 성장이 정지됩니다.
해당작용이 있고 MCT1만 발현하는 다른 유형의 암세포도 성장 감소, 세포 사멸 및 방사선 민감성을 나타내는 MCT1 억제제에 민감할 것입니다.
b 대부분의 해당암 세포는 MCT1과 MCT4를 모두 발현합니다.
이 두 MCT 사이의 기능적 중복성으로 인해 AZD3965는 종양의 저산소 영역에 영향을 미치지 않습니다.
c MCT1 및 MCT4의 결합된 억제는 해당 속도 감소 및 심각한 성장 정지를 초래합니다.
그러나, 증가된 세포내 젖산 풀 및 후속적으로 증가된 세포내 피루브산 농도는 트리카르복실산(TCA) 주기에 연료를 공급하여 해당 작용에서 OXPHOS로의 대사 이동을 유도합니다.
따라서 종양 세포는 천천히 성장하지만 생리학적 ATP 풀을 유지하여 생존하고 젖산 수출 차단을 피할 수 있습니다.
d OXPHOS를 억제하는 메트포르민 또는 펜포르민과 MCT 억제제의 동시 적용은 합성 치사율을 유도하여 "ATP 위기"를 초래합니다.
결과적으로 "대사 재앙"으로 인해 빠른 종양 세포 사멸이 발생합니다.
바시긴(BSG); MCT4 억제제(MCT4 i)
*******************************************************************
https://pubmed.ncbi.nlm.nih.gov/31395464/
Monocarboxylate transporters in cancer - PubMed
Lactate and MCTs, especially MCT1 and MCT4, are important contributors to tumor aggressiveness. Analyses of MCT-deficient (MCT+/- and MCT-/-) animals and (MCT-mutated) humans indicate that they are druggable, with MCT1 inhibitors bein
pubmed.ncbi.nlm.nih.gov
<Monocarboxylate transporters in cancer>

그림 2 암에서 젖산 교환을 기반으로 한 대사 공생 및 공생.
이 그림은 암세포에 포도당과 산소를 전달하는 종양을 공급하는 혈관을 묘사합니다.
산화성 암세포는 혈관에 가깝게, 저산소성 암세포는 멀리, 숙주세포를 바닥에 표현하였다.
대사적 관점에서 볼 때 저산소성 암세포는 생존을 위해 혐기성 해당과정을 수행할 수밖에 없는데, 이는 많은 양의 포도당에 접근할 수 있음을 의미합니다.
이에 비해 산화성 암세포는 여러 가지 다른 대사 연료를 사용할 수 있습니다.
근처의 해당 세포가 젖산염을 제공할 때(보통 MCT4 의존적 과정), 젖산염을 포도당보다 우선적으로 산화 연료로 사용합니다(보통 MCT1 의존적 과정).
산화성 암세포는 숙주 세포가 해당 대사를 채택하도록 하여 추가적인 젖산을 얻을 수 있습니다.
젖산을 이용할 수 없거나 MCT가 억제되면 산화성 암세포가 포도당 기반 대사로 전환되어 다른 세포에서 이 중요한 자원을 빼앗아 궁극적으로 저산소성 암세포를 죽입니다.
따라서 MCT1 및 MCT4 억제제는 암에서 젖산 교환을 기반으로 하는 대사 공생과 공생을 모두 파괴할 수 있습니다.
********************************************************************
https://www.frontiersin.org/articles/10.3389/fcell.2020.00651/full
Role of Proton-Coupled Monocarboxylate Transporters in Cancer: From Metabolic Crosstalk to Therapeutic Potential
Proton-coupled monocarboxylate transporters (MCTs), representing the first four isoforms of the SLC16A gene family, mainly participate in the transport of lactate, pyruvate, and other monocarboxylates. Cancer cells exhibit a metabolic shift from oxidative
www.frontiersin.org
<Role of Proton-Coupled Monocarboxylate Transporters in Cancer: From Metabolic Crosstalk to Therapeutic Potential>
MCT1 선택적 억제의 또 다른 단점은 MCT1 활성에 대한 MCT4의 보상 효과로 인해 MCT4가 발현될 때 효과가 없다는 것입니다( Fiaschi et al., 2012 ).
그러나 MCT4 억제제는 아직 발견 단계에 있습니다.
MCT1과 MCT4를 동시에 억제하는 약물을 개발하면 젖산 분비와 종양 성장을 차단하는 데 더 효과적일 수 있습니다.
그러나 MCT1/4 억제제를 통한 젖산 흡수의 억제는 종양 세포 생존을 유지하기 위해 미토콘드리아 대사에 대한 포도당 유입을 유도할 수 있습니다( Beloueche-Babari et al., 2017 ; Corbet et al., 2018).
따라서 MCT1/4 억제제와 미토콘드리아 복합체 I 억제제 메트포르민 또는 미토콘드리아 피루브산 운반체 억제제와 같은 미토콘드리아 표적 요법의 병용 투여는 상승된 미토콘드리아 대사를 상쇄할 수 있습니다.
MCT1이 젖산 수송체로서의 역할 이상으로 종양 진행을 중재할 수 있다는 점은 주목할 만합니다.
예를 들어, MCT1은 전사 인자 NF-κB를 활성화하여 수송체 활성과 독립적으로 종양 세포 이동을 촉진하는 것으로 밝혀졌습니다( Payen et al., 2017 ).
이는 종양 발달을 차단하기 위한 MCT1 억제제 및 기타 치료제의 조정이 향후 약리학적 전략의 핵심 포인트가 될 수 있음을 시사합니다.

종양 미세 환경 내 대사 공생.
MCT1, 모노카르복실레이트 수송체 1; MCT4, 모노카르복실레이트 수송체 4; M2 대식세포, 대안적으로 활성화된 대식세포.
***************************************************************
? 삶 프로토콜
MCT1, MCT4를 억제
퀘르세틴 (또는 디클로페낙) + 스타틴
미토콘드리아 컴플렉스1을 억제
아세토제닌, 호노키올, 메트포르민, 피르비늄 중에서 3제 이상을 사용
(ROS를 이용하시는 표준항암의 경우에는 호노키올이 빠져야 하고, 구충제인 니클로사미드나 니타족사나이드도 추가가 가능합니다.)
오토파지를 억제
피르비늄, 로라타딘, 디피리다몰, 클로로퀸 등으로 합니다. (니클로사미드, 니타족사나이드, 베르베린 고용량 등을 사용해볼 수도 있습니다.) 이미프라민
apoptosis (oncogene shock 상태로 )
항암제와 구충제 등을 더해서
'정보' 카테고리의 다른 글
| ?Advanced Clinical Naturopathic Medicine-Elsevier (2020) (0) | 2021.08.27 |
|---|---|
| ⚡종양미세환경 (0) | 2021.08.22 |
| ⚡ 암세포의 에너지생산 특징을 이용한 암치료-란야 (0) | 2021.08.22 |
| ⚡약물과 영양제의 상호작용과 부작용--리리 (0) | 2021.08.22 |
| ⚡ 산화환원 균형--루스 (0) | 2021.08.22 |