2017
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5514969/
Combination therapy in combating cancer
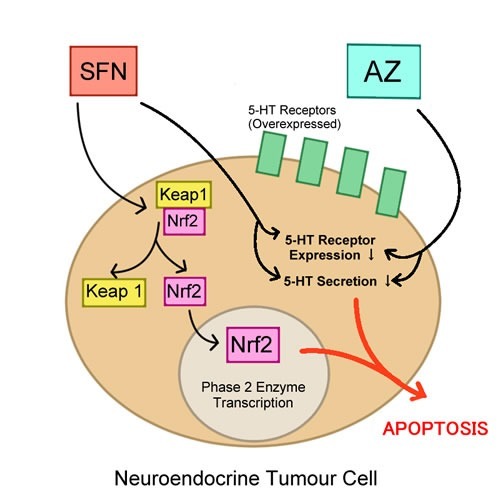
용도가 변경된 아세타졸아미드(AZ)가 인간 신장 암종 세포에서 5-HT 분비 및 증식을 감소시키는 것으로 이전에 보고된 바 있습니다 (5-HT autocrine growth factor)
Hypoxia and the carbonic anhydrase pathway
암세포는 정상 세포와 다른 특성을 가지고 있으며 이러한 중요한 특성 중 하나는 부분적으로 불규칙한 혈관 구조로 인한 비정상적인 성장 패턴입니다.
이 비정상적인 성장 패턴은 결과적으로 영양 혈관 사이의 큰 확산 거리를 초래합니다..
종양에 산소를 공급하는 혈액의 부족은 종양 개시 세포의 출현을 선호하는 강한 저산소 상태를 만듭니다.
산소 부족은 종양 분화를 억제하고 CSC가 번성할 수 있도록 프로그래밍을 상향 조절합니다.
또한, 저산소 상태는 암세포가 산화적 인산화 대신에 혐기성 해당과정을 채택하도록 유도하며, 이는 본질적으로 종양 미세 환경에서 젖산 축적과 낮은 세포외 pH 수준으로 이어집니다.
또한, 저산소 상태에서 전사 인자인 저산소 유도 인자-1(HIF1alpha)이 핵으로 전위되어 HIF-1베타와 이량체화되어 혈관 신생, 상피-중간엽 전이, 세포 생존, 및 전이에 관련된 다양한 유전자 발현을 유도합니다.
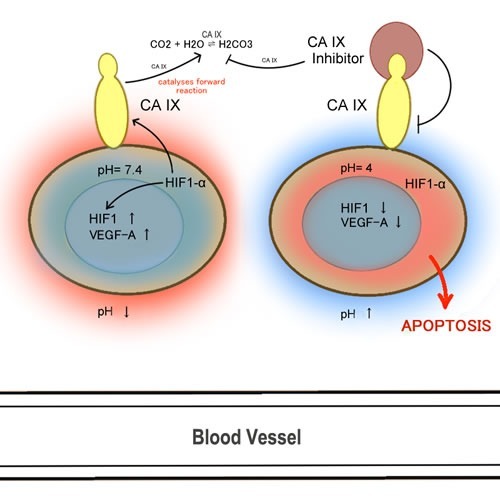
HIF1alpha에 의해 활성화되는 특히 중요한 유전자는 탄산탈수효소(carbonic anhydrase, CA) 이며, CA는 이산화탄소의 양성자와 중탄산염으로의 가역적 전환을 촉매하여 종양 미세 환경의 산성 조건을 중화함으로써 종양이 저산소 스트레스에 적응하도록 돕습니다[
생체 내 테스트는 줄기 세포 조절이 pH 조절에 크게 의존한다는 것을 입증했습니다.
따라서 CA를 표적으로 하는 약제는 잠재적인 치료 이점이 높기 때문에 암 연구의 가치 있는 후보로 간주되어야 합니다.
암의 후성유전학 및 히스톤 조절 경로
후성유전학은 DNA 서열의 변화와는 반대로 유전자 발현의 조절에 초점을 맞춘 염색질 역학에 대한 연구입니다.
후성적 조절은 특정 유전자의 발현과 침묵을 설명하고 게놈의 구조를 조절하여 세포 항상성 환경을 생성합니다.
돌연변이와 스트레스의 결과로 후성유전학적 조절 경로가 변경되어 암을 유발하고 이에 따라 증식 활성이 상향 조절될 수 있습니다.
또한 암세포는 일반적으로 덜 분화되고 염색질에는 DNA를 압축하는 히스톤이 더 많이 포함되어 있기 때문에 암세포는 정상 세포와 비교하여 다른 DNA 구조를 나타냅니다. 결과적으로 암세포는 일반적으로 전사를 위해 DNA의 열린 영역을 더 적게 노출시킵니다.
암세포가 특징적으로 덜 분화됨에 따라 분화가 세포 이동을 억제하기 때문에 더 침습적으로 행동합니다.
결과적으로, 유전자 발현을 조절하는 후성유전적 조절은 암에서 매우 활성화되어 귀중한 치료 표적을 제공합니다.
DNA 메틸화, 히스톤 아세틸화, 히스톤 인산화, 히스톤 유비퀴틴화 및 기타 번역 후 변형을 포함하여 후성유전체가 변형되는 다양한 방법이 있습니다.
후성유전체를 조절하는 효소의 돌연변이는 잠재적으로 암과 유사한 상태로 이어질 수 있습니다.
히스톤 아세틸라제, 히스톤 데아세틸라제(HDAC) 및 전사 인자의 돌연변이와 같은 암 돌연변이는 표적 유전자 산물의 상향 조절 또는 하향 조절을 유발할 수 있으므로 종양을 줄기와 유사한 미분화 상태로 만드는 능력이 있습니다.
지난 10년 동안 특히 히스톤 데아세틸라제 억제제(HDACi)는 모든 유형의 질병에 대한 임상 시험에서 중요한 관심 약제로 부상했습니다.
암 치료에 대한 HDACi의 특정 매력은 분화 유도, 세포 주기 정지, 세포자멸사 및 혈관신생 억제와 같은 광범위한 항암 효과 때문입니다.
HDAC 자체는 또한 암 세포에서 광범위한 활성을 나타 냈습니다 .HDAC가 염색질을 압축하여 미분화 상태를 생성함으로써 암 형태를 돕기 때문입니다.
또한, 종양 세포는 정상 세포에 비해 HDACi에 의해 유도된 세포자멸사에 더 민감하지만 이유는 아직 알려져 있지 않습니다.
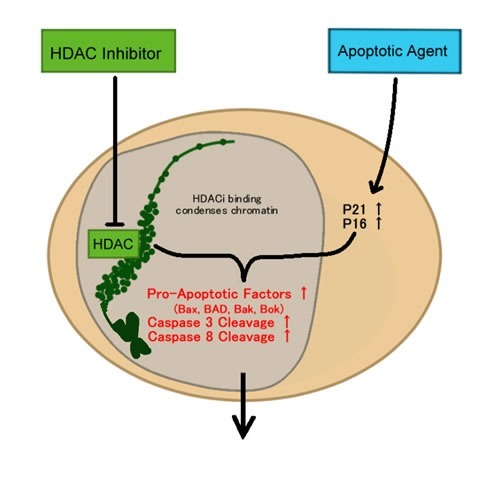
또한 HDACi의 특정 기능은 히스톤 분자의 라이신 잔기를 탈아세틸화하는 효소인 히스톤 탈아세틸화효소의 활성을 억제하여 DNA의 전사 활성 영역에 접근할 수 없도록 하는 것입니다(그림(그림 3).3).
HDAC는 본질적으로 유전자 발현을 조절함으로써 후성유전학 및 염색질 역학에서 역할을 합니다.
혈관신생- 암 유지 경로
공격적이 되는 신생물은 악성으로 특징지어지며 전이 가능성이 있습니다. 악성 상태에서 종양 세포는 잠재적으로 원발성 덩어리에서 분리되어 모세혈관으로 이동하여 결국 내피를 통해 침입하여 혈액 순환에 들어갈 수 있습니다.
그 후, 종양 세포는 몸 전체를 순환할 수 있고 모세혈관에서 멀리 떨어진 장기로 이동할 수 있으며, 그곳에서 전이라는 과정을 통해 또 다른 종양을 형성할 수 있습니다. 암이 전이되면 기존 치료법으로 치료하기가 매우 어려워집니다 .
따라서 전이를 방지하는 약제를 찾는 것이 중요해지고 있으며 그 중 하나가 혈관신생을 억제하는 것이다.
성장을 위한 암세포의 높은 대사 요구 사항 및 암세포와 혈관 사이의 증가된 확산 거리로 인해 종양은 일반적으로 저산소 상태를 경험합니다.
결과적으로, 혈관신생은 대사 요구를 유지하는 데 도움이 될 뿐만 아니라 침습적 특성을 유도합니다.
이 과정은 먼저 저산소증으로 인한 HIF1알파 발현에 의해 시작됩니다.
HIF1알파는 혈관 내피 성장 인자(VEGF)의 상향 조절을 매개하는 것으로 나타났습니다.
HIF1알파는 혈관신생 과정에 기여하는 자가분비 성장 인자인 VEGF-A의 전사 영역에 있는 프로모터 요소에 결합하여 그 발현을 유도한다
역학적으로 혈관신생을 억제하는 약물은 종양 세포에서 중요한 영양소와 산소를 박탈하여 종양의 성장과 진행을 억제합니다. 항혈관신생 활성은 종양 성장을 제어하는 새로운 접근법인 규칙적인 화학요법에서 분명합니다. 여기서 항혈관신생 특성을 가진 저용량 약물의 장기 투여는 암 치료에 효과적인 전략입니다[.
따라서 강력한 항암 효과를 얻기 위해서는 VEGF/VEGFR과 같은 전이 전 저산소 상태에서 상향조절되는 인자를 표적으로 하는 것이 중요하다.
이트라코나졸, 항 곰팡이 제는 혈관 내피 세포의 증식과 이주 및 VEGFR2의 억제 활성과 FGFR3를 억제하는 것으로 나타났습니다
보다 일반적인 항혈관신생제 중 하나는 항체 매개를 통해 VEGF 억제 활성을 나타내는 항체인 베바시주맙입니다. Yue et al . 의 연구 에서 강황 에탄올 추출물(흡수성 커큐민 포함)과 함께 베바시주맙은 종양 성장 억제, 세포자멸사 촉진 효과 및 혈관 성장 억제를 통해 단독 요법에 비해 HT29 결장암 세포에서 향상된 항암 효과를 나타냈습니다.
세포자멸사 표적화제
니트로글리세린은 산화질소(NO) 공여자이며, 산화질소는 HIF1알파를 하향 조절하고 혈관신생을 억제하는 주요 역할과 함께 2차 효과로 세포자멸사를 유도하는 것으로 밝혀졌습니다
클라리스로마이신 (CAM)은 프로테아좀 억제제인 보르테조밉과 병용할 때 소포체 스트레스 매개 세포자멸사를 향상시키는 것으로 나타났지만 CAM은 유방암과 골수종 세포에서 병용 요법으로 투여될 때만 효과적인 것으로 나타났습니다
'암치료' 카테고리의 다른 글
| ⚡혈관신생 억제 천연물 (0) | 2021.11.12 |
|---|---|
| 종양 산증 표적화 (0) | 2021.11.11 |
| 미토콘드리아를 표적으로 하는 천연물 (0) | 2021.11.09 |
| 미토콘드리아 대사의 표적 (급성 골수성 백혈병) (0) | 2021.11.09 |
| 암 조절을 위한 치료식물: 개요 (0) | 2021.11.01 |