2022
Targeting cancer signaling pathways by natural products: Exploring promising anti-cancer agents
https://www.sciencedirect.com/science/article/pii/S0753332222004437
Targeting cancer signaling pathways by natural products: Exploring promising anti-cancer agents
Cancer is one of the leading causes of death and significantly burdens the healthcare system. Due to its prevalence, there is undoubtedly an unmet nee…
www.sciencedirect.com
천연물을 항암제로 사용하는 것은 접근성, 적용 가능성 및 세포 독성 감소로 인해 허용되는 치료 접근 방식입니다.
천연물은 신약 개발의 현대 시대에 비교할 수 없는 항암제의 원천이었습니다.
천연물은 파생물 및 유사체와 함께 암 미세 환경 및 다양한 신호 전달 경로 를 조절하여 암 치료에 중요한 역할을 합니다 .
이 화합물은 여러 신호 경로, 주로 세포 사멸 경로(아폽토시스 및 자가포식) 및 배아 발달 경로(Notch 경로, Wnt 경로 및 Hedgehog 경로)에 대해 효과적입니다.
많은 표적 특이적 항암제가 성공적인 결과를 제공하지 못하여 더 나은 결과를 얻기 위해 다중 표적 특성을 가진 천연물에 대한 연구가 필요합니다.
이 리뷰는 발암의 동인 역할을 하는 다양한 신호 전달 경로를 억제하여 항암제 개발 및 발견을 위한 길을 닦는 천연 제품의 중요성을 탐구합니다.
1 . 소개
암은 일반적으로 유전적 돌연변이의 축적으로 인한 세포의 통제되지 않은 성장과 증식을 특징으로 하는 병리학적 상태로 설명됩니다
암은 일반적으로 방사선 요법, 화학 요법 및 외과 적 제거와 같은 기존 치료법을 사용하여 치료됩니다.
그러나 이러한 치료법에 대한 세포의 내성은 효과를 감소시킵니다
천연 화합물은 건강 개선 및 암 치료를 포함하는 다양한 유익한 활성을 나타냅니다.
현재 사용되는 많은 치료제는 알칼로이드 , 탁산 , 플라보노이드 와 같은 천연 자원에서 파생됩니다
강력한 천연 화합물의 건강한 조직에서 항종양 활성 과 최소 독성은 전통적인 항암제와의 시너지 효과를 연구하기 위해 제안되었습니다 [10] , [11] .
천연물은 정상세포에 비해 암세포 에 대해 선택적인 이점을 나타내었지만, 그 화학적 구조는 신약 개발의 모델이기도 하다.
이 모델은 부작용과 내성이 낮은 기존 천연 제품과 유사하거나 더 나은 이점을 가진 약물을 공식화합니다.
천연물 및 그 유도체는 높은 선택성, 낮은 비용 및 낮은 독성으로 인해 더 나은 화학 치료제가 될 수 있습니다 .
다양한 세포 신호 경로는 다른 종양 유형에서 변경됩니다.
세포 신호 경로는 세포의 생물학적 활성을 조절하는 상호 작용 분자의 복잡하고 상호 연결된 통신 네트워크입니다 .
세포는 다양한 성장 인자 수용체 로부터 정보를 수신 하고 이 정보를 통합하여 세포 증식 , 세포 사멸 , 단백질 합성 , 세포 운동성 , 분화, 세포 구조 및 극성 과 같은 다양한 세포 과정 을 조절합니다 ..
신호 전달 경로는 세포 발달을 조절하고 다양한 세포 유형에서 다양한 변화를 일으킵니다.
다중 신호 경로는 세포 생존, 증식 및 운동성을 조절합니다.
따라서 돌연변이로 활성화된 경로가 억제제에 의해 차단되면 암세포가 대체 신호 경로를 통해 증식할 수 있습니다 .
따라서 암에 대한 고급 치료는 신호전달 억제제 또는 신호전달 억제제와 DNA 손상 화학요법제의 조합과 같은 효과적인 조합 요법이 필요합니다 .
따라서 이러한 경로의 복잡성을 이해하는 것은 종양 세포 행동을 연구하는 데 필수적입니다.
세포 주기 경로, PI3K/Akt 및 Ras/MAP-Kinase 경로와 같은 여러 경로가 암에서 자주 변경되는 것으로 확인되었습니다.
또한 Wnt/β-카테닌 신호 전달의 이상이 다양한 종양 유형에 걸쳐 관찰되었습니다 .
이러한 암 관련 세포 신호 전달 경로의 분자 메커니즘에 대한 방대한 지식이 있음에도 불구하고 발암성 바이오마커를 표적으로 하는 화학요법적 접근은 제한적 입니다 [28] .
따라서 잠재적인 치료 표적을 식별하기 위해서는 세포 신호 전달 경로의 변화에 대한 철저한 이해가 필수적입니다.
많은 천연 화합물은 다양한 암 유형에서 수많은 항암 활성을 보여 왔습니다.
따라서 이 검토에서는 다양한 암에서 일부 주요 천연 화합물의 포괄적인 기능에 대해 논의할 것입니다. ( 표 1 )
여기에서 광범위하게 검토된 중요한 것들 외에 암 예방에서의 역할과 함께 추가 천연 화합물에 대해 논의합니다.

Table 1. 항암 활성과 천연 화합물의 포괄적인 목록.
| Formononetin (Red clover) |
Gastric cancer | •Inhibition of cell proliferation in MGC803 cells •Inhibition of the migration in SGC7901 tumor cells via Wnt/β-Catenin and Akt/ mTOR pathway |
|
| Honokiol (Magnolia officinalis [Magnoliaceae]) |
Colon cancer, Oral cancer, Thyroid cancer | •Recruitment of Jagged-1 and Hes-1 towards downstream gene target •Downregulation of CSC marker DCLK1 •Downregulation of CD44 and Wnt / β-catenin (SP) receptor inhibitor |
|
| Curcumin (Turmeric) |
Colon cancer, Gastric cancer, AML, Breast cancer, Head and neck cancer, Lung cancer | •Reduction of CD44 and CD166 expression in chemoresistant colon cancer •Inhibition of tumor growth of ALDH+ /CD133 + cells •Downregulation of Gli-1, Notch-1, and cyclin D1 •Downregulation of the mRNA and the protein expression of cyclin D1 |
|
| Ursolic acid and Koetjapic acid (Apples, pears, and prunes) |
Colon cancer | •Inhibition of STAT3 phosphorylation and induction of caspase-3 cleavage in ALDH(+)/CD133(+) colon cancer-initiating cells | |
| Hesperidin (Citrus fruits) |
Non-small-cell lung carcinoma | •Modulation of NF-κB signal transduction thereby mediating growth inhibition through apoptosis | |
| Isobutyrophenone and Arnicolide (Centipeda minima (L.) A.Braun & Asch. [Compositae]) |
Colon cancer | •Promotion of intracellular ROS production •Downregulation of NF-κB protein |
|
| Epigallocatechin gallate (Green tea) |
Skin cancer | •Inhibition of PKD1 activation | |
| Gossypol (Cotton plants) |
Prostate cancer | •DNA damage induction, activation of p53, and induction of apoptosis | |
| Ethoxy Mansonone G (Mansonia gagei J.R.Drumm. [Malvaceae]) |
Breast cancer | •Inhibition of estrogen‐induced cell proliferation | |
| Genistein (Soybeans and Soy products) |
Prostate cancer, Cervical cancer, Colorectal cancer, Non-small-cell lung carcinoma | •Inhibition of Hedgehog-Gli signaling and expression of CSC markers CD44 •p53 stabilization through APE1 pathway •Inhibition of Akt pathway |
|
| Sulforaphane (Cruciferous vegetables) |
Prostate and Pancreatic cancer | •Induction of apoptosis and inhibition of self-renewing potential, ALDH1 activity, clonogenicity, xenograft growth in pancreatic CSCs. Enhanced drug cytotoxicity when combined with other conventional drugs in prostate CSCs. •Inhibited relapse of gemcitabine-treated tumor cells in nude mice |
|
| Proanthocyanidins(Grape seeds) | Pancreatic adenocarcinoma | •Reduction of NF-κB expression and reversal of the epithelial-mesenchymal transition process | |
| Methyl antcinate A (Antrodia camphorate) |
Breast cancer | •Downregulation of heat shock protein 27 •Upregulation of IkBα and p53 expression |
|
| Oridonin (Rabdosia rubescens [Lamiaceae]) |
Breast cancer | •Downregulation of Jagged2 expression and Notch1 activity •Activation of the PI3K/PTEN/ Akt/mTORC1 and WNT/β-catenin pathways |
|
| Resveratrol (Grapes) |
Head and neck cancer, Gastric cancer, Thyroid cancer, Lung cancer | •Downregulation of ALDH1 and CD44 in HNC-TICs in a dose-dependent manner | |
| Guggulsterone (Commiphora mukul (Hook. Ex Stocks) Engl. [Burseraceae]) |
Colon cancer, Prostate cancer, Head and neck cancer | •Activation of caspase-9, caspase-8, and caspase-3 •Induction of cell death in PC-3 cells •Induction of apoptosis in HT-29 cells by activating caspases-3 and − 8 •Downregulation of cIAP1, cIAP2, and Bcl-2 levels and upregulation of truncated Bid, Fas, p-JNK, and p-c-Jun |
|
| Emodin (Rhubarb) |
Prostate cancer | •Activation of Notch signaling pathway | |
| Artesunate (Artemisia annua [Compositae]) |
Chronic myeloid leukemia | •Inhibition of VEGF expression | |
| Allicin (Garlic) |
Ovarian cancer | •Activation of JNK pathway | |
| Caffeic acid phenethyl ester (CAPE) (Propolis of honeybee hives) |
Prostate cancer | •Induction of cell G1 or G2/M cell cycle arrest | |
| Erinacine A (ditherpenoid) (Hericium erinaceum) |
Gastrointestinal cancer, Colorectal cancer | •ROS-mediated cell cycle arrest •Attenuation of NF-κB activity in cancer stem cells |
|
| Morusin (Morus alba L. [Moraceae]) |
Cervical cancer | •Downregulation of the PI3K/Akt/mTOR pathway | |
| Deoxyshikonin (Arnebia euchroma [Boraginaceae]) |
Colorectal cancer, Glioma | •Growth inhibition and apoptosis inductionby modulating Bcl-2, Bax, and STAT3 proteins | |
| Apigenin (Scutellaria spp) |
Colorectal cancer, Lung Cancer, Osteocarcinoma, Liver Cancer, Melanoma, Prostate cancer | •Induction of cell cycle arrest at G2/M phase •Promotion of different anti-inflammatory pathways, including p38/MAPK and PI3K/Akt •Alteration of Raf-1 kinase mediating apoptosis |
|
| Paclitaxel (Pacific yew tree) |
Endometrial cancer, Sarcoma, Cervical cancer, Gastroesophageal cancer, Prostate cancer, Head and neck cancer | •Activation of MEK-independent signaling pathway | |
| Tannins/ Tannic acid (Syzygium guineense,Gall nuts) |
Triple-negative Breast cancer, Colon cancer, Lung cancer, Liver cancer, Ovarian cancer, Prostate cancer, Pancreatic cancer, Embryonic carcinoma |
•Inhibits cell proliferation via Wnt3a-induced β-catenin •Downregulate JAK/STAT pathway •Inhibit cell cycle progression by G1/S phase arrest •Decrease TGF-β induced EMT and NF-κB activation •Act synergistic with cisplatin and oxaliplatin •Promotes TRAIL-induced extrinsic apoptosis |
|
| Calotropin (Asclepiadoideae family) |
Colon cancer | •Inhibits β-catenin | |
| Quercetin (Nuts, tea, onions, apple and in plant sources) |
Colorectal cancer, Triple-negative Breast cancer | •Inhibits phosphorylation of GSK-3β •Upregulate E-cadherin |
|
| Lycopene (Red fruits and vegetables) |
Prostate cancer | •Decrease cyclin E expression •Inhibits β-catenin •Inhibits phosphorylation of GSK-3β |
Abbreviations: Wnt: wingless-related integration site; β-catenin: beta-catenin; Akt: protein kinase B; mTOR: mechanistic target of rapamycin; CSC: cancer stem cell; DCLK1: doublecortin like kinase 1; cluster of differentiation 44; cluster of differentiation 166; ALDH: aldehyde dehydrogenase; CD133: cluster of differentiation 133; Gli1: GLI family zinc finger 1; Notch-1: notch receptor 1; STAT3: signal transducer and activator of transcription 3; NF-κB: nuclear factor kappa b; ROS: reactive oxygen species; PKD1: polycystin 1; APE1: apurinic/apyrimidinic endonuclease 1; ALDH1: aldehyde dehydrogenase 1; IkBα: I-kappa-B-alpha; PI3K: phosphoinositide 3-kinases; PTEN: phosphatase and tensin homolog; mTORC1: mammalian target of rapamycin complex 1; HNC-TICs: head and neck cancer-derived tumor-initiating cells; cIAP1: cellular inhibitor of apoptosis protein 1; cIAP2: cellular inhibitor of apoptosis protein 2; Bcl-2: B-cell lymphoma-2; Bid: BH3 interacting domain death agonist; Fas: fas cell surface death receptor; p-JNK: phospho- jun nuclear kinase; p-c-Jun: phosphorylated c-Jun; VEGF: vascular endothelial growth factor; JNK: jun nuclear kinase; Bax: Bcl-2 associated X, apoptosis regulator; p38/MAPK: p38 mitogen-activated protein kinase; MEK: mitogen-activated protein kinase kinase; TGF-β: transforming growth factor-β; EMT: epithelial to mesenchymal transition; TRAIL: tumor necrosis factor-related apoptosis-inducing ligand; GSK-3β: glycogen synthase kinase-3β.
2 . 천연물에 의한 신호 전달 경로 표적화
천연 화합물은 다양한 신호 전달 경로 를 표적으로 할 수 있으므로 세포의 분자 활성에 영향을 미칩니다.
결과적으로, 그들은 암 치료에서 잠재적인 보조제로 사용될 수 있습니다.
최신 연구에 따르면 종양 및 자가 재생을 시작할 수 있는 암 줄기 세포(CSC)가 종양 재발 및 화학 요법 치료에 대한 내성을 담당합니다 .
따라서 증가된 CSC 개체군은 환자의 예후가 좋지 않고 여러 항암 치료의 효과가 없습니다( 그림 1 ).
다음 섹션에서는 암에서 비정상적인 세포 신호 전달 경로를 표적으로 하는 다양한 천연 화합물의 중요성을 강조합니다( 그림 2 ).
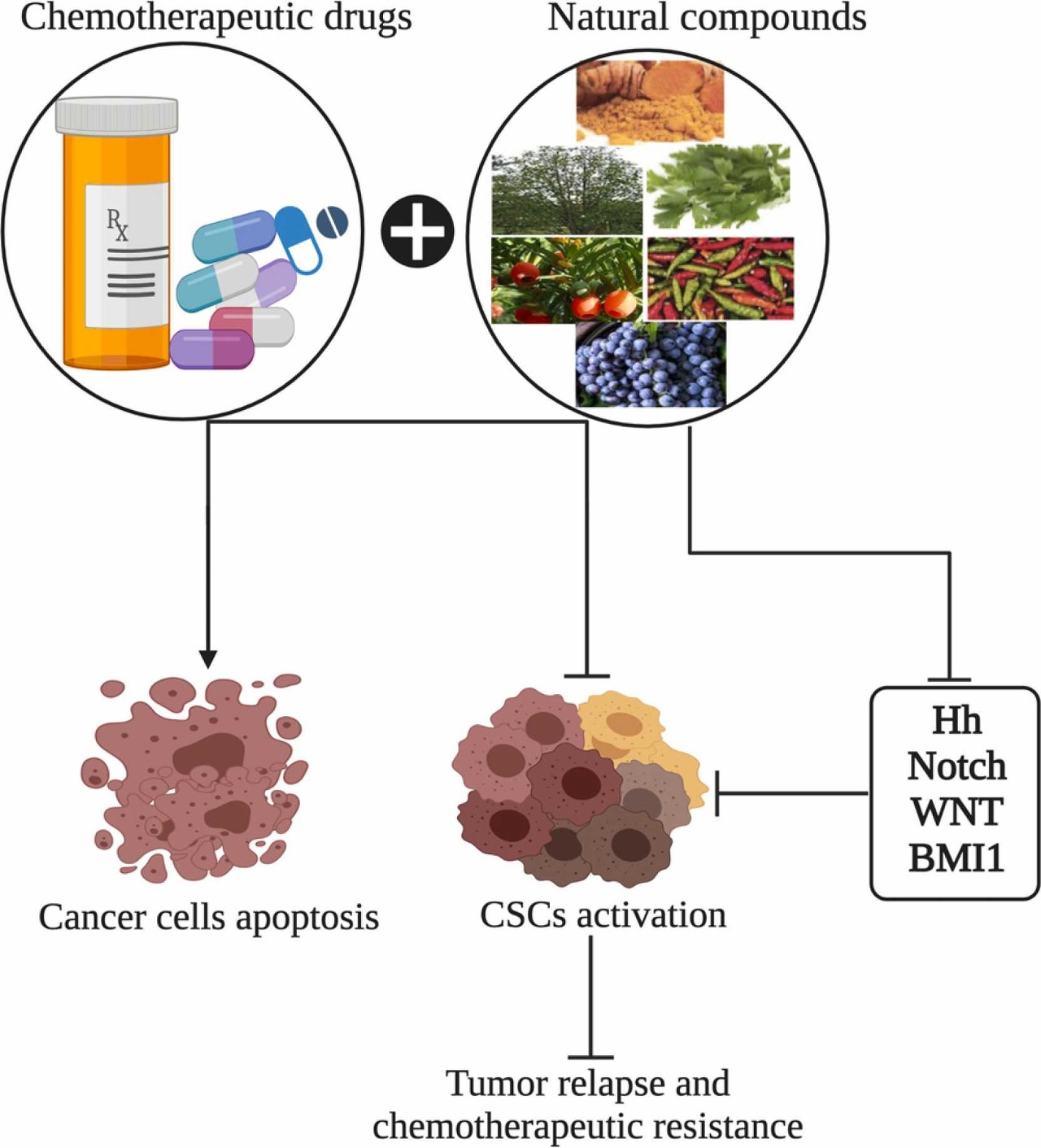
그림 1 . 암 예방에서 천연물의 역할. 암 세포의 세포 사멸 경로를 표적으로 하는 보조 요법과 암 세포의 자가 재생 경로(Hh, Notch, WNT 및 BMI1)를 억제하는 단독 요법 으로서 천연 화합물의 활용은 후속적으로 종양 재발 및 화학요법 약물에 대한 내성을 억제합니다.
(Hh: hedgehog; Wnt: wingless-related integration site; BMI1: B lymphoma Mo-MLV insertion region 1 homolog).

그림 2 . 암 신호 전달 경로 를 표적으로 하는 천연 화합물의 도식적 표현 .
Honokiol 은 Sos가 Ras와 결합하는 것을 억제하여 Ral 및 PDL을 억제함으로써 Ras 활성화를 억제함으로써 항암 특성을 발휘합니다.
PDL의 억제는 PA의 결합을 허용하지 않아 BAD 발현을 증가시키면서 mTOR 억제를 초래합니다.
Apigenin 은 PTEN 발현을 증가시키고 paclitaxel 및 curcumin 은 phopho-PI3K의 활성을 억제하여 Bax를 상향 조절하고 미토콘드리아 막을 유도하는 Bcl-2를 하향 조절하는 phospho-Akt의 발현을 억제합니다.
AIF의 손상 및 해제. Curcmin은 또한 IL-6 유도 JAK2/STAT3 경로를 억제합니다.
또한 커큐민 은 Wnt 신호 전달 을 방해 하고 캡사이신 은 STAT 활성화를 억제하여 β-카테닌을 인산화하여 STAT와 함께 핵으로 들어가는 것을 방해합니다.
인산화된 β-카테닌은 c-Myc가 사이클린 D1 을 자극하는 것을 허용하지 않습니다 .
Resveratrol 은 E-cadherin을 상향 조절하는 동안 Snail, N-cadherin 및 vimentine의 하향 조절을 유발하는 GSK-3의 활성을 증가시킵니다.
그 결과 EMT 전환이 억제됩니다.
이 모든 경로는 암세포 의 사멸 을 일으키 거나 증식과 전이 를 억제합니다.그리고 침략.
(Sos: son of sevenless (guanosine nucleotide exchange factors); Ras: rat sarcoma virus ; Ral: ras-like; PDL: phospholipase D ; mTOR:mechanistic target of rapamycin; PA:phosphatidic acid; BAD: BCL2 associated agonist of cell death; PI3K: phosphatidylinositol 3-kinase; Akt: protein kinase B; PTEN: phosphatase and tensin homolog; IL-6: interleukin 6; Bax: Bcl-2-associated X protein; Bcl-2: B-cell lymphoma 2; AIF: apoptosis inducing factor; JAK-2: janus kinase 2; STAT signal transducer and activator of transcription; Wnt: wingless-related integration site; c-Myc: cellular myelocytomatosis ; GSK-3: glycogen synthase kinase 3 ; N-cadherin: neural cadherin : EMT:epithelial–mesenchymal transition).
2.1 . 호노키올
Honokiol 은 Magnolia grandiflora L 이 생산하는 천연 페놀성 세포독성 화합물 입니다. [목련과]
대부분의 아시아 국가에서 전통 약재로 사용됩니다.
Honokiol은 항염증, 항혈관신생, 항산화 및 항종양 활성을 나타냅니다.
피부암에서 cyclooxygenase-2, prostaglandin E2, proliferating cell nuclear antigen and tumor necrosis factor-alpha, interleukin (IL)− 1β, and IL-6 의 발현을 억제하는 것으로 보고되었다.
또한, honokiol 치료는 apoptosis 를 유도했습니다.
피부 종양이 UVB를 통해 유도된 SKH-1 마우스에서. 피부암의 세포자멸사는 p53의 활성화, DNA fragmentation, caspase activation, poly (adenosine 5′-diphosphate-ribose) polymerase (PARP) 절단 을 통해 촉진되었습니다
Honokiol은 또한 유방암에서 항암 특성을 나타내는 것으로 보고되었습니다 .
삼중음성 유방암 세포주인 MDA-MB-231에서 호노키올은 포스포리파제 D 와 Ras 활성화를 억제했습니다 .
또한 핵인자-카파 B(NF-kB), COX-2, 프로스타글란딘 E2 및 Src/표피 성장 인자 수용체에 의해 매개되는 세포 신호 전달을 억제했습니다 .
최근 Honokiol은 FBXW7/c-Myc 신호 전달을 통해 miR-188-5p의 발현을 하향 조절함으로써 유방암 세포 를 독소루비신 에 민감하게 만드는 것으로 밝혀졌습니다.
유방암 외에도 호노키올은 카스파아제의 활성화와 PARP의 절단을 통해 난소암 세포에서 세포자멸사를 유도하는 것으로 밝혀져 난소암 에서도 항암 활성을 보였다.
더욱이, 호노키올 처리는 sub-G 0 /G 1 단계 에서 난소암 세포의 축적을 초래하였다.
또한 Honokiol은 AMPK를 활성화하고 난소암 세포에서 mTOR 의 인산화를 감소시키기 때문에 AMP-activated protein kinase/mechanistic target of rapamycin(AMPK/mTOR) 신호 전달 경로를 통해 난소암에서 항암 특성을 발휘하는 것으로 보고되었습니다 ..
Honokiol은 또한 전립선암 의 예방 및 치료와 관련이 있습니다.
Honokiol은 안드로겐 또는 p53 상태에 관계없이 전립선암 세포에서 DNA 단편화 및 세포자멸사를 유도했습니다.
전립선암 세포의 apoptosis는 anti-apoptotic protein을 감소시키고 pro-apoptotic protein을 유도함으로써 유도되었다.
또한, 호노키올은 종양 성장에 관여하는 것으로 밝혀진 Cyclooxygenase-2(COX-2)와 peroxisome proliferator-activated receptor-gamma(PPAR-γ)를 감소시키고, 위암 세포에서 15-LOX-1의 발현 증가시켜 위암에서 항종양 효과를 나타내는 것으로 보고되었습니다. ,
Honokiol은 또한 칼슘 의존성 티올 프로테아제 , caspase-7, 12 활성화를 유도하고 포도당 조절 단백질(GRP94) 발현을 감소시켜 위암 세포에서 세포 사멸을 유도했습니다 .
또한, 호노키올은 신장암 세포에서 c-Met 및 인산화된 Ras의 하향 조절을 통해 신장암 에서 항암 효과를 나타냈습니다.
또한, 호노키올은 신장암 세포에서 세포자멸사를 유도하고 혈액 혈관계 를 감소시키는 것으로 밝혀졌습니다 .
2.2 . 파클리탁셀
Paclitaxel(Taxol™)은 Taxus brevifolia Nutt의 바늘(가시?)과 껍질에서 생산됩니다.
파클리탁셀은 튜불린에 결합하여 미세소관으로의 조립을 촉진하여 항암 효과를 발휘합니다.
그것은 미세 소관의 해리를 방지하여 세포 진행을 차단하고 궁극적으로 암세포의 성장을 방지합니다.
Paclitaxel은 apoptotic-promoting 속성과 관련될 수 있는 많은 신호 전달 경로에 관여하는 것으로 보고되었습니다.
2.3 . 캡사이신
캡사이신 은 고추속에서 유래한 항종양 바닐로이드 화합물입니다 .
유방암 세포에서 caspase-independent pathway와 proto-oncogene, FBI-1 매개 NF-kB의 억제를 통해 apoptosis를 유도하는 것으로 보고되었습니다.
또한 유방암에서는 Bcl-2, survivin , Ki-67의 in vivo 및 in vitro 발현을 감소시키는 반면 Bax 및 활성화된 caspase 3의 발현을 증가시켰다.
삼중음성 유방암 세포주인 MDA-MB-231에서 캡사이신은 사이클린 의존성 키나아제 8(CDK8)의 발현을 감소시키고 암세포 생존율 을 감소시키며 G2/M 단계에서 세포 주기 정지를 유도하는 것으로 나타났습니다 . .
또한, 캡사이신은 CDK8/PI3K/Akt를 하향 조절하고 Wnt/β-카테닌 신호 전달 경로를 억제하여 유방암 세포 생존을 억제하는 것으로 보고되었습니다.
유방암 외에도 캡사이신 은 기질 금속단백분해효소-9(MMP-9), AMP 활성화 단백질 키나제 및 (NF-κB)의 발현을 감소시키는 식도 편평 세포 암종 에서도 항암 특성을 나타냅니다.
위암 세포에서 캡사이신은 MAPK(mitogen-activated protein kinase) 신호 전달 경로의 조절을 통한 세포자멸사를 유도합니다.
대장암 에서 캡사이신은 cyclin D1 의 분해와 20S proteasome 의 비활성화를 통해 항암 활성을 유도하는 것으로 보고되었습니다.
또한 캡사이신은 Wnt/β-catenin 경로의 억제를 통해 전립선암에서 항암 효과를 발휘한다고 보고된 바 있다.
전립선 암 줄기세포에서 p-GSK3β, Wnt-2, β-카테닌, 사이클린 D1 및 c-Myc를 억제했습니다.
또한 캡사이신은 Hedgehog, 세포외 신호 조절 키나아제 및 c-Jun 신호 전달 경로를 억제하여 췌장암 세포 증식을 억제하는 것으로 보고되었습니다.
또한 capsaicin 은 NPC 세포 의 G1 단계 에서 증식을 억제하고 autophagy, apoptosis 및 세포주기 정지를 유도 했습니다.
또한 캡사이신 처리는 Akt, mTOR, Erk 및 p-GSK3β의 인산화를 억제하고 NPC 세포에서 PI3K의 발현을 감소시키는 것으로 밝혀져 캡사이신이 PI3K/Akt/mTOR 신호전달 경로를 하향 조절함으로써 항암 효과를 발휘함을 시사한다.
다른 연구에서 캡사이신 치료는 골육종 의 세포 생존력을 감소시키고 증식을 억제하는 것으로 밝혀졌습니다.
또한, 연구는 골육종 세포 에서 캡사이신에 의해 유도된 세포자멸사에서 미토콘드리아 세포자멸사 경로의 관여를 보고했습니다.
또한, 연구에서는 캡사이신이 발휘하는 항암 효과가 MAPK 신호 전달 경로를 포함한다고 보고했습니다.
2.4 . 레스베라트롤
레스베라트롤 (RES)(3,4',5-트리하이드록시 스틸벤)은 포도, 땅콩, 자두, 베리를 포함한 식물 종에서 추출한 비 플라보노이드 파이토알렉신 화합물입니다 .
그러나 Polygonum cuspidatum [Polygonaceae] 및 Vitis rotundifolia Michx [Vitaceae]식물에는 증가된 수준의 RES가 존재합니다.
RES는 마우스 전립선(TRAMP) 세포의 형질전환 선암종 에서 세포 증식을 억제하고 미토콘드리아 매개 및 카스파제 비의존적 세포자멸사를 유도하는 것으로 보고되었습니다 .
RES는 Bax/Bcl-2의 발현 변화와 미토콘드리아 막 전위 의 교란을 통해 항암 효과를 발휘하는 것으로 나타났습니다.
RES는 효과적인 항종양제로 보여지지만 낮은 수용해도와 낮은 생체이용률로 인해 적용이 제한됩니다.
이러한 한계를 극복하기 위해 고분자 나노입자 , 지질 나노입자(리포좀, 미셀 , 지질 나노입자), 금 및 은 나노입자, RES 로딩을 위한 실리카 나노입자 와 같은 다양한 나노 전달 시스템 이 활용되었습니다.
이러한 나노구조나노제형은 더 나은 안전성과 생체적합성 외에도 높은 적재 용량, 화물 보호 및 깊은 종양 침투와 같은 뚜렷한 물리화학적 특성을 가지고 있습니다.
리포솜은 내부 친수성 코어와 외부 소수성 지질 이중층 을 가진 인지질 과 콜레스테롤 로 주로 구성되어 철저히 연구된 최초의 지질 기반 약물 나노 운반체 중 하나입니다.
리포솜 의 이러한 분자 구성은 효율적인 전달을 가능하게 하고 약물의 효과 를 향상시킵니다..
동일한 기술을 사용하여 한 연구에서는 마우스 모델에서 유방 종양을 치료하기 위한 리포솜 캡슐화 RES의 효율성을 평가했습니다.
연구는 캡슐화된 RES가 정상 조직에 대한 세포독성 없이 감소된 용량에서 종양 성장을 효과적으로 억제한다는 것을 발견했습니다.
또한, 캡슐화된 RES는 종양 억제인자 p53의 발현을 상향 조절하고, 항-세포사멸 단백질 Bcl-2의 발현을 하향 조절하고, 카스파제-3 활성화를 유도함으로써 유방 종양에서 세포자멸사를 유도하였다..
또한 RES 는 생체 외 및 생체 내에서 마우스 유방암 세포에서 활성 산소종 (ROS)을 중화하고 MMP-9를 억제하여 항암 효과를 발휘하는 것으로 나타났습니다 .
또 다른 연구는 RES 가 Akt 및 Erk1/2 신호 전달 경로의 비활성화를 통해 신장 암종 세포 의 세포 증식, 이동 및 침윤을 억제한다는 것을 보여주었습니다 .
또한, 연구는 RES가 vimentin , N-cadherin, Snail과 같은 중간엽 표지자를 억제하고 상피 표지자 E-cadherin의 발현을 증가시켜 신암 세포에서 상피에서 중간엽으로의 전이 (EMT)를 역전시키는 역할을 입증한다는 것을 발견했습니다.
연구는 전립선암 세포주 에서 RES와 도세탁셀 의 시너지 효과를 보여주었습니다(C4–2B 및 DU-145).
병용 치료는 pro-apoptotic 유전자를 상향 조절하고 anti-apoptotic 유전자를 하향 조절하여 전립선 암 세포에서 apoptosis를 촉진했습니다.
또한, 병용 치료는 종양 억제 인자 p53과 p21 및 p27 과 같은 세포 주기 억제제의 발현을 상향 조절하여 G2/M 단계에서 세포 주기 정지를 초래했습니다.
RES는 또한 내피 성장 인자 (VEGF) 의 발현을 억제함으로써 골육종 세포에서 항증식 효과 를 나타내는 것으로 나타났습니다 .
RES는 caspase 3 활성화, PARP 절단, Bax 상향 조절, Bcl-2 및 Bcl-xL 하향 조절을 통해 골육종 세포에서 세포 사멸을 유도했습니다.
또한, Janus kinase 2(JAK2), 신호 변환기 및 전사 활성제 3(STAT3)의 인산화를 감소시켰고 골육종 세포에서 p-PI3K, p-Akt 및 NF-κB의 발현을 억제했습니다 .
결장직장암 유래 세포주에서 RES 는 Wnt/β-catenin 신호전달 경로의 억제를 통해 전이 와 세포 침윤을 억제하였다.
RES는 결장암 세포와 누드 마우스 의 종양 조직에서 Akt/GSK-3β/달팽이 신호 전달 경로를 통해 EMT를 역전시켰 습니다.
RES 처리는 상피 표지자 E-cadherin의 발현을 증가시키고 N-cadherin 및 Snail과 같은 중간엽 표지자의 발현을 감소시켰다.
또 다른 연구에서 RES는 결장암 세포의 G1 단계에서 세포 증식을 억제하고 세포 사멸을 유도하며 세포 주기를 정지시킵니다. 또한 이 연구는 Akt1과 Akt2를 RES의 잠재적 표적으로 식별했습니다.
또한, 연구는 Akt1/2 녹다운이 결장암 세포에서 세포 증식 및 집락 형성을 억제한다는 것을 발견했는데, 이는 RES 치료에 의해 유발된 것과 유사한 효과입니다 .
2.5 . 아피게닌
아피게닌 은 다양한 과일, 채소 및 견과류에서 발견되는 천연 트리하이드록시플라본입니다.
그것은 항암, 항산화, 항균 및 항바이러스 특성 을 포함하여 상당한 생리학적 및 약리학적 특성을 나타냅니다 [97] .
아피게닌의 항암 효과는 대장암 [98] , [99] , 흑색종 , 전립선암, 폐암, 골육종, 간암, 유방암 [100] , [101] 을 포함한 여러 암에서 관찰되었습니다 .
Apigenin은 여러 신호 경로를 억제하고 세포 사멸, 자가 포식, 세포 주기 정지 [122] , 세포 이동 및 침입 [102] 을 유도하여 항암 효과를 발휘합니다 .
연구에 따르면 아피게닌은 Wnt/β-카테닌 [99] , [103] , JAK/STAT [101] , AMPK [104] , TGF-β [105] 및 FAK 와 같은 많은 세포 신호 전달 경로의 조절과 관련이 있음을 보여줍니다. /ERK1/2 [106] .
Apigenin은 또한 유전자 변형 마우스 의 폐에서 NF-κB 활성을 조절함으로써 유기적 특이적인 방식으로 면역 조절 활성을 발휘하는 것으로 밝혀졌습니다 [107] .
한 연구에 따르면 아피제닌과시스플라틴 은 여러 세포주(MCF-7, HeLa, A549 및 HCT116)에서 시스플라틴의 세포독성 효과를 향상시켰습니다.
또한, 아피제닌은 Erk/MAPK 경로 활성화를 통해 인간 폐암 A549 세포에서 세포자멸사를 유도하는 것으로 밝혀졌다.
또한 A549 세포에서 아피게닌과 시스플라틴으로 유도된 카스파제 의존성 세포자멸사를 병용 처리하면 A549 세포에서 p53의 발현이 증가하고 p53 인산화 및 축적이 촉진된다 [108] .
이전 연구에서는 자연적으로 발생하는 여성 성호르몬 인 프로게스테론 의 효과를 모방한 약물인 프로게스틴 이 유방암 전이를 촉진하거나 프로게스틴을 섭취하는 여성에서 유방암 발병의 위험 요소가 될 수 있다고 보고했습니다 [109] , [110] .
이를 감안할 때, 연구는 프로게스틴(메드록시프로게스테론 아세테이트)에 노출된 누드 마우스에서 BT-474 이종이식 종양 의 성장에 대한 아피게닌의 효과를 입증했습니다 [111] .
연구에 따르면 아피제닌은 증식을 억제하고 세포자멸사를 유도하며 원종양유전자 HER2/neu의 발현을 감소시켜 이종이식 종양의 진행을 효과적으로 억제하는 것으로 나타났습니다 [111].
또한, 아피제닌은 VEGF 수준을 감소시켜 세포 생존을 억제하는 것으로 밝혀졌습니다 [111] .
또 다른 연구에서는 아피게닌이 시험관 내 및 생체 내 간세포 암종에서 PI3K/Akt/mTOR 신호 전달 경로를 억제함으로써 세포 증식을 억제하고 자가포식을 유도한다는 것을 보여주었습니다 [112] .
또한, 아피제닌 7-O-글루코시드(AGL)이 PTEN/Akt/PI3K 경로를 통해 자궁경부암 세포의 세포자멸사를 촉진한다는 것을 발견했습니다 .
EMT는 결장직장암의 전이에서 중요한 과정입니다.
천연 제품과 식이 화합물을 사용하여 EMT를 표적으로 하는 것은 지난 수십 년 동안 많은 관심을 받았습니다.
Apigenin은 E-cadherin의 발현을 상향 조절하고 Snail의 발현을 하향 조절함으로써 결장암 세포에서 EMT를 역전시키는 것으로 밝혀졌습니다.
또한, 아피제닌은 NF-kB의 발현을 억제하고 달팽이의 전사 활성을 감소시켜 아피제닌이 NF-kB/Snail 경로를 억제함으로써 EMT를 역전시키는 것으로 입증되었다 .
다른 연구에서는 아피게닌이 mTOR/PI3K/Akt 신호 전달 경로를 억제함으로써 시스플라틴 내성 HT-29 결장암 세포에서 세포자멸사 및 자가포식을 유도하는 것으로 나타났습니다.
2.6 . 커큐민
Diferuloylmethane으로도 알려진 커큐민 은 강황의 주성분입니다.
커큐민은 다양한 세포 표적과 상호작용하므로 다면발현성 분자로 간주됩니다 .
많은 연구에서 염증, 감염, 간 질환, 암 및 당뇨병과 같은 다양한 병리학적 과정 에서 커큐민의 효과를 조사했습니다 .
여러 생체 내 연구에서 커큐민의 세포자멸사 촉진 효과가 입증되었습니다.
커큐민은 폐암 NCI-H460 세포의 종양구를 주사한 누드 마우스에서 종양 성장을 억제했습니다.
커큐민은 JAK2/STAT3 신호 전달 경로를 억제함으로써 NCI-H460 종양구를 억제하는 것으로 밝혀졌습니다 .
JAK2/STAT3 경로 활성은 암세포를 구성하며 다양한 암 개시 과정에 관여합니다 .
따라서 JAK2/STAT3 경로는 커큐민이 종양 형성을 억제하는 훌륭한 표적입니다.
다른 연구에서 커큐민은 원발성 삼출성 림프종 세포 에서 JAK/STAT3 경로 억제를 통해 용량 의존적으로 세포 증식을 억제하고 카스파제 의존적 세포자멸사를 유도했습니다 .
연구에 따르면 IL-6은 STAT3 인산화를 통해 다발성 골수종 세포의 증식과 생존을 촉진합니다.
따라서 커큐민과 같은 STAT3 인산화를 억제하는 약제는 다발성 골수종 치료를 위한 잠재적인 치료 표적입니다.
커큐민을 사용한 치료는 다발성 골수종 세포에서 구성적 STAT3 인산화 및 증식을 억제하는 것으로 밝혀졌습니다 .
흥미롭게도 커큐민은 Janus kinase 2 (JAK2)/STAT3 신호 전달 경로 의 선택적 억제제 인 AG490 보다 훨씬 더 강력한 STAT3 인산화 억제제로 나타났습니다.
또한 췌장과 같은 다른 난소 및 자궁내막, 악성 신경교종 및 간세포 암세포 주에서 커큐민은 또한 JAK-STAT3 신호 전달 경로를 하향 조절하여 세포 증식을 억제하는 것으로 보고되었습니다.
암에서 여러 miRNA 가 병리학적 과정을 조절하는 데 관여하는 것으로 나타나며 항암 요법의 중요한 표적으로 간주됩니다.
커큐민은 miRNA에 대한 후성적 조절 효과 를 나타내는 것으로 나타났습니다.
폐암 세포에 대한 최근 연구에 따르면 커큐민 은 miR-let 7c 및 miR-101의 상향 조절을 통해 mRNA 발현을 코딩하는 EZH2의 인핸서( enhancer of zeste homolog 2 )를 억제하는 것으로 나타났습니다.
흥미롭게도 많은 연구에서 EZH2가 종양 악성 종양 및 불량한 예후와 관련이 있다는 증거를 제공합니다 .
따라서 EZH2를 억제하는 것은 폐암을 치료하는 잠재적인 표적이 될 수 있습니다.
또한, 커큐민은 miR-9의 발현을 상향 조절하는 것으로 밝혀졌으며, 이후 구강 편평 세포 암종 세포 에서 Wnt/β-카테닌 발현이 하향 조절되었습니다 .
비정상적인 Wnt/β-카테닌 경로 활성화는 세포 주기 진행 , 세포 생존 및 침입 을 변경함으로써 종양 형성에서 중요한 역할을 합니다.
따라서 miR-9 및 Wnt/β-카테닌 신호 전달 경로의 발현을 조절함으로써 커큐민은 구강 편평 세포 암종(SCC-9) 세포의 증식을 억제합니다 .
또한, miR-31은 일반적으로 구강 편평 세포 암종에서 상향 조절되는데, 이는 표피 성장 인자(EGF)의 활성화로 인한 것일 수 있습니다.
놀랍게도, 커큐민 치료는 Akt 활성화를 감소시켜 구강 편평 세포 암종 세포에서 C/EBPβ의 약화와 miR-31 상향 조절의 억제를 초래했습니다 .
마찬가지로 커큐민은 miR-7의 발현을 조절하는데, 이는 세포 성장과 증식을 억제하고 췌장암 세포의 세포자살을 촉진하며 miR-7의 표적인 히스톤 라이신 메틸트랜스퍼라제 (SET8) 발현을 감소시키는 것으로 나타났습니다 .
또한 miR-146a 발현은 건강한 조직에 비해 췌장암 샘플에서 감소합니다.
miR-146a 표적 중 하나는 EGFR이고, 췌장암 세포를 difluorinated curcumin 커큐민(CDF)으로 치료하면 miR-146a가 재발현되어 종양 이종이식체 성장이 억제되고 세포외 신호인 EGFR의 발현이 감소했습니다. -
조절된 키나제(Erk1, Erk2) 및 Kirsten 쥐 육종 바이러스 종양 유전자 동족체(KRas). 췌장 AsPC-1 세포주에서 miR-146a 녹다운은 EGFR 발현을 증가시키고 클론 생성 성장을 향상시켰습니다.
따라서 CDF 치료를 통한 miR-146a의 상향조절에 의한 EGFR 억제는 췌장암 치료에 사용될 수 있다 .
이러한 발견은 다양한 miRNA가 커큐민에 대한 훌륭한 항종양 표적임을 시사합니다.
또한 커큐민은 세포주기 진행 중 G1에서 S로의 전환을 억제하여 위암에서 필수적인 역할을 합니다.
Cyclin D1 활성은 세포 주기 동안 세포 증식 및 조절에 중요하며 G1 단계에서의 분해는 세포가 S기로 진행하는 것을 중단시킵니다.
위암 세포주 (AGS) 에서 커큐민과 화학요법제인 독소루비신의 시너지 효과 가 보고되었습니다.
이 시너지 효과는 독소루비신 또는 커큐민 단독에 비해 종양 회전 타원체 형성, 침습 및 이동 을 상당히 감소시키는 것으로 나타났습니다.
두 화합물의 효과는 함께 caspase-9와 Bax의 상향 조절과 Bcl-2 발현의 하향 조절을 일으켰습니다.
이는 커큐민이 독소루비신 효능을 증가시켜 화학요법 치료에서 독소루비신 약물 내성을 개선할 수 있음을 의미합니다.
그러나 임상 조사에서 curcumin의 제한된 효능은 낮은 용해도, 높은 대사율 및 낮은 생체 이용률에 기인합니다.
나노기술 전략의 사용은 장애물을 극복하고 벤치에서 클리닉으로 커큐민의 번역을 촉진하는 데 도움이 될 수 있습니다.
커큐민(curcumin nanoformulations 또는 nanomedicine)의 고급 약물 전달은 생체 이용률 및 약동학 을 향상시켜 치료 효과를 활용할 수 있습니다.,
증가하는 종양 결합, 내재화 및 표적화. 이러한 혁신적인 약물 전달 시스템을 채택함으로써 얻을 수 있는 이점은 막대하며 잘 연구되었습니다 .
3 . 암의 면역 조절제로서의 천연물
면역계의 항상성 의 유지 는 생명체의 생리적 안정성에 필수적인 핵심 메커니즘이다.
천연물은 다양한 선천 면역 및 후천 면역 과정에 참여하며 면역 체계 기능 의 중요한 조절자입니다 .
면역 조절 특성을 가진 천연물 및 그 유도체는 현재 다양한 유형의 암에 대한 치료제로 사용되고 있습니다.
천연물은 선천적 백혈구(NK 세포, 호산구 , 호염기구 , 비만 세포) 및 식세포(호중구, 대식세포, 수지상 세포)와 같은 면역계 매개체가 병원체에 대한 방어를 제공 하는 비특이적 선천 면역 반응을 자극하는 것으로 알려져 있습니다.
선천 면역의 증폭은 면역 세포 침투 , 식균 작용 및 종양 세포 파괴 로 이어지는 NK 세포 매개 세포 독성과 같은 기타 세포 독성 메커니즘과 같은 이펙터 선천 면역 반응을 촉진합니다 [144] ( 그림 3 ).
타고난 면역 반응을 활성화하는 것 외에도 일부 천연 화합물은 면역 조절제로 작용하여 적응 면역 시스템의 후속 활성화를 유도합니다.
적응 면역에서 종양 항원 은 세포 표면 항원 특이적 수용체를 통해 T 및 B 림프구 에 의해 인식되고 향상된 체액 반응 을 유도합니다.및 T 세포 매개 암 세포 사멸 과 같은 다양한 메커니즘에 의한 종양 세포의 제거 ( 도 3 ).

그림 3 . 선천 및 적응 면역 반응에서 천연물의 역할.
천연 제품은 면역 세포 침투 , 식균 작용 및 NK 세포 매개 세포 독성과 같은 다양한 메커니즘에 의해 종양 세포를 제거하는 비특이적 타고난 반응을 자극합니다 .
천연 제품은 또한 T 세포 매개 종양 세포 사멸 및 강화된 체액 반응 으로 이어지는 적응 면역 시스템의 활성화를 유발할 수 있는 면역 조절 특성을 가지고 있습니다 .
(NK: natural killer).
암의 면역 조절에 중요한 역할을 하는 임상 시험에서 잘 알려진 천연 화합물 중 일부는 커큐민 , RES , 에피갈로카테킨-3-갈레이트(EGCG), 케르세틴 , 캡사이신 및 제니스테인 입니다.
curcumin, RES, quercetin, genistein과 같은 천연 면역 조절 화합물의 항산화 특성으로 인해 종양 시작 및 발달에 대한 예방제로 사용할 수 있습니다.
자연적으로 발생하는 면역 조절제는 세포 주기 정지 및 세포자멸사 유도를 통해 종양 전파를 예방할 수 있습니다.
커큐민의 잘 알려진 항암 및 항염증 효과 외에도 다양한 범위의 분자 표적을 조절함으로써 커큐민의 면역 조절 효과가 보고되었습니다.
커큐민은 인간 위암 이종이식 및 마우스 결장암 동종이식 모델 에서 비장, 혈액 및 종양 조직에서 골수 유래 억제 세포(MDSC)의 축적을 억제하는 것으로 보고되었습니다.
또한, 생체 내 연구에 따르면 커큐민은 입양 요법과 결합될 때 종양 미세 환경 (TME)의 변경을 통해 종양에 대한 CD8(+) T 세포의 세포 독성을 향상시키는 것으로 보고되었습니다.
또한 T 세포의 미토겐 및 항원 유도 증식 가능성을 향상시킵니다
반면, RES는 TME에서 종양 억제 세포를 선호하고 면역원성 을 증가시켜 시험관 내 및 생체 내 다양한 암 모델에서 면역 조절 효과를 나타내는 것으로 보고되었습니다.
또한 RES와 커큐민은 YAC-1 세포에서 자연 살해(NK) 세포 활성화를 자극하는 것으로 나타났습니다.
플라보노이드 중 아피게닌( apigenin ) , 루테올린( luteolin ) 과 같은 플라본 (flavone) 은 면역조절 특성을 나타내는 것으로 보고되고 있다.
연구에 따르면 아피게닌, 루테올린, 케르세틴과 같은 플라보노이드가 폐암 세포에 대한 NK 세포 매개 세포 독성을 향상시키는 것으로 나타났습니다.
또한, 연구에서는 아피게닌과 루테올린 처리가 NK 세포에서 perforin 과 granulysin (NK 세포 내부에 저장된 세포 용해 단백질) 의 분비 수준을 증가시켰다고 보고했습니다 .
또 다른 자연 발생 플라보노이드인 제니스테인은 자궁경부암 마우스 모델 에서 림프구 증식 을 증가시켜 면역 조절 효과를 나타냈습니다 .
또 다른 연구에서는 제니스테인 처리가 생체 내 및 시험관 내 B16F10 흑색종 종양 세포에서 세포독성 T-세포(CTL) 활성을 강화하고 IL-2로 자극된 NK 세포 활성을 강화한 것으로 나타났습니다 .
또 다른 연구에서 녹차의 항산화 성분인 EGCG와 DNA 백신 접종 의 조합은 쥐 종양 모델에서 종양 특이적 T 세포 면역 반응을 향상시켰습니다 .
생체 내 연구에 따르면 EGCG 치료는 쥐 백혈병 및 방광암 모델에서 각각 NK 세포 활성을 촉진하고 T 및 B 세포 증식을 증가시키고 NK 세포 매개 세포 독성을 향상시키는 것으로 나타났습니다 .
또는 녹차의 항산화 성분인 EGCG는 유방암 환자에서 분리한 말초혈액 단핵구 의 증식을 억제하고 mitogen, anti-CD3, 암항원 펩타이드와 별도로 자극하여 면역억제 효과 를 나타내는 것으로 보고되었다 .
칠리 페퍼의 활성 성분인 캡사이신을 사용한 치료는 결장암 세포에서 CTL 활성을 향상시키고 Meth A 섬유육종 종양 마우스 모델 에서 강력한 T 세포 반응을 유도하는 것으로 보고되었습니다 .
따라서 천연물, 그 추출물 및 유도체의 면역조절 특성은 면역 감시 를 회복 하고 암 치료제의 주요 장애물인 복합 면역억제 TME를 표적으로 삼을 수 있는 화학 요법을 보완하는 새로운 면역 조절제를 개발하기 위한 효율적인 치료 표적으로 작용할 수 있습니다.
4 . 결론
다양한 암을 유발하는 유전자 돌연변이의 빈번한 발생은 암 관리 요법의 실패로 이어져 암 예방을 항암 연구의 흥미로운 영역으로 만들고 있습니다.
천연물을 포함하는 모든 연구에서 나타난 한 가지 공통된 주제는 분자 표적의 활성이나 발현 또는 둘 다를 조절하여 세포 사멸, 세포 증식, 이동/침습, 혈관신생, 전이 및 특정 천연 제품에 고유한 다른 경로에 영향을 미침으로써 동시에 여러 발암성 신호 전달 경로를 표적으로 삼는 경향입니다.
대부분의 천연물은 내재적 세포자멸사 신호전달 경로를 표적으로 하여 암세포 사멸을 초래하는 미토콘드리아로 부터 시작되는 이벤트를 유발하는 여러 세포 내 신호를 생성합니다.
흥미롭게도, 천연물은 내화학성 암의 약물 감작성을 개선하기 위한 보조제로 사용될 수 있습니다.
'암치료' 카테고리의 다른 글
| 암 성장 또는 재발을 증가시키는 허브 또는 천연 제품 (0) | 2022.05.25 |
|---|---|
| 암 성장을 감소시키는 허브 또는 천연 제품 (0) | 2022.05.24 |
| 암에서 대사 재프로그래밍을 표적으로 하는 파이토케미칼: 역할, 메커니즘, 경로 및 치료 관련성 평가 (0) | 2022.05.19 |
| ⚡자가포식 유도제와 자가포식 억제제의 조합 (0) | 2022.01.12 |
| ⚡Cystathionine-β-synthase (0) | 2022.01.12 |