https://www.mdpi.com/2076-3921/10/1/83/htm
Role of Phytochemicals in Perturbation of Redox Homeostasis in Cancer
Over the past few decades, research on reactive oxygen species (ROS) has revealed their critical role in the initiation and progression of cancer by virtue of various transcription factors. At certain threshold values, ROS act as signaling molecules leadin
www.mdpi.com
<Role of Phytochemicals in Perturbation of Redox Homeostasis in Cancer>
3. 파이토케미칼: ROS 매개 암세포 사멸에서 유망한 역할
다양한 연구에서 생성된 수많은 증거를 고려할 때, ROS는 임계값을 넘어서는 항종양 역할을 한다는 것이 분명합니다.
요구되는 역치 ROS 수준을 달성하기 위한 치료적 개입은 Programmed Cell Death(PCD)를 유도하기 위한 유망한 전략입니다.
3.1. ROS 매개 세포자멸사를 통해 작용하는 파이토케미칼
3.1.1. 캡사이신
캡사이신( N-바 닐릴-8-메틸노넨아미드)은 고추에서 얻은 호모바닐산 유도체입니다[ 64 ].
그것의 활성은 산화 스트레스 유발 세포자멸사를 통해 매개되는 것으로 제안된다.
췌장암 세포주인 BXPC-3 및 AsPC-1에서는 캡사이신 처리 1시간 이내에 4~6배의 ROS 생성이 관찰되었지만 정상 췌장 세포에서는 ROS 생성이 없었습니다.
캡사이신은 미토콘드리아의 성분인 카디오리핀의 산화를 유도했습니다.
카디오리핀의 산화는 결과적으로 세포자멸사를 초래했습니다.
ETC complex-I 및 complex-III는 capsaicin 처리 후 ROS 생성 물질로 관찰되었습니다. [ 67 , 68].
3.1.2. 설포라판
Sulforaphane(SFN; 1-isothiocyanato-4-(methyl-sulfinyl)-butane)은 양배추, 브로콜리, 콜리플라워, 케일과 같은 십자화과 야채에 존재하는 이소티오시아네이트입니다[ 69 ].
Sulforaphane은 PC-3 및 DU145 인간 전립선암 세포에서 ROS 매개 세포자멸사를 유도했습니다.
구체적으로, 설포라판 처리 후 카스파제-8 활성화 및 Fas 단백질 유도는 세포자멸 활성을 확인하였다.
ROS 생성은 비미토콘드리아 및 미토콘드리아 메커니즘 모두에 의해 유발되는 것으로 제안되었습니다.
GSH 고갈은 비-미토콘드리아 메커니즘으로 제안되었습니다.
ROS는 EUK-134(SOD 및 카탈라제 모방체)로 처리한 후 카스파제-8 감쇠를 기반으로 한 세포자멸사의 업스트림 활성제로 가정되었습니다[ 70 ].
3.1.3. α-리포산
α-리포산(1,2-Dithiolan-3-yl pentanoic acid)은 과일과 채소에서 발견되는 자연 발생 디티올 화합물입니다
간세포 암종 세포주 HepG2에서는 ROS 생성이 선행된 미토콘드리아 세포자멸사를 유도했습니다.
정확히는 C/EBP 상동 단백질(CHOP)의 증가된 수준이 검출된 α-리포산 유도 ER(소포체) 스트레스입니다.
ER 스트레스는 PERK(phospho-extracellular signal-related kinase) 경로와 IRE1(inositol-required enzyme 1) 경로를 활성화시켜 세포자멸사를 유도합니다.
α-리포산은 또한 ATF6(전사 인자 6 활성화) 매개 생존 촉진 경로를 억제했습니다[ 72 ].
3.1.4. 벤질 이소티오시아네이트(BITC) Benzyl Isothiocyanate
BITC는 콜리플라워, 겨자, 물냉이, 양배추, 양 고추 냉이와 같은 십자화과 야채에 존재하는 이소티오시아네이트입니다[ 73 ].
BITC는 이전에 다양한 연구에서 항암 효과에 대해 연구되었습니다 [ 74 , 75 , 76 , 77 , 78].
BITC는 췌장암 세포주인 Capan-2 및 MIAPaCa-2 세포에서 항암 가능성에 대해 연구되었습니다.
BITC 처리는 치료 1시간 이내에 관찰된 ERK 및 JNK의 활성화와 함께 MAPK 신호전달을 활성화한 반면, ROS 생성은 처리 30분 이내에 관찰되었습니다.
또한, 정상적인 HPDE-6 세포주에서는 MAPK 계열 구성원의 활성화가 없었습니다.
따라서 BITC 처리는 ROS 생성에 이어 MAPK 계열 구성원인 ERK, JNK 및 P38의 활성화 및 후속적인 세포자멸사를 유도했습니다[ 79 ].
3.1.5. 페네틸 이소티오시아네이트(PEITC) Phenethyl Isothiocyanate
십자화과 야채에 존재하는 또 다른 이소티오시아네이트인 PEITC는 항암 효과와 ROS 생성 특성에 대해 연구되었습니다[ 80 , 81 , 82 , 83 , 84 , 85 ].
유방암 세포에 대한 PEITC의 효과를 조사하기 위한 연구에서 PEITC는 MDA-MB-231 및 MCF-7 세포주에서 ROS 매개 세포자멸사를 보여주었습니다.
PEITC로 치료한 후 암세포에서 높은 수준의 과산화수소가 관찰되었습니다.
항산화 전처리는 PEITC에 의해 유도된 세포 사멸 및 세포자멸사 비율을 차단했습니다.
따라서 높은 수준의 ROS를 확인하면 세포 사멸이 발생합니다 [ 86 ].
3.1.6. 피페린
Piperine [1-(5-[1,3-benzodioxol-5-yl]-1-oxo-2,4-pentadienyl) piperidine]은 검은 후추( P. nigrum )와 긴 후추( P. longum ) 에서 추출한 알칼로이드입니다 . ) [ 87 ].
Piperaceae 계통 에서 파생된 다양한 소분자 는 암세포의 ROS 매개 세포자멸사 세포사에 연루되어 있습니다 [ 88 , 89].
피페린은 SKMEL-28 및 B16-F0 흑색종 세포주에서 ROS 생성과 관련이 있습니다.
ROS 생성은 처리 30분 이내에 관찰되었으며 수준은 24시간까지 지속되었습니다.
Chk1(체크포인트 키나제 1)의 인산화가 DNA 손상에 대한 반응으로 관찰되었으며 결과적으로 G1 세포 주기 정지 및 세포자멸사를 초래했습니다.
Ser 428에서 인산화된 모세혈관확장성 운동실조와 Rad3 관련 단백질(ATR)과 Ser 296에서 Chk1의 현저한 발현이 관찰되었으며, 이는 DNA 손상을 시사합니다[ 90 ].
3.1.7. 커큐민
Curcumin(1,7-bis(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione)은 Curcuma longa의 뿌리줄기에서 추출한 폴리페놀입니다.
그것은 항암 효과를 포함한 다발성 치료 효과를 가지고 있습니다[ 91 , 92 ].
curcumin의 apoptotic 역할은 결장직장암에서 연구되었으며 순차적 투여는 ROS 매개 apoptotic 유도에 중요한 것으로 간주되었습니다.
이 연구에서 순차적 치료는 자가포식 조절 장애 및 ER 스트레스를 동반한 리소좀 투과화 및 ROS 생성을 유발했습니다.
리소좀 투과화는 BID 의존성 미토콘드리아 막 투과화 및 그에 따른 카스파제 의존성 세포자멸사를 초래했습니다.
카텝신 B는 순차 치료 후 세포 사멸에 관여하는 것으로 확인되었다[ 93 ].
그림 1 파이토케미칼의 ROS 매개 아폽토시스 작용을 묘사합니다.

3.2. ROS 매개 Ferroptosis를 통해 작용하는 파이토케미컬
3.2.1. 위다페린 A Withaferin A
Withaferin A(WA)는 Withania somnifera 식물에서 분리된 스테로이드성 락톤입니다 .
그것은 항염증 및 항종양 특성에 대해 널리 연구되었습니다[ 94 ].
Withaferin A는 신경모세포종 세포에서 ferroptotic 세포 사멸을 유도했습니다.
WA는 Nrf2(핵인자 적혈구계 2 관련 인자(2))의 음성 조절자인 Keap-1(켈치 유사 ECH 관련 단백질(1))을 표적으로 했습니다.
Keap-1 억제는 Nrf2의 방출을 일으켰습니다.
방출된 Nrf2는 헴 분해를 촉매하여 철(Fe2+)을 생성하는 HMOX1[heme oxygenase (decycling) 1]을 상향 조절합니다.
높은 농도의 Fe2+는 ROS 생성과 궁극적으로 세포 사멸로 이어졌습니다.
3.2.2. 브로멜라인
Bromelain은 Bromeliaceae 과에 속하는 파인애플 식물의 줄기에서 추출한 단백질 분해 효소의 혼합물 입니다[ 96 ].
브로멜라인은 지질 생합성 및 지방산 분해에 역할을 하는 장쇄 아실-CoA 합성효소-4(ACSL4) 동위효소의 수준을 증가시킨 KRAS 돌연변이 결장직장암에서 ferroptotic 세포 사멸을 유도하는 것으로 나타났습니다.
특히, ACSL4는 산화된 세포막 인지질을 축적합니다.
3.2.3. 루스코게닌
Ruscogenin [(1β,3β,25 R )-Spirost-5-ene-1,3-diol]은 Ruscus aculeatus 식물 에서 추출한 스테로이드성 사포게닌입니다 [ 98 ].
Ruscogenin은 췌장암 세포주 BxPC-3, SW1990, PANC-1 및 AsPC-1에서 ferroptotic 효과에 대해 연구되었습니다.
Ruscogenin 처리 는 transferrin의 발현을 상향조절하고 ferroportin의 발현을 하향조절하여 Fe 2+ 이온 농도를 증가시켰다.
결론적으로, ruscogenin은 철 수송을 조절하여 ROS의 과잉 생산을 초래하여 세포 사멸을 초래합니다[ 99 ].
3.2.4. 오리도닌
Oridonin(Ori)은 Isodon Rubescens [ 100 ] 에서 얻은 사환식 디테르페노이드 입니다.
Ori의 ferroptotic 효과는 식도암 세포주 TE1에서 연구되었으며 감마-글루타밀 회로의 억제는 oridonin 처리된 세포에서 관찰되었습니다.
정확히는 Ori는 산화 스트레스로부터 세포를 보호하고 시스테인 항상성을 유지하는 데 중요한 감마-글루타밀 회로의 핵심 효소인 GGT1에 영향을 미쳤습니다.
또한 Ori는 TE1 세포에 들어간 후 시스테인과 공유 결합하여 GSH를 억제했습니다.
공유 결합은 ferroptosis를 담당하는 세포 내 시스테인 수준을 감소시킵니다.
Ori 치료 후 GPX4 수준의 감소도 감지되었습니다
그림 2 phytochemicals의 ROS 매개 ferroptotic 활동을 묘사합니다.

3.3. ROS 매개 자가포식을 통해 작용하는 파이토케미칼
3.3.1. 쿠커비타신 B
Cucurbitacin B(1,2-Dihydro-alpha-elaterin)는 Cucurbitaceae 및 기타 다양한 기타 식물과 의 식물에서 발견되는 사환식 트리테르펜 화합물 입니다.
쿠커비타신 B의 공급원 중 일부는 Helicteres angustifolia , Licaniaintra petiolaris , Casearia arborea 및 Cucumis propheterarum입니다 [ 103].
Cucurbitacin B는 인간 자궁경부암 HeLa 세포에서 항암 효과에 대해 연구되었습니다.
Cucurbitacin B는 autophagic 세포 사멸을 유도했으며 미토콘드리아 ROS 생산을 통해 매개되는 것으로 관찰되었습니다.
HeLa 세포를 cucurbitacin-B로 처리하면 세포질 autophagic 액포가 있는 여러 층상 구조가 축적되었습니다.
또한, cucurbitacin-B로 처리한 후 non-autophagic soluble LC3(LC3-I)가 autophagic LC3(LC3-II)로 전환되는 것이 감지되었습니다.
항산화제 NAC와 Mito-TEMPO(미토콘드리아 표적 항산화제)로 전처리하면 LC3-II 전환, 세포 사멸 및 자가포식소체 형성이 억제되었습니다.
따라서 결과는 ROS가 cucurbitacin 치료 후 autophagic 세포 사멸을 촉진하는 데 중요한 역할을 함을 나타냅니다[ 104].
또 다른 연구에서는 MCF-7 유방암 세포에서 ROS를 통해 쿠커비타신-B가 자가포식 세포 사멸을 유도함을 확인했습니다.
ROS의 역할은 LC3 II의 단백질 발현을 감소시키는 항산화 전처리의 사용으로 확인되었습니다[ 105 ].
3.3.2. 실리비닌
실리비닌은 밀크씨슬( Silybum marianum ) 에서 추출한 플라보노이드 입니다.
실리비닌의 자가포식 활성은 인간 섬유육종 HT1080 세포에서 연구되었으며, 여기서 실리비닌은 ROS-p38 경로를 통해 p53을 활성화하는 것으로 나타났습니다.
p53의 활성화는 MEK/ERK1/2 및 PI3K/Akt 경로를 억제함으로써 부분적으로 매개된 자가포식 세포 사멸을 매개합니다.
Beclin1(자가포식소체 마커)의 발현 증가와 LC3 I에서 LC3 II로의 전환이 silibinin 처리 후 관찰되었습니다
또 다른 연구에서는 실리비닌이 미토콘드리아 기능 장애를 통해 매개되는 자가포식 세포 사멸을 유도한다고 밝혔습니다[ 107 ].
3.3.3. 알리신
Allicin(2-propene-1-sulfinothioic acid S -2-propenyl ester)은 항균 연구를 위해 초기에 연구된 마늘에 존재하는 유기황 화합물입니다[ 108 ].
알리신은 비소세포 폐암 세포주 A549(선암종) 및 NCI-H460(대세포 암종)에서 ROS 생성 증가를 통해 자가포식 및 세포자멸사를 모두 유도하는 것으로 나타났습니다.
저자는 알리신의 용량 의존적 자가포식 작용을 관찰했습니다.
낮은 복용량에서 알리신은 중간 정도의 ROS 수준과 관련된 자가포식을 유도한 반면, 복용량을 늘리면 ROS 생산이 증가하고 리소좀 파괴가 일어나 세포 사멸을 초래했습니다.
리소좀 파괴는 세포 내 가수분해 효소 방출을 초래했습니다 [ 109]. 알리신의 유사한 자가포식 작용이 간세포 암종 세포에서 연구되었습니다.
흥미롭게도 알리신은 p53 정상 인간 간암 세포에서 자가포식 유도를 일으키고 p53 결핍 세포주에서는 세포자멸사를 통해 p53에 대한 자가포식 작용의 의존성을 보여줍니다[ 110 ].
3.3.4. 카르노솔
Carnosol은 지중해 허브 로즈마리, 세이지 및 오레가노에서 발견되는 오르토-디페놀성 디테르펜입니다 항산화 활성에 대해 연구되었지만 일부 증거는 ROS 과잉 생산을 통한 카르노솔의 세포 독성 효과를 보여줍니다.
carnosol에 의한 ROS 생산은 용량과 시간 의존적 과정입니다[ 112 ].
MDA-MB 231 유방암 세포에 대한 Carnosol 연구는 치료 1시간 이내에 ROS 축적을 보여주었으며, 치료 후 3시간에 LC3II 축적을 보여주었으며, 이는 ROS가 자가포식의 업스트림 유도제임을 시사합니다.
낮은 농도(<25 μM)에서는 carnosol에 의해 유도된 ROS 매개 자가포식만이 관찰되었고, 더 높은 농도(>50 µM)에서는 ROS가 자가포식과 세포자멸사를 모두 유도하는 것으로 관찰되었습니다.
흥미롭게도 carnosol에 의한 autophagy 유도는 beclin-1과 무관합니다.113].
3.3.5. 케르세틴
케르세틴은 포도, 레드 라즈베리, 사과와 같은 과일과 브로콜리, 샬롯, 토마토, 양파, 차와 같은 야채에서 발견되는 플라보노이드입니다[ 114 ].
케르세틴은 항암 효과에 대해 널리 연구되어 왔으며 여러 경로를 통해 그 효과를 발휘합니다.
골육종 세포에서 케르세틴에 대한 연구는 자가포식소체 형성, 화물 분해 및 자가포식소체-리소좀 융합에 관여하는 핵단백질 1(NUPR1)에 대한 작용을 통해 자가포식 플럭스를 활성화시키는 것으로 나타났습니다.
케르세틴에 의해 유도된 ROS의 과잉 생산은 NUPR1의 발현과 활성화를 증가시키는 것으로 관찰되었습니다.
대부분의 연구에서 NUPR1과 ROS 사이에 역관계가 있음을 보여주지만 직접적인 관계가 있다고 가정합니다[ 115 , 116 ].
3.3.6. 베르베린
Berberine(5,6-dihydro-9,10-dimethoxybenzo[g]-1,3-benzodioxolo[5,6-a] quinolizinium)은 많은 식물과 주로 속하는 식물의 줄기 껍질과 뿌리에서 추출한 4급 벤질이소퀴놀린 알칼로이드입니다.
최근에 베르베린이 광역학 요법(PDT)과 결합된 신세포 암종 모델에서 항암 역할에 대해 조사되었습니다.
베르베린의 형광성은 조합 효과의 핵심 특성이었습니다.
베르베린은 레이저와 광감작제의 상보적 작용이 ROS 생성을 유도하여 세포 사멸을 유도하기 때문에 광감작제로 사용되었습니다.
PDT와 함께 베르베린은 베르베린 단독과 비교하여 상당히 증가된 자가포식을 보여 베르베린의 광활성화가 ROS 매개 자가포식 및 궁극적인 세포 사멸에 필요함을 시사합니다[ 118 ].
그림 3 은 파이토케미칼의 ROS 매개 자가포식 작용을 보여줍니다.
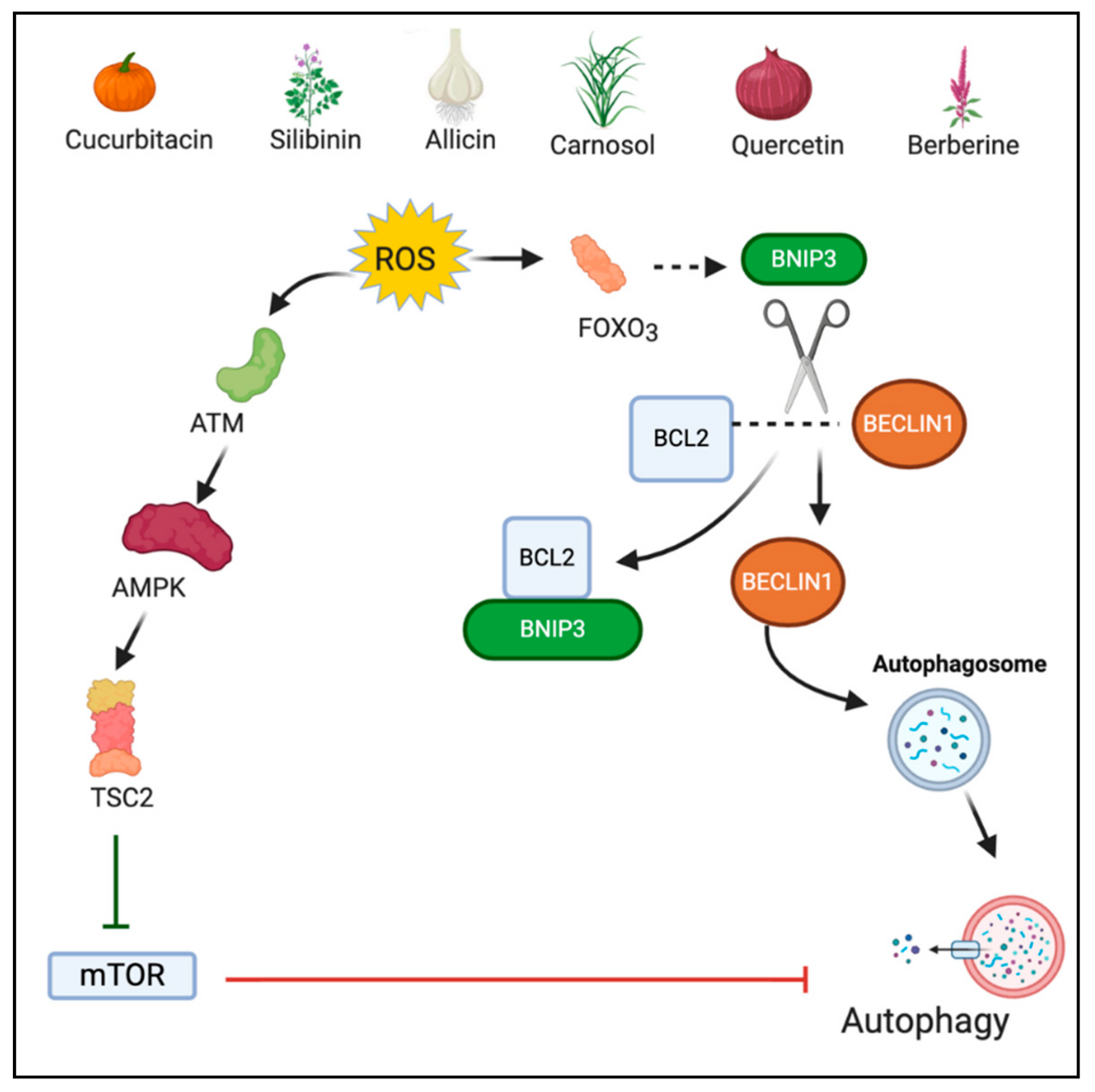
3.4. ROS 매개 파이로프토시스를 통해 작용하는 파이토케미칼
노빌레틴
Nobiletin(5,6,7,8,3',4'-hexamethoxyflavone)은 감귤류에서 추출한 폴리메톡시플라보노이드입니다.
노빌레틴은 항대사 장애, 항암, 신경 보호, 항염, 항산화, 심혈관 보호 등 다양한 약리 활성을 가지고 있다
Nobiletin은 인간 난소암 세포주 A2780 및 OVCAR3에서 항암 활성에 대해 연구되었습니다.
연구에서 노비레틴 처리는 ROS 생성을 초래했으며, 이는 용량 의존적 방식으로 미토콘드리아 막 전위의 현저한 감소로 나타났습니다.
또한, ROS는 pyroptosis의 두 가지 바이오마커인 GSDMD와 GSDME의 절단에 기여했으며, 그 중 GSDMD는 pyroptosis의 실행자로 간주됩니다
그림 4 phytochemicals의 ROS 매개 pyroptotic 활동을 묘사합니다.

3.5. ROS 매개 Anoikis를 통해 작용하는 파이토케미칼
에모딘
Emodin(1,3,8-trihydroxy-6-methylanthraquinone)은 대황( Rheum palmatum )과 알로에 베라 에서 얻은 안트라퀴논 유도체입니다 [ 122 ].
Emodin은 위암 세포에서 ROS 생성에 이어 anoikis를 유도하는 것으로 나타났습니다.
Emodin은 산화 스트레스를 유발하고 세포골격 재배열에서 중요한 신호 분자인 RhoA의 비활성화를 유발했습니다.
RhoA의 비활성화는 초점 접착 복합체와 궁극적으로 anoikis [ 61 ] 의 붕괴를 초래했습니다 .
그림 5 는 파이토케미칼에 의한 ROS 매개 아노이키anoikis를 나타냅니다.

4. 결론
암세포는 정상 세포보다 약간 높은 ROS 수준에서 생존하기 때문에 외부 교란에 더 민감합니다.
그러나 파이토케미칼의 약동학적 매개변수 측면에서 해결해야 할 몇 가지 문제가 있습니다.
항암 활성을 위한 충분한 ROS 수준을 유도하기 위해서는 파이토케미칼의 특정 혈장 수준에 도달해야 합니다.
일부 파이토케미컬은 필요한 혈장 수준을 달성하는 것으로 관찰되었습니다.
좋은 약동학 매개변수를 가진 몇 가지 이러한 후보에는 BITC, PEITC, 실리비닌 및 베르베린이 포함됩니다.
그러나 대부분의 파이토케미칼은 필요한 세포독성 수준을 달성하지 못합니다.
이 문제는 나노 약물 전달 제형과 같은 고급 약물 전달 시스템에서 천연 화합물을 제형화하여 해결할 수 있습니다.
이 측면에서 다양한 연구가 수행되었으며 나노 약물 전달은 식물 화학 물질의 높은 혈장 농도를 달성하는 효과적인 도구임이 입증되었습니다.
성공적인 후보 중 일부는 설포라판과 커큐민을 포함합니다. 나노 구조의 지질 제형은 쥐 혈장에서 설포라판의 생체이용률을 증가시킨 반면 나노 입자 제형은 인간 혈장에서 커큐민 수준을 10-15배 증가시켰습니다.
약동학 데이터의 개요, 피토케미컬에 의한 정상 세포와 암세포 사이의 선택적 작용이 표 1에 제시되어 있습니다.
Phytochemicals are associated with ROS-mediated programmed cell death in cancer.
Effective Anti-Cancer Concentration (In Vitro)Dose Administered (In Vivo)
Pharmacokinetic DataTtt Cell Lines/ SubjectsOutcome/ Comments
| 1 | Capsaicin | Apoptosis | 150 µM | 2.5 mg/kg | Not stated | Animal subject—Mice In vitro study Pancreatic cancer cells |
Apoptosis was observed in AsPC-1 and BXPC3 cell lines at 150 µM concentration, while no effect were observed in normal (HPDE-6) cells. In an animal study, an oral dose 2.5 mg/kg was effective in suppressing tumor growth. Human equivalent dose—0.202 mg/kg. | [67,68] |
| 2 | Capsaicin (Pharmacokinetic study) | - | - | 5 g | Cmax: 2.47 ± 0.13 ng/mL | Human subjects | The oral bioavailability of capsaicin is effective for anti-diabetic effect, but plasma level is less for its anti-cancer activity. | [123,124] |
| 3 | Sulforaphane | Apoptosis | 5–10 µM | - | - | - | Various studies report anticancer activity in a range of 5–10 µM which is not attainable through dietary intake. A study in normal vs. cancerous prostate cells revealed selective cytotoxicity of sulforaphane in cancerous cells. No effect was observed in normal cells at a dose range of 0–15 µM. | [125,126] |
| 4 | Sulforaphane (Pharmacokinetic study) | - | - | 30 mg/kg | Cmax: 772.8 ± 54.36 ng/mL | Animal subject—Rats | Nano structured lipid formulation of sulforaphane increased its bioavailability in rat plasma wherein a dose close to effective anticancer level was achieved. | [127] |
| 5 | α-lipoic acid | Apoptosis | 500 µM | - | - | In vitro study hepatoma cell line | ROS-mediated apoptosis was observed at 500 µM. However, in another study, no effect was observed in normal L02 liver cells at 5 mM concentration. | [72,128] |
| 6 | α-lipoic acid (Pharmacokinetic study) | - | - | 600 mg per day | Cmax: 8–52 nM |
Human subjects | Plasma levels achieved in plasma following oral administration of racemic α-lipoic acid is much less than required for its anti-cancer activity. | [129] |
| 7 | BITC | Apoptosis | - | - | - | In vitro study Pancreatic cancer cells | BITC caused ROS generation in a concentration dependent manner starting from 2.5 to 20 µM in MIAPaCa-2 and Capan-2 cell lines | [79,130] |
| 8 | BITC | Apoptosis | <2.5–5 µM | - | - | In vitro study Breast cancer cells and normal mammary epithelial cell line | BITC induced ROS-mediated apoptosis in MDA-MB-231 and MCF-7 at IC50 value of <2.5 µm and 5 µM respectively at 24-h time point. However, the IC50 was 20 µM in normal mammary epithelial cell line MCF-10A. | [131] |
| 9 | BITC | Apoptosis | 8 µM | - | - | In vitro study Pancreatic cancer cells | An IC50 of 8 µM was observed when BXPC3 cells were treated with BITC. | [132] |
| 10 | BITC (Pharmacokinetic study) | - | - | 12 µM/day | Cmax: 7.5 µM in tumor |
Animal subject—Mice | BXPC3 cells were subcutaneously implanted and a 43% tumor inhibition was observed with a concentration near IC50 value achieved in plasma. | [74] |
| 11 | PEITC | Apoptosis | <5 µM | - | - | In vitro study Breast cancer cells | PEITC caused ROS-mediated apoptosis in MDA-MB-231 and MCF-7 cell lines. | [86] |
| 12 | PEITC | Apoptosis | 5–10 µM | - | - | In vitro study normal ovarian epithelial cell line | Ovarian epithelial cell line T72 was transfected to over express Ras oncogene to form oncogenic T72Ras cell line. Following PEITC treatment, the transformed cells showed higher sensitivity to ROS as compared to normal cells. Thus, showing selective activity of PEITC. | [133] |
| 13 | PEITC (Pharmacokinetic study) | - | - | 10–100 µmol/kg | Cmax: 9–42 µM |
Animal subjects—Rats | A considerably high level of PEITC was achieved after oral administration of PEITC than required for its anti-cancer activity. | [134] |
| 14 | Piperine | Apoptosis | 136–137 µM | - | - | In vitro study Melanoma cell lines |
Piperine induced RPS mediated apoptosis in SKMEL-28 and B16-F0 cells at 136 µM and 137 µM respectively at 72-h time point. | [90] |
| 15 | Piperine | Apoptosis | 132 µg/mL | - | - | In vitro study Lung cancer cells and normal lung fibroblasts |
Piperine induced apoptotic cell death via p53 dependent mitochondrial pathway in A549 cancer cell line while no significant cytotoxicity was observed in normal WI38 human lung fibroblasts. ROS are considered to be downstream effectors of p53 mediated apoptosis. | [135,136] |
| 16 | Piperine (Pharmacokinetic study) | - | - | 200 mg tablets (Benjakul formulation) | Cmax: 1.078 µg/mL |
Human subjects | Piperine is a major component of a traditional Thai medication called Benjakul. A dose of 200mg resulted in a Cmax level of 1.078 µg/mL which is significantly lower than that required for anticancer effect. | [137] |
| 17 | Curcumin | Apoptosis | 25 µM | 5 mg/kg | - | In vitro study Colorectal cancer cells Animal subjects—Mice |
Curcumin induced ROS-mediated apoptotic cell death in HCT-116 cell line at 25 µM concentration within 48hh. Curcumin showed considerable tumor inhibition in in vivo xenograft model following administration of 5 mg/kg I.P dose. |
[93] |
| 18 | Curcumin | Apoptosis | 20 µM | - | - | In vitro study Cervical cancer cells and normal cervical cells |
Curcumin induced ROS-mediated apoptosis in cervical cancer cell lines C33A, CaSki, HeLa, and ME180 cells at approximately 20 µM in 48-h time period, while it did not induce significant toxicity in normal counterparts until 40 µM concentration. | [138] |
| 19 | Curcumin (Pharmacokinetic study) | - | - | Various doses (2–10 g) | Cmax: 1–3200 ng/mL | Healthy human volunteers and patients (cancer, Alzheimer’s disease etc.) | The serum levels of curcumin achieved by oral administration of crude curcumin are much lower than required for anti-cancer activity. However, a 10–15-fold increase in plasma levels was observed when curcumin was formulated as nanoparticle or combined with piperine, lecithin, etc. | [139] |
| 20 | Withaferin A | Ferroptosis | 5–10 µM | 4 mg/kg | Not stated | In vitro study Neuroblastoma cell lines Animal subjects— Mice |
Crude Withaferin A and its nano particle formulation for tumor targeting showed ROS-mediated ferroptosis at 10 µM in neuroblastoma cell lines IMR-32, SK-N-SH, Kelly, NB69, and CHP-134 within 4–8 h. Tumor regression was mediated through lipid peroxidation. | [95] |
| 21 | Withaferin A | Apoptotic | 1–50 µM | 4 mg/kg | Cmax: 1.8 µM |
In vitro study Breast cancer cell lines Animal subject—Mice |
Withaferin A displayed cytotoxicity in breast carcinoma cell lines MDA-MB 231, H1299, T47D, MCF-7, LN686, as well as normal fibroblast cell line COS-7 in a wide range of 1–50 µM at 72-h time point. The IC50 was lesser than normal fibroblasts in majority of the cancer cell lines. | [140] |
| 22 | Bromelain | Ferroptosis | - | 3 mg/kg | Not stated | In vitro study Colon carcinoma cell lines and normal colon cell line. Animal subjects—Mice |
Bromelain inhibited proliferation of in Kras mutant colon cancer cell lines HCT-116 and DLD-1 at 50 µg/mL, while it induced significant ferroptosis in cancer cell lines at a concentration of 5 µm when combined with Erastin as compared to normal colon cells CCD1co. Bromelain increased survival rate in treatment group as compared to vehicle group. | [81] |
| 23 | Bromelain (Pharmacokinetic study) | - | - | 143 mg/kg | Cmax: Very low (specific value not stated) | Human subjects | Bromelain showed very low (ng/mL) plasma levels following oral administration at 143 mg/kg body weight. | [141] |
| 24 | Ruscogenin | Ferroptosis | 7.3–28.19 µM | 5 or 10 mg/kg | Not stated | In vitro study Pancreatic cancer cells Animal subjects—Mice |
Ruscogenin induced significant ferroptotic cell death in pancreatic cancer cell lines BxPC-3, SW1990, PANC-1, and ASPC-1 cells, as compared to normal pancreatic cell line HPDE-6-C7 wherein not IC50 was detected at 72-h time point in HPDE6-C7 cells. Additionally, it inhibited pancreatic cancer growth in vivo. | [99] |
| 25 | Ruscogenin (Pharmacokinetic study) | - | - | 8 mg/kg | Cmax: 504.50 ± 63.47 ng/mL (Mean value) |
Animal subjects—Rats | Following IV administration of Ruscogenin in rats, a plasma level between 2–1000 ng/mL was observed which roughly translates to 2.35 µM, a level much lower than required for anticancer effect. | [142] |
| 26 | Oridonin | Ferroptosis | 26.93 µM | - | - | In vitro study Esophageal cancer cells |
Oridonin induced ferroptotic cell death in esophageal cancer cell line TE1 at 27 µM within 24-h time point. | [101] |
| 27 | Oridonin | Apoptosis | 2.5–10 µM | - | - | In vitro study Esophageal cancer cell lines |
Oridonin induced cellular death in human esophageal cancer cell lines (KYSE70, KYSE410, and KYSE450) at 2.5–10 µM concentration, while it showed 40% cell death in normal esophageal cell line SHEE at 40 µM, a significantly higher concentration. | [143] |
| 28 | Oridonin (Pharmacokinetic study) | - | - | 20 mg/kg | Cmax: 146.9 ± 10.17 ng/mL | Animal subjects—Rats | A concentration of approximately 150 ng/mL translating to 412 nM was achieved. Combination with verapamil increased the Cmax level of oridonin to 194 ± 10 ng/mL, still a lower level for anti-cancer efficacy. | [144] |
| 29 | Cucurbitacin B | Autophagy | Approximately 1 µM | - | - | In vitro study Cervical cancer cell line and breast cancer cell lines |
Cucurbitacin B induced caspase independent autophagic cell death in HeLa cells at 1 µM. Additionally, it induced autophagy and increased ROS levels in MCF-7 at 200 nM. Autophagic cell death in normal counterparts was not studied. | [104] |
| 30 | Cucurbitacin B | Apoptosis | 0.2 µM | - | - | In vitro study Prostate cancer cell lines |
Cucurbitacin B induced cell death and ROS production in human prostate cancer cell lines LNCaP and PC-3 at 0.2 µM while no significant cell death or ROS production was observed in normal prostate cell line PrEC. | [145] |
| 31 | Cucurbitacin B (Pharmacokinetic study) | - | - | 2–4 mg/kg | Cmax: 9–31 µg/L |
Animal subjects—Rats | Following an oral administration of 2–4 mg/kg, a significantly low plasma level was achieved in rat plasma than required for anti-cancer activity. | [146] |
| 32 | Silibinin | Autophagy | 40 µM | - | - | In vitro study Fibrosarcoma cells |
Silibinin induced autophagy in human fibrosarcoma cell lines HT1080 at 40 µM within a period of 4 h. Cellular death was concluded to be an autophagy mediated apoptosis process. Effect on normal cells was not studied. | [106] |
| 33 | Silibinin (Pharmacokinetic study) | - | - | 360, 720 and 1440 mg | Cmax: 0.4, 1.4 and 4 ± 5.3 µM respectively |
Human Subjects—Colorectal cancer patients | Silibinin formulated capsules showed considerably high levels required to exert its anti-tumor effect. | [147] |
| 34 | Allicin | Autophagy and apoptosis | 15–30 µg/mL | - | - | In vitro study Non-small cell lung cancer cell lines |
Allicin induced both autophagy and apoptosis in human lung cancer cell lines A549 and NCI-H460. | [109] |
| 35 | Carnosol | Autophagy | <25 µM | - | - | In vitro study Breast cancer cell lines |
Carnosol induced ROS-mediated autophagy in triple negative breast cancer cell line MDA-MB-231. Effect on normal cell counterparts was not studied. | [113] |
| 36 | Quercetin | Autophagy | 200 µM | 100 mg/kg | - | In vitro study Osteosarcoma cell line Animal subjects—Mice |
Quercetin induced ROS-mediated autophagic cell death in human osteosarcoma cell line MG-63 and also inhibited tumor growth in mice model. | [116] |
| 37 | Berberine | Autophagy | - | - | - | In vitro study Renal carcinoma cell lines and normal kidney cell line. |
Berberine induced autophagic cell death in 786-O, ACHN cell lines via its photosensitizer activity when combined with laser. Additionally, it induced cell death in normal kidney cell line HK-2 at when combined with laser. Treatment with Berberine alone failed to induce cell death >20% in cancer cells, while it induced cell death >20% in HK-2 normal cells at 40 µM within 48 h. |
[118] |
| 38 | Berberine (Pharmacokinetic study) | - | - | 200 mg/kg | Cmax: 25.85 ± 7.34 µg/L |
Animal subject— Rats | A plasma level of 25.85 ± 7.34 µg/L equivalent to 76 µM was achieved. | [148] |
| 39 | Nobiletin | Pyroptosis | 34.85–35.31 µM | - | - | In vitro study Ovarian cancer cell lines |
Nobiletin induced cytotoxicity at concentration of 35 µM but no data regarding its effect on normal cell lines were shown. | [120] |
| 40 | Nobiletin | Apoptosis | 40–80 µM | 100 mg/kg | - | In vitro study Ovarian cancer cell lines OVCAR-3 and A2780 Animal subject— Mice |
Nobiletin exhibited cytotoxicity in ovarian cancer cell lines at 40–80 µM while the IC50 for normal ovarian cell line was around 160 µM. Additionally, significant tumor growth inhibition was observed in athymic nude mice model at a dose of 100 mg/kg. |
[149] |
| 41 | Nobiletin (Pharmacokinetic study) | - | - | 50 mg/kg | Cmax: 1.78 µg/mL in plasma |
Animal subject—Rats | The plasma level achieved after oral administration is 1.78 µg/mL which correlates to approximately 4–5 µM. | [150] |
| 42 | Emodin | Anoikis | 10 µM | - | - | In vitro study Gastric cancer cell lines |
Significant difference observed in RhoA expression between cancer and normal cell lines. | [61] |
| 43 | Emodin | Apoptosis | 70 µM | - | - | In vitro study Cancer cell lines isolated from breast, lung, colon, and cervix carcinomas, normal human fibroblasts, and normal human keratinocytes |
No effect observed on normal cell lines after 48-h treatment while cytotoxicity was observed in cancer cell lines. | [151] |
| 44 | Emodin (Pharmacokinetic study) | - | - | 4.5 mg/kg | Cmax: 0.2 ± 0.1 µM | Animal subject—Rats | The concentration of free emodin achieved in rat plasma after oral administration of rhubarb extract was found to be much lower than required for its anti-cancer activity. | [152] |
'암치료' 카테고리의 다른 글
| 암환자의 건강기능식품 사용 안전성 (0) | 2021.09.13 |
|---|---|
| 암 연구에서의 식물 유래 천연 제품 (0) | 2021.09.13 |
| Autophagy(자가포식) (0) | 2021.08.26 |
| 천연항암제: 한약재의 빛 (0) | 2021.08.22 |
| ⚡용도 변경을 통한 암 치료제 발견: 노견에게 새로운 기술 가르치기 (0) | 2021.08.22 |