**************************************************************
2019
Antioxidants as a Double-Edged Sword in the Treatment of Cancer
https://www.intechopen.com/chapters/66504
Antioxidants as a Double-Edged Sword in the Treatment of Cancer
Antioxidant compounds are thought to prevent and treat diseases, especially cancer, under any circumstances. For this purpose, nature-based antioxidants nowadays are being commonly used to prevent and treat diseases. Indeed, phenolic compounds found in med
www.intechopen.com
1. 소개
많은 이전 연구에서 항산화 보충제가 암 치료에 유용하다는 것이 밝혀졌습니다.
세포의 항산화 물질은 낮은 농도로 존재하며 산화 가능한 기질의 산화를 현저히 감소시키거나 방지합니다그러나 최근 일부 연구에서는 활성산소(ROS)가 증가함에 따라 세포의 산화제 수준을 낮추는 것이 세포자멸사 비율을 증가시키는 것으로 보고되어 치명적이고 치료하기 어려운 암을 치료하는 접근법으로 간주될 수 있습니다.
2. 암의 산화 스트레스
산화 스트레스와 만성 염증 과정은 밀접하게 연결되어 있으며 이러한 과정을 차단하지 못하면 발암의 시작을 이끄는 유전적/후생적 변화를 초래할 수 있습니다[ 9 ].
ROS 생성과 제거 사이의 불균형으로 인한 산화 스트레스는 거대 분자, 세포 및 조직에 과도한 산화 손상을 유발합니다. [ 10].
막 지질의 산화/질산화 스트레스 유발 과산화는 유동성 정도와 같은 막의 생물학적 특성의 변경을 초래하고 막 결합 수용체 또는 효소의 불활성화로 이어질 수 있기 때문에 매우 손상될 수 있습니다.
정상적인 세포 기능을 비활성화하고 조직 투과성을 증가시킬 수 있습니다[ 11 ].
산화/질산화 스트레스의 주요 결과는 지질, 핵산 및 단백질의 손상으로, 반응물질의 생성을 통해 다양한 세포 반응을 유도하거나 세포 건강 및 생존력을 손상시킬 수 있으며, 결국 세포 사멸 또는 괴사를 통해 세포 사멸을 일으킬 수 있습니다.
3. 활성산소종(ROS)
자유 라디칼과 반응성 대사 산물 생산 사이의 불균형이 발생하면 ROS가 형성되고 잠재적으로 유기체에 부정적인 영향을 미칠 수 있습니다[ 15 ].
ROS는 슈퍼옥사이드 음이온(O2-), 과산화수소(H2O2), 하이드록실 라디칼(HO˙)을 포함하는 총칭입니다.
신체의 라디칼 형성은 내인성 및 환경적 요인을 모두 포함하는 여러 메커니즘을 통해 발생합니다].
4. 암에서의 ROS
암은 시작, 촉진, 진행으로 정의되는 다단계 과정이며 산화 스트레스는 세 단계 모두와 상호 작용합니다.
ROS 수준의 약간의 증가는 세포 수준의 일시적인 변화를 일으킬 수 있는 반면, ROS의 심각한 증가는 돌이킬 수 없는 산화 손상을 초래하고 세포 사멸을 초래할 수 있습니다.
ROS는 또한 발암성 신호 전달 경로와 DNA 돌연변이를 유도하여 발암을 촉진할 수 있습니다.
암세포는 정상 세포보다 ROS를 더 많이 생성하고 산화 스트레스를 증가시킵니다[ 20 ].
ROS는 종양 형성을 유도하고 DNA 손상을 유도하여 종양 진행을 촉진할 수 있습니다[ 21 ].
ROS는 DNA의 유전자 돌연변이와 구조적 변화를 유도하여 종양 발생 초기 단계에서 DNA 손상을 일으킵니다.
또한 ROS는 두 번째 메신저 시스템을 수정하여 비정상적인 유전자 발현을 유발하고 세포 통신을 차단하여 세포 증식을 증가시키고 세포 사멸을 감소시킬 수 있습니다.
마지막으로, 산화 스트레스는 DNA 변경을 추가하여 세포 집단을 시작하고 암 진행을 촉진할 수 있습니다.
ROS는 양날의 검과 같은 역할을 할 수 있습니다( 그림 1 ).
ROS의 적당한 증가는 세포 증식과 생존을 촉진할 수 있습니다.
그러나 ROS의 증가가 특정 수준(독성 역치)에 도달하면 세포의 항산화 능력을 압도하여 세포 사멸을 초래할 수 있습니다.
항산화제가 정상적인 세포 과정에서 생성되는 ROS를 제거하고 산화적 손상으로부터 세포를 보호할 수 있다고 오랫동안 생각되어 왔습니다.

ROS 작용과 암 촉진 및 퇴치 사이의 관계
활성 산소 종(ROS)은 세포 과정을 암으로 촉진할 수 있습니다.
또한, 그들은 apoptosis를 유발할 수 있습니다.
실제로 ROS는 양날의 검과 같은 역할을 할 수 있습니다.
5. 암에서 양날의 검인 항산화제
중화된 자유 라디칼과 상호 작용하는 화학 물질인 산화 방지제는 손상을 일으키는 것을 방지할 수 있습니다.
항산화제는 효소적 항산화제와 비효소적 항산화제를 포함하는 두 가지 주요 하위 그룹으로 나뉩니다.
카탈라아제, 슈퍼옥사이드 디스뮤타아제, 글루타티온 퍼옥시다아제는 가장 중요한 효소적 항산화제의
일부입니다.
또한 플라보노이드, 알칼로이드, 쿠마린, 카로티노이드 및 비타민 E, A, C(아스코르브산), D3와 같은 비타민은 일반적으로 많은 천연 제품에서 사용할 수 있는 가장 중요한 비효소적 항산화제입니다[ 24 ].
항산화제는 자유 라디칼 제거제로 알려져 있습니다.
식이 항산화제의 예로는 베타카로틴, 리코펜, 비타민 A, C, E(알파 토코페롤)가 있습니다. 또한 미네랄 성분인 셀레늄은 종종 식이 항산화제로 생각됩니다.
또한, 플라보노이드, 특히 ECGC 및 레스베라트롤과 같은 천연 화합물은 항산화제 및 항암제로서 유망한 미래를 갖는 것으로 나타났습니다.
그러나 천연 항산화제와 같은 많은 천연 화합물은 농도에 따라 암세포에서 반대 특성을 나타냅니다( 그림 2 ).
일부 최근 연구에서는 말기 암의 불치의 대부분이 너무 많은 항산화제를 보유하고 있기 때문일 수 있다고 암시합니다[ 14 ].
사실, 항산화제는 DNA와 세포에 직접적인 손상을 줄 수도 있습니다.
왓슨은 최근 항산화제 사용이 암을 예방하기보다 암을 유발하는지 여부를 진지하게 물어볼 때가 왔다고 썼다[ 26 ].
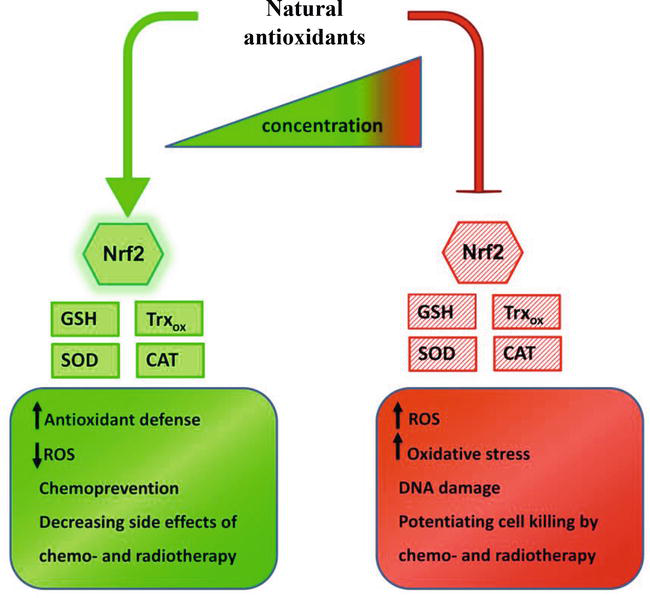
그림 2.
천연 항산화제는 암에서 양날의 검으로 작용합니다.
이러한 연구 중 일부는 경우에 따라 고용량 항산화제 보충제가 건강 위험과 관련이 있을 수 있다고 제안했습니다.
예를 들어 고용량의 베타카로틴은 흡연자의 폐암 위험을 높일 수 있습니다.
전립선암은 고용량의 비타민 E를 처리할 때 발생할 수 있습니다.
이러한 새로운 개념에 기초하여 글루타티온, 슈퍼옥사이드 디스뮤타제, 카탈라제, 티오레독신과 같은 특정 항산화제의 지속적인 사용은 ROS를 과도하게 감소시켜 주요 항암 기전인 세포자멸사에 대한 장벽 역할을 할 수 있습니다.
ROS를 통한 과도한 손상은 미토콘드리아 막 투과성의 변화와 관련될 수 있으며, 이는 시토크롬 C 방출 및 세포자멸사를 초래합니다.
이에 반해 암세포는 세포 사멸을 피하기 위해 활성화된 B 세포(NFĸB) 경로의 핵 인자 카파-경쇄 증강 인자와 같은 항-세포자멸사 메커니즘을 강화합니다[ 9 ].
세포에서 산화 환원 균형의 붕괴는 산화 환원에 민감한 전사 인자로서 핵 인자(Nrf2), NFβ 및 활성 단백질 1(AP-1)과 같은 전사 인자의 활성화를 유발합니다[ 28 ].
Nrf2 전사 인자는 DNA 손상, 내인성 및 외인성 위험, 결과적으로 암 발병에 대한 보호로 이어지는 항산화 발현의 주요 동인입니다 [ 29 , 30].
Nrf2는 피부, 두경부, 편평 세포 암종, 식도, 췌장, 담낭, 전립선, 결장직장, 유방, 폐 및 난소를 포함한 일부 유형의 인간 암에서 과발현됩니다.
Nrf2의 세포 보호 특성은 이 경로가 종양 세포의 생존을 촉진하기 위해 이용될 수 있음을 나타냅니다.
ROS에 민감한 암세포에서 Nrf2 경로의 천연물 유래 억제제는 ROS를 유도하여 세포 사멸을 유발할 수 있습니다[ 28 ].
폴리페놀과 같은 많은 항산화제는 Nrf2 억제제의 중요한 그룹입니다.
특히 암의 경우 Nrf2 경로는 반대 특성을 가지고 있습니다.
경로 활성화는 화학 예방chemoprevention에 필수적이지만 제어가 손실되면 암세포는 빠른 증식, 노화 및 세포 사멸의 탈출, 화학 요법 및 방사선 요법에 대한 내성을 초래합니다
따라서 Nrf2 활성의 활성화와 억제는 모두 유익할 수 있습니다[ 33 ].
위에서 언급했듯이 항산화제가 포함된 천연물은 항암 접근법으로 Nrf2 경로를 표적으로 합니다[ 28 ].
몇몇 항산화제는 다른 항산화제와 상호작용하여 주요 특성이 재생성될 수 있습니다.
이 메커니즘은 "항산화 네트워크"로 알려져 있습니다.
암의 예방 및 치료에 있어 항산화제와 같은 천연물의 반대 작용은 그 농도에 달려 있습니다.
더 적은 양에서는 Nrf2 의존적 신호전달을 활성화하고 ROS 스캐빈저의 발현을 향상시켜 세포의 항산화 능력을 촉진합니다.
그러나 더 높은 농도는 항산화 방어를 억제하고 산화 스트레스를 유발할 수 있습니다.
6. 항산화제 및 종양 형성
종양을 촉진하는 유전자 변형은 내인성 항산화제를 생성합니다[ 14 ].
이 과정에서 Nrf2는 산화환원 항상성 유지에 관여하는 유전자의 전이 활성화에 대한 주요 인자입니다
암세포에서 항산화 활성을 차단하면 산화 손상의 균형을 맞추는 능력이 감소하고 세포 사멸을 초래할 수 있습니다[ 42 ].
Nrf2 외에도 전사 인자 p53은 SOD2, GPX1 및 CAT를 포함한 다양한 항산화 유전자의 발현 및 대사 TIGAR 유전자(TP53 유도성 해당과정 및 세포자멸 조절인자)의 유도를 통해 조절함으로써 ROS 축적을 억제하는 것으로 나타났습니다.
산화 스트레스는 효소 항산화 활성의 감소로 인해 발생할 수 있습니다.
또한 이온화, 방사선, 화학 요법, 노화, 전단 응력, 사이토카인 및 성장 인자 수용체 상호 작용으로 인해 발생할 수 있습니다[ 14 ].
항산화제와 산화 스트레스는 암의 시작, 촉진 및 진행과 상호 작용합니다[ 41 ].
실제로, 자유 라디칼의 세포 손상 효과는 항산화제에 의해 균형을 이룰 수 있습니다.
7. 항산화제를 항암 접근법으로 사용할 때의 이점
방사선 요법과 화학 요법에서 ROS와 자유 라디칼은 부분적으로 다양한 부작용을 유발합니다[ 46 ]. ROS 생성은 다양한 조직 또는 기관 손상을 유발합니다.
예를 들어, 독소루비신 및 기타 안트라사이클린 항생제는 심장독성을 유발하는 것으로 알려져 있습니다.
시스플라틴 및 기타 백금은 신독성, 이독성 및 말초 신경병증을 유발합니다[ 48 ].
블레오마이신은 폐 손상을 유발합니다[ 49 ].
알킬화제는 약물 처리된 세포의 DNA 손상을 유발합니다[ 50 ].
조직이나 장기 손상도 발암을 유발할 수 있습니다 [ 51].
많은 이전 연구에서 이러한 금 본위제 방법과 함께 항산화제를 사용하면 이러한 세포 손상을 크게 줄일 수 있다고 보고했습니다.
8. 미래의 치료적 관점
산화환원 적응은 암 세포가 지속적인 내인성 ROS 스트레스 하에서 생존하고 특정 항암제에 내성을 갖게 되는 메커니즘을 상당 부분 설명하는 중요한 개념입니다.
산화 환원 조절 전략으로 암세포의 이러한 생화학적 특성을 표적으로 하는 것은 치료 선택성을 가능하게 하고 약물 내성을 극복할 수 있는 실현 가능한 치료 접근법입니다.
또한 Nrf2는 세포 내에서 항산화 기능을 하는 분자의 발현을 조절하는 가장 중요한 조절 인자입니다.
Nrf2는 이러한 효소의 발현을 조절하며 세포 내 항산화 반응의 마스터 조절자로 간주됩니다.
정상 세포에서 증가된 Nrf2 활성은 산화 스트레스에 대해 보호적이고 유익하지만 암세포는 스트레스 조건에서 생존하기 위해 Nrf2의 능력을 이용합니다[ 14 ].
글루타치온(GSH) 대사는 현재 사용되는 항암제의 주요 표적으로 보인다. GSH 억제제(또는 기타 항산화 억제제)와 산화 스트레스에 의해 유도된 세포 사멸을 유발하는 방사선 요법 또는 화학요법 약물의 조합은 암세포를 보다 효과적으로 죽이는 데 유용한 것으로 입증될 수 있습니다.
9. 결론
항산화제가 많은 유형의 암을 예방하고 치료하는 데 기여하지만 항암 효과가 절대적이지 않으며 다양한 암을 치료하기 위해 투여하는 시간, 양 및 조건에 따라 다르다는 것을 보여줍니다.
의사는
(1) 환자의 배경 및 상태,
(2) 항산화제 용량 및 유형,
(3) 암 및 항종양 요법의 유형을 고려하여 통합된 결정을 내리는 것이 중요합니다.
'정보' 카테고리의 다른 글
| 암 진행 및 예방에서 항산화제의 산화환원 잠재력 (0) | 2021.10.18 |
|---|---|
| 암에서 항산화제와 ROS 간의 상호작용 (0) | 2021.10.18 |
| 암 치료에서 식이 항산화제의 양면 (0) | 2021.10.18 |
| hallmarks 중 metastasis (0) | 2021.10.17 |
| ?암세포 굶기기를 통한 암세포와 함께 살아가기(living with cancer) 9가지 방법 (0) | 2021.08.27 |