2020
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-019-1126-8
Crosstalk between autophagy and metabolic regulation of cancer stem cells - Molecular Cancer
Cancer is now considered as a heterogeneous ecosystem in which tumor cells collaborate with each other and with host cells in their microenvironment. As circumstances change, the ecosystem evolves to ensure the survival and growth of the cancer cells. In t
molecular-cancer.biomedcentral.com
Crosstalk between autophagy and metabolic regulation of cancer stem cells
암 줄기 세포(CSC)는 종양을 생성할 수 있는 능력을 갖고 자가 재생 및 분화 특성을 나타내는 종양 내 세포의 하위 집합입니다. CSC는 암 치료법에 내성이 있으며 전이 및 재발과 관련된 별개의 집단입니다.
CSC의 자가포식
Autophagy는 종양 개시, 종양 미세 환경의 이웃 세포와의 종양 상호 작용 및 암 치료에 관련된 정상적인 세포 기능에 필요한 과정입니다.
암에서 autophagy의 역할은 다면적입니다.
.Autophagy는 성장을 위해 재활용된 대사 산물을 공급하여 종양 세포 생존을 촉진하고,
mitophagy(미토콘드리아의 선택적 분해)를 통해 미토콘드리아 기능을 조절하고,
pro-migratory cytokines의 분비 제어 및 국소 접착 변화를 통해 종양 세포 이동 및 침입 기능을 조절합니다.
또한 여러 연구에서 autophagy가 종양 미세 환경에서 중심적인 역할을 한다는 것이 입증되었습니다
예를 들어, autophagy는 종양 세포와의 결합에 의해 암 관련 섬유아세포(CAF)에서 유도되며, 이는 성장을 유지하기 위해 주변분비 방식으로 종양 세포에 제공되는 아미노산의 섬유아세포 생성을 증가시킵니다.
종양의 대사 재프로그래밍에 영향을 미치는 두 가지 중요한 요소는 종양의 미세 환경과 혈관계까지의 거리입니다.
첫째, 새로운 증거는 악성 세포(CSC 및 비-CSC 모두)가 상보적인 대사 활성으로 이웃 세포가 제공하는 영양소로 대사를 보충하여 종양 세포 생존 및 증식 능력을 향상시키는 예상치 못한 능력을 나타냅니다. .
둘째, 혈액 공급에 더 가까운 곳에 위치한 암세포는 산화 스트레스를 통해 ATP를 생성하고, 이는 지방산과 같은 이화 산물을 생성하는 주변 이화 기질/암 세포(다시 말하지만 CSC 및 비 CSC 모두에서)에서 해당과정과 자가포식을 유도합니다.
젖산염 및 케톤은 동화성 암세포(CSC 및 비 CSC 모두)에 의해 차례로 흡수되어 미토콘드리아 대사 및 ATP 생산에 연료를 공급하는 데 사용됩니다.
이것은 역 Warburg 효과로 알려져 있습니다(표 1 ).
원위부 및 산소가 부족한 종양 영역에서 활성화된 병렬 자가포식 반응은 동화작용 중간체를 제공하여 동화작용 요구를 유지하고 암 성장을 지원합니다(표 1 ).
Warburg 및 Reverse Warburg 효과
호기성 해당작용 또는 바르부르크 효과는 산소가 있는 상태에서도 해당작용 경로로 대사 방향을 바꾸고 해당작용으로 인한 피루브산을 젖산으로 전환시키는 암 세포의 현상입니다.
이 대사 재프로그래밍은 많은 암에서 종양 형성 과정의 한 단계입니다.
이것은 암세포에서 발생하는 가장 잘 설명된 대사 적응 중 하나입니다.
그러나 이제 악성 변형이 Warburg 효과에만 근거한 것이 아니라는 것이 확인되었습니다.
실제로, 종양 세포는 산화적 인산화(OXPHOS)를 통해 ATP의 상당 부분을 생산합니다.
악성 세포는 그들의 에너지 대사를 미세 환경의 조건, 특히 종양의 산소 공급 조건에 적응시킵니다..
역 Warburg 효과는 동화성 상피암 세포가 인접한 기질 섬유모세포 또는 이웃하는 이화 암세포에서 호기성 해당과정을 유도할 때 관찰됩니다.
이 이화 세포(상피암 세포 또는 암 관련 섬유아세포)는 젖산, 피루브산(호기성 해당작용으로 인한 에너지 대사물), 유리 지방산 및 케톤체와 같은 이화 대사물을 분비합니다.
동화 상피암 세포는 이러한 에너지가 풍부한 대사 산물을 흡수하여 OXPHOS에 연료를 공급하는 데 사용합니다.
이는 더 높은 증식 능력을 초래합니다(그림 1 및 [ 1 ] 참조).
기질 Cav-1의 부재는 역 Warburg 효과에 대한 바이오마커일 수 있습니다.
CSC에서 autophagy는 다양한 암 유형에서 정상 조직 줄기 세포와 CSC 모두에서 줄기를 유지하는 데 필요한 것으로 보입니다 .
정상 조직 줄기 세포의 생존과 정지는 자가포식에 의존하며, 자가포식은 또한 다능성을 촉진하는 것으로 보고되었습니다.
CSC에서 autophagy는 CD44와 같은 줄기 세포 마커의 발현과 vimentin과 같은 중간엽 마커의 발현을 촉진합니다.
Autophagy는 또한 CSC를 유지하는 데 중요한 역할과 일치하는 생체 내 종양 형성에서 Spheroid 형성을 촉진합니다. (Spheroid--3차원 배양을 하면 일반 암세포는 죽게 됩니다. 이에 반해서 암줄기세포는 동그란 덩어리 형태로 증식합니다. 이를 spheroid라고 하며 일반 암세포와 암줄기세포를 구분하는 기준이 됩니다.)
또한 autophagy의 억제는 종양 휴면을 제한하고 전이의 성장을 촉진합니다.
주요 전사 인자는 자가포식 유도 및 줄기세포에서 자가포식 유전자의 발현을 유도하고 자가포식에 의해 전환되는 Forkhead box 3A(FOXO3A)를 비롯한 줄기세포 상태와 관련되어 있습니다.
핵심 줄기 인자인 sex determining region Y-box (SOX2) 및 Nanog Homeobox(NANOG)를 포함한 다른 전사 인자도 자가포식 유도와 관련이 있습니다.
또한 SOX2와 STAT3는 자가포식 유전자를 조절하고 CSC의 줄기를 결정하는 것으로 나타났습니다.
Mitophagy는 정상 조직 줄기 세포 항상성 제어의 핵심으로 떠오르고 있습니다. 미토파지는 미토콘드리아의 질을 조절하고 세포 대사를 조절하는 기능을 합니다.
예를 들어, ROS의 주요 공급원인 손상된 미토콘드리아를 미토파지에 의해 제거하면 노화를 방지하고 ROS에 의한 게놈 손상을 제한합니다.
ROS 손상을 제한하는 것은 줄기를 유지하는 데 필수적입니다.
미토파지를 통한 미토콘드리아의 전환은 산화적 인산화(OXPHOS)에 대한 줄기 세포의 능력을 제한하고 줄기 세포가 에너지 요구에 대해 해당 작용에 더 의존하게 함으로써 줄기 세포 상태를 유지하는 데 도움이 됩니다.
미토파지의 억제는 CD44 발현을 억제하고 또한 p53의 핵으로의 전위를 촉진하여 줄기 세포 유전자의 발현을 길항합니다.
CSC에서 관찰되는 높은 수준의 자가포식은 다능성 유지, 화학요법에 대한 내성, 이동 및 침입과 관련이 있습니다.
Autophagy는 종양 미세 환경에서 저산소증 및 낮은 수준의 영양소에도 불구하고 CSC가 생존할 수 있도록 합니다.
CSC는 다른 분화된 암세포보다 해당작용이 더 큽니다.
연구는 CSC의 신진 대사가 대량 종양의 신진 대사와도 다르다는 것을 시사합니다.
CSC의 유지 및 증식을 위한 포도당의 중요성은 먼저 교모세포종(GBM)에서 확립된 후 유방암, 결장암, 폐암, 난소암 및 골육종을 포함한 다른 유형의 암에서 확립되었습니다 .
CSC 특성을 가진 부수적 집단 세포는 포도당을 열렬히 소비하고 상당량의 ATP와 젖산을 생성합니다.
또한, 이들 세포에서 AKT 키나제 경로는 포도당에 의해 활성화되고 해당 과정의 억제는 생체 내에서 종양을 형성하는 이들 세포의 능력을 감소시킵니다.
CSC에서 their differentiated counterparts와 비교하면 포도당 흡수, 해당 효소 발현, 젖산 생산 및 ATP 함량의 증가는 분화된 대응물과 비교하여 미토콘드리아 활성의 수반되는 감소 및 OXPHOS 및 베타 산화의 유지와 관련이 있는 것으로 보입니다
산화적 인산화의 주요 조절자인 피루브산 탈수소효소(PDH)의 감소된 발현과 활성이 CSC의 pro-glycolytic 표현형을 촉진하는 데 중요한 역할을 한다는 것을 보여주었습니다.
PDH의 강제 활성화를 통한 대사 재프로그래밍은 우선적으로 CSC를 제거합니다 ..
CSCs의 마커인 CD44는 대사 조절자 역할을 하여 저산소 조건에서 해당 작용을 활성화하고 해당 작용과 항산화 반응을 감소시키고 ROS의 관련 증가와 함께 미토콘드리아 생성을 향상시키는 것으로 나타났습니다.
CD44는 다른 암세포주에서 PKM2와 상호작용하고 그 활성을 억제하며, 이는 p53 결핍 세포의 해당 표현형과 관련이 있습니다.
결장암 개시 세포의 대사 특징은 해당 경로 및 트리카르복실산 회로(TCA)의 유전자 및 대사 산물의 발현 증가와 관련이 있습니다.
CSC는 미토콘드리아 산화 대사에 의존
암세포의 줄기 표현형을 해당 대사와 연결하는 데이터와 대조적으로, 새로운 증거는 CSC가 OXPHOS 대사를 선호한다는 것을 나타냅니다(그림 1 ).
두 경우 모두 미토콘드리아 기능은 줄기세포의 이동 및 CSC의 약물 내성에 필수적입니다.
분화된 자손에 비해 더 많은 포도당을 소비하고 젖산을 적게 생산하며 ATP 함량이 높습니다.
대사 표현형이 이질적이며 분화된 자손과 구별되는 대사 상태를 가지고 있습니다.
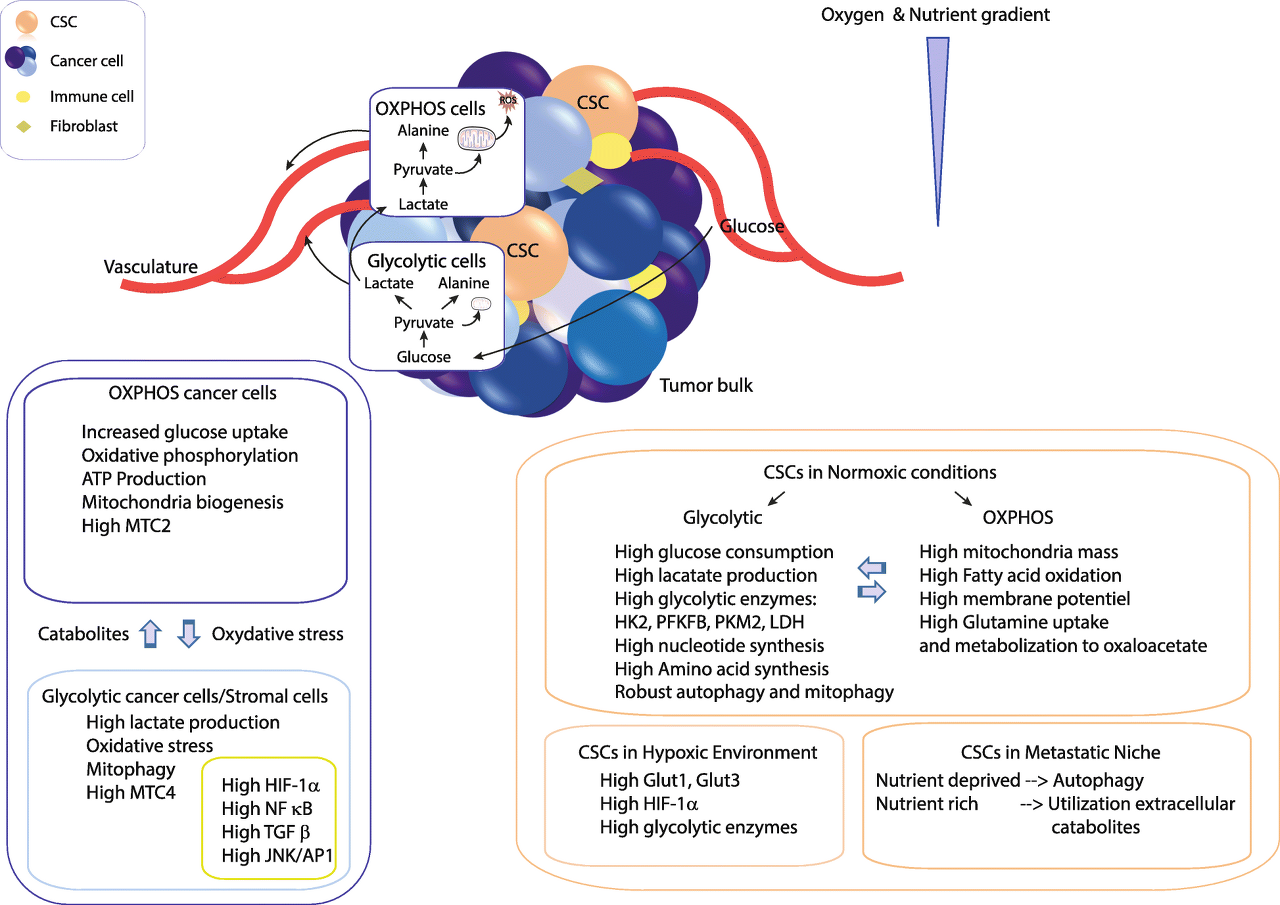
(그림) 암 줄기 세포의 대사 이질성.
종양은 다양한 대사 활성을 갖는 숙주 세포(예: 섬유아세포 및 면역 세포) 및 암세포의 집단을 포함하는 복잡하고 역동적인 구조입니다.
이 세포는 미세 환경 조건과 다른 종양 세포의 생물학적 활동에 의해 다양한 방식으로 영향을 받습니다.
예를 들어, 혈관 구조에 가까운 암세포는 산화 대사를 나타내는 반면,
저산소 영역에 있는 세포에 포도당이 존재할 때 해당 대사로의 이동이 관찰됩니다.
대사의 이질성에도 불구하고 암세포는 대사 요구 사항이 충족되도록 조건 변화에 적응할 수 있도록 협력합니다.
실제로, 증식하는 세포와 같은 산화성 암세포는 ATP를 생성하고 세포 증식을 지원하는 바이오매스를 생성하기 위해 포도당 소비를 증가시킵니다.
암세포의 급속한 증식으로 인한 산화 스트레스는 기질 세포 및/또는 해당 작용 암세포에서 해당 작용 및 자가포식/미토파지를 유도하여 다량의 젖산을 방출하여 산화성 암세포의 대사를 촉진합니다.
젖산 셔틀의 핵심 요소는 원형질막 모노카르복실레이트 수송체(MCT)입니다.
MCT4는 젖산의 수출에 관여하고 MCT1과 MCT2는 이 이화 산물의 흡수에 관여합니다.
HIF-1α, NF-κB, TGF-β 및 JNK/AP1을 포함한 여러 요인의 높은 수준은 해당 표현형과 관련이 있습니다.
CSC의 대사 상태는 위치에 따라 다릅니다.
활발하게 성장하는 종양 영역과 적절한 수준의 산소(정상 산소 조건)가 있는 경우 CSC는 해당 대사 및/또는 산화 대사에 의존합니다.
저산소 환경에서 HIF-1α의 과발현은 GLUT1, GLUT3 및 해당 효소의 상향 조절을 촉진합니다.
전이성 상황에서 CSC는 세포 외 이화 산물의 활용도를 높였습니다.
영양이 부족한 상태에서는 자가포식이 활성화되어 대체 에너지원을 제공합니다.
OXPHOS와 동화성 포도당신생합성 경로는 포도당 항상성을 조절합니다.
Abbreviations: ATP, adenosine triphosphate; CSC, cancer stem cell; GLUT1/GLUT3, glucose transporter 1/3; HIF-1α, hypoxia-inducible factor 1α; HK2, hexokinase 2; JNK/AP1, c-Jun N-terminal kinases/activator protein 1; LDH, Lactate dehydrogenase; XMCT2/4, monocarboxylate transporter 2/4; NF-κB, nuclear factor-κB; OXPHOS, oxidative phosphorylation; PFKFB, phosphofructokinase/fructose bisphosphate; PKM2, pyruvate kinase isozyme M2; TGF-β, transforming growth factor β
뚜렷한 유방암 세포 집단에서 증가된 미토콘드리아 질량은 줄기 유사 표현형에 기인하며 전이 가능성 및 화학요법 내성과 관련이 있습니다.
해당과정보다 OXPHOS를 선호하는 세포에서 일반적이지 않은 높은 비율의 오탄당 인산 경로 활성에도 불구하고, 상피암 환자로부터 분리된 CSC는 포도당 흡수, OXPHOS 및 지방산 베타 산화와 관련된 유전자를 과발현하여 이러한 세포에서 피루브산은 우선적으로 TCA 회로로 향합니다.
대사 OXPHOS 프로파일과 일치하게, CSC는 정상 세포보다 더 높은 미토콘드리아 ROS 생성과 증가된 막 전위를 가지며 미토콘드리아 호흡 사슬의 억제 시 세포자멸사를 겪습니다.
이전에 보고된 데이터와 일치하게 , CSC는 비종양유발성 세포에 비해 향상된 항산화 방어를 나타내며, 이는 치료에 대한 종양 내성에 기여할 수 있습니다.
De Luca et al. 등은 최근에 미토콘드리아 생합성이 줄기와 같은 특성을 유지하는 데 필요하다고 보고했습니다.
췌관 선암종(PDAC)에서 CSC는 해당 작용을 하는 비 CSC와 달리 OXPHOS에 의존하는 것으로 나타났습니다.
또한, MYC 발현의 억제와 PGC1α의 증가된 발현은
CSC의 OXPHOS 의존성과 미토콘드리아 억제에 의해 해당 작용으로 전환하는 능력을 제한하는 핵심 결정 요인입니다.
최근 연구에 따르면 말차 녹차는 BrestCSC의 번식을 억제합니다. 흥미롭게도, 이 화합물을 사용한 치료가 대사 표현형이 OXPHOS와 해당 작용 흐름을 모두 억제하여 암세포를 보다 조용한 대사 상태로 전환시키는 것으로 나타났습니다.
CSC 유지 및 증식과 관련된 기타 대사 경로
메발로네이트 대사 경로
기저/중간엽 BCSC의 자가 재생을 조절하는 데 있어 메발로네이트 대사 경로의 두드러진 역할이 입증되었습니다. 히드록시-3-메틸글루타릴 CoA 환원효소(hydroxy-3-methylglutaryl CoA reductase) 차단제를 사용한 이 경로의 억제는 콜레스테롤 생합성 및 단백질 파르네실화(farnesylation) 억제와 무관하게 BCSC 증식을 감소시킵니다. 특히, geranylgeranyl transferase I은 BCSC 유지에 중요합니다.
중간엽 줄기 세포는 백혈병, 폐 및 유방 종양에서 미토콘드리아 및/또는 미토콘드리아 DNA를 이동시키고 시스테인 이량체 시스틴을 소비하여 백혈병 세포에 화학 보호 시스테인을 제공하는 것으로 보고되었습니다
저산소증과 산화 환원 항상성
종양 내 영역에서 관찰되는 감소된 산소 가용성 또는 저산소증이 저산소증 유도 인자(HIF)를 활성화됩니다HIF-1은 세린 합성 경로 및 미토콘드리아 1탄소(엽산) 주기에서 피루브산 탈수소효소(PHGDH) 및 5개의 하류 효소를 인코딩하는 유전자의 발현을 조정합니다.
PHGDH 발현의 억제는 NADPH 수준 감소, 미토콘드리아 산화환원 항상성 방해, 세포자멸사 증가를 초래하여 저산소 조건에서 BCSC 농축을 중단합니다.
NAD 및 nicotinamide phosphoribosyl transferase pathways 는 종양 형성과 관련이 있습니다
NAD는 신진대사, 에너지 생산, DNA 복구, 미토콘드리아 적합성 유지 및 다양한 유형의 암세포에서 신호 전달에 필수적인 보조인자입니다. NAD의 생합성은 de novo 및 salvage 경로를 통해 발생합니다.
NAD는 주로 NAD 회수 경로로 알려진 과정인 니코틴아미드에서 합성됩니다.
NAMPT(Nicotinamide phosphoribosyl transferase)는 NAD 회수 경로의 속도 제한 단계인 니코틴아미드를 니코틴아미드 모노뉴클레오타이드(NMN)로 전환하는 것을 촉매합니다. 따라서 NAMPT는 NAD 생합성에 중요합니다. NAMPT를 억제하면 NAD + 가 고갈되어 ATP 합성이 억제됩니다.
보조인자 SAM에서 니코틴아미드 및 기타 피리딘과 같은 다양한 기질로의 메틸 그룹 전달을 촉매하는 효소인 니코틴아미드 N-메틸트랜스퍼라제(NNMT)도 GSC에서 과발현됩니다. NNMT가 증가하면 SAM이 감소합니다.
NAD + 및 자가포식
감소된 NAD + 가용성은 PARP1 관련 염기 절단 DNA 복구 경로를 손상시킵니다.
올라파립(olaparib) 약물을 사용한 PARP1의 화학적 억제는 염기 절단 DNA 복구를 손상시켜 테모졸로미드 유도 손상을 향상시킵니다.
역학 연구에 따르면 PARP1의 활성화는 AMP 활성화 단백질 키나제(AMPK) 신호 경로를 상향 조절하고 mTOR 신호 경로를 하향 조절하여 이온화 방사선이나 기아에 따른 자가포식을 촉진한다고 제안합니다
NAD 농도의 약리학적 또는 유전적 조작은 SIRT1 활성을 변경하여 자가포식을 조절하는 것으로 보입니다. SIRT1의 억제는 이 자가포식 조절을 폐지하여 SIRT1이 이 과정에 중요함을 시사합니다.
그러나 SIRT1에 의해 조절되는 NAD + 대사가 CSC에서 자가포식 개시에 기여 한다는 것을 확인하기 위해서는 추가 연구가 필요합니다 .
글루타민분해
글루타민분해는 또한 상피 CSC의 증식과 생존에 필수적입니다. 왜냐하면 글루타민 대사에서 방출되는 암모니아 분자가 이들 세포에서 관찰되는 현저한 Warburg 효과로 인한 과도한 수준의 양성자(젖산)를 중화하기 때문입니다
상피 CSC는 우선적으로 생물 에너지를 위해 호기성 해당 작용에 의존하고, 활성 세린-1-탄소-글리신 대사를 나타내며, TCA 회로로 포도당 유래 탄소의 감소된 전환을 상쇄하는 다양한 탄소원(예: 지방산 및 글루타민)을 활용하기 위해 증가된 대사 유연성을 보여줍니다.
최근 연구는 CSC에서 철 대사의 역할에 대해 밝히고 CSC에서 철 대사의 특정 표적화가 암 치료의 효능을 향상시킬 수 있음을 시사합니다.
대사 재프로그래밍 및 유연성
상피-중간엽 전이(EMT)는 암 세포에 줄기 세포와 같은 특성을 부여할 수 있고 상피 프로그램에서 운동성 중간엽 표현형으로의(an epithelial program to a motile mesenchymal phenotype) 전환을 유발할 수 있는 것으로 나타났습니다[.
그러나 고형 종양에서 CSC는 EMT와 독립적으로 발생할 수 있습니다.
상피 CSC(ECSC)는 강화된 Warburg 효과와 아미노산 및 지방산 대사로 인한 탄소 및 에너지원 유연성이 향상되었다는 점에서 구별됩니다.
ECSC는 또한 글루타민 대사에 의해 부여되는 양성자 완충 능력에 대한 중요한 의존성을 특징으로 합니다.
ECSC에 대한 대사 유전자 서명은 여러 암 유형에서 종양 진행 및 전이와 상관관계가 있습니다
EMT의 유도는 향상된 해당과정 및 감소된 미토콘드리아 활성과 관련이 있습니다.
분석은 이 과정이 cytochrome c oxidase 또는 fructose-1,6-bisphosphatase의 억제의 결과라는 것을 보여주었습니다 .
Luo et al. 등은 EMT에 의해 구동되는 CSC는 역 Warburg 효과로 알려진 현상인 대체 고에너지 대사 산물을 대사할 수 있다고 보고했습니다(표 1 )
중간엽 유사 CSC(MCSC)와 ECSC를 비교한 결과 뚜렷한 대사 경로가 밝혀졌습니다.
MCSC는 ECSC에 비해 해당 작용이 향상되고 O 2 소비 감소, ROS 생성 감소, 항산화 능력 증가, 미토콘드리아 질량 및 막 전위 감소가 나타납니다.
Luo et al. 은 또한 최근에 유방암의 증식성 ECSC와 정지 MCSC가 해당과정과 산화환원 대사의 억제제에 대해 서로 다른 민감성을 나타낸다고 보고했습니다.
대사 또는 산화 스트레스는 낮은 수준의 ROS를 가진 MCSC에서 높은 수준의 ROS를 가진 ECSC로의 전환을 촉진합니다.
이 전환은 AMPK-HIF1α 경로에 따라 달라지며 N-아세틸시스테인에 의해 역전됩니다.
더욱이, 핵 인자 적혈구계 2-유사 2(NRF2)를 코딩하는 유전자의 발현을 억제하거나 다운스트림 티오레독신 및 글루타티온 항산화 경로의 억제는 ROS 유도 분화 및 세포독성에 민감한 ECSC를 초래합니다.
그러나 MCSC와 ECSC는 해당과정과 티오레독신 및 글루타티온 경로의 동시 억제에 의해 제거됩니다.
이 동시 억제는 종양 시작 가능성, 종양 성장 및 전이를 폐지합니다.
포도당 수송체 Glut3의 상향 조절은 높은 대사 유연성을 부여받은 공격적 교모세포종이 포도당이 부족한 환경에서 생존하는 방법을 나타내는 GSC의 생성을 증가시킵니다.
'줄기세포' 카테고리의 다른 글
| 암 줄기 세포의 신호 전달 경로를 표적으로 하는 새로운 약제 (0) | 2021.11.09 |
|---|---|
| ⚡암 줄기세포와 대사 (0) | 2021.10.18 |
| 암 줄기 세포를 위한 천연 제품에 의한 자가포식 조절의 치료 가능성 (0) | 2021.10.14 |
| 다제내성 극복을 위한 잠재적 표적으로서의 암 줄기세포 (0) | 2021.10.14 |
| 암 줄기 세포를 표적으로 하는 식이 파이토케미컬 (0) | 2021.10.14 |