2020
Targeting EMT in Cancer with Repurposed Metabolic Inhibitors
https://www.cell.com/trends/cancer/fulltext/S2405-8033(20)30189-8
-
암에서 배아 표현형 가소성 프로그램(embryonic phenotypic plasticity program)인 상피에서 중간엽으로의 전이(EMT)는 침습성, 전파 및 화학/면역 요법 내성을 부여합니다.
-
EMT는 높은 전이 개시 잠재력을 지닌 dynamic intermediate states (partial EMT)를 통해 구동합니다. 게놈 및 기능 분석은 여러 인간 암 유형에서 EMT/partial EMT 기능의 존재를 결정했습니다.
-
EMT는 중요한 대사 재배선과 관련이 있으며 일부 대사 경로는 EMT를 촉진하고 유지합니다.
-
EMT 유발 암에서 항대사 약물의 용도를 변경하면 전이 발생률을 줄이고 치료에 대한 환자의 반응을 개선할 수 있습니다.
-
EMT와 신진대사 간의 상호의존성에 대한 더 나은 이해는 공격적인 암에 대한 새로운 치료법의 발견을 가속화할 수 있습니다.
상피에서 중간엽으로의 전이(EMT)는 암, 전이 형성 및 화학 내성의 가장 치명적인 특징을 결정하므로 종양학에서 매력적인 표적을 나타냅니다.
그러나 EMT 이펙터 분자의 직접적인 표적화는 대부분의 경우 약리학적으로 어렵습니다.
새로운 연구에서 EMT와 관련된 뚜렷한 대사 회로가 강조되었기 때문에 FDA가 승인했거나 임상 시험 중인 대사 특이적 억제제를 암에서 EMT를 표적으로 하는 약물 용도 변경 접근 방식으로 제안합니다.
대사 억제 약물은 표준 화학 요법 또는 면역 요법과 결합하여 EMT로 인한 내성 및 공격적인 암과 싸울 수 있습니다.
EMT의 조절자로서의 대사
암세포는 특히 EMT 동안 대사 회로를 미세 조정하여 세포 이동 중에 복잡한 문제에 직면하게 되는 증가된 생체 에너지 요구를 충족시킵니다.따라서 EMT 동안 대사 경로의 전환을 이해하면 취약한 주요 치료 대상을 밝힐 수 있습니다.
최근 연구에 따르면 EMT 동안 중요한 대사 재프로그래밍 이벤트가 보고되었습니다.
대사 및 EMT의 재프로그래밍이 상호 의존적인 사건이며 대사 수준에서 치료적 이용의 프라이밍으로 EMT가 효과적으로 표적화될 수 있음을 보여줍니다.
여기에서 우리는 EMT 표현형을 되돌리거나 줄이기 위해 용도를 변경할 수 있는 대사 효소 또는 경로( 표 1 , 주요 표에 요약됨)의 몇 가지 유망한 약리학적 억제제에 대해 논의 합니다.
EMT와 싸우기 위한 대사 경로 억제제
아래에서는 EMT 기능을 완화하는 대사 억제를 위해 다양한 FDA 승인 또는 시험 중인 약물을 재배치하는 것의 중요성을 강조합니다( 그림 1 ).
용도 변경 능력이 있는 표로 만든 약물 목록( 표 1 )은 신진대사 중심의 표적화가 EMT 기반 공격성 암의 미래 임상 연구를 위한 귀중한 자원이 될 수 있음을 보여줍니다.
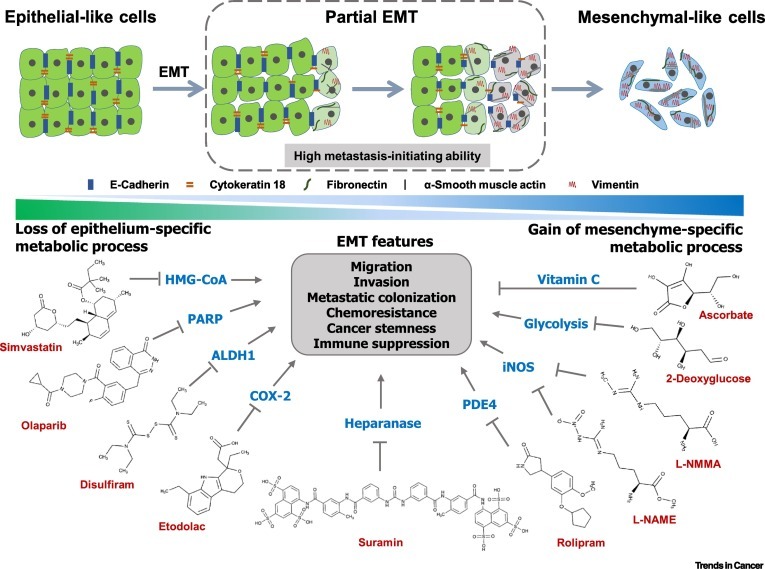
그림 1 상피-중간엽 전환(EMT) 중 대사 재프로그래밍 및 대사 억제 약물의 용도 변경.
EMT 억제 기능이 있는 FDA 승인 또는 임상 시험 중인 대사 억제 약물 목록
Drug Target FDA approval/treatment for Clinical trial for
| Simvastatin | HMG-CoA | FDA approved for hypolipidemia | Advanced rectal cancer | |
| Pancreatic cancer | ||||
| Small cell lung cancer | ||||
| Brain metastasis | ||||
| Olaparib | PARP | FDA approved for cancer | Metastatic renal cell carcinoma | |
| Disulfiram | ALDH1 | FDA approved for alcoholism | Metastatic breast cancer | |
| CTC/EMT metastatic breast cancer | ||||
| Etodolac | COX-2 | FDA approved for pain and inflammation | Colorectal metastasis | |
| Metastatic pancreatic cancer | ||||
| Suramin | Heparanase | Treatment for trypanosomiasis | Autism | |
| Prostate cancer | ||||
| Advanced solid tumors | ||||
| NSCLC | ||||
| Rolipram | PDE4 | Treatment for depression | Multiple sclerosis | |
| L-NAME | iNOS | Cardiovascular | ||
| Cardiovascular | ||||
| L-NMMA | Multiple cancers | |||
| Metastatic TNBC | ||||
| 2-DG | Glycolysis | Advanced tumors | ||
| Ascorbate | Vitamin C | Resectable or metastatic | ||
| Pancreatic cancer | ||||
| Malignant tumors |
상피-중간엽 전환(EMT) 중 대사 재프로그래밍 및 대사 억제 약물의 용도 변경

****************************************************************
2019
Controversies around epithelial–mesenchymal plasticity(EMP) in cancer metastasis
https://europepmc.org/article/med/31666716

EMP 자극의 유형
많은 범주의 인자가 상피-중간엽 전이mesenchymal-epithelial transition(EMT)를 유도하는 것으로 알려져 있으며, 이의 억제 또는 제거는 중간엽-상피 전이(MET)의 역 과정을 촉진할 수 있습니다.
미세환경 세포(예: tumour-associated macrophages, hypoxic adipocytes and other inflammatory cells )는 (TGFβ), (EGF), (FGF), (HGF),IL-6(REF.225) 및 렙틴 같은 EMT 촉진 인자를 생성합니다.
(NF-κB) 경로의 활성화를 통해 이 세포는 EMT 활성화 전사 인자와 상호작용를 유발합니다.
빠른 원발성 종양 성장에 의해 유도된 대사 미세 환경의 변경은 또한 EMT를 유도할 수 있고, 저산소증은 저산소증 유도 인자 1α(HIF1α)의 작용을 통해 다양한 종양 유형에서 EMT 활성화 전사 인자의 발현을 직접적으로 유도할 수 있습니다
매트릭스 강성은 또한 EMT를 자극하는 것으로 나타났습니다.
일부는 MET와 관련이 있지만 치료제는 주로 약물 내성과 관련하여 EMT를 촉진하는 것으로 나타났습니다.
게놈 및/또는 후성유전체 조절자에 의해 활성화될 수 있는 발달 경로는 (EMP)에도 관련되어 있습니다.
ECM, extracellular matrix.

치료 유도 EMT 및 잠재적 EMT 억제 요법.
다양한 치료제 및 양식에 의해 유도된 상피-중간엽 전이(EMT)는 많은 암 유형에 걸쳐 치료 내성 및/또는 전이에 대한 결과를 가져옵니다.
EMT가 치료 저항에 기여할 수 있는 잠재적 메커니즘에는 세포자멸사 신호에 대한 민감도 감소, 줄기 기능 획득, 혈관신생 자극, 면역 체크포인트 분자 발현 상향 조절, 침투하는 면역 세포의 균형을 변경하여 면역 억제를 증가, DNA 복구 강화와 함께 DNA 손상 감소, 세포에서 세포독성 약물을 적극적으로 제거하는 수출 펌프의 발현 상향 조절 등이 있습니다.
더욱이, 치료에 의해 유도된 EMT를 겪는 세포는 감소된 속도로 증식할 수 있으므로 화학요법제에 대한 감수성이 감소하고 암세포가 약물에 접근하기 어려운 미세 환경으로 이동합니다(예: 혈액을 통해 뇌 장벽) 치료 개입의 영향을 줄일 수 있습니다.
예를 들어, (HER2) 양성 유방암에서 HER 표적 요법(예: 트라스투주맙)으로 계속 치료하면 EMT를 촉발할 수 있으며 다른 곳에서 진행 중인 양호한 반응에도 불구하고 뇌에서만 재발이 발생할 수 있습니다.
기존 또는 새로운 치료법(예: eribulin 또는 vinca alkaloids)을 사용한 치료는 EMT 관련 기능을 최소화하거나 되돌릴 수 있으므로 치료 내성의 출현을 줄일 수 있습니다.
CRC, colorectal cancer; EMT-TF, EMT-activating transcription factor; HCC, hepatocellular carcinoma; miRNA, microRNA; NSCLC, non-small-cell lung cancer; TGFβ, transforming growth factor-β.
'대사' 카테고리의 다른 글
| 암세포의 에너지 대사 이해 (0) | 2022.01.12 |
|---|---|
| 지방산 대사 표적화 (0) | 2021.11.28 |
| fatty acid synthesis(FAS) 억제 천연물-다이어트 식품 (0) | 2021.11.10 |
| Cystathionine-β-synthase(CBS) Inhibition--Myricetin, St.John's Wort (0) | 2021.10.30 |
| G6PD 억제제-?Ketotifen? (0) | 2021.10.27 |