Diet and cancer metabolism – A vulnerable axis to explore in cancer therapy
Reading time: 5 minutes Diana Moreira The need for new and improved anti-tumor therapies has led the research field to implement different strategies to reduce, and ideally cease, tumor development…
oncobites.blog
Diet and cancer metabolism – A vulnerable axis to explore in cancer therapy
종양 세포의 시작과 발달은 복잡한 진화 과정에서 시간이 지남에 따라 여러 돌연변이를 획득한 결과입니다.
이러한 돌연변이된 세포는 세포 방어 메커니즘을 극복하고 무한한 복제 잠재력을 얻는 경향이 있습니다.
이 분야의 연구자들 사이에서 제기된 주요 질문 중 하나는 이러한 세포가 높은 증식 속도를 유지할 수 있는 방법 입니다.
이에 답하기 위해 일부 연구자들은 암 증식의 가능한 동인으로서 세포 대사의 역할을 탐구하기 시작했습니다.
신진대사란 무엇이며 왜 중요한가요?
종양 세포는 이 미세 조정된 시스템을 이용하여 높은 증식 상태를 유지하고, 영양소에 대한 높은 요구로 인해 이러한 경로 및 분자 중 일부의 활성을 증가 및 변경합니다.
이 세포는 대사 재프로그래밍 으로 알려진 과정에서 대사 프로그램을 채택합니다 .
이 과정은 고도로 분열하는 세포에 필수적인 뉴클레오티드, 지질 및 단백질로 알려진 빌딩 블록의 형성에 크게 의존합니다.
포도당 및 아미노산 과 같은 연료는 이러한 주요 대사 경로를 공급하여 종양 대사 조절 장애 및 결과적으로 종양 성장에 대한 매력적인 표적이 됩니다.
신진대사 재프로그래밍은 어떻게 처음 확립되고 시간이 지남에 따라 조절됩니까?
암의 대사 재프로그래밍은 유전적 및 환경적 단서 에 의존합니다 .
시간이 지남에 따라 돌연변이를 획득하면 효소와 운반체를 포함한 대사 경로의 여러 구성 요소의 유전 프로그램이 변경될 수 있으며, 이는 영양소를 세포로 가져오는 데 중요한 역할을 합니다.
유전적 요인과는 별개로, 종양 세포를 둘러싸고 지지하는 조직은 종양 미세 환경 의 분자 구성을 형성 하여 종양 부위에서 영양소 의 가용성을 제어합니다 .
다른 세포에 의한 국부적 영양소 획득은 종양 미세환경에 대사 압력을 부과 하여 종양 부위에서 대사 커뮤니티 를 형성할 수 있습니다.
여기서, 세포 대사의 중간 또는 최종 산물을 구성하는 대사 산물의 교환은 대사 경로와 이 공동체에 있는 모든 세포의 전반적인 기능에 영향을 미칠 수 있습니다.
종양 부위에서 영양소의 국부적 이용 가능성은 유기체의 혈류를 순환하는 대사 산물 및 영양소의 전체 양에 의해 영향을 받을 수 있습니다.
대사 산물의 전신 수준은 다양성과 함께 유기체의 식단 구성을 반영합니다.
식이와 암 대사 사이의 이 흥미로운 연관성 은 현재 식이 구성의 조절을 통해 종양 대사를 변경하는 잠재적인 도구로 탐구되고 있습니다.
암세포는 종종 건강한 세포가 획득하는 수준을 초과하는 양으로 대사산물을 획득합니다.
특정 영양소에 대한 이 독특한 결합력 은 건강한 세포를 돌연변이 세포와 구별합니다.
이러한 대사 기능은 최근 식이 제한 전략의 기초를 구성합니다.
수석 저자인 Weill Cornell Medicine의 Bryan Ngo가 수행한 연구에서 영양소의 약리학적 고갈에 초점을 맞춘 식이 전략이 시행되었습니다 .
이 연구는 세린 및 파생 글리신 과 같은 영양소의 생산을 선택적으로 제한했습니다.
마우스 뇌 전이에서. 이 두 아미노산은 몇 가지 예를 들면 뉴클레오티드, 지질 및 단백질의 형성과 같은 여러 대사 과정에 광범위한 영향을 미칩니다.
암세포에서 세린과 글리신은 필수 아미노산입니다.
이 세포는 고도로 증식하는 상태를 유지하기 위해 환경에서 이러한 영양소의 수입에 크게 의존합니다.
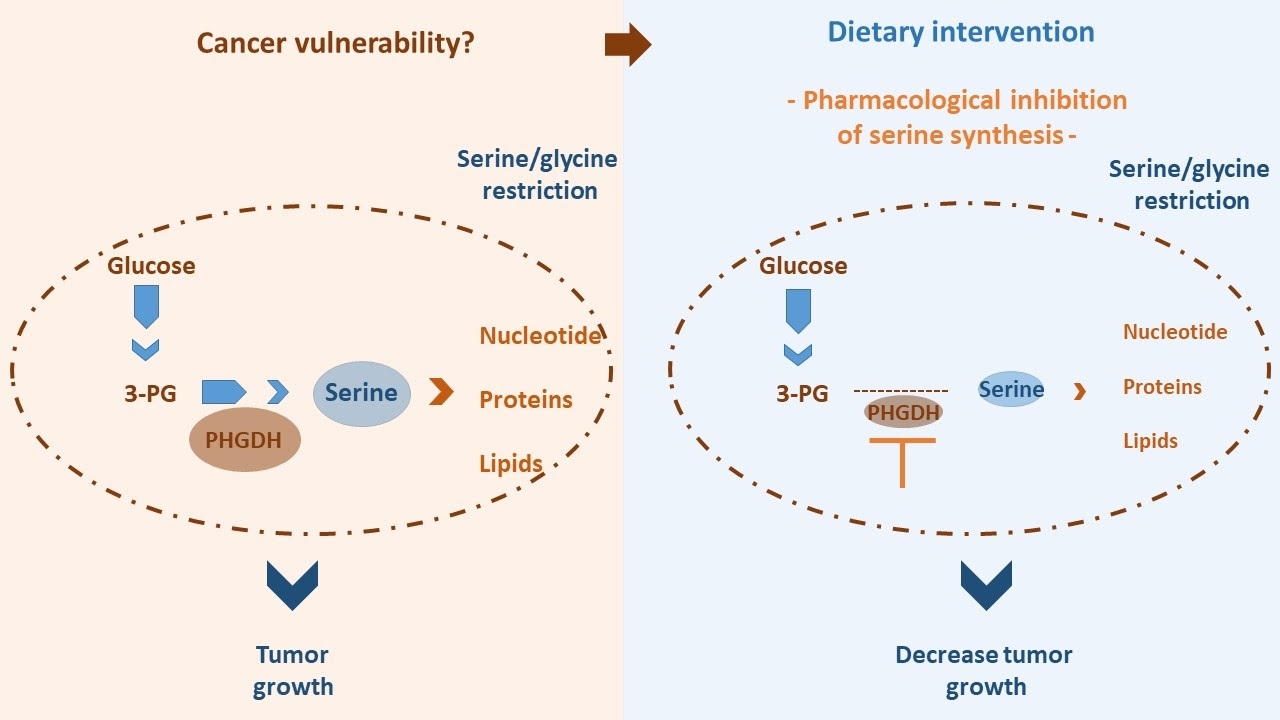
지역 환경에 의해 감소된 수준의 세린과 글리신 이 부과되는 일부 유형의 암에서 종양 세포는 종양 성장을 지원하기 위해 세린 합성 경로로 알려진 과정을 통해 세린을 생성 해야 합니다.
Ngo와 동료들의 최근 연구에서 저자들은 마우스 뇌 전이에서 국소적으로 형성되는 세린/글리신에 대한 제한적인 환경을 발견했습니다.
이 대사 기능은 잠재적으로 항종양 표적으로 탐색될 수 있는 중요한 암 취약성 으로 세린 합성 경로 를 노출합니다.
포도당 분해 경로(해당 분해)의 단계 중 하나인 3-포스포글리세르산으로부터 세린의 합성은 효소 3-포스포글리세르산 탈수소효소(PHGDH) 에 의해 고도로 제어됩니다 .
이 효소 반응은 세린 합성을 지원하는 핵심입니다.
동일한 연구에서 효소 PHGDH 의 약리학적 억제 는 두개 외 종양 성장에 영향을 미치지 않으면서 뇌 전이를 감소 시키고 마우스 생존을 개선했습니다.
이 결과는 세린 합성 경로에 대한 뇌 전이의 의존성을 강조합니다.
이러한 약리학적 전략은 잠재적인 치료 적용 가능성이 있을 수 있습니다.
왜냐하면 PHGDH 효소는 다양한 인간 암 유형에서 뇌 전이의 주요 추진 요인으로 저자에 의해 정의되었기 때문입니다.
전반적으로, 이 연구에서 설명된 영양소의 국부적 제한은 뇌 전이를 선택적으로 세린 합성 억제를 위한 보다 매력적인 표적으로 전환시키는 세포 대사 재프로그래밍 을 유도합니다.
이 보고서 는 잠재적인 식이 개입의 결과에 대한 암 대사 환경 (예: 뇌 전이) 의 주요 영향을 강조합니다 .
'암치료' 카테고리의 다른 글
| 암 예방 및 화학요법 효능에서 식이의 역할 (0) | 2022.10.09 |
|---|---|
| 식이 요법, 암 치료의 유망한 보조제 (0) | 2022.10.09 |
| 암의 식이 요인에 대한 과학적 평가 (0) | 2022.10.09 |
| 암을 교란하는 맞춤형 영양 (0) | 2022.10.09 |
| 식이요법과 암 (0) | 2022.10.07 |