2005
https://www.ibric.org/myboard/read.php?Board=news&id=99694
p53와 AMPK 활성화를 우회하여 암세포는 계속 증식
미국 펜실베니아 의대 (University of Pennsylvania School of Medicine) 의 Craig Th...
www.ibric.org
p53와 AMPK 활성화를 우회하여 암세포는 계속 증식
이번 연구 결과는 학술지 “Molecular Cell “ 에 발표되었다.
이번 연구는 세포의 정상적 능력을 초과하여 증식하기 위해 대사를 조절하는 세포적 대사 경로를 암세포가 가지고 있다는 새로운 개념을 시험하는 것이었다.
암 세포는 높은 대사율을 가지고 높은 비율의 당을 소비한다.
이번 연구에서 시험된 기본적인 질문은 암에서의 대사의 중요성과 어떻게 암세포가 정상세포와 달라서 생존하고 증식을 계속하느냐에 관한 것이다.
“ 세포내에 세포의 에너지 환경, 즉 낮은 수치의 산소, 낮은 수치의 당, 자유 라디칼을 감지하는 효소가 있어서 p53를 통하여 복제에 대한 통제를 하여 종양 억제자로서 작용한다라고 생각하고 있다. “ 라고 연구진은 말했다.
이 연구를 위해 연구진은 섬유세포(fibroblasts)라 불리우는 암세포가 아닌 마우스 세포를 이용하여 어떻게 정상 세포가 낮은 당수치같은 환경적 변화에 처했을때 생리학적으로 무엇을 하고 어떻게 반응을 하는지를 조사하였다.
AMP 에 의해 활성화되는 단백질 카이네이즈, AMPK (AMP-activated protein kinase (AMPK))가 활성화되면 이 효소는 세포 복제를 방지한다.
AMPK 는 세포내 에너지 수치를 감지하는 센서로서 작용한다.
세포가 낮은 수치의 당과 같은 에너지 제한적 조건에 처했을때 효소는 생성되는 에너지보다 더 많은 에너지를 사용하여 에너지 결핍 상태로 들어가게 된다.
AMPK 가 연료 게이지로 작용하여 당이 위험 수치일 정도로 낮은 수치임을 세포가 알게끔 한다.
이 낮은 당수치에 의해 활성화되면 AMPK효소는 세포가 복제하는 것을 중지시킨다.
그러나 어떻게 p53 가 관련되어 있을까?
정상적으로 p53는 스트레스에 반응하여 세포가 복제하는 것을 중지시킨다.
예를 들면 세포가 방사선에 조사되면 p53을 활성화시켜 세포 복제를 방지한다.
" 우리는 변이로 인해 p53가 없는 세포는 낮은 당 수치 조건하에서도 AMPK 체크포인트를 통과하여 계속 증식한다라는 것을 발견했다." 라고 연구진은 말했다.
연구진은 종양 세포에서 AMPK가 활성화되었을 때 활성화된 p53 가 없으면 여전히 계속 증식한다는 것을 발견하고 있다.
이번 연구는 암을 치료하기 위해 새로운 항암제의 접근 방법으로 이용될 수 있을지 모른다.
원본논문:
Molecular Cell, Vol 18, 283-293, 29 April 2005
AMP-Activated Protein Kinase Induces a p53-Dependent Metabolic Checkpoint
Russell G. Jones,1 David R. Plas,1 Sara Kubek,1 Monica Buzzai,1 James Mu,2 Yang Xu,4 Morris J. Birnbaum,2 and Craig B. Thompson1,3,*
출처: [BRIC Bio통신원] p53와 AMPK 활성화를 우회하여 암세포는 계속 증식 ( https://www.ibric.org/myboard/read.php?Board=news&id=99694 )
****************************************************************************************
2014
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3911293/
AMP-Activated Protein Kinase Induces p53 by Phosphorylating MDMX and Inhibiting Its Activity
AMP-activated protein kinase (AMPK) has been shown to activate p53 in response to metabolic stress. However, the underlying mechanisms remain unclear. Here we show that metabolic stresses induce AMPK-mediated phosphorylation of human MDMX on Ser342 in ...
www.ncbi.nlm.nih.gov
AMP-Activated Protein Kinase Induces p53 by Phosphorylating MDMX and Inhibiting Its Activity
AMP 활성 단백질 키나아제(AMPK)는 대사 스트레스에 반응하여 p53을 활성화하는 것으로 나타났습니다. 그러나 근본적인 메커니즘은 여전히 불분명합니다
여기에서 우리는 대사 스트레스 가 시험관 내 에서 Ser342에서 인간 MDMX의 AMPK 매개 인산화를 유도한다는 것을 보여줍니다
ubiquitylation을 현저하게 억제하고 p53을 상당히 안정화시키고 활성화시킵니다.
대조적으로, AMPK에 의한 MDM2의 인산화는 관찰되지 않았습니다.
AMPK 매개 MDMX 인산화 및 비활성화를 통한 p53의 활성화는 두 가지 AMPK 활성화제인 메트포르민과 살리실레이트(아스피린의 활성 형태)가 있는 세포 및 동물 모델 시스템을 사용하여 추가로 확인되었습니다.
p53 종양 억제 인자는 주로 전사 활성을 통해 항종양 기능을 실행하여 p53 의존성 세포자멸사, 세포 성장 정지, 분화 및 노화를 담당하는 단백질 암호화 유전자의 발현을 유도할 뿐만 아니라 전사 독립적 기전에 의한 세포자멸사 및 자가포식을 유도하는 능력을 유도합니다.
이러한 세포 기능은 세포에 유해하기 때문에 p53은 정상적으로 성장하는 세포에서 MDM2(인간에서는 HDM2라고도 함) 및 MDMX(MDM4라고도 함)라는 한 쌍의 파트너 단백질에 의해 종종 밀접하게 모니터링됩니다.
MDM2와 MDMX는 초기 배아 발생 동안 복합체로 작용하여 p53을 편재화하고 프로테오솜 회전율을 매개할 뿐만 아니라 부정적인 피드백 방식으로 활성을 비활성화합니다.
그리고 p53에 결합하고, 전사 활성을 억제하고/하거나 유비퀴틴화를 강화함으로써 다른 조직의 정상적인 발달과 기능을 유지하기 위해 협력적으로 또는 개별적으로 p53 수준을 억제합니다.
따라서 p53을 활성화하기 위해 세포는 다양한 스트레스에 대한 반응으로 이러한 단백질 중 하나의 변형을 통해 MDM2-MDMX-p53 피드백 루프를 차단하는 다양한 세포 메커니즘 또는 경로를 유발해야 합니다.
돌연변이 MDMX는 실질적으로 감소된 14-3-3을 나타내고, p53 활성화를 감소시키고, 마우스를 매우 방사선 내성이 있게 하고 저산소 신호에 덜 민감하게 만듭니다.
또한 발암성 스트레스는 ARF의 발현을 유도하여 ARF와 MDM2의 상호작용을 강화하여 MDM2 활성을 비활성화함으로써 p53을 활성화할 수 있습니다.
또한, 리보솜 스트레스 신호는 여러 리보솜 단백질과 MDM2의 결합을 높이고 MDM2 활성 및 MDMX 활성을 감소시켜 p53을 활성화하는 것으로 나타났습니다.
따라서 이러한 연구는 유전 독성, 발암 성, 리보솜 스트레스 및 저산소 신호가 MDM2 및 MDMX의 억제 효과를 직접 차단하여 p53을 켜는 것을 확고히 보여줍니다.
******************************************************************************
2015
https://www.oncotarget.com/article/3629/text/
Targeting AMPK for cancer prevention and treatment | Oncotarget
https://doi.org/10.18632/oncotarget.3629 Weidong Li, Shakir M. Saud, Matthew R. Young, Guohong Chen, Baojin Hua
www.oncotarget.com
Targeting AMPK for cancer prevention and treatment
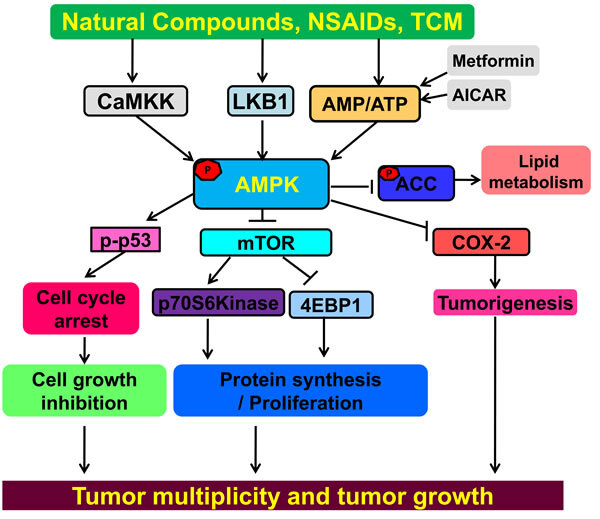
그림 1: AMPK는 암 예방 및 치료를 위한 종양 억제제입니다.
NSAID, 천연 제품, TCM 및 메트포르민은 모두 AMPK를 활성화할 수 있습니다.
AMPK는 mTOR 신호 경로를 부정적으로 조절하여 암 증식과 성장을 억제합니다.
활성화된 AMPK는 종양 형성과 관련된 염증 유발 효소인 COX-2를 부정적으로 조절합니다.
AMPK는 종양 억제 인자 p53의 인산화를 유도하여 세포 주기를 정지시킬 수 있습니다.
AMPK의 활성화는 또한 지질 대사에 영향을 미치는 ACC의 인산화를 유도할 수 있습니다.
분자 표적의 활성화로 이어지는 상호 작용은 화살표로 표시됩니다. 억제된 것은 막대로 표시됩니다.
AMPK의 활성화는 항암 활동으로 이어지는 여러 경로를 조절할 수 있습니다.
AMP 활성 단백질 키나아제(AMPK)는 세포 에너지 항상성을 유지하는 데 중요한 매개체입니다.
AMPK는 에너지 부족에 반응하여 활성화됩니다.
일단 활성화되면 AMPK는 ATP 생산을 촉진하고 대사 에너지를 조절할 수 있습니다.
AMPK는 대사 증후군 및 제2형 당뇨병 치료를 위한 알려진 표적입니다.
그러나 최근 AMPK는 암 예방 및 치료의 가능한 대사성 종양 억제 및 표적으로 부상하고 있습니다.
AMPK의 활성화는 여러 암 유형에서 종양 진행을 방해하는 것으로 밝혀졌으며 유망한 암 치료법을 제공합니다.
AMPK 활성은 부분적으로 염증과 대사를 조절함으로써 종양 발달과 진행을 반대합니다.
소개
AMPK는 또한 ATP의 고갈, 낮은 포도당, NADPH 수준의 변화와 같은 세포외 변화에 의해 활성화될 수 있습니다.
메트포르민 및 일부 비스테로이드성 항염증제(NSAID)는 AMPK를 활성화할 수 있습니다.
폴리페놀(레스베라트롤), 플라보노이드(퀘르세틴) 및 한방 화합물(베르베린)또한 AMPK를 활성화하는 것으로 나타났습니다.
NSAID 및 기타 항염증제에 의한 AMPK 활성화는 염증 동안 AMPK의 잠재적인 역할을 암시합니다.
일단 활성화된 AMPK는 암 발병에 기여하는 다양한 조절 과정에 관여하는 많은 이펙터 단백질에 영향을 미칠 수 있습니다.
암 대사와 관련하여 포유동물의 라파마이신 표적(mTOR)은 중요한 AMPK 표적이며 임상에서 이를 표적으로 하기 위해 많은 노력을 기울이고 있습니다.
AMPK는 또한 p53을 조절하고 세포 주기를 제어하는 전사 인자 및 공동 조절인자의 활성을 조절할 수 있습니다.
현재의 증거는 AMPK가 염증을 조절하고, 종양 형성 동안 발생하는 대사 변화에 반대하고, 세포 주기 정지를 직접 유도함으로써 종양 억제인자로 작용할 수 있음을 시사합니다.
이 검토는 종양 억제인자로서의 AMPK 역할과 암 예방 및 치료를 위한 치료 가능성에 대한 개요를 제공할 것입니다.
AMPK: 최신 기술
AMPK는 지질 대사와 콜레스테롤 및 지방산 수준 조절에 대한 역할 때문에 처음 설명되었습니다.
그 이후로 세포 에너지 항상성을 조절하는 AMPK의 역할은 이 효소를 에너지 대사의 주요 조절자로 지정합니다.
일반적으로 AMPK는 세포 에너지가 변경될 때 활성화됩니다.
포도당 결핍, 허혈, 저산소증 및 산화적 스트레스를 포함한 여러 스트레스가 AMPK를 활성화할 수 있습니다. .
일단 활성화된 AMPK는 ATP를 소비하는 경로와 ATP를 생성하는 활성화 경로(예: 포도당 흡수 및 지방산 산화)를 급격히 억제하는 수많은 대사 효소를 인산화합니다.
신진대사를 조절하는 AMPK의 역할은 잘 알려져 있습니다. 주로 제2형 당뇨병과 대사 증후군의 맥락에서 연구되었습니다.
당뇨병 마우스(db/db)에 투여되었을 때 당뇨병과 관련된 증상을 완화하고 혈당, 콜레스테롤 및 순환하는 유리 지방산을 낮추었습니다.
AMPK는 지방산, 인지질, 단백질 및 리보솜 RNA 합성을 포함하여 세포 성장을 촉진하는 모든 동화 경로를 본질적으로 억제합니다.
따라서 빠른 성장과 분열로 인해 세포의 에너지 요구량이 증가하는 암에서 AMPK 활성화제는 암 치료에 적합한 치료적 개입이 될 수 있습니다.
암에 대한 AMPK의 관련성
세포 에너지 조절 장애는 암의 핵심 특징입니다.
AMPK 활성화는 에너지 수준을 조절하고 대사 체크포인트를 강화하며 세포 성장을 억제함으로써 대사 종양 억제인자로 작용할 수 있습니다.
전립선 및 흑색종과 같은 다른 암에서 증가하는 문헌과 함께 폐암, 결장직장암 및 간암에서 AMPK의 종양 억제 기능을 입증하는 방대한 문헌이 있습니다.
반면에 다른 연구에서 구성적으로 활성인 형태의 AMPK를 과발현하면 낮은 포도당에 의해 유도되는 세포 사멸이 감소합니다.
AMPK의 암 관련 표적
mTOR
COX-2
p53
p53은 DNA 손상, 종양유전자 활성화 및 저산소증을 비롯한 여러 세포 스트레스에 반응하고 세포 주기 정지 또는 노화를 유도하여 종양 발달을 예방하는 데 중요한 역할을 하는 종양 억제인자입니다.
p53은 인간 암의 약 50%에서 비활성화되는 것으로 추정됩니다.
많은 키나아제는 대사 스트레스 조건에서 인산화에 의해 p53을 안정화합니다.
AMPK는 p53을 직접 인산화하여 안정화 및 전사 활성을 유도하고 p53 유전자 발현을 촉진할 수 있습니다.
p53의 활성화는 세포가 포도당이 회복될 때까지 증식을 저지함으로써 포도당 결핍에 반응하도록 합니다.
p53을 유도하는 포도당 결핍의 능력은 AMPK 의존적인 것으로 밝혀졌습니다.
p53의 손실은 암세포에 선택적 성장 이점을 제공하지만, p53의 손실은 메트포르민 또는 AICAR에 의해 유도된 대사 변화에 반응하고 영양소 결핍 조건에서 생존하는 암세포의 능력을 손상시킵니다.
메트포르민은 또한 p53 결핍 세포에서 암세포 증식을 억제할 수 있습니다.
아세틸-CoA 카르복실라제(ACC)
Acetyl-CoA carboxylase(ACC)는 지질 대사에 관여하는 AMPK의 잘 확립된 하류 표적입니다[.
ACC는 아세틸-CoA 카르복실화를 촉매하여 지방산 생합성을 위한 기질이자 지방산 흡수 억제제인 말로닐-CoA를 생성합니다.
여러 암에서 종양 진행은 ACC를 포함한 지방산 항상성에 관여하는 효소의 발현에 현저한 변화를 동반합니다.
여러 경우에 암세포 증식과 생존은 ACC 활성에 의존하고 ACC 억제는 세포자멸사를 초래합니다.
Akt
암 예방 및 치료를 위한 AMPK 표적화
메트포르민
비스테로이드성 소염제(NSAID)
비스테로이드성 소염제(NSAID)인 아스피린은 특히 대장암(CRC)을 예방하는 암 발병 위험 감소와 상관관계가 있는 것으로 나타났습니다
흥미롭게도 아스피린과 다른 NSAIDs도 AMPK를 활성화시키는 것으로 나타났습니다.
천연 제품
Table 1: Natural products extracted from herbal medicines that can activate AMPK to inhibit the growth of multiple cancer types.
AMPK를 활성화하여 여러 암 유형의 성장을 억제할 수 있는 한약에서 추출한 천연 제품.
| Natural products | Effect of AMPK activation | Cancer type | References |
| Berberine | Inhibition metastasis by AMPK/ERK | Melanoma | [11] |
| Ginsenoside 20-O-b-D-Glucopyranosyl-20(S)-Protopanaxadiol | Induces autophagic cell death by AMPK/JNK | Melanoma | [48] |
| Wogonin | Inhibition translation by AMPK/mTOR/4EBP1 | Glioblastoma | [119] |
| Tanshinone IIA | Induces autophagic cell death by AMPK/mTOR/p70S6kinase | Leukemia | [120] |
| Quercetin | Growth inhibition through AMPK/COX-2 | Breast and colon cancer | [121, 122] |
| Cryptotanshinone | Induce autophagic cell death by AMPK/mTOR | Hepatoma and colon cancer | [123] |
| Resveratrol | Triggered autophagic cell death via AMPK/mTORC2/p62 | Leukemia | [124] |
| Magnolol | Induce apoptosis of colon cancer by AMPK/p53 | Colon cancer | [125] |
| Epigallocatechin-3-gallate | Suppress colon cancer proliferation by ROS/AMPK/COX-2 | Colon cancer | [126] |
| Widdrol | Induction of apoptosis via AMPK | Colon cancer | [127] |
| Nordihydroguaiaretic acid | Inhibition breast cancer growth by AMPK/mTORC1 | Breast cancer | [128] |
| Demethoxycurcumin | Inhibition breast cell growth by AMPK/mTORC1 | Breast cancer | [129] |
| Curcumin | Suppress proliferation by AMPK/p53 | Ovarian cancer | [130, 131] |
| Antroquinonol | Anticancer by AMPK/mTOR/p70s6kinase and 4EBP1 | Hepatocellular carcinoma | [133] |
| Honokiol | Inhibition invasion and migration of breast cancer by LKB1/AMPK/mTOR | Breast cancer | [134] |
| Berberine | Inhibition growth by AMPK/mTOR and AMPK/COX-2 | Colon cancer | [135] |
AMPK 활성화의 잠재적인 단점
AMPK를 표적으로 하는 것이 암 치료의 매력적인 표적이 되었지만 AMPK 활성화가 암을 촉진할 수 있는 경우가 있습니다.
mTOR의 경우 isoform 특이성이 특히 중요합니다.
대부분의 암은 위에서 논의한 바와 같이 4EBP1 및 S6K1과 같은 이펙터를 통해 성장을 조절하는 mTOR 복합체 1(mTORC1)에서 활성화됩니다.
따라서 mTORC1을 억제하면 세포 단백질 합성 및 증식이 방지됩니다.
그러나 mTOR 복합체 2(mTORC2)를 억제하지 않고 mTORC1을 억제하면 앞서 언급한 바와 같이 PI3K-Akt 신호 전달 경로를 활성화하고 종양 생존을 촉진할 수 있습니다.
대부분의 경우 AMPK가 활성화되면 mTORC1이 억제됩니다. 그
러나 mTORC2 및 Akt 활성화에 대한 효과는 불완전하게 이해됩니다.
특정 AMPK 활성제가 mTOR를 조절하기 위해서만 사용된다면 그 성공은 두 복합체를 모두 억제하는 능력에 달려 있습니다.
최근 연구에서 AMPK 작용제는 종양 억제 및 종양 촉진 능력을 모두 가지고 있는 것으로 나타났으며, 이는 피드백 조절과 관련된 메커니즘에서 기인할 수 있습니다..
암 치료의 경우 AMPK 활성화는 세포 유형 및 상황에 따라 달라질 수 있으며 향후 연구에서 해결하기 가장 어려운 난제 중 하나가 될 것입니다.
****************************************************************************************************************
'전사인자' 카테고리의 다른 글
| 세포 신호 경로 억제제 카탈로그 (0) | 2023.06.18 |
|---|---|
| (Curcumin) HIF-1α는 질병 치료를 위한 한약의 잠재적인 분자 표적 (0) | 2022.10.01 |
| (Melatonin) HIF-1 전사 인자를 표적으로 하는 항암제의 최근 개발 개요 (0) | 2022.10.01 |
| 암에서 저산소증 및 HIF의 치료 표적화 (0) | 2022.10.01 |
| 암에서 (HIF-1)를 표적으로 하는 치료: 암세포 대사의 고르디안 매듭 절단 (0) | 2022.10.01 |