https://synapse.koreamed.org/articles/1074952
부수적으로 체세포 돌연변이는 세포가 새로운 능력을 획득하도록 하여 생존에 도움이 되었습니다.
일련의 사건에서 단일 세포에 비정상적인 표현형이 축적된 후 악성 암세포가 발생할 수 있습니다.
최근 연구에 따르면 많은 HDAC가 악성 세포에서 증가하고 HDAC는 암 발생에서 악성 표현형의 획득과 밀접하게 연관되어 있습니다. 클
래스 I HDAC는 전임상 및 임상 연구를 기반으로 세포 증식 및 생존을 자극하는 것으로 간주됩니다. 예를 들어, HDAC1의 증가된 발현은 위장관 암, 5 , 6 전립선, 7 및 유방 8 암종 에서 보고되었습니다 .
HDAC2의 비정상적인 상향조절이 자궁, 자궁경부, 9및 위암 10개 . HDAC2는 결장직장암에서 APC 발현 손실의 원인으로 간주됩니다. 11
다른 그룹에서는 HDAC3 또는 HDAC6이 결장암 및 유방암 세포에서도 각각 고도로 과발현된다는 것을 발견했습니다.
HDAC 발현은 고형 종양 및 혈액암에서 증가하는데, 이는 불량한 예후와 상관관계가 있습니다.
HDAC의 비정상적인 과발현의 기능적 관련성은 특정 하위 유형 간에 다소 다양합니다.
클래스 I HDAC는 일반적으로 세포 증식을 유도합니다.
또한 HDAC1과 HDAC2는 모두 암세포의 세포자멸사를 억제합니다.
다른 HDAC인 HDAC3, 4, 5, 8은 분화를 억제하는 경향이 있으며 HDAC4, 6, 9, 10은 암 혈관신생과 밀접하게 연관되어 있는 반면,
IIb HDAC인 HDAC6과 10은 세포 운동성을 유발하여 전이를 유발합니다. 그림 1 ).
증식, 분화, 혈관신생 및 이동을 표적으로 하는 HDAC의 억제제는 잠재적인 암 치료 전략입니다.

2. 항암제로서의 HDAC 억제제의 가능한 한계
분명히 HDAC 억제제는 세포 주기 정지를 유도하여 배양된 암세포에서 세포자멸사를 유도합니다.
HDAC 억제제는 강력한 세포 주기 억제인자인 p21의 전사 수준을 증가시킬 뿐만 아니라 p53의 아세틸화를 활성화합니다.
일반적인 효과를 위해 HDAC 억제제는 Bax, Bak 및 Apaf1과 같은 proapoptotic 유전자의 전사를 자극합니다. 39
그러나 인간의 항암 특성은 다소 제한적인 것으로 보입니다.
HDAC 억제제는 비특이적으로 혈관신생, 염증 및 증식을 차단합니다.
종양 혈관신생의 억제는 고형 종양으로의 약물 전달 실패를 초래합니다.
항염 작용은 또한 종양과 싸우는 면역 세포의 세포자멸사를 유도합니다.
이러한 원치 않는 부작용은 고형 종양에 대한 한계 효과의 가능한 메커니즘으로 간주됩니다.
그러나 화학 요법에서 HDAC 억제제의 일반적인 부작용은 죽상 동맥 경화증, 심근 경색, 부정맥 및 심부전의 이행과 같은 만성 심혈관 질환에 유익한 것으로 보입니다.
--------------------------------------------------
임상 및 비임상 연구에 따르면 HDAC 억제제는 세포 주기 정지, 세포자멸사, 분화, 항염증, 항침투 및 항증식을 유발할 수 있습니다. 요컨대, HDAC 억제제는 일반적인 항종양 활성을 가지고 있습니다. 미국 FDA 승인을 받은 4가지 HDAC 억제제는 혈액암에 효과가 있지만 단일 약물요법으로 고형종양에서는 실망스러운 결과를 보이고 있다. 고형 종양에 대한 제한된 효과는 항혈관신생 효과로 인한 혈액 공급 부족으로 인해 암 조직으로의 약물 전달 실패로 보입니다. 37
HDAC 억제제는 또한 여러 심혈관 질환의 질병 진행을 예방하는 데 유용합니다. 다양한 HDAC 억제제를 사용한 연구에 따르면, 여러 심혈관 질환은 심장 부정맥, 심근 경색, 글로벌 심장 리모델링, 비대, 고혈압 및 심장 섬유증을 포함한 HFpEF를 포함한 HDAC 억제제에 대한 새로운 적응증의 이점을 얻을 수 있습니다. 그러나 그들은 혈관 석회화를 악화시킬 수 있습니다. 실제로 혈전은 환자에서 보리노스타트의 심각하고 빈번한 부작용으로 보고되고 있습니다.
항간질제로 널리 사용되는 VPA는 자궁경부암이나 난소암과 같은 고형 종양, 심지어 척수성 근위축증에 대한 임상 3상 시험에 있습니다
****************************************************************************************************************
https://www.sciencedirect.com/science/article/pii/S1574789112000956
Table 2. HDI classification by chemical structure and clinical trial use.
Classification by chemical structureNamed examples (INN)HDAC specificityClinical trial stage
| Hydroxamates | SAHA (vorinostat) | Pan-inhibitor | Approved for CTCL, phase III alone or in combination |
| PXD101 (belinostat) | Pan-inhibitor | Phase II alone or in combination | |
| LBH589 (panobinostat) | Classes I and II | Phase III alone or in combination | |
| ITF2357 (givinostat) | Pan-inhibitor | Phase II alone or in combination | |
| 4SC-201 (resminostat) | Pan-inhibitor | Phase II alone or in combination | |
| PCI 24781 (abexinostat) | Classes I and II | Phase II alone or in combination | |
| Cyclic peptides | Depsipeptide/FK228 (romidepsin) | Class I | Approved for CTCL and PCTL, phase III alone or in combination |
| Benzamides | MS-275 (entinostat) | Class I | Phase II alone or in combination |
| MGCD0103 (mocetinostat) | Class I | Phase II alone or in combination | |
| Aliphatic fatty acids | Valproic acid | Classes I and IIa | Phase II alone or in combination |
| Butyrate | Classes I and IIa | Phase II alone or in combinationThe inhibitory effect of a large number of HDAC inhibitors depends on the Zn2+ |
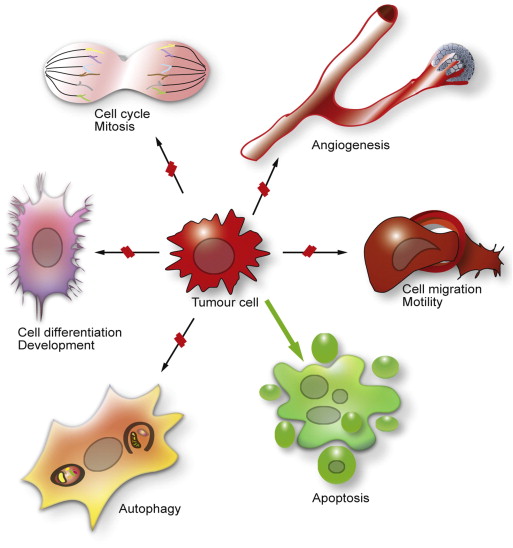
Figure 2. Influence of HDACs on different cell biological processes and consequences of HDAC inhibition. HDACs are involved in many cellular processes, including progression through the cell cycle, cell differentiation and development, cell migration and motility, angiogenesis and autophagy. These processes could promote tumour cell survival, proliferation and metastasis. HDAC inhibition blocks some of these processes, indicated by red lines, or favours other processes such as apoptosis, here indicated by the green arrow.
*****************************************************************************************************************
https://www.ingentaconnect.com/content/ben/cpd/2018/00000024/00000002/art00003
HDAC는 조절이 커큐민의 추정되는 항암 효과에 기여할 수 있는 커큐민의 새로운 표적으로 부상했습니다. 커큐민은 HDAC 활성을 억제하고 다양한 암 세포주와 마우스에서 HDAC 유형 1, 2, 3, 4, 5, 6, 8 및 11의 발현을 하향 조절하는 반면 HDAC2의 활성 및 발현은 증가하는 것으로 보고되었습니다. -COPD 및 심부전 모델에서 커큐민에 의해 조절됩니다.
결론: 이용 가능한 시험관 내 및 생체 내 데이터는 고무적이며 커큐민의 HDAC 억제 활성에 찬성하지만 암 환자의 보조 치료로서 커큐민의 효능에 대한 임상 증거는 부족합니다.
-------------------------------------------------------------------------------------
https://acsjournals.onlinelibrary.wiley.com/doi/full/10.1002/cncr.21552
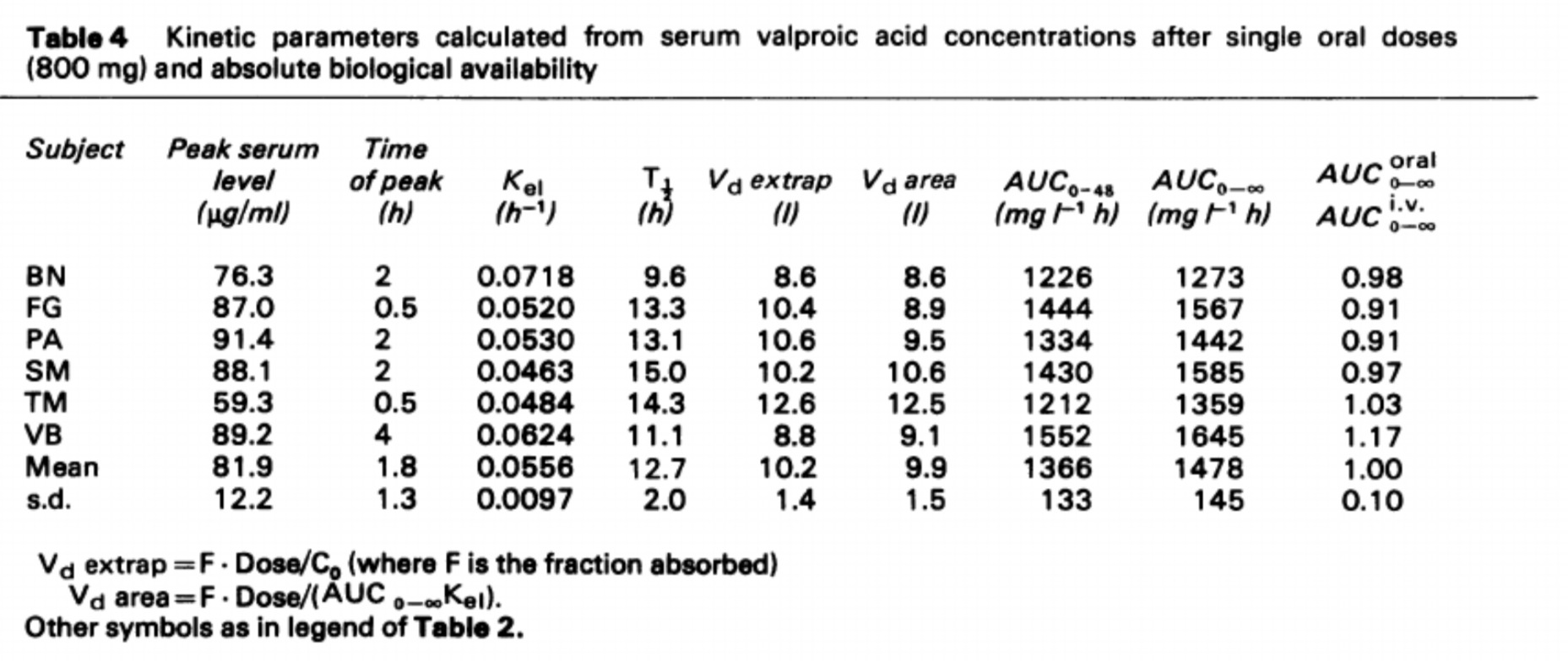
VPA는 항간질 치료의 치료 범위이기도 한 50~100μg/mL의 혈청 농도에 도달하도록 투여되었습니다.
-------------------------------------------------------------------------------------
https://bpspubs.onlinelibrary.wiley.com/doi/epdf/10.1111/j.1365-2125.1978.tb01713.x
'약물' 카테고리의 다른 글
| Artemisinin과 Sodium Butyrate의 시너지적 암세포독성 (0) | 2021.07.28 |
|---|---|
| ?부티레이트 (0) | 2021.07.23 |
| ? 스타틴 (0) | 2021.07.17 |
| ? Vitamin D3 (0) | 2021.07.17 |
| ? salvestrol (0) | 2021.07.17 |