A Pro-Oxidant Strategy to Fight Cancer, Support Chemo and Radiotherapy
Science-based Blog and Forum consolidating a list of drugs and food supplements (& dose) that may help increase the efefctivness of conventional teraphies.
www.cancertreatmentsresearch.com
<Modulating the Yin and Yang Energy of Cells to Fight Cancer: Pro-Oxidant Strategy>
우리의 목표는 암세포에서 지속 가능하지 않은 수준으로 암세포의 ROS를 증가시키는 것입니다.
아래에 논의된 ROS 증가 접근법의 전부는 아니지만 대부분은 암세포에만 선택적인 것이 아니며 정상 세포와 암세포 모두에 산화제 압력을 유도합니다.
그러나 정상 세포는 초기에 ROS 수준이 낮기 때문에 암세포에 비해 산화촉진제에 훨씬 더 잘 대처할 수 있습니다.
세포 내 ROS를 증가시키기 위해 우리는 다음과 같은 조치를 취할 수 있습니다.
- 세포내 항산화제 감소
- 세포내 ROS(활성산소종) 증가
항산화 수치를 낮추는 방법은 다음과 같습니다.
- 산화 방지제 생산을 위한 연료를 줄입니다. 직접연료와 간접연료가 있다
- 항산화제 생산에 필요한 간접 연료(또는 이것을 "연료의 연료"라고 부르자)는 포도당, 글루타민, 메티오닌입니다.
- 항산화제 생산에 사용되는 직접 연료는 예를 들어 시스테인, NADPH, 글루타메이트입니다.
- 항산화제 생산 시스템(예: 티오레독신 시스템)의 활성을 감소시키고 항산화제를 감소시킵니다.
- 항산화 마스터 레귤레이터 NRF2 의 활성 감소
이러한 주요 목표(간접 연료 제외)는 아래 그림에 나와 있습니다.

위 그림에서 노란색 강조 표시 육각형은 산화 촉진 전략의 일부로 우리가 조절하고 하향 조절하려는 우리의 목표가 될 것입니다. 나는 이 게시물의 후반부에 이러한 목표의 대부분을 조절하는 데 도움이 될 수 있는 약물과 보충제가 무엇인지 논의할 것입니다.
그러나 항산화제를 감소시키기 위한 이러한 주요 접근법 외에도 예를 들어 항산화제의 작용을 억제함으로써 항산화제 작용을 감소시키는 것도 가능하다는 점에 유의하십시오.
예를 들어, 내가 선호하는 천연 추출물 중 하나인 Piperlogumine(Long Pepper의 주요 성분)은 글루타티온의 항산화 작용을 가능하게 하는 글루타티온 S-트랜스퍼라제(GST)를 억제합니다.
글루타티온 S-트랜스퍼라제(GST)는 항암제에 대한 약물 내성을 유도하는 것으로 알려진 효소 중 하나입니다( Ref .1, Ref .2, Ref ..삼). Piperlogumine은 글루타티온 고갈제로도 발견되었습니다.
아세트아미노펜은 또 다른 글루타티온 고갈 물질입니다. 이것은 글루타티온과 반응하여 글루타티온 고갈을 유발할 수 있는 N-아세틸-p-벤조퀴논 이민(NAPQI)으로 대사됩니다.
세포 내 ROS를 증가시키는 것이 보다 직접적인 접근 방식입니다.
위에서 논의한 바와 같이, 이는 예를 들어 ROS를 생성할 수 있는 고용량 비타민 C 치료 또는 화학 요법 또는 방사선 요법으로 직접 달성할 수 있습니다.
그럼에도 불구하고 이러한 직접적이고 보다 분명한 ROS 생성 접근법 외에도 ROS 생성에 도움이 될 수 있는 또 다른 접근법은 미토콘드리아 활성을 증가시키거나 미토콘드리아 활성을 감소시키는 것입니다.
이것은 직관적이지 않으며 둘 다 작동할 수 있는 이유는 다음과 같습니다.
- 정상 기능 동안 미토콘드리아는 ROS를 생성합니다(복합체 I 및 III은 미토콘드리아 ROS의 대부분을 생성함)( Ref .). 기능을 높이면 자연스럽게 ROS가 증가합니다.
- 반면에 미토콘드리아가 미토콘드리아 억제제로 억제 되면 산소로의 불완전한 전자 전달이 유도되어 추가 ROS가 형성될 수 있습니다( 참고 .1, 참고 .2 , 참고 .3). 그러나 이것은 미토콘드리아 억제제 유형과 호흡 사슬 기질에 따라 ROS를 증가 또는 감소시킬 것인지 결정하기 때문에 항상 그런 것은 아닙니다. 따라서 일반적으로 우리가 무엇을 하고 있는지 정확히 알지 못한다면 이 전략의 일환으로 미토콘드리아 억제제에 의존하지 않을 것입니다. 그럼에도 불구하고 Atorvaqone(말라리아 약물)과 같은 미토콘드리아 억제제가 종양의 산소 소비량을 급격히 감소시켜 결과적으로 종양 내부의 산소 가용성을 증가시켜 산소의 능력을 회복할 수 있기 때문에 방사선과 함께 사용하는 경우 특히 사용합니다. 방사선 과민제( Ref .)로 작용합니다.
이에 따르면 세포 내 ROS를 증가시키기 위해 발효 억제제 로 발효를 억제하는 데 집중할 수도 있습니다 .
이는 미토콘드리아에서 생성되는 ROS가 너무 많으면(높은 에너지 요구로 인해) 악성 세포가 발효 기반(해당) 에너지 생산을 채택하기 시작하여 차례로 미토콘드리아 기능 및 관련 ROS 생성을 감소시키기 때문입니다.
발효를 억제함으로써 악성 세포는 미토콘드리아를 통해 에너지를 생산하는 것 외에 다른 선택권이 없습니다.
암세포가 미토콘드리아에서 발효로 에너지 생산을 전환하는 한 가지 방법은 PDK(피루브산 탈수소효소 키나제)라는 효소를 활성화하는 것입니다.
실제로 PDK 효소의 억제는 증가된 미토콘드리아 활성 및 후속 ROS 생성을 통해 세포 사멸을 유도하는 것으로 나타났습니다( 참고 문헌 ).
이것은 DCA( Ref .) 라고 하는 기존 약품으로 가능하고 저렴 합니다.
메트포민의 도움으로, 미토콘드리아 복합체 I와 간섭하면서 또한, 상기 ROS 생성 (향상시킬 수있는, DCA와 그 재 활성화 미토콘드리아를 도시 한 참고 위에서 논의 인라인이다.).
따라서 세포의 항산화 수준을 낮추면 산화 촉진 치료(ROS 유도 치료) 효과의 가능성이 높아집니다.
이렇게 함으로써 우리는 실제로 종양의 주요 약물 내성 메커니즘 중 하나를 다루고 있습니다.
이는 산화촉진제 치료가 종양을 공격하자마자 종양이 항산화제를 증가시키는 능력과 관련이 있습니다.
이것이 종양 전문의가 환자에게 화학 요법이나 방사선 요법을 받는 동안 항산화제를 사용하지 말라고 권고하는 이유입니다.
그래서 나는 화학 요법/라디오 치료 후 며칠 동안 항상 항산화제를 멀리했습니다.
제 생각에는 화학 요법/라디오 요법 동안 피해야 하고 화학 요법 이후에는 일주일 정도만 주어야 하는 항산화제는 글루타티온 정맥 또는 경구, 알파 리포산 정맥 또는 경구, NAC, 비타민 E, SOD입니다.
이 복용량은 종양 수준에서 인간의 항산화 잠재력이 제한적인 대부분의 식물 추출물에는 적용되지 않으며 실제로 많은 식물 추출물이 암에서 산화 촉진 작용을 합니다.
아래 논의에서도 분명해지겠지만, 커큐민, 케르세틴, EGCG, 파이퍼로구민 등과 같은 식물 추출물은 암세포 내부의 항산화 효소 생성을 억제할 수 있습니다.
이것은 종종 항산화제로 언급되는 경우에도 산화촉진제로 효과적으로 작용합니다.
이 외에도 폴리페놀과 같은 식물성 식품 성분은 다음 조건에서 산화촉진제로 작용할 수 있는 것으로 나타났습니다.
- 고용량에서
- 다량의 철 또는 구리 이온을 함유한 세포 내부(암 세포의 경우)
- 높은 수준의 pH를 갖는 세포에서
이것이 내가 이 게시물의 후반부에 더 논의할 것처럼 "항산화제"가 두 가지 주요 범주로 나뉘는 것을 보는 이유입니다.
- 강력한 항산화제(이 게시물에서 논의된 전략에서 피해야 하며 일반적으로 화학 요법/방사선 요법과 결합해서는 안 됨)
- 산화 촉진 효과가 있는 것으로 알려진 산화 방지제는 커큐민, 케르세틴 등과 같은 식물 추출물을 포함하는 범주이며 제 생각에는 화학 요법/방사선과 결합할 수 있지만 화학 요법/방사선에서 며칠 떨어져서 사용할 것입니다.
실제로 Curcumin 정맥 주사는 종종 전 세계 암 클리닉에서 사용되며 화학 요법 및 방사선 요법과 함께 좋은 결과를 얻습니다.
그럼에도 불구하고 화학 요법 및 방사선 요법과 함께 또는 직후가 아니라 며칠 후(예: 3일) 후에 항상 사용하기 시작했습니다.
항산화 억제제로 다시 돌아와서, 실제로 다양한 연구에서 항산화제 치료 옆에 항산화 억제제(예: Sulfasalazin, Auranofin 등)의 동시 억제가 대부분의 암 유형에는 치명적이지만 정상 세포에는 치명적이지 않다는 것이 입증되었습니다.
다음은 이러한 연구의 몇 가지 예입니다.
- 티오레독신 및 글루타티온 의존성 대사 억제를 통한 유방암 줄기세포의 방사선 반응 향상
- 글루타티온의 조절은 삼중 음성 유방암 세포에서 세포자멸사를 촉진합니다
- 글루타티온 고갈은 시험관 내 및 생체 내에서 시스플라틴 및 테모졸로마이드 내성 신경교종 세포를 민감하게 만듭니다.
- 글루타티온과 티오레독신 대사를 동시에 방해하여 카보플라틴 매개 폐암 세포 사멸 향상
- 포도당-6-인산 탈수소효소의 억제는 시스플라틴 내성 세포를 사멸에 민감하게 만듭니다
- Xc- 억제제 설파살라진은 글루타티온 의존적 기전을 통해 전립선암 세포에서 약리학적 비타민 C의 항암 효과를 향상시킵니다
- 고처리량 약물 검사는 소세포 폐암에서 시스플라틴의 잠재적인 감작제로 아우라노핀을 식별합니다
- 삼중음성 유방암 치료를 위한 티오레독신 환원효소 억제제인 아우라노핀과 항PD-L1 항체의 치료 협력
- 난소암 환자를 치료하는 Auranofin과 Sirolimus
- Auranofin은 thioredoxin reductase를 표적으로 하여 활성 산소 종의 과잉 생산을 통해 종양 세포를 방사선 민감하게 만듭니다.
- Erastin는 XCT와 시스타-γ-리아제 능 억제하여 테모 졸로 마이드를 아교 모세포종 세포를 민감하게 N을
- 등등 …
항산화제 억제가 모든 암 유형에서 대체 및 기존 치료법을 포함한 산화촉진제 치료의 효과를 증가시킬 수 있다는 사실을 뒷받침하는 수천 개의 논문, 따라서 많은 양의 과학 문헌이 있습니다.
암과 싸우기 위해 세포의 음과 양 에너지 조절: 도구
이제 항산화제 고갈이 항산화제 치료의 효과를 뒷받침할 수 있다는 것이 분명해졌으므로, 문제는 항산화제를 억제하는 데 도움이 될 수 있는 표적은 무엇이며 우리가 할 수 있는 항산화제 치료는 무엇입니까?
핵심 치료법으로 사용하거나 일반적으로 이 전략의 구성 요소로 사용할 생각입니다.
아래에서는 주요 목표와 이를 구조화된 방식으로 조절할 수 있는 약물 및 보조제에 대해 설명하겠습니다. 그러나 그렇지 않으면 이 게시물이 매우 길어질 것이므로 각 목표에 대해서는 설명하지 않습니다.
항산화제 수치를 낮추려면 다음 약물과 보조제를 사용할 수 있습니다.
- 산화 방지제 생산을 위한 직접 연료 감소:
-
- 시스테인을 감소시키는 약물 및 보조제: 설파살라진 (x(c) (-) 억제제) ( 참고 .) 소라페닙 및 에라스틴 (x(c) (-) 억제제) ( 참고 .)
- NADPH를 감소시키는 약물 및 보조제: DHEA (PPP 억제제)( Ref .), Polydatin (PPP 억제제)( Ref .), EGCG (PPP 억제제)( Ref .), Rosmarinic acid (PPP 억제제)( Ref .)
- 글루타메이트를 감소시키는 약물 및 보조제: BPTES (GLS 억제제), ( Ref .) 카페인산 ( GLS 억제제)( Ref .), Usolic Acid (ASCT2/SLC1A5 억제제), EGCG (GLDH, GDH, GLUD 억제제), Hesperidin (AST, AspAT/ASAT/AAT, GOT, SGOT 억제제)
-
- 항산화제 생산 시스템의 활동을 감소시키고 항산화제를 감소시킵니다.
-
- 티오레독신을 감소시키는 약물 및 보조제: Auranofin (TrxR 억제제)( Ref .), Curcumin (TrxR 억제제)( Ref .), EGCG (TrxR 억제제)( Ref .), Quercetin (TrxR 억제제)( Ref .)
- 글루타티온 및 GPx를 감소시키는 약물 및 보조제: 티오프로닌 (글루타티온 퍼옥시다제(GPx) 억제)( 참조 ), 메틸글리 옥살 (글루타티온 퍼옥시다제(GPx) 억제)( 참조 ), BSO (글루타메이트 시스테인 리가제 억제제)( 참조 ) Piperlogumine (글루타티온 트랜스퍼라제 억제제)( Ref .), 파라세타몰/아세트아미노펜 (글루타티온 고갈)( Ref .), 스타틴 (글루타티온 퍼옥시다제(GPx) 억제)( Ref .)*, Ethacrynic acid (글루타티온 트랜스퍼라제 억제제)( Ref . ),피루비늄 파모에이트 (기질 세포에서 글루타티온 공급 억제)( 참고 .), 오메가 3 오일 에서 DHA (세포 내 GSH 고갈)( 참고 .), 펜벤다졸 (글루타티온 고갈)( 참고 .)
*멜라보네이트 경로와 GPx, 그리고 스타틴이 마침내 세포 내부의 항산화제 수준을 감소시키는 이유: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5345622/의 그림 1 - SOD를 감소시키는 약물 및 보조제: Tetrathiomolybdate (SOD 감소)( Ref .), Disulfiram (SOD 감소)( Ref .), Salinomycin (SOD 감소)( Ref .)
- 카탈라아제를 감소시키는 약물 및 보조제: EGCG ( Ref .1, Ref .2), Myricetin ( Ref .)
- 퍼옥시레독신을 감소시키는 약물 및 보조제: 효과적이고 이용 가능한 억제제를 찾을 수 있습니다.
-
- 항산화 마스터 레귤레이터 NRF2의 활성 감소
산화 방지제 생산을 위한 연료를 줄이는 다른 방법은 간접 연료 또는 "연료의 연료"를 줄이는 것입니다.
이것은 다음과 같은 방법으로 해결할 수 있습니다.
다음 중 일부를 사용하여 세포 내 ROS를 증가시킬 수 있습니다.
-
-
-
- 화학 요법 (알킬화제 및 기타)(잘 알려져 있음 – 참조 필요 없음)
- 방사선 요법 (잘 알려져 있음 – 참조 필요 없음)
- 고용량 비타민 C (정맥 주사)( Ref .)
- 타우로리딘 (정맥 주사)( Ref .)
- 아르테미시닌/아르테수네이트 (정맥내, 경구)( Ref .)
- 은 나노 입자 용액 (경구, 정맥내)( Ref .)
- 메틸글리옥살 (경구, 정맥내)( Ref .)
- 3 브로 모피루베이트(3BP)( Ref .)
- 오존 (정맥 주사)( Ref .)
- 전기천공 ( 참조 .1, 참조 .2)
- 과산화수소 (정맥 주사, 분무)( Ref .)
- DCA (Dichloroacetate)(정맥 주사, 경구) 또는 DCA+Metformin 증폭 ROS 생성( Ref .)
- 살리노마이신 ( 참고 .)
- 알벤다졸 ( 참고 .)
- 기타
-
-
암과 싸우기 위한 세포의 음과 양 에너지 조절: 응용
위의 목록을 사용하여 완전하게 시도하지는 않았지만 가장 관련성이 높은 대상과 이를 조정하는 데 사용할 수 있는 도구 중 일부를 강조 표시했습니다. 위에서 볼 수 있듯이 화학 요법 및 방사선 요법을 지원하거나 단독으로 사용하여 강력한 치료 칵테일을 만들 수 있는 많은 약물과 보조제가 있습니다. 아래 그림 은 그 중 일부를 함께 통합하는 방법 의 예 를 보여줍니다 .
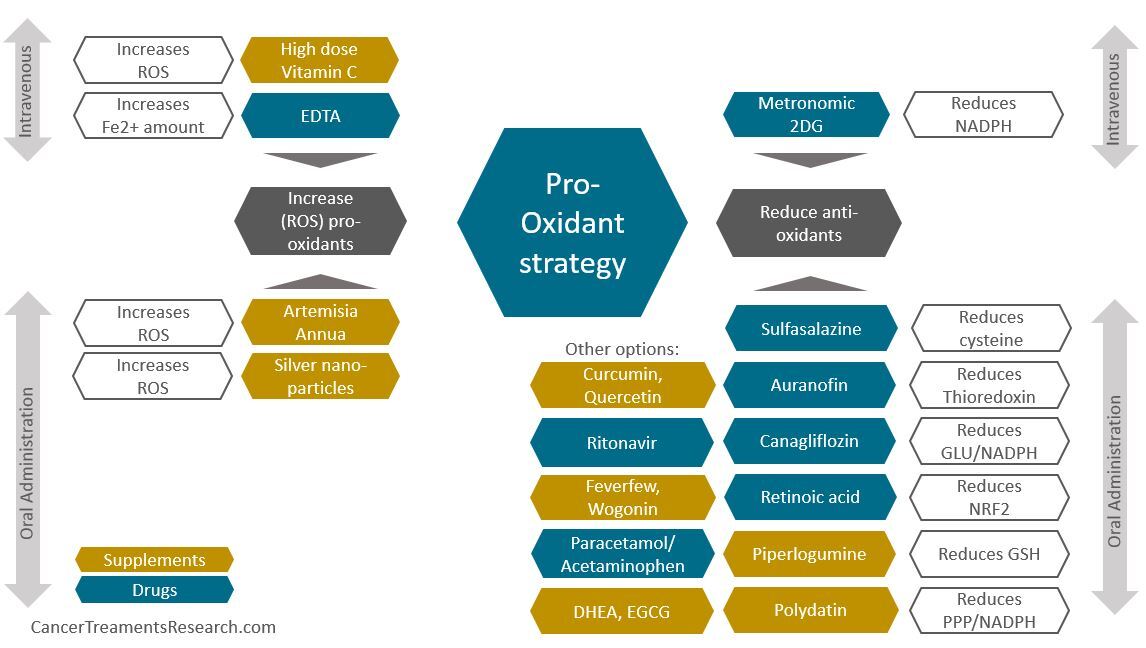
위 그림을 참고하세요.
- 각 약물 또는 보충제에 대해 이 전략과 관련된 주요 목표만 언급됩니다(그렇지 않으면 대부분의 약물 및 보충제는 다중 목표를 가짐)
- 파란색 육각형은 용도 변경 약물을 나타내고 머스타르색 육각형은 천연 추출물을 나타냅니다.
나는 항상 목표 복용량을 향해 단계별로 각 약물 보충제를 시작하고 한 번에 모두 시작하지는 않습니다.
예를 들어, 나는 2일마다 하나의 신약이나 보충제를 추가하고(원하지 않는 반응이 있는 경우 확인하기 위해) 예를 들어 2주 동안 목표 용량을 향해 증량합니다.
위의 그림은 내가 우선순위로 선택한 약물 및 보조제 클러스터를 보여줍니다. 그러나 이것이 모든 것을 사용해야 한다는 것을 의미하지는 않습니다.
위의 약물 중 하나만 사용하여 화학 요법이나 방사선 요법을 지원하더라도 여전히 도움이 됩니다. 물론 가능하면 모두 사용하는 것이 바람직합니다.
그림의 오른쪽에는 Sulfasalazine, Auranofin, Canagliflozin, Retinoic Acid, Piperlogumin, Polydatin에 대한 대안을 나타낼 수 있는 선택된 약물/보충제에 대한 "기타 옵션"도 강조 표시되었습니다.
노트:
- sulfasalazine 치료는 뇌암 환자에서 뇌 부종을 유발할 수 있으므로 ( 참고 .) 이 경우 피하는 것이 가장 좋습니다.
- 나는 환자가 호르몬 암을 다룰 때 DHEA 사용을 피하고 전립선 암에 사용하지 않을 것입니다.
내 경험에 따르면 높은 수준의 DHEA를 단독으로 사용하여 항산화제 생성을 처리하는 것은 충분히 효과적이지 않습니다.
이것은 환자에서 매우 높은 수준의 DHEA를 생성하는 기능적 부신피질 종양에 의해 입증되지만, 이러한 종양은 매우 공격적이고 화학 요법에 내성이 있습니다.
DHEA 단독의 이러한 비효율성은 두 가지 사실에 의해 설명될 수 있습니다.
DHEA는 호르몬에서 매우 빠르게 전환되거나(이는 문헌에서 자주 사용되는 주장입니다), 종양은 NADPH를 생성하는 다른 방법을 찾습니다(NADPH는 PPP 경로를 억제할 때 DHEA에 의해 억제됨).
사실, 나는 PPP가 NADPH의 약 20% 생성을 담당하기 때문에 문제는 후자라고 생각합니다..
대부분의 NADPH는 10-포르밀-THF와 같은 다른 경로를 통해 생성됩니다.
그럼에도 불구하고,제 생각에는 위의 약물 중 Auranofin, Sulfasalazin 및 Retinoic Acid가 항산화 생성을 억제하는 능력이 탁월하며 화학 요법 또는 라디오를 지원하는 데 사용하는 첫 번째 약물이 될 것입니다.
사용할 수 없는 경우 위에 나열된 관련 옵션이 많이 있습니다.
위의 전략을 적용하기 위해 나는 먼저 나의 핵심/중심 치료가 무엇인지 고려할 것입니다. 화학 요법이나 방사선 요법이 핵심 치료인 경우 다음과 같은 방법으로 이 전략을 적용할 것입니다.
예를 들면 다음과 같습니다.
- 항산화제를 줄이기 위해 약물 사용: 화학 요법/방사선 치료 며칠(예: 2-3일)부터 시작하여 화학 요법/방사선 치료 후 며칠(예: 5-7일); 그 중 몇 가지는 더 오래 지속할 수 있지만 너무 많은 시간 동안 너무 많은 것은 몸에 너무 버거울 수 있습니다.
- 식품 보조제(예: Curcumin, EGCG, Quercetin, Piperlogumine 및 위에서 언급한 기타)는 화학 요법/라디오 치료 며칠 전(2-3일) 시작하여 며칠 후(2 -3 일). 우리는 위의 보충제가 산화 촉진 작용에 대한 잠재력을 감안할 때 이 전략에 가치를 더할 것이라고 기대하지만(그리고 유지하는 경우에도 안전하다고 느낄 수 있습니다), 100%로 우리가 화학 요법/라디오를 방해하지 않기 위해 그들을 중단할 수 있습니다
- 화학 요법/라디오 세션 사이에 가능한 경우 고용량 비타민 C와 Artesunate를 모두 정맥 주사합니다. Curcumin과 Quercetin 정맥 주사는 여기에 오존 요법, Salinomyin, DCA 및 기타 ROS 생성 치료와 함께해도 적합합니다.
- 나는 쉬지 않고 은 나노 입자와 오메가 3를 섭취할 것 입니다. 여기에 논의된 절차에 따라 이 시간 동안 Artemisia Annua 차 또는 캡슐과 Artemisinin 캡슐을 사용할 수도 있습니다 .
- 강력한 항산화제는 화학 요법/방사선 치료 전 며칠과 약 7일 이내에 사용해서는 안 됩니다. 강력한 항산화제로 N-아세틸시스테인(NAC), 글루타티온, 알파리포산, 비타민 E를 이해하십시오.
참고: 위의 몇 줄은 화학 요법 기간 동안 Curcumin, EGCG, Quercetin, Piperlogumine과 같은 보충제 사용의 안전성에 관한 일부 논의를 수용하기 위해 처음 게시된 버전과 비교하여 변경되었습니다.
따라서 본질적으로 식품 보조제에 대해 다음 규칙을 적용합니다.
- NAC, ALA 등과 같은 강력한 항산화제는 화학 요법 전후 6-7일 동안 복용해서는 안 됩니다.
- 산화 촉진 효과가 있는 것으로 알려진 항산화제(예: 케르세틴, 커큐민 등)는 화학 요법 전후 2-3일 동안 복용해서는 안 됩니다.
- 방사선/화학요법에 좋은 이점을 가져오는 것으로 널리 알려진 산화촉진제 또는 기타 화학요법/방사선 요법을 계속할 수 있습니다. 예: 오메가 3, 아레미시아 아누아, 실버 솔루션.
따라서 항산화제 감소 전략(보다 구체적으로 이 전략에서 용도 변경 약물)은 화학 요법에 대한 펄스에 적용됩니다. 이 전략을 지원하기 위해 보충제와 추가 정맥내 치료가 추가되며 보다 지속적인 방식으로 사용할 수 있습니다.
화학 요법이 더 지속적인 방식으로 이루어지고 펄스가 아닌 경우(예: 경구 화학 요법 약물의 경우) 식품 보조제에 대해 다음 접근 방식을 적용합니다.
- NAC, ALA 등과 같은 강력한 항산화제는 피해야 합니다.
- 산화 촉진 효과가 있는 것으로 알려진 항산화제(예: 케르세틴, 커큐민 등)는 2주 켜기 및 2주 끄기와 같은 주기로 사용됩니다.
- 방사선/화학 요법에 좋은 이점을 제공하는 것으로 널리 알려진 산화촉진 식품 보조제 또는 기타 식품을 지속적으로 사용할 것입니다. 예: 오메가 3, 아레미시아 아누아, 실버 솔루션.
이 경우 설파살라진, 아우라노핀 등의 용도변경된 산화촉진제를 2주 ON, 2주 OFF 등의 주기로 사용할 수도 있다.
수행한 화학 요법/ 방사선 요법이 없는 경우(또는 예를 들어 Taurolidine ) 위 그림에 언급된 정맥 주사 요법을 핵심 요법으로 고려하고, 즉 비타민 C + EDTA, Artesunate, 2DG를 고려하고 이를 중심으로 전략을 수립합니다.
그 경우, 나는 아마도 "산화 방지제 감소 범주"에 의해 지원되는 치료를 2x/주를 사용하고 3-4주 동안 이러한 사이클을 수행할 것입니다(신체의 산화제 압력을 줄이기 위해 2주간 휴식) .
ferroptosis는 autophagic 세포 사멸 과정이므로 이 전략을 사용하는 동안 HydroxyChloroquine을 사용하지 않는 것이 가장 좋습니다( Ref .).
화학 요법이나 라디오를 사용하는 경우 ferroptosis에 덜 의존하고 Autophagy 억제제로서의 화학 요법에 대한 추가 가치 때문에 HydroxyChloroquine을 사용합니다.
치료와 병행하여 식단을 살펴보고 특히 포도당(설탕), 글루타민(붉은 고기) 및 메티오닌(고기, 생선 및 유제품에 들어 있음)의 섭취를 줄이려고 노력합니다.
이것은 포도당이 NADPH 생산의 좋은 연료가 되고, 글루타민이 글루타메이트 생산의 좋은 공급원이 되며, 메티오닌이 세포 내부의 시스테인에서 전환되기 때문입니다.
이들 중 메티오닌이 없는 식단은 달성하기 가장 쉽고 이 전략과 가장 관련이 있을 수 있습니다. 다음은 메티오닌이 없는 식단에 대한 몇 가지 관련 연구입니다.
Extending the “Pro-Oxidant Strategy” Strategy-"친산화 전략" 전략 확장
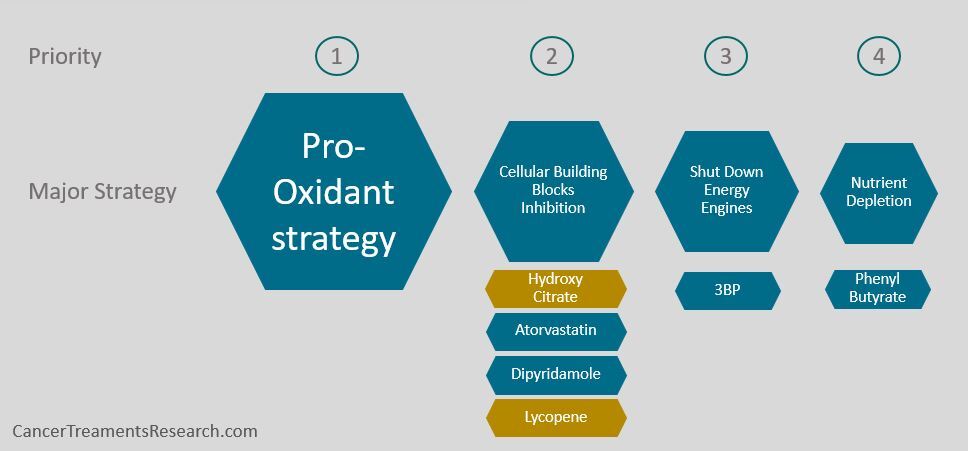
"Pro-Oxidant 전략"의 강도를 높이고 싶다면 첫 번째 단계는 "Cellular Building Blocks" 억제 전략에 초점을 맞추는 것입니다.
보다 구체적으로 말하면 Melavonate Pathway를 억제하기 위해 최선을 다할 것입니다.
그렇게 함으로써 과산화수소에 대한 세포의 첫 번째 방어선인 글루타티온 과산화효소(glutathione peroxidase, GPx)를 억제할 수 있는 좋은 기회가 있습니다.
"세포 구성 요소" 억제 및 멜라보네이트 경로 억제
Melavonate 통로의 억제는 광범위하게이 웹 사이트에 언급 된 여기 와 여기 . 다음은 내가 사용할 주요 억제제입니다.
- HydroxyCitrate (HCA)는 온라인에서 보충제로 사용되며 일반적으로 하루에 약 1.5g 이상 사용됩니다.
- 암 치료에 일반적으로 사용되는 아토르바스타틴 은 40-80mg/일의 용량으로 사용됩니다.
- 디피리다몰은 일반적으로 200mg 2x/day의 범위에서 사용됩니다.
- 일반적으로 100mg/day 범위에서 사용되는 리코펜
" 에너지 엔진 정지 "
더 많은 공간이 있다면 " 에너지 엔진 정지 "를 추가하는 것을 강력히 고려할 것이며 특히 발효 억제제 에 중점을 둘 것 입니다. 그 중 발효를 억제하는 바로 옆에 ROS를 증가시키기 때문에 여기에 가장 적합한 것은 3BP (3- Bromopyruvate )입니다.
" 에너지 엔진 정지 " 중에서 저는 미토콘드리아에서 생성된 ROS가 너무 많을 때(높은 에너지 요구로 인해) 발효 억제제 만 선택합니다 (미토콘드리아 억제제 제외).
악성 세포는 발효 기반(당분해) 결국 ROS의 미토콘드리아 생성을 감소시키는 대사. 따라서 발효를 줄임으로써 악성 세포는 미토콘드리아를 통해 세포를 죽이거나 성장을 늦추는 ROS를 생성하는 에너지를 생산하는 것 외에 다른 선택이 없습니다.
“영양소 고갈”
또한, 글루타민 고갈제로 PhenylButyrate (일반적으로 몇 g/일 범위에서 사용)의 사용을 고려할 것 입니다.
마지막으로, 장기간의 항산화제 고갈은 우울증, 근육성 뇌척수염/만성 피로 증후군 및 파킨슨병을 포함한 다양한 신경 면역 장애의 기초가 될 것으로 예상되기 때문에 이 전략은 일시적으로만 사용해야 한다는 점을 강조해야 합니다( 참고 문헌 ).
몇 가지 추가 세부 사항
음: 반응성 산소 종
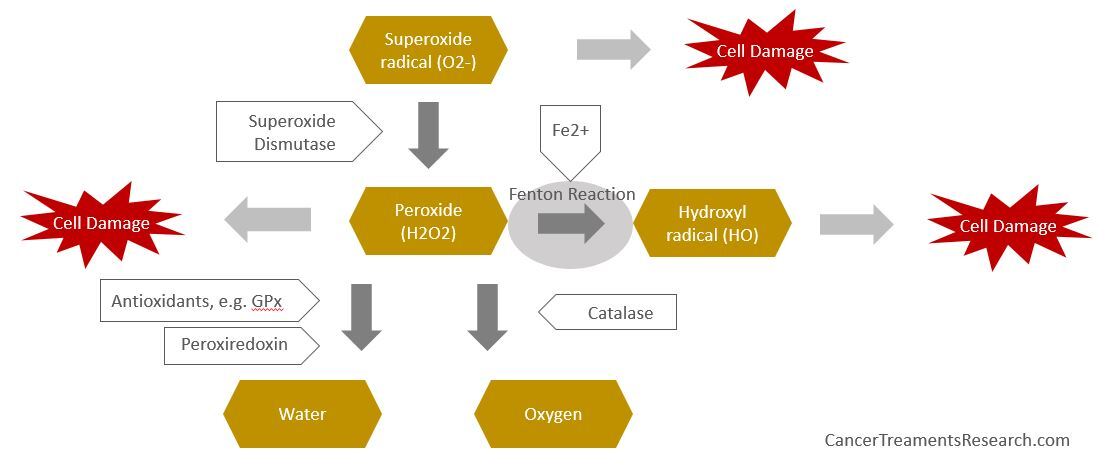
반응성 산소종(ROS)은 다음을 포함하는 반응성이 높은 분자 세트입니다.
- 자유 라디칼
- 슈퍼옥사이드 음이온(O2−)
- 수산기(OH)
- 비 라디칼 종
- 과산화수소(H2O2)
- 일중항 산소(1O2)
ROS는 미토콘드리아 호흡 사슬에서 지속적으로 탈출합니다.
고농도에서는 핵산, 단백질 및 지질과 같은 많은 세포 성분과 반응하여 DNA 복구 시스템을 벗어나는 DNA 손상을 일으킬 수 있습니다( 참고 .).
반응성 질소종(RNS)은 산화질소(NO) 및 과산화물 음이온(O2-)에서 파생된 또 다른 자유 라디칼 계열로, ROS와 함께 작용하여 세포를 손상시킬 수 있습니다.
미토콘드리아는 포유동물 세포에서 ROS의 가장 큰 기여자이며 소비된 산소의 약 1%를 과산화물 음이온(O2-)으로 전환합니다( Ref .).
이것은 슈퍼옥사이드 음이온(O2-) 및 과산화수소(H2O2)와 같은 ROS를 생성하는 산소로의 전자 누출로 인해 발생합니다.
미토콘드리아에는 슈퍼옥사이드 음이온(O2-)과 과산화수소(H2O2) 생성이 일어나는 곳이 최소 11곳이 있습니다( 참고 .).
미토콘드리아 복합체 I 및 III는 전통적으로 (O2-) 및 (H2O2) 미토콘드리아 생성의 주요 부위로 인식됩니다.
양: 세포의 항산화 방어
세포에는 세포 소기관, 세포질, 심지어 세포외 공간에서 ROS 수준을 제어하는 항산화 시스템이 있습니다. 다음은 세포에 존재하는 주요 항산화제 또는 항산화제 시스템입니다.
효소적 항산화제 또는 항산화 시스템:
- 슈퍼옥사이드 디스뮤타제(SOD) – 슈퍼옥사이드(O2-) 라디칼을 일반 분자 산소(O2)와 과산화수소(H2O2)로 변환(또는 분할)하는 것을 촉매하는 효소입니다. 신체의 산화 스트레스에 대한 매우 중요한 항산화 방어를 나타냅니다. 구리, 철, 망간, 아연 등의 금속 이온을 보조인자로 사용하여 (O2-)의 변이를 촉매하는 금속효소입니다.
- 카탈라아제 – 과산화수소(H2O2)를 물(H2O)과 산소(O2)로 분해하는 촉매 작용을 하는 효소.
- 글루타티온(GSH) 시스템 – 글루타티온(GSH)은 일반적으로 2단계 반응을 통해 생성됩니다. 첫 번째 단계에서 γ-글루타밀시스테인은 효소 글루타메이트 시스테인 리가제(GCL)에 의해 활성화되는 시스테인과 글루타메이트(글루타민에서 유래) 사이의 반응 산물입니다. 그런 다음 글리신이 첨가되어 글루타티온 합성효소를 통해 GSH를 생성합니다. GCL 활성과 시스테인 수준은 글루타메이트 또는 글리신이 아닌 속도 제한 기질입니다. 왜냐하면 글루타메이트와 글리신 둘 다의 세포내 농도가 더 높기 때문입니다( 참고 .)
- 티 오레 독신 (의 Trx) 시스템 - 세포 내 산화 환원 항상성을 유지하는 주요 항산화 시스템 중 하나는 티 오레 독신 (의 Trx) 시스템이다.
- 퍼옥시 레독신 – 세포 내 과산화물 수준을 조절하는 데 지배적인 역할을 하는 시스테인 의존성 퍼옥시다제 효소. 이러한 효소는 종종 높은 수준으로 존재하며 과산화물을 빠르게 제거할 수 있습니다( 참고 .)
- 헴 옥시게나아제-1(HO-1) 단백질 – 헴 옥시게나아제-1의 항산화 메커니즘은 슈퍼옥사이드 디스뮤타아제 및 카탈라아제의 증가를 포함합니다( Ref .)
비효소적 항산화제의 예(식품 보조제로 발견됨):
- 비타민 E와 A
- 알파리포산(ALA)
- N-아세틸 시스테인(NAC)
- 코엔자임Q
- NADPH
- 글루타치온(GSH)
- 요산
- 알부민
- 빌리루빈
위에서 논의한 바와 같이 세포 내부의 항산화 수준 은 산화 스트레스 반응의 전체적인 조절자인 Nrf2 에 의해 제어됩니다 .
.
위의 많은 항산화제는 온라인 상점에서 식품 보조제로 찾을 수 있습니다. 여기에는 슈퍼옥사이드 디스뮤타제(SOD), 글루타티온(GSH), 카탈라제, 알파리포산(ALA), N-아세틸 시스테인(NAC), 비타민 E 및 A가 포함됩니다.
화학 요법이나 방사선 요법의 효과는 그 부작용이 달리 관리할 수 없을 때 사용합니다.
아래는 다양한 항산화제에 의해 ROS가 어떻게 다루어지는지 느낌을 주는 그림입니다.
참고문헌
항암제로서의 산화촉진 천연물 https://www.ncbi.nlm.nih.gov/pubmed/22594470
암세포는 높은 수준의 활성산소(ROS)를 생성하여 기저 산화 스트레스를 증가시킵니다. 이러한 산화 스트레스 상태는 암세포를 ROS 수준을 더욱 증가시키는 약제에 취약하게 만들기 때문에, 산화촉진제의 사용은 종양 세포를 선택적으로 표적화하기 위한 흥미로운 전략으로 떠오르고 있습니다. 천연물은 현재 암 화학 요법에 사용되는 여러 약물의 개발에 상당한 기여를 했습니다. 많은 천연물이 세포의 산화환원 상태에 영향을 미치는 것으로 알려져 있지만 이러한 화합물에 대한 대부분의 연구는 산화촉진 특성 대신 항산화 활성에 초점을 맞추었습니다. 이 기사는 식물의 2차 대사산물에 특히 초점을 두고 산화촉진 및 항암 활성이 있는 천연물에 대한 개요를 제공합니다.
미토콘드리아 전자 수송 사슬, ROS 생성 및 분리 https://www.spandidos-publications.com/10.3892/ijmm.2019.4188
포유류의 미토콘드리아 전자 수송 사슬(ETC)에는 복합체 I-IV와 전자 수송체 유비퀴논 및 시토크롬 c가 포함됩니다.
ETC에는 두 가지 전자 전달 경로가 있습니다. NADH를 기질로 하는 복합체 I/III/IV와 숙신산을 기질로 하는 복합체 II/III/IV입니다.
전자 흐름은 내막을 가로지르는 양성자 구배의 생성과 결합되며 양성자 구배에 축적된 에너지는 복합 V(ATP 합성효소)에 의해 ATP를 생성하는 데 사용됩니다.
글루타치온 대사 표적화: 항암 치료의 범죄 파트너 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6724225/#B43-nutritions-11-01926
글루타치온(GSH)은 세포 내부에 편재되어 있는 주된 저분자량 항산화제입니다. 세포 GSH의 정상 상태 수준은 합성, 가수분해, 이황화글루타티온(GSSG)의 재활용 사이의 균형뿐만 아니라 환원, 산화 또는 접합된 형태의 세포 압출에 의존합니다. 암세포의 전형적인 증가된 산화 스트레스는 글루타티온 수치의 증가를 동반하여 성장 이점과 다수의 화학요법제에 대한 내성을 부여합니다. 글루타티온 대사를 표적으로 하는 것은 암 치료를 위해 광범위하게 조사되었지만 단일 치료 전략으로서의 GSH 고갈은 조합 접근법과 비교할 때 크게 효과가 없었습니다. 이번 리뷰에서는 우리는 글루타티온 대사의 여러 단계를 방해하는 것이 치료 목적으로 어떻게 이용될 수 있는지에 초점을 맞춰 종양 발달 및 진행에서 글루타티온의 역할을 정황합니다.
천연 화합물에 의한 암 항산화 방어 억제 https://www.oncotarget.com/article/13723/text/
암 줄기 세포를 표적으로 하는 대사 기반 치료 전략 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6438930/
암 이질성은 질병 진행 및 치료 실패의 주요 원인을 구성합니다. 종양은 기능적으로 다양한 하위 집단으로 구성되며, 암 줄기 세포(CSC)가 이 이질성의 근원입니다. 이들 세포는 생체내 종양원성과 전이 가능성을 갖고 있고, 화학요법에서 생존하고 재발을 유도하기 때문에, 이 세포를 제거하는 것이 환자의 장기 생존을 달성하는 유일한 방법일 수 있습니다. 지난 몇 년 동안 이 분야의 큰 발전 덕분에 우리는 이제 세포 대사와 줄기세포가 정상적인 발달과 암에 밀접하게 얽혀 있다는 것을 알고 있습니다. 실제로, CSC는 그들의 우세한 대사 표현형이 종양 개체, 환자 및 종양 내의 서브클론에 따라 다르지만 더 분화된 자손과 비교하여 뚜렷한 대사 기능을 보여줍니다. 포도당 대사에 초점을 맞춘 초기 작업에 이어, 현재 연구는 산화 환원 상태, 지질 대사 및 아미노산 또는 케톤체와 같은 대체 연료의 사용 측면에서 CSC 대사의 특성을 공개했습니다.
Ferroptosis: 과거, 현재 및 미래 https://www.nature.com/articles/s41419-020-2298-2
Ferroptosis는 최근 몇 년 동안 발견된 새로운 유형의 세포 사멸이며 일반적으로 세포 사멸 과정에서 다량의 철 축적 및 지질 과산화를 동반합니다. ferroptosis의 발생은 철 의존적입니다. 페롭토시스 유도 인자는 다양한 경로를 통해 글루타티온 과산화효소에 직간접적으로 영향을 미쳐 항산화 능력이 감소하고 세포 내 지질 활성 산소 종(ROS)이 축적되어 궁극적으로 산화적 세포 사멸을 초래할 수 있습니다.
암의 산화 환원 및 대사 회로 https://www.frontiersin.org/research-topics/6407/redox-and-metabolic-circuits-in-cancer
'대사' 카테고리의 다른 글
| 췌장암에서 기능 장애 지방 조직의 역할: 분자적 관점 (0) | 2021.08.10 |
|---|---|
| ⚡지방산 산화 경로 FAO-건강한 삶 (0) | 2021.08.09 |
| 암 대사: HIF, c-Myc and p53 (0) | 2021.08.09 |
| 암에서 변화된 에너지대사 (0) | 2021.08.09 |
| Out of Warburg effect: 종양 특이적 대사 및 조절 장애 pH를 표적 (0) | 2021.08.09 |