https://www.sciencedirect.com/science/article/pii/S1044579X20300948
Repurposing of drugs: An attractive pharmacological strategy for cancer therapeutics
Human malignancies are one of the major health-related issues though out the world and anticipated to rise in the future. The development of novel dru…
www.sciencedirect.com
Repurposing of drugs:
An attractive pharmacological strategy for cancer therapeutics

인간 악성종양에 대한 항당뇨병제/약물의 역할
비구아나이드인 메트포르민
티아졸리딘디온(TZD),
즉 트로글리타존(TGZ), 피오글리타존(PGZ) 및 로지글리타존(RGZ)은 당뇨병 환자의 혈당 농도를 조절하는 데 사용되는 합성 증식제 활성화 수용체-감마(PPAR-γ) 작용제이지만 간독성으로 인해 TGZ는 중단되었습니다.
이 TZD는 또한 항암 활성에 대해 연구되었습니다. 그들은 PPAR-γ에 결합하고 활성화하여 세포 성장, 이동, 염증, 침습을 감소시키고 암세포의 분화 및 세포 사멸을 증가시킵니다.
PGZ는 배양에서 원발성 지방육종 세포의 증식을 차단하고 분화를 일으키는 것으로 나타났으며[ 48 ] 유방암 세포에서 성장 정지 및 분화를 일으키는 것으로 나타났으며 연골육종, 식도암, 위암 및 간암과 같은 다양한 암에서 세포자멸사를 일으키는 것으로 나타났습니다
RGZ에 의한 PTEN의 과발현은 간세포 암종(HCC) 세포의 5-FU 억제 세포 성장을 향상시킵니다[ 57]
13,197명의 환자를 TZD(PGZ: n = 3,710 및 RGZ: n = 9,487)로 등록하고 12,359명을 위약으로 등록한 22건의 RCT에 대한 메타 분석에서 암 유병률이 유의하게 감소한 것으로 나타났습니다.
하위 그룹에 대한 추가 분석은 부위 특이적 악성 종양의 감소를 보여주었습니다.
예를 들어, PGZ가 아닌 RGZ는 대장암 위험을 유의하게 감소시키는 것과 관련이 있었습니다. 반대로 PGZ는 RGZ가 아닌 유방암의 유의한 감소와 관련이 있었습니다. [ 59].
SGLT2(Sodium-glucose cotransporter-2) 억제제는 신세뇨관에서 SGLT2 수용체를 억제하여 신장에서 혈장으로의 포도당 재흡수를 제한하는 항당뇨병 약물 계열에 속합니다.
SGLT2 억제제의 일반적인 예는 다파글리플로진(DAPA), 카나글리플로진(CANA) 및 엠파글리플로진입니다.
최근에 SGLT2 억제제가 잠재적으로 포도당 흡수 차단을 통해 췌장암 성장을 감소시킬 수 있는 전립선 및 췌장 종양 조직에서 SGLT2의 강력한 발현이 관찰되었습니다.
또 다른 보고서는 CANA가 CDK1, CDK2, Cyclin B1 및 CDC25C의 하향 조절과 CHK1 및 p21의 상향 조절을 일으켜 HCC 세포에서 G2/M 정지를 유도함으로써 혈관신생을 독점적으로 약화시키고 SGLT2를 발현하는 HCC의 종양 성장을 억제한다는 것을 보여주었습니다. 67]
반면 Hung M은 CANA가 HCC에서 WNT/β-카테닌 신호전달 경로를 억제 하고 시험관내 및 생체내 성장 에 영향을 미치고 [ 68 ] AMPK의 인산화를 강화하고 mTOR 신호전달을 억제함으로써 결장암 세포의 성장을 지연 시킨다는 것을 보여주었습니다 .
CANA는 또한 단일 제제로 및/또는 방사선 및 화학요법(도세탁셀)과 함께
미토콘드리아 복합체-I 호흡, 지방 생성 및 ATP를 감소시키고 AMPK의 인산화를 향상시켜
폐암 및 전립선암 세포의 세포 성장 및 클론 생성 능력을 방해하는 것으로 나타났습니다.
다파글리플로진은 당뇨병 치료제로 승인된 최초의 SGLT2 억제제였다. 암과 관련된 DAPA에 대한 실험 및 역학 데이터는 제한적입니다. Saito T는 DAPA로 처리한 결장암 세포에서 세포 사멸과 무관한 세포 사멸을 입증한 반면 [ 70 ] 세포 주기와 세포 사멸을 조절하는 정상 인간 신장 세포보다 인간 신장 세포 암종 세포(RCC)에 더 높은 세포 독성 효과를 발휘하는 것으로 나타났습니다. 종양 성장 억제 및 생체 내 SGLT2 발현 감소 [ 71].
SGLT2 억제제 이프라글리플로진은 막 과분극과 미토콘드리아 기능 장애를 유발하여 유방암에서 세포자멸사를 유발하는 것으로 나타났습니다.
빌다글립틴, 시타글립틴 및 삭사글립틴과 같은 DPP4 억제제는 포도당 항상성에 중요한 호르몬인 글루카곤 유사 펩티드-1(GLP-1)의 분해를 방지하지만 항암 활성도 있는 것으로 밝혀졌습니다.
빌다글립틴은 대식세포 매개 NK 세포 활성을 통해 폐암 성장을 억제했습니다[ 82 ].
빌다글립틴(가브스) 치료는 자가포식을 유의하게 억제하고 세포 주기 조절인자 pCDC2를 억제하며 세포자멸사를 증가시켜 마우스에서 폐 전이의 발병률과 성장을 감소시켰습니다[ 83 ].
또한 쥐에서 고지방식이로 유발된 간세포암종을 예방하고[ 84 ] 마우스에서 종양 혈관신생과 간세포암종의 종양 성장을 억제했습니다[ 85 ]. 1 번 테이블다양한 항당뇨병 약물과 그 분자 표적을 요약합니다.
. 표 2 는 이들 약물의 조합과 인간 암에 대한 효과를 요약한 것입니다.

그림 2 . 인간 악성 종양에 대한 디펩티딜 펩티다제 4 억제제.
세린 프로테아제 DPP4는 GLP-1 및 GIP(인크레틴)를 비활성화합니다. DPP4 억제제는 DPP4의 효소 활성을 방해하고 인크레틴의 분해를 억제하여 혈당을 낮추어 암세포의 성장을 억제합니다.
인간 악성 종양에 대한 항균제/약물의 역할
안트라사이클린 약물은 종양 생물학에 적용하기 위해 광범위하게 연구됩니다. 일반적으로 사용되는 안트라사이클린 약물은 독소루비신, 다우노루비신, 이다루비신, 에피루비신, 미톡산트론이며 고형암 및 혈액암에서 광범위하게 테스트됩니다[ [88] , [89] , [90] ].
독시사이클린은 전이성 암세포 성장을 감소시키고, 췌장 종양 이종이식편의 80% 감소, 유방암 골 전이의 60-80% 감소를 감소시키는 것으로 보고되었습니다 .
줄기세포 표지자 CD44의 현저한 감소가 관찰된 반면 미토콘드리아, 증식 세포자멸사 및 혈관신생에 대한 다른 표지자는 변하지 않았습니다[ 92 ].
따라서 독시사이클린이 암 줄기 세포(CSC)를 특이적으로 표적으로 한다는 것을 시사합니다.
그 후 Fransesco 등은 독시사이클린과 비타민 C 조합을 테스트하여 CSC를 근절했습니다.
그들은 또한 독시사이클린 내성 CSC에 대한 이리노테칸, 클로로퀸, 소라페닙, 니클로사미드, 아토바쿠온 및 스티리펜톨의 효과를 연구하고 독시사이클린 내성 세포에 대한 대안을 보고했습니다[ 93 ].
Fiorillo et al.은 유방 암 줄기세포에 아지트로마이신과 함께 조합을 사용하고 저농도에서 더 효과적인 치료법을 발견했습니다[ 94].
5 . 인간 악성 종양에 대한 항진균제/약물의 역할
이트라코나졸은 광범위의 항 종양 효과에 대해 검토되고 트리아 항진균제 인 시험 관내에서 뿐만 아니라 생체 내에서 . Hedgehog 경로를 표적으로 하고, 혈관신생을 억제하고, 자가포식을 유도하고, 다른 종양에서 약물 내성을 감소시키는 것으로 보고되었습니다.
경구용 항진균제인 티아벤다졸(TBZ)은 잠재적으로 새로운 혈관 형성을 억제합니다. 전임상 섬유육종 이종이식편에서 TBZ는 종양 크기를 감소시키고 혈관 교란제로 작용하는 것으로 보고되었습니다[
Griseofulvin은 여러 림프종과 다발성 골수종 세포에서 예정된 세포 사멸을 유도합니다[ 105 ].
Clotrimazole은 교모세포종 세포에서 세포 이동 및 침습을 표적으로 합니다.
합성 살균제인 Ciclopirox(CPX)는 mTOR 독립 경로를 통해 p53 null HeLa 세포에서 노화를 유발했습니다
이는 CDC-CDK 분해, Bcl-xL의 하향 조절 및 카스파제 의존성 경로의 활성화에 의해 유방, 결장 및 횡문근육종에서 세포자멸사를 유도합니다[ 118 ].
ethacrynic acid가 간암에서 상승적인 항암 활성을 나타내었지만 CPX의 낮은 농도는 암세포뿐만 아니라 정상 세포에도 독성이 있다고 보고했습니다[ 119 ].
난노시스틴 A는 결장암과 유방암 세포에서 항암 활성을 보였다.
6 . 인간 악성 종양에 대한 항염증제/약물의 역할
여러 NSAID의 고용량은 종양 세포의 증식을 억제하고 세포 사멸을 증가시키는 것으로 보고되어 항암 치료에 대해 평가할 수 있습니다.
메타 분석에서 NSAID는 항종양 효과가 있고 전이 확산을 감소시키는 것으로 나타났습니다[ 122 ].
아스피린은 1968년부터 항암 특성에 대해 광범위하게 연구되었습니다. 아스피린의 작용 기전은 COX 의존적이고 독립적인 경로를 포함합니다.
결장직장암[ 123 ] 및 식도암[ 124 ] 에서 사이클로옥시게나제(COX) 활성 억제,
골육종에서 NF-κB 전사 활성 억제 [ 124 ]를 포함합니다. 125 ], COX-2 유전자 전사 [ 126 ],
전립선암에서 IκB 키나아제-β 억제 [ 127 ], 포유동물의 라파마이신 표적 변경(mTOR) 신호전달 및 결장직장암에서 AMPK 활성화 [ 128 ] 및 기타 기전이 밝혀졌습니다.
COX는 종양 미세 환경에서 항암 면역을 억제하는 골수 유래 억제 세포(MDSC) 및 조절 T 세포(Treg)의 확장을 강화하기 위해 PGE2의 생성을 유도합니다[ 135]. 따라서 COXs의 차단은 MDSC의 확장을 억제할 수 있습니다.
아스피린을 통한 COX 활성 차단은 CXCL9/10 및 CXCL10의 분비를 증가시켜 자연 살해 세포 및 세포독성 T 림프구에 관여하고 PD-L1, PD-L2, CTLA4와 같은 면역 억제 분자의 발현을 약화시킵니다( 그림 4 ) [ 136 ] 아스피린은 M1 대식세포 분극과 M2 대식세포로의 전환을 억제하여 면역 반응을 억제합니다.
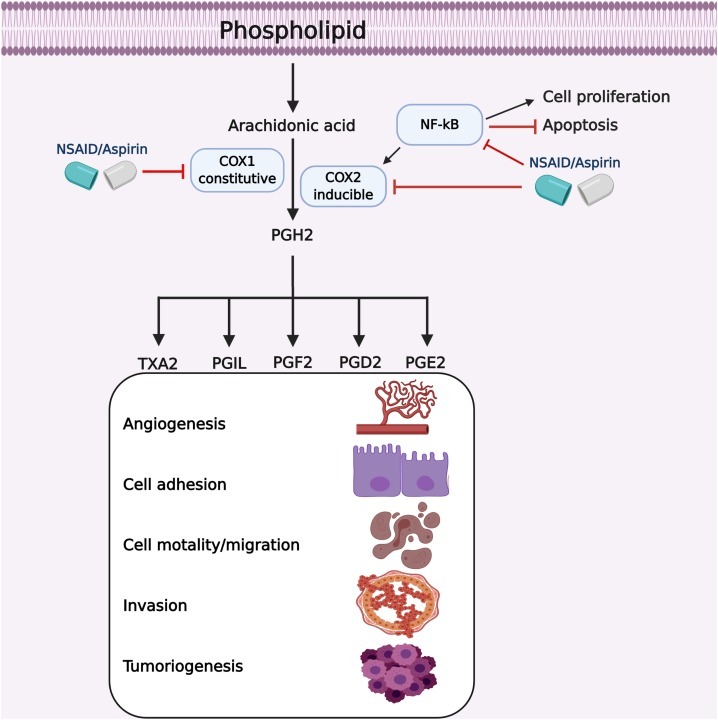
그림 3 . 인간 악성 종양에 대한 COX 억제제의 작용 메커니즘.
COX는 아라키돈산으로부터 프로스타글란딘 생성에 중요합니다. 아스피린에 의한 COXs 활성 억제는 프로스타글란딘 합성을 억제하고 혈관 신생, 이동, 침습 및 종양 형성을 억제합니다.
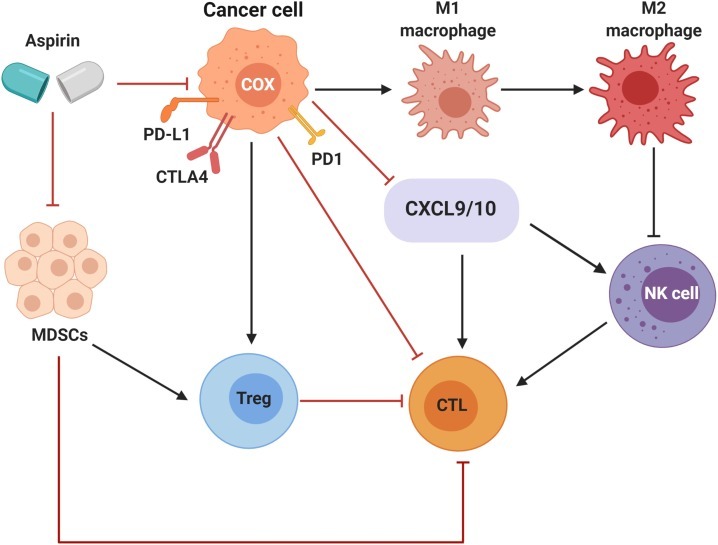
그림 4 . 항종양 면역 반응을 높이는 아스피린의 메커니즘.
아스피린은 COX 활성을 억제하여 골수 유래 억제 세포, 조절 T 세포(Treg) 및 암 촉진 대식세포(M1 및 M2)의 억제를 통해 항암 면역 반응을 촉진합니다. 아스피린은 또한 암세포에서 면역억제 분자(CTLA4, PD-L1, PD-1)의 발현을 제한합니다.
이부프로펜은 COX 의존 기전과 함께 암세포의 성장을 억제하는 COX 독립적 기전도 가지고 있습니다. Ibuprofen은 결장암 형성의 쥐 모델에서 peroxisome PPARγ의 직접적인 리간드로 확인되었으며, 이는 항세포자멸사 전사인자 NfκB의 하향조절을 유도하고 세포자멸사를 유도합니다[ 146 ]. 이부프로펜은 또한 대장암에 대해 아스피린보다 안전한 화학 예방제인 것으로 밝혀졌습니다[ 147 ].
Diclofenac은 자궁 경부암 세포에서 고유 한 세포 사멸 경로의 유도를 유발합니다.
Diclofenac은 또한 혈관 내피 성장 인자(VEGF) 수준과 아르기나제 활성을 조절하여 쥐에서 췌장암의 종양 성장을 억제하는 것으로 나타났습니다[ 151]
교모세포종 세포에서 Wnt/β-카테닌/Tcf 신호전달의 활성화도 억제합니다[ 152 ]. 항
인도메타신은 부분적으로 Bcl-2 발현의 하향 조절을 통해 원발성 만성 골수성 백혈병(CML) 및 K562 세포에서 시간 및 용량 의존적 방식으로 세포자멸사를 유도하면서 세포 증식을 억제하는 것으로 관찰되었습니다
셀레콕시브, 나프록센, 피록시캄
코르티손, 프레드니손, 덱사메타손과 같은 글루코코르티코이드의 사용이 입증되었습니다
7 . 인간 악성 종양에 대한 중추 신경계(CNS)를 표적으로 하는 항정신병제 또는 약물의 역할
도파민 수용체는 apoptosis, autophagy 및 ferroptosis를 유도하는 것으로 보고됩니다. 5개의 도파민 수용체 중 DR-2는 암세포에서 과발현되는 것으로 밝혀졌습니다.
Lamotrigine 은 유방암에서 잘 알려진 종양 억제 인자인 FoxO3a의 발현을 증가시켜 사이클린과 CDK 단백질을 표적으로 하여 세포 성장을 지연시키고 G 0 -G 1 단계 에서 세포를 정지시킵니다
Trifluoperazine(TFP)은 정신분열증 및 정신병적 장애의 치료를 위해 FDA 승인을 받았습니다. 최근 TFP는 다양한 인간 악성 종양에 대해 재배치되었습니다..
이는 칼모듈린 서브타입 2에 대한 결합을 통해 IP3R 채널에서 칼슘 이온을 방출함으로써 교모세포종에서 항증식 활성을 보였다[ 180 ].
TFP는 폐 암 줄기세포에서 제피티닙 내성을 극복하기 위해 Wnt/β-카테닌 경로를 억제하는 것으로 나타났습니다[ 181 ].
Pimozide는 각각 STAT3 및 STAT5 신호전달 캐스케이드를 차단함으로써 간세포암종 및 유방암 세포에서 항암 효과를 나타냈다.
Penfluridol은 Integrin 경로를 억제하여 원발성 및 전이성 TNBC의 성장을 억제하는 것으로 보고되었습니다[ 186 ].
Valproic acid는 또한 뇌 전이가 있는 유방암 환자에서 항종양 활성을 나타내는 것으로 보고되었습니다
페노이틴은 항암 가능성이 있는 또 다른 항간질제입니다. 시험관 내 및 이종이식편 모두에서 종양 성장을 감소시키고 세포자멸사를 증가시키는 것으로 나타났습니다 [ 188 ]. 그러나 페노이틴은 DAPT와 병용하여 유방암 세포에서 상승적인 반응을 나타내지 않았습니다. 따라서 이 조합이 화학요법에 유익하지 않음을 시사합니다.
모르핀은 폐암 세포에서 감소된 세포 성장으로 관찰되었습니다[ 191 ]. 그러나 수행된 연구에서는 세포 증식을 촉진하고 유방암의 진행을 허용한다고 제안했습니다[ 192 ].
카페인은 CNS의 각성제 역할을 하며 카페인 섭취는 암 위험을 감소시키는 것으로 알려져 있습니다. 폐암에서 시스플라틴과 함께 카페인은 ATM, caspase-3를 활성화하고 ATR을 억제하여 세포를 세포 사멸시킵니다[ 195 ]. 위암에서도 유사한 결과가 관찰되었습니다[ 196 ]. 카페인과 히드라존의 새로운 복합체는 백혈병, 폐암, 결장직장암 세포주에서 항암 활성을 나타냅니다[ 197 ].
8 . 인간 악성종양에서 포스포디에스테라제(PDE) 억제제와 ER 길항제의 역할
PDE 억제제는 임상적으로 발기부전 치료에 사용됩니다.
다양한 암에서 PDE5 발현이 증가하기 때문에; PDE5 억제제는 항암제로 용도가 변경됩니다.
일반적으로 투여되는 억제제는 sildenafil, vardenafil 및 tadalafil입니다.
표준 화학요법 약물과 함께 실데나필은 방광 및 췌장 종양 세포의 성장을 억제했습니다[ 202 ].
셀레콕시브와 조합된 PDE5 억제제는 mTOR를 억제하고 자가포식을 증가시키며 ER 스트레스 반응을 유도함으로써 신경교종 세포의 상승적인 성장 억제를 나타냈습니다[ 203 ].
타다라필이 말기 골수종 및 HNSCC 환자에서 MDSC를 감소시켰다고 보고했습니다[ 206 , 207]. 조골 세포에서 Aromatase를 감소시키고 안드로겐을 증가시켜 PDE5 억제제가 스테로이드 호르몬 경로를 표적으로 할 수 있음을 시사합니다.
Vardenafil은 폐암[ 208 ] 및 뇌종양[ 209 ] 에서 세포내이입을 통해 trastuzumab의 흡수를 증가시켰습니다 .
Clomifene은 여성의 다낭성 난소 증후군과 남성의 성선기능저하증 치료를 위한 선택적 에스트로겐 수용체(ER) 길항제 중 하나입니다[ 215 ].
Clomifene은 ER의 길항제로 사용됩니다. Zheng과 동료들은 구조 기반 가상 리간드 스크리닝 접근법을 통해 돌연변이 이소시트레이트 탈수소효소 1(IDH1)의 새로운 억제제로서 클로미펜을 발견했습니다.
IDH1 돌연변이가 있는 신경교종 암세포 는 시험관 내 및 생체 내에서 클로미펜에 노출될 때 세포자멸사 증가를 나타냅니다
네프론과 간세포에 독성을 일으키지 않습니다.
9 . 인간 악성 종양에 대한 Antabuse 약물의 역할
Disulfiram
10 . 인간 악성 종양에 대한 항기생충제의 역할
MBZ와 ABZ는 모두 in vitro 및 in vivo 연구 에서 부신피질암, 결장암, 교모세포종 및 난소암에서 항암 활성을 나타냅니다 [ [227] , [228] , [229] ].
폐암에서 MBZ는 튜불린의 중합을 억제하는 반면 흑색종 세포에서는 BCL-2 비활성화에 의한 세포자멸사를 촉진합니다.
간세포암종 및 진행성 대장암 환자에서 ABZ 치료는 환자 10명 중 3명에서 호중구감소증과 같은 부작용과 함께 항종양 효능을 보였다[ 230].
담관암에서 MBZ는 caspase-3 발현의 증가로 세포 증식을 억제하여 세포 사멸을 유도합니다[ 231 ].
또 다른 연구에서는 MBZ가 약물 전달체 발현을 감소시키고 위암의 복수에서 MDR 유전자 발현을 억제한다는 것을 보여주었습니다[ 232 ].
거대고리 락톤인 이버멕틴(Ivermectin)은 낮은 농도에서 Wnt-TCF에 대한 길항제 역할을 하며 결장암에서 β-카테닌과 사이클린 D의 수준을 억제합니다[ 233 ].
CSC에 대한 Ivermectin 효과는 유방암의 CSC를 우선적으로 표적화하고 만능 및 자가 재생 마커를 하향 조절함을 시사합니다. 이것은 Ivermectin이 암 치료를 위한 강력한 후보가 될 수 있음을 나타냅니다[ 240 ].
수라민은 전이암 환자 15명에게 투여했을 때 성장인자가 각각의 수용체에 결합하는 것을 억제해 종양세포의 성장을 억제했다. 그러나 환자들은 또한 단백뇨, 가역적 간 기능 검사 이상, 소용돌이 각막병증, 부신 기능 부전, 글리코사미노글리칸 수치 증가 및 다발성 신경병증과 같은 독성을 경험했습니다
Nitazoxanide는 c-MYC 억제 및 apoptosis를 통해 종양 성장을 감소시키는 thiazolide 화합물입니다. 상피암 세포에서 mTOR 억제를 통해 자가포식을 자극합니다. 결장암에서는 항기생충 효과를 반영하여 핵 응축과 DNA 단편화에 의해 세포자멸사를 유도했습니다[ 242 ].
클리오퀴놀은 골수종과 백혈병 세포에서 HDAC의 발현을 하향 조절하는 것으로 나타났습니다. 도킹 연구에 따르면 클리오퀴놀은 HDAC의 활성 주머니에 적합합니다. HDAC의 하향 조절은 p21, p53의 발현, 세포 주기 정지 및 세포 사멸을 초래했습니다 [ 243].
항종양 활성을 나타내는 항기생충제는 수용성이 낮고 생체이용률이 낮습니다. 따라서 시클로덱스트린 포접 복합체를 사용하여 알벤다졸과 드리벤다졸의 특성이 향상되었으며 유방암에서 항종양 활성이 개선되었습니다[ 244 , 245 ].
Atovaquone은 산소 소비를 억제하고 산화 스트레스를 증가시키면서 MCF 7에서 미토콘드리아 복합체 III의 CoQ10 의존성을 목표로 하는 유비퀴틴화 유사체입니다[ 246 ].
유사한 항종양 활성이 RCC, 자궁경부암 및 갑상선암에서 관찰되었습니다[ [247] , [248] , [249]].
또한 미토콘드리아 호흡과 STAT3 발현을 감소시켜 독소루비신의 억제 효과를 증가시키는 것으로 나타났습니다[ 249 ].
FDA 승인을 받은 또 다른 약물인 칼륨 안티모닐 타르트레이트는 NSCLC 세포에서 혈관신생을 억제할 뿐만 아니라 이종이식편에서 시스플라틴과 함께 종양 무게, 부피 및 상승 효과를 감소시켰습니다. 또한 HUVEC에서 티로신 키나제, Src의 활성화 및 국소 접착 키나제를 억제했습니다[ 250 ]. 따라서 이러한 항기생충제의 항종양 효과에 대한 인식은 약물의 용도 변경을 위한 문을 열었습니다.
클로로퀸(CQ)은 자가포식의 좋은 억제제이며 잘 알려진 항말라리아 약물입니다. 많은 수의 새로운 증거가 암 환자의 임상 결과를 개선하기 위해 자가포식을 억제한다는 아이디어를 뒷받침합니다.
Autophagy는 종양 세포 생존에 중요한 역할을 합니다.
Valproic acid는 t(8;21) 백혈병 세포와 기본 샘플에서 CQ와 함께 사용되었습니다. 이 치료는 이러한 백혈병 세포의 생존력을 상승적으로 감소시켰습니다.
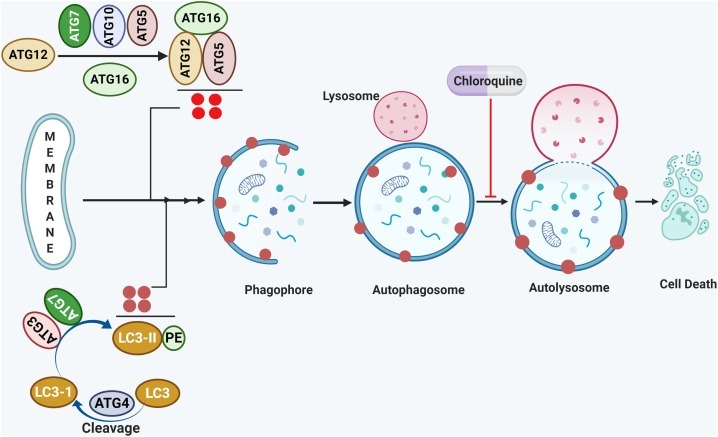
그림 5 . 인간 암에서 autophagy의 억제:
Autophagy는 LC3-II의 생성과 ATG5, ATG12, ATG16의 복합체를 포함하는 복잡한 다단계 과정으로 autophagy 과정을 시작하여 phagophore, autophagosome, autolysosome을 형성합니다. 클로로퀸(CQ)은 리소좀이 자가포식소체에 융합되는 것을 방지하고 자가포식소체로 들어가 암세포를 사멸시키는 것을 방지합니다.
11 . 인간 악성 종양에 대한 심혈관 제제 또는 약물의 역할
두 가지 심장 배당체, 즉 디곡시제닌과 디곡신은 종종 심부전 위험이 높은 환자를 치료하거나 심박수를 줄이는 데 사용되며 항암 효과도 있는 것으로 나타났습니다.
11.1 . 이뇨제
나트륨-칼륨 펌프 차단제인 Furosemide는 고농도에서 방광암의 다제 내성을 역전시키는 것으로 보고되었습니다.
Bumetanide는 나트륨-칼륨 및 염화물 이온의 동시 수송을 억제하는 이뇨제로 사용됩니다. 누드 마우스에서 고급 신경교종의 침입을 줄이고 Caspase-3,-8을 활성화하여 세포 사멸을 활성화했습니다
11.2 . 베타 차단제
프로프라놀롤은 세포 증식, 침습, 혈관신생, 전이를 표적으로 하고 다양한 암세포에서 전통적인 화학요법제를 민감하게 한다고 보고했습니다[ 276 ].
선택적 베타 차단제인 Betaxolol은 폐암 세포에서 항종양 반응을 보였습니다.
Atenolol은 유방암에 대한 메트포르민의 항암 활성을 향상시켰습니다[ 279 ].
11.3 . 스타틴
스타틴은 geranylgeranyl pyrophosphate, farnesyl pyrophosphate 및 isoprenyl 그룹의 가용성을 제한하는 mevalonate 경로에서 HMG-CoA 환원효소를 억제하여 혈중 콜레스테롤을 감소시키는 것으로 나타났습니다.
이는 생존 신호 전달 경로와 함께 세포 성장, 이동과 관련된 신호 G 단백질의 변형을 초래하므로 스타틴의 항암 활성에 영향을 미칩니다.
실험적으로 스타틴은 암세포주에서 증식을 지연시키는 것으로 나타났습니다.
예를 들어, lovastatin, fluvastatin, simvastatin은 전립선암에서 CDK2-CyclinE 의존성 G1/S 전환을 차단하는 것으로 나타났습니다[ 283].
스타틴은 Bcl-xl 및 Bcl-2를 포함한 항-세포사멸 단백질의 단백질 발현을 감소시키고[ 284 ] Bax를 포함하는 세포사멸 촉진 단백질의 자극 을 감소시키는 것으로 나타 났습니다[ 285 ].
스타틴 치료는 높은 스타틴 용량에서 마우스의 종양 혈관 생성을 감소시키는 것으로 나타났습니다,
그들은 integrin의 결합 능력을 억제하여 ECM 단백질에 대한 악성 세포의 접착력을 차단합니다
11.4 . 안지오텐신 전환 효소(ACE) 억제제 및 안지오텐신 II 수용체 차단제(ARB)
Captopril은 apoptosis를 유도하고 증식과 혈관신생을 억제하여 폐암과 대장암을 감소시키는 것으로 보고된 ACE 억제제이다,
암 환경 주변의 다양한 세포에서 레닌의 과발현이 관찰됩니다. 이는 암 염증, 혈관신생, 세포자멸사 및 세포 증식에 중요한 역할을 합니다
11.5 . 칼슘 채널 차단제
니페디핀은 교모세포종에서 시스플라틴의 세포사멸 촉진 효과를 향상시키는 것으로 나타났습니다[ 309 ].
Verapamil은 마우스 모델에서 유방암과 수막종에 대한 항증식 효과를 보였습니다[ 310 , 311 ]. 또한 진행성 NSCLC에서 이포스파미드 및 빈데신과 함께 사용할 때 환자의 전체 생존율을 증가시켰습니다[ 312]
그러나 베라파밀의 항암 특성도 논란의 여지가 있습니다.
암로디핀과 니카르디핀은 표피양암 세포에서 항증식 효과를 보인 반면, 베라파밀과 니페디핀은 성장을 방해하지 않았다.
Verapamil은 3상 시험에서 표준 약물과 함께 다발성 골수종에 유익한 효과가 없었습니다[ 314 ]. 메타 분석에 따르면 칼슘 채널 차단제 사용자는 일반적으로 피부암 위험이 증가합니다[ 315 ]. 현재, 암에 대한 베라파밀의 사용과 관련된 많은 시험이 피험자를 모집하고 있습니다.
11.6 . 항협심증제
니트로글리세린은 심혈관 증상의 치료에 사용되는 혈관 확장제이지만 항암제로도 용도가 변경되었습니다.
Isosorbide 5-mononitrate와 isosorbide dinitrate는 용량 의존적으로 혈관신생을 억제하고 종양 성장을 감소시키는 다른 질산염 혈관 확장제입니다.
라놀라진은 협심증 치료제로 사용되는 전압 개폐 나트륨 채널(VGSC) 억제제이지만 항암 활성에 대한 실험적 증거가 있습니다.
또한, 라놀라진은 프로프라놀롤과 함께 유방암 세포의 침윤을 억제했습니다[ 321].
라놀라진의 항전이 효과는 전립선암의 생체 내 쥐 모델에서도 나타났습니다[ 322 ].
펜딜린(Fendiline)은 항암 활성의 실험적 증거를 보여주는 현재 철회된 항협심증 칼슘 채널 차단제입니다. 이것은 전립선 암 세포 [칼슘 이온의 세포 내 농도를 증가시키기 위해 도시되었다 (324) , 골육종 [ 325 ], 방광 암 전이 암 [ 326 ], 간암 [ 327] 그리고 이 증가는 암 신호에 필요한 많은 세포 과정을 방해합니다
'암치료' 카테고리의 다른 글
| ⚡링크--보조 암 치료로서 천연 보충제의 조합 (0) | 2021.08.18 |
|---|---|
| Synergies (암 치료에 시너지효과를 일으키는 보충제들) (0) | 2021.08.18 |
| 암 치료에 대한 잠재적 보조제로서의 천연 화합물: 전임상 증거 (0) | 2021.08.09 |
| ⚡수명을 연장하는 암 치료-란야 (0) | 2021.08.09 |
| ⚡암 산화치료-란야 (0) | 2021.08.09 |