Multiple cell death modalities and their key features (Review)
https://www.spandidos-publications.com/10.3892/wasj.2020.40
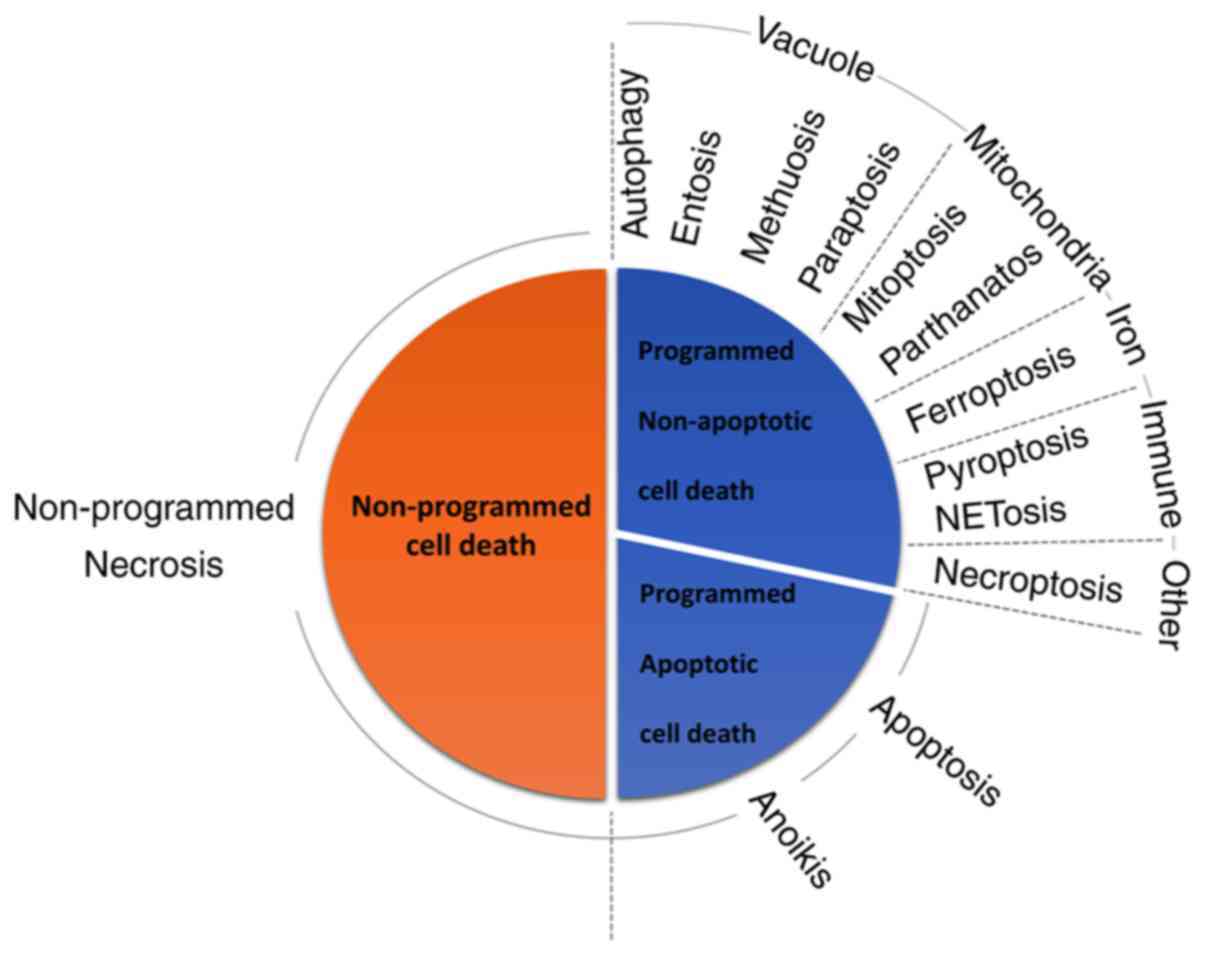
그림 1 - 세포 사멸 분류.
세포 사멸 개체는 신호 의존성, 형태학적 특성 및 분자 메커니즘에 따라 분류됩니다.

그림 2 - 각 세포 사멸의 일반적인 형태.
형태학적 변화는 세포 크기, 막 완전성, 염색질 밀도, 소기관 배열 및 액포의 존재에 중점을 둡니다.
(cell size, membrane integrity, chromatin density, organelle arrangement and presence of vacuoles.)
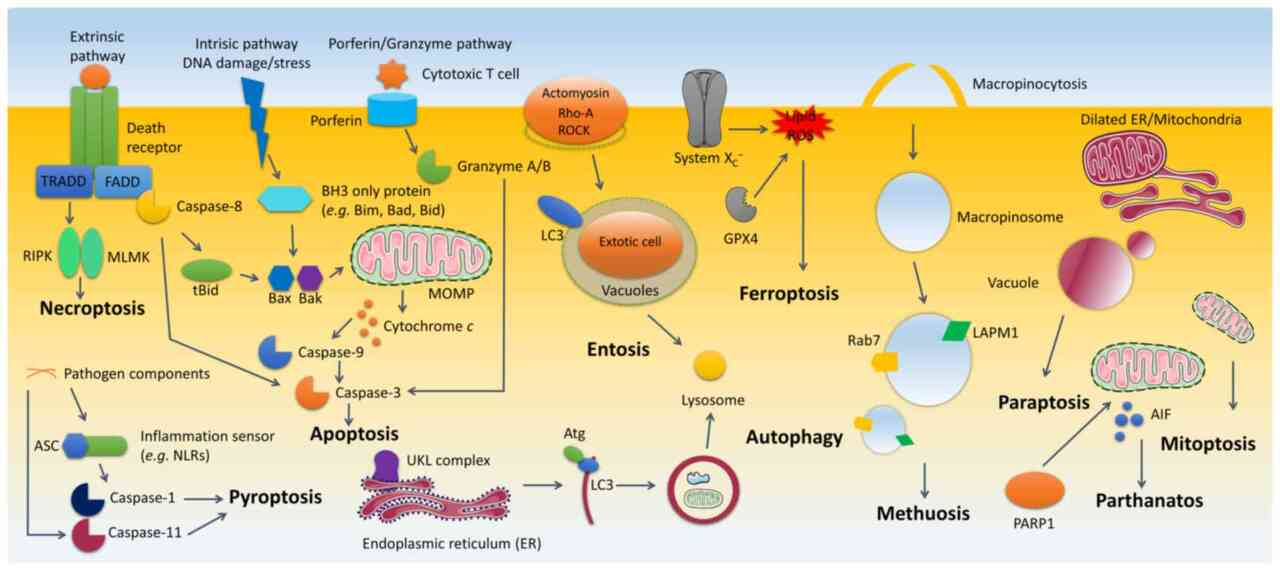
그림 3 - 세포 사멸 과정의 개요.
10가지 세포 사멸 양식(아폽토시스, 자가포식, 엔토시스, 뮤토시스, 파랍토시스, 유사분열, 파르타나토스,
페로프토시스, 파이롭토시스 및 necroptosis)이 제시됩니다.
(apoptosis, autophagy, entosis, methuosis, paraptosis, mitoptosis, parthanatos, ferroptosis, pyroptosis and necroptosis)
Anoikis는 부적절하거나 부적절한 세포-기질 상호작용에 의해 자극된다는 사실을 제외하고는 세포사멸과 동일한 신호 전달 경로를 공유합니다.
설명 메커니즘이 없는 세포 사멸 양식(괴사 및 NETosis)은 포함되지 않았습니다.
회색은 비기능성 분자를 나타냅니다. 화살표 방향은 인과 관계를 나타냅니다.
2. 프로그램되지 않은 세포 사멸
프로그램되지 않은 괴사
프로그램되지 않은 괴사는 감염, 독소 및 신체 손상과 같은 여러 외부 요인에 의해 자극되어 세포질 팽창과 같은 형태학적 변화[oncosis, Ca + 유입과 같은 이온 펌프의 중단으로 인한 사망 전 단계],
원형질막 파열 및 심한 염색질 응축 없이 세포내 소기관의 후속 손실, 그러나 무작위로 분해된 DNA 를 초래합니다( 그림 2 ).
프로그램되지 않은 괴사는 허혈, 외상 및 일부 형태의 신경변성에서 종종 관찰됩니다.
이것은 일반적으로 새로운 거대 분자 합성이 필요하지 않지만 최소한의 에너지를 필요로 하는 수동 프로세스로 간주됩니다.
괴사의 형태학적 특징을 기반으로 하여 젖산 탈수소효소(LDH) 활성 검출 및 세포 불투과성 DNA 결합 염료를 포함한 여러 방법이 일반적으로 세포 누출 및 막 투과성을 인증하는 데 사용됩니다( 표 I ).
3. 프로그램된 세포 사멸 세포 사멸
아폽토시스
아폽토시스는 엄격하게 제어되는 일련의 사건을 포함하며 세포 수축, 막 수포, 위치 소기관 손실, DNA 응축 및 단편화를 특징으로 합니다( 그림 2 ).
세 가지 신호 전달 경로가 세포 사멸을 유발하는 것으로 알려져 있습니다:
외인성(사멸 수용체) 경로, 내인성(미토콘드리아) 경로 및 퍼포린/그랜자임 경로 (perforin/granzyme pathway)( 그림 3 )
Anoikis는 본질적으로 apoptosis와 동일한 경로를 공유하는 특정 유형의 apoptosis입니다.
그러나 부족하거나 부적절한 세포-기질 상호작용에 의해 유발됩니다( 그림 3 ).
세포골격의 구조적 상태는 생존을 촉진하는 효과인 인테그린의 기능을 방해할 것으로 예상됩니다.
그러나, 세포 구조 변경과 세포자멸사 사이의 연결은 제대로 확인되지 않은 상태로 남아 있습니다.
(JNK) 신호전달은(BIM) 발현 및 (BMF) 인산화를 증가시켜 BAK/BAX 의존적 방식을 통한 효율적인 아노이키스에 필요하다는 것이 최근에 나타났습니다.
Vacuole-presenting cell death Autophagy
Autophagic 세포 사멸은 염색질 응축이 없을 때 큰 세포 내 소포, 원형질막 수포, 확대된 세포 소기관 및 세포질 소기관의 고갈의 출현을 특징으로 합니다( 그림 2 ).
주목할만한 것은 세포 과정에서 지렛대 역할을 한다는 것입니다.
자가포식은 보호 반응으로 세포 스트레스에 따라 시작됩니다.
일단 세포 스트레스가 되돌릴 수 없으면, 세포는 과도한 수준의 자가포식을 통해서도 죽음을 맞이하게 됩니다.
자가포식에는 세 가지 형태가 있습니다:
매크로-자가포식( 그림 3 ),
마이크로-자가포식 및
샤페론 매개 자가포식.
macro-autophagic 과정은 잘 문서화되어 있습니다( 그림 3).
mivro자가포식에서 세포질 성분은 리소좀으로 직접 격리되며, 여기서 산성 가수분해효소는 분해를 추가로 중재합니다.
샤페론 매개 자가포식은 KFERQ 모티프(Lys-Phe-Glu-Arg-Gln) 함유 단백질을 선택적으로 표적화합니다.
이 단백질은 샤페론에 의해 인식될 수 있으며, 이후에 리소좀으로 포확되어 결국 분해됩니다.
미토콘드리아의 특정 분해를 미토파지 mitophagy라고 합니다.
외래 병원체의 선택적 자가포식을 제노파지(xenophagy)라고 합니다.
lipophagy, aggrephagy 및 lysophagy와 같은 다른 선택적 autophagy 형태도 있습니다 .
Entosis. 엔토시스(or cannibalism)는 세포 내 세포 형성이 특징입니다( 그림 2 ).
내부화 시, 엔토시스된 세포는 짧은 기간 동안 생존할 수 있습니다.
이 과정은 종종 리소좀 매개 분해 및 비-세포자멸사 세포 사멸이 뒤따르는 반면, 내부화된 세포의 일부는 스스로 빠져나오거나 숙주 세포에서 배출될 수 있습니다.
엔토시스는 인테그린-세포외 기질(ECM) 분리에 의해 유발되는 것으로 믿어집니다.
식균작용(phagocytosis)과 달리 엔토시스 세포의 삼켜짐은 RhoA 및 Rho 관련 코일 코일 함유 단백질 키나제(ROCK)를 통한 자기 제어 과정을 나타냅니다.
엔토시스 세포와 숙주 세포는 E-cadherin과 α-catenin 세포 접합 계면을 통해 서로 상호 작용합니다.
엔토시스 세포의 RhoA와 ROCK는 접합 경계면 반대편에 있는 세포 피질에서 액틴과 미오신 복합체(액토미오신)의 특정 축적을 유발하여 세포 내 세포 형성을 유도하는 불균형 수축력을 생성합니다.
그러나 기질 부착 상피 세포에서도 엔토시스가 관찰된다.
Wan et al은 미오신의 과활성화 또는 접촉 세포 사이의 조절 극성 단백질을 통한 불균형 미오신 활성화가 기질 부착 상피 세포에서 엔토시스의 추진력으로 작용한다고 제안했습니다(30). 삼켜진 후에는 자가포식 세포 사멸과 다른 리소좀 매개 분해가 뒤따릅니다.
Methuosis는 특히 Ras 과활성화 및 세포자멸사 손상을 동반하는 macropinosomes에서 파생된 큰 유체로 채워진 단일 막 액포의 대량 축적의 존재를 특징으로 하는 세포 사멸 유형을 나타냅니다.
흥미롭게도, 메튜오시스는 기존의 Ras-Raf-MEK-ERK 축 또는 클래스 III (PI3K) 신호 전달과 관련이 없습니다..
결과적인 형태는 세포 팽창 및 원형질막 완전성 손실의 방식으로 괴사와 유사합니다.
paraptosis의 특징은 확장된 소포체(ER) 또는 미토콘드리아( 그림 2 ) 에서 파생된 광범위한 세포질 공포화 입니다.
많은 연구에서 파라프토시스는 활성 산소종(ROS) 생성 및 ER에서 잘못 접힌 단백질의 축적, 공포화를 위해 ER 내강과 미토콘드리아를 팽창시키는 삼투압을 생성하는 미토콘드리아 Ca2+ 과부하와 관련이 있음을 나타냅니다.
현재 이용 가능한 증거에도 불구하고, paraptosis의 기본 분자 메커니즘은 아직 완전히 해결되지 않았습니다.
미토콘드리아 의존성 세포 사멸 Mitoptosis
미토파지(미토콘드리아의 자가포식 분해)와 달리 미토콘드리아 자살이라고도 알려진 Mitopsis는 미토콘드리아의 프로그램된 분열 및 융합 과정과 수반되는 아데노신 삼인산(ATP) 공급 중단을 나타냅니다.
결과적으로 Mitopsissms 세포자멸사와 자가포식 모두와 연관될 수 있습니다 .
분해된 미토콘드리아는 자가포식소체(autophagosome) 또는 미토콘드리아체(mitoptotic body)가 되어 세포에서 압출된다.
그런 의미에서 mitoptosis 자체는 cell death pathway가 아니라 mitochondrial death pathway입니다.
그러나 상승된 핵분열을 통한 광범위한 미토콘드리아 단편화는 결국 세포 사멸을 초래합니다.
기계적으로 말해서, BAX/BAK에 의해 유도된 미토콘드리아 외막 투과화mitochondrial outer membrane permeabilization(MOMP)는 미토콘드리아 내막 8a의 트랜스로카제translocase of inner mitochondrial membrane 8a (TIMM8a/DDP)라고 하는 미토콘드리아 막간 공간 단백질의 방출을 유발합니다.
DDP는 이후 세포질에서 DRP1에 결합합니다.
DDP와 DRP1 사이의 상호작용은 DRP1의 모집과 미토콘드리아에서의 체류로 이어져 미토콘드리아 분열과 마지막으로 Mitopsis을 유도합니다
Parthanatos는 미토콘드리아와 연결되어 있지만 카스파아제와 무관한 세포 사멸을 나타내며 PARP의 과활성화가 특징입니다.
PARP는 폴리(ADP-리보스)(PAR)의 합성을 매개하며, 이는 핵에서 세포질로 더 이동하고 특정 미토콘드리아 단백질에 결합한 다음 세포자멸사 유도 인자(AIF)를 방출합니다.
유리 AIF는 미토콘드리아에서 핵으로 이동합니다.
핵에서 AIF는 염색질 응축과 DNA 파손을 유도합니다.
세포 사멸 과정과 비교하여 PARP 절단보다는 온전한 PARP와 그 활성화가 필요합니다.
더욱이, 파르타나토스는 광범위한 카스파제 억제제에 의해 억제될 수 없습니다.
이는 caspases의 독립성을 증명합니다.
Parthanatos는 apoptotic body의 형성을 포함하지 않습니다.
또한, DNA 단편화는 세포자멸사에서 일반적으로 관찰되는 바와 같이 중소 규모보다는 대규모입니다( 그림 2 ).
PAR 축적, PARP-1 활성화 및 핵 AIF는 실제로 파르타나토스의 바이오마커로 사용됩니다.
철 의존성 세포 사멸 Ferroptosis
Ferroptosis는 일반적으로 수포가 없는 온전한 세포막과 염색질 응축이 없는 정상적인 크기의 핵을 갖는 정상으로 보이는 형태와 관련이 있지만, 크리스타가 감소하고 막이 붕괴되고 파열된 작은 미토콘드리아가 있습니다( 그림 2 ).
이것은 시스템 X C - 또는 글루타티온 퍼옥시다제 4(GPX4)의 결함을 통한 글루타티온 의존성 항산화 방어의 실패에 의해 시작됩니다
시스템 X C −세포외 시스틴을 세포로 수송한 다음 글루타티온(GSH) 합성을 위해 시스테인으로 변형됩니다.
GPX4는 글루타티온과 지질 과산화수소 사이의 반응을 직접 촉매하여 지질 과산화의 세포 수준을 감소시킬 수 있습니다.
GSH의 고갈 또는 GPX4의 억제는 지질 과산화수소 축적을 초래합니다.
유리 철은 Fenton 반응을 통해 지질 과산화수소와 상호 작용하여 지질 ROS를 형성합니다( 그림 3 ).
과도한 지질 ROS 생성은 결국 세포 사멸로 이어집니다.
면역 반응성 세포 사멸 Pyroptosis
Pyroptosis는 면역 세포에서 세포내 병원체를 인식할 때 일반적으로 발생하는 염증 형태의 프로그래밍된 세포 사멸입니다.
감염된 대식세포의 염증 센서[예: NOD-유사 수용체(NLR)]는 병원체의 플라젤린 성분을 인식하고 다중 단백질 복합 인플라마솜의 형성을 시작하여 이후에 카스파제-1을 활성화합니다 ( 그림 3 ).
활성화되면 caspase-1은 gasdermin D의 절단을 통해 막 기공 형성을 매개하여 세포막의 파열을 허용합니다.
이 과정은 또한 DNA 응축 및 단편화를 동반합니다( 그림 2 ).
또한 caspase-11은 세균성 지질다당류(LPS)에 의해 직접 활성화될 수 있으며 파이롭토시스(pyroptosis)를 유도합니다.
Neutrophil extracellular trap-associated cell death (NETosis).호중구 세포외 트랩 관련 세포 사멸(NETosis). 독특한 형태의 세포 사멸인 NETosis는 병원체 또는 그 구성 요소의 존재에 의해 시작되며 대부분 면역 세포, 특히 호중구에서 발생합니다.
호중구 내의 병원체가 인식되면 세포는 히스톤 변형, 염색질 탈축합 및 호중구 세포외 트랩[NET, 염색질 및 myeloperoxidase, neutrophil elastase, cathepsin G, lysozyme 및 defensins을 포함한 항균 성분으로 구성 ] 방출을 겪으며 이는 결국 세포 사멸이 발생합니다.
이 과정은 NADPH oxidase 4(NOX4), autophagy 및 peptidylarginine deiminase 4(PAD4) 의존 히스톤 시트룰린화에 의해 생성된 슈퍼옥사이드를 통해 촉진됩니다
다른 유형의 괴사
프로그램된 괴사라고도 알려진 Necroptosis는 여러 신호 경로를 통한 수용체 상호 작용 단백질 키나제(RIPK)의 활성화를 특징으로 합니다
RIPK는 다양한 세포 표면 수용체인 사멸 수용체(DR), 톨 유사 수용체(TLR) 및 T-세포 수용체(TCR)에서 거대분자 복합체로 모집되면 활성화됩니다( 그림 3 ).
RIPK1 및 RIPK3은 괴사체의 주요 구성요소로 기능합니다.
RIPK3은 인산화를 통해 다운스트림 분자 혼합 계통 키나제 도메인 유사 단백질(MLKL)을 추가로 활성화합니다.
이는 MLKL 올리고머화로 이어집니다. 올리고머화된 MLKL은 세포막에 삽입되어 세포막을 투과하여 결국 세포 사멸을 일으킵니다
Necroptosis는 막 파열과 세포 소기관의 손실을 동반한 괴사 형태를 나타냅니다( 그림 2 ).
********************************************************
https://journals.physiology.org/doi/pdf/10.1152/ajpheart.00259.2019

세포 사멸 메커니즘을 구별하고 식별하는 다양한 단계.
GPX4, glutathione peroxidase 4;
GSDMD, gasdermine D;
LC3BII microtubule-associated proteins 1A/1B light chain 3BII; MLKL, mixed-lineage kinase domain-like;
MTP, mitochondrial permeability transition pore;
NLPR3, NACHT, LRR, and PYD domainscontaining protein 3;
PARP, poly-ADP ribose polymerase;
RIP3, receptorinteracting protein kinase 3.
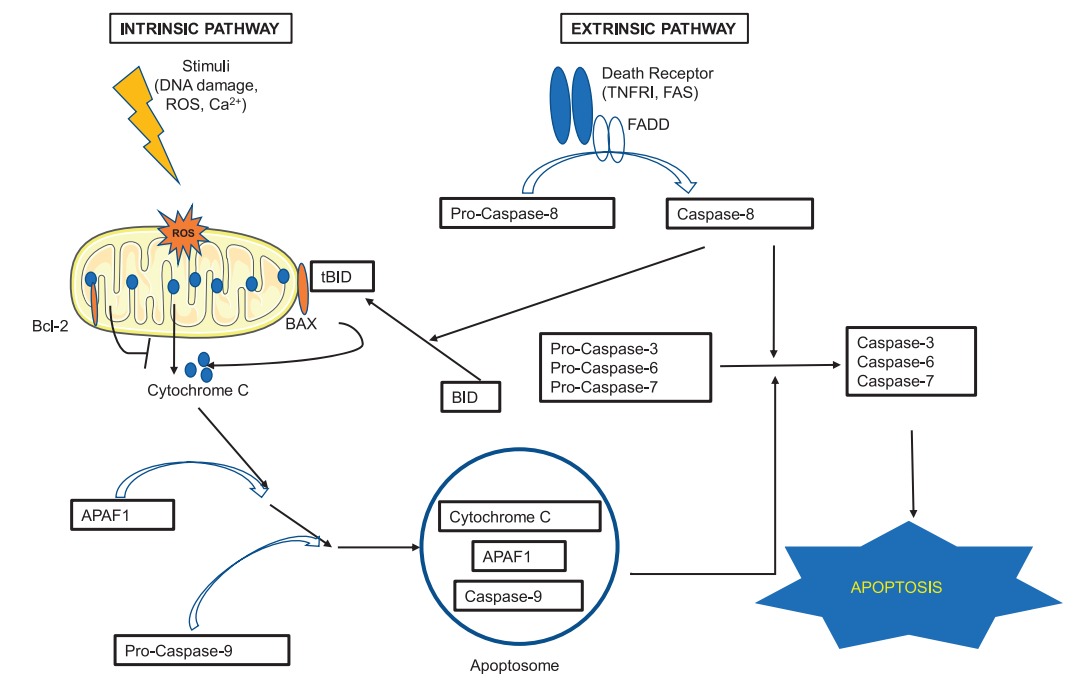
아폽토시스 경로.
세포 사멸로 이어지는 2가지 주요 경로가 있습니다.
외인적 및 내인적.
외인적 경로는 리간드가 세포 표면의 사멸 수용체(예: 종양 괴사 인자 수용체 I 및 Fas)에 결합할 때 촉발됩니다.
결합은 어댑터 단백질 Fas-associated protein with death domain (FADD)의 도움으로
pro-caspase-8을 caspase-8로 활성화시키는 수용체의 구조적 변화를 유도합니다.
활성화된 caspase-8은 pro-caspases-3,-6, -7을 활성화시키며, 이 활성화는 결국 세포사멸로 이어집니다.
내인적 경로는 미토콘드리아 의존적이며 DNA 손상, 산화 스트레스 및 높은 칼슘 농도와 같은 손상에 대한 반응으로 발생합니다.
BAX와 같은 pro-apoptotic protein의 활성화는 Bcl-2 family의 antiapoptotic protein의 효과를 중화시키고 미토콘드리아로부터 apoptogenic factor cytochrome c의 방출을 유도한다.
시토크롬 c는 APAF1(아폽토시스 프로테아제 활성화 인자-1)에 결합하고 함께 pro-caspase-9에 결합하여 활성화합니다.
시토크롬 c, APAF1 및 활성화된 caspase-9의 복합체는 apoptosome을 형성하고 pro-caspases-3, -6 및 -7도 활성화하고 apoptosis를 유도합니다.
외부 경로와 내부 경로 사이의 상호작용은 BH3 상호 작용 도메인(BID)을 통해 이루어집니다.
BID가 활성화된 caspase-8에 의해 절단되면 BID의 절단된 형태(tBID)로 활성화되고 미토콘드리아로 전위되어 시토크롬 c 방출을 촉진합니다.

Necroptosi 경로.
TNF 수용체는 복합체 I의 형성을 유도합니다.
수용체 상호작용 단백질 키나아제(RIP)1가 유비퀴틴화된 상태로 유지되면 세포가 생존합니다.
복합체 I은 RIP1의 탈유비퀴틴화에 의해 복합체 II를 형성하고 cellular inhibitor of apoptosis 1/2 (cIAP1/2)의 세포 억제제의 손실에 의해 매개됩니다.
복합체 II에서 카스파제 8 활성화는 RIP3를 억제하고 세포자멸사를 촉진하는 반면,
카스파제 비활성화는 RIP1을 인산화하여 괴사를 촉진하고, 이는 차례로 RIP3를 인산화합니다.
인산화된 RIP3는 MLKL 올리고머화를 유발하는
혼합 계통 키나제 도메인 유사mixed-ineage kinase domain-like (MLKL) 인산화를 유발하고,
이어서 세포막으로 전위를 일으켜 기공을 만들고 손상 관련 분자 패턴damage-associated molecular patterns(DAMP)을 방출합니다.

미토콘드리아 투과성 전이(MPT) 매개 괴사.
칼슘 과부하 및/또는 극도로 높은 산화 스트레스로 인해 미토콘드리아 막이 투과성이 되고 미토콘드리아 막 전위가 소실되어 ATP 합성이 중단됩니다.
증가된 투과성은 또한 세포질 물 분자의 유입을 유발하여 매트릭스 팽창을 유발하여 궁극적으로 미토콘드리아 막 파열 및 세포 사멸 인자의 방출을 초래합니다.
ATP가 존재하면 세포자멸사를 유발합니다.
그러나 ATP가 고갈되면 MPT 괴사가 발생합니다.
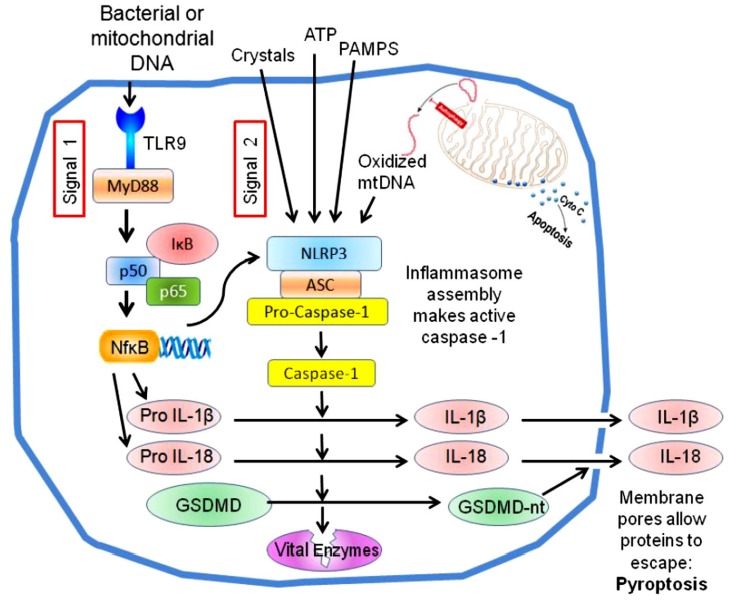
pyroptosis의 표준 NACHT, LRR 및 PYD domains-containing protein 3(NLRP3) 인플라마좀inflammasome 경로.
허혈 재관류 동안 생성된 많은 물질(termed signal 2)은 NLRP3 인플라마솜의 조립을 촉발하여 cysteineaspartic protease caspase-1 의 활성화를 초래합니다.
Toll-like receptors (signal 1)의 동시 활성화는 NF-B를 통한 pro-interleukins 및 NLRP3의 발현을 증가시킵니다.
Caspase-1은 pro-interleukins를 활성화하고 gasdermin D의 NH2 말단 도메인을 방출하여 원형질막에 큰 구멍을 만듭니다.
이러한 모공은 전염증성 인터루킨이 분비되도록 하고 막 완전성의 손실은 또한 세포를 죽입니다(파이롭토시스).
Caspase 1은 또한 독성에 기여할 수 있는 GAPDH와 같은 일부 필수 효소를 포함하여 세포의 다른 많은 단백질을 공격하는 것으로 보고되었습니다.
pyroptosis의 특성
인간 caspase-1/4/5(또는 murine caspase-1/11) 매개 세포 사멸은 세포 내 내용물의 손실을 허용하는 막 장애에 의한 것입니다.
pyroptosis는 종종 DNA 단편화와 관련이 있습니다.
Pyroptosis와 다른 형태의 세포 사멸의 차이점
Pyroptosis는 GSDMD의 caspase 활성화로 인한 것으로 믿어지며, 이는 원형질막에 큰 구멍을 형성합니다.
허혈 유발 파이롭토시스의 증거는 허혈 동안 에너지의 손실만으로도 괴사에 의한 막 부전을 유발할 수 있고 염증 성분이 에너지 결핍에 기여할 수 있다는 사실에 의해 복잡합니다

ferroptosis의 신호 전달 경로
ferroptosis의 특징은 다음과 같습니다.
1) 철 의존성,
2) 글루타티온(GSH) 및 글루타티온 과산화효소 4(GPX4) 매개 산화환원 균형의 장애,
3) 지질 과산화.
뾰족한 화살촉은 운송, 제품 또는 활성화를 나타냅니다.
무딘 화살촉은 억제를 나타냅니다.
빨간색 화살표는 ferroptosis 활동 또는 ferroptosis를 촉진하는 기능을 나타냅니다.
파란색 화살표는 ferroptosis를 억제하는 과정을 나타냅니다.
GSSG, glutathione disulfate; ROS, reactive oxygen species; RSL3,
Ras-selective lethal 3.
Ferroptosis와 다른 형태의 세포 사멸의 차이점
GPX4 및 GSH
GPX4 활성은 ferroptosis의 경우에만 낮아져야 하며 apoptosis와 같은 다른 형태의 세포 사멸에서 크게 변경되어서는 안 됩니다.
ferroptosis는 또한 GSH/total glutathione총 글루타티온 비율을 낮추거나 총 글루타티온을 낮추거나 둘 모두를 초래해야 합니다.
지질 ROS
일반적인 ROS 생성은 비병리학적 조건에서 존재하며 세포자멸사 및 괴사와 같은 다른 형태의 세포 사멸에서 발견될 수 있습니다.
지질 ROS는 ferroptosis에 더 특이적이며 GPX4 활성의 특정 감소로 인해 다른 형태의 세포 사멸보다 훨씬 더 많은 양으로 축적됩니다.
철 의존성
Ferroptosis에는 철분이 필요하지만 비정상적으로 높은 수준의 철분이 필요하지 않습니다.
높은 수준의 철은 세포가 ferroptosis를 겪고 있다는 신호일 수 있습니다.
ferroptosis가 발생하는 경우, 킬레이트제 투여 또는 세포 내 철분을 감소시키는 다른 방법은 세포 사멸 및 지질 ROS를 상당히 감소시키고 GPX4 및 GSH를 회복시켜야 합니다.
철이 킬레이트제나 다른 방법을 통해 제거되는 경우 다른 비 철 의존적 형태의 세포 사멸은 크게 영향을 받지 않아야 합니다.
추가 기능: 미토콘드리아 형태 변화
미토콘드리아 단편화는 ferroptosis와 구별되지 않을 수 있습니다.
미토콘드리아 막에 있는 많은 양의 지질 ROS와 동시에 존재하면 구별됩니다.
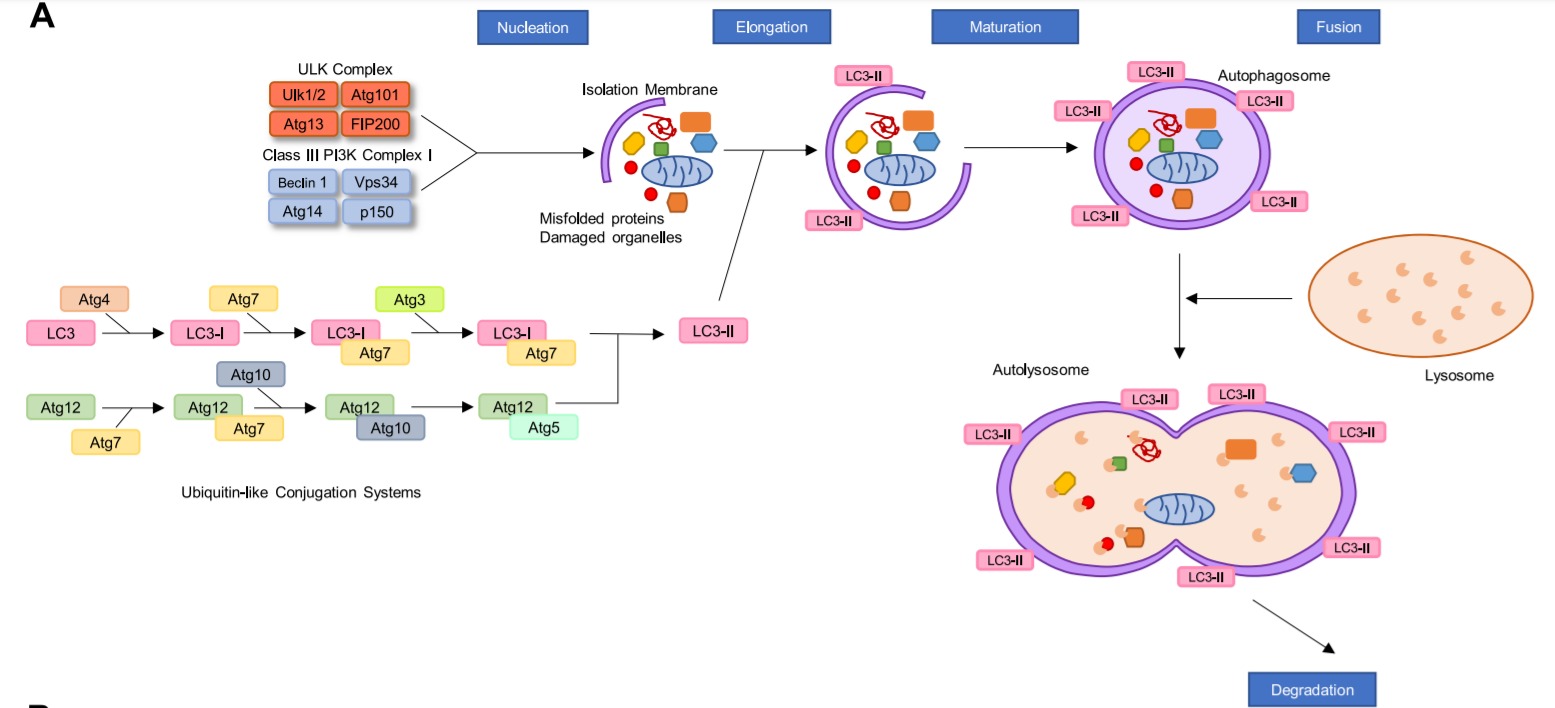
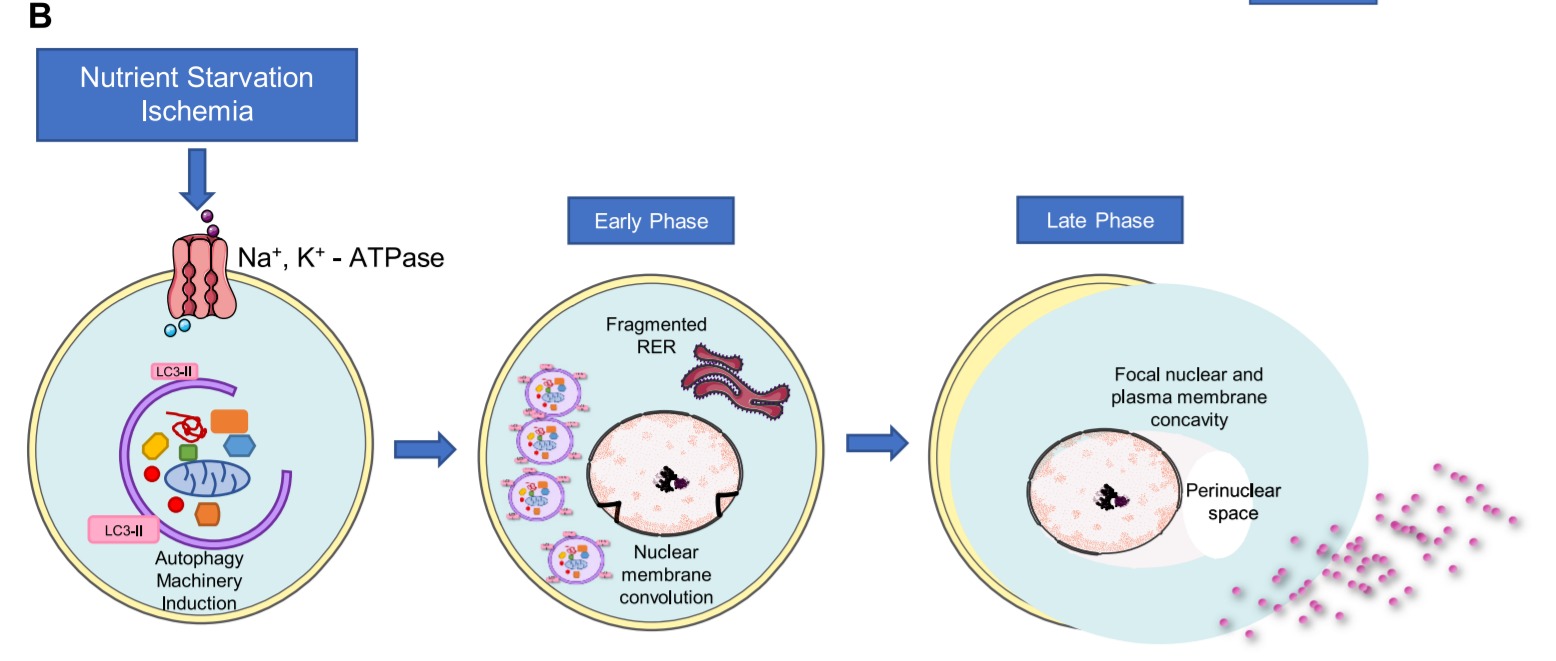
Autophagic 세포 사멸 경로 및 autosis.
A: 적응형 자가포식/자가포식 세포 사멸의 단계 및 다양한 단계에 관련된 단백질.
B: autophagy 시스템에 의해 매개되는 autosis를 유도하는 요인과 autosis의 초기 및 후기 단계 동안 세포 형태의 변화.
LC3, microtubule-associated proteins 1A/1B light chain 3; RER, rough endoplasmic reticulum.
자가포식에 의한 세포사멸은 자가포식의존성 세포사라고도 알려져 있으며, 세포사에 관한 명명위원회(Nomenclature Committee on Cell Death)에서 인정한 유일한 형태의 자가포식성 사멸이며, 적응성 자가포식을 통한 세포사멸과의 구별을 강조합니다
******************************************************************
https://www.nature.com/articles/s41418-017-0012-4
Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018 - Cell Death & Differentiat
For a long time, cell death has been dismissed by biologists as an inevitable and, hence, spurious consequence of cellular life. A large body of experimental evidence accumulating over the past decades, however, has unveiled and characterized in ever great
www.nature.com

여러가지 세포 사멸
세포내 또는 세포외 미세환경의 회복 불가능한 변화에 노출된 포유동물 세포는 궁극적으로 그들의 죽음으로 이어지는 많은 신호 전달 캐스케이드 중 하나를 활성화할 수 있습니다.
이러한 조절된 세포 사멸(RCD) 모드 각각은 상당한 수준의 상호 연결성을 나타내는 분자 메커니즘에 의해 시작되고 전파됩니다.
ADCD: autophagy-dependent cell death, ICD: immunogenic cell death, LDCD: lysosome-dependent cell death, MPT: mitochondrial permeability transition.
우발적 세포 사멸Accidental cell death(ACD) . 극단적인 물리적, 화학적 또는 기계적 신호로 인한 원형질막의 물리적 분해에 해당하는 사실상 즉각적이고 제어할 수 없는 형태의 세포 사멸입니다.
아노이키스Anoikis . 인테그린 의존성 고정의 상실에 의해 시작된 내인성 세포자멸사의 특정 변이.
자가포식 의존성 세포 사멸Autophagy-dependent cell death . autophagic 시스템(또는 그 구성 요소)에 의존하는 RCD의 한 형태.
오토시스Autosis . 원형질막 Na + /K + -ATPase 에 결정적으로 의존하는 자가포식 의존적 세포 사멸의 특정 사례 .
세포 사멸 . 중요한 세포 기능의 비가역적 퇴화(특히 ATP 생성 및 산화환원 항상성 보존)는 세포 무결성(영구적 원형질막 투과성 또는 세포 단편화)의 손실을 초래합니다.
세포 노화 . 노화 관련 분비 표현형(SASP)을 포함한 특정 형태 및 생화학적 특징과 관련된 증식 가능성의 비가역적 손실. 세포 노화는 RCD의 한 형태를 구성하지 않습니다.
에페로사이토시스Efferocytosis. . 죽은 세포와 그 단편이 식세포에 의해 흡수되어 처리되는 메커니즘입니다.
Entotic 세포 사멸 Entotic cell death. 액토미오신 의존성 세포내 세포 내재화(엔토시스)에서 유래하고 리소좀에 의해 실행되는 RCD 유형입니다.
외인성 세포 사멸 Extrinsic apoptosis. 원형질막 수용체에 의해 감지된 세포외 미세 환경의 섭동에 의해 시작된 RCD의 특정 변이체, CASP8에 의해 전파되고 주로 CASP3의 집행자 카스파제에 의해 침전됩니다.
페로프토시스 . GPX4에 의해 구성적으로 제어되고 철 킬레이트제 및 친유성 항산화제에 의해 억제될 수 있는 세포내 미세 환경의 산화적 섭동에 의해 시작된 RCD의 한 형태.
면역원성 세포 사멸Immunogenic cell death . 면역력이 충분한 숙주에서 적응 면역 반응을 활성화하기에 충분한 RCD의 한 형태.
내인성 세포 사멸 Intrinsic apoptosis. 세포 외 또는 세포 내 미세 환경의 열악한 변화에 의해 시작되고 MOMP에 의해 구분되고 집행자 카스파제(주로 CASP3)에 의해 침전되는 RCD의 유형입니다.
리소좀 의존성 세포 사멸 Lysosome-dependent cell death. 1차 LMP에 의해 구분되고 카텝신에 의해 침전되는 일종의 RCD로, 선택적으로 MOMP와 카스파아제가 관여합니다.
미토콘드리아 투과성 전이(MPT) 구동 괴사 Mitochondrial permeability transition (MPT)-driven necrosis. 세포 내 미세 환경의 열악한 변화에 의해 유발되고 CYPD에 의존하는 특정 형태의 RCD.
유사 분열 재앙Mitotic catastrophe . RCD 또는 세포 노화에 의한 유사분열 불능 세포의 조절을 위한 종양 억제 메커니즘. 그 자체로 유사분열 재앙은 형태나 RCD를 구성하지 않습니다.
유사 분열 죽음 Mitotic death. 유사분열 재앙에 의해 유발된 RCD의 특정 변종(대부분 내재적 세포자멸사).
괴사 Necroptosis . MLKL, RIPK3 및 (적어도 일부 설정에서는) RIPK1의 키나제 활성에 결정적으로 의존하는 세포외 또는 세포 내 항상성의 섭동에 의해 유발되는 RCD 양식입니다.
NETotic 세포 사멸 NETotic cell death. 조혈 유도 세포로 제한되고 NET 압출과 관련된 RCD의 ROS 종속 양식.
Parthanatos . PARP1 과활성화에 의해 시작되고 AIF 의존적 및 MIF 의존적 DNA 분해와 결합된 결과적인 생물 에너지 재앙에 의해 침전된 RCD 양식.
프로그램된 세포 사멸 Programmed cell death (PCD) . 엄격하게 생리학적 시나리오에서 발생하는 특정 형태의 RCD, 즉 항상성의 변화과 관련이 없으므로 스트레스에 대한 적응 실패 맥락에서 발생하지 않습니다.
Pyroptosis . 염증성 카스파제 활성화의 결과로 종종(항상 그런 것은 아니지만) 가스더민 단백질 패밀리 gasdermin protein family의 구성원에 의한 원형질막 기공 형성에 결정적으로 의존하는 RCD 유형입니다.
조절된 세포 사멸 Regulated cell death(RCD) . 하나 이상의 신호 전달 모듈의 활성화로 인해 발생하는 세포 사멸의 형태로, 약리학적 또는 유전적으로(적어도 동역학적으로 어느 정도) 조절될 수 있습니다.
'Ferroptosis' 카테고리의 다른 글
| Ferroptosis의 메커니즘과 종양 치료의 응용 (0) | 2021.11.07 |
|---|---|
| 페롭토시스 억제 약물 (0) | 2021.11.07 |
| 아폽토시스 와 페롭토시스의 상호관계 (0) | 2021.11.04 |
| Ferroptosis: 질병과의 메커니즘 및 연결 (0) | 2021.10.27 |
| ferroptosis 후성 유전 적 조절자와 대사 변화 (0) | 2021.10.27 |