2018
Till Death Do Us Part: The Marriage of Autophagy and Apoptosis
https://www.hindawi.com/journals/omcl/2018/4701275/
Till Death Do Us Part: The Marriage of Autophagy and Apoptosis
Autophagy is a widely conserved catabolic process that is necessary for maintaining cellular homeostasis under normal physiological conditions and driving the cell to switch back to this status quo under times of starvation, hypoxia, and oxidative stress.
www.hindawi.com
Autophagy는 정상적인 생리적 조건에서 세포의 항상성을 유지하고 기아, 저산소증 및 산화 스트레스의 시간에 이러한 상태로 다시 전환하도록 세포를 구동하는 데 필요한 널리 보존된 이화 작용 과정입니다.
활성산소종(ROS)과 자가포식 사이의 관계는 복잡합니다.
세포 ROS는 주로 미토콘드리아에서 파생됩니다.
Autophagy는 이 사건에 의해 촉발되고 결함이 있는 세포 소기관을 효과적으로 제거함으로써 세포 ROS를 낮추어 세포 항상성을 회복합니다.
그러나 세포 항상성에 도달하지 못하면 세포는 다시 전환하여 조절된 세포 사멸 반응을 선택할 수 있습니다.
흥미롭게도 자가포식 및 세포사멸 기계는 모두 동일한 스트레스에 반응하고 주요 조절 단백질을 공유하여 경로가 복잡하게 연결되어 있음을 시사합니다.
여기에서 autophagy와 apoptosis 사이의 교차점은 ROS가 수행하는 역할에 특히 중점을 두고 논의됩니다.
Autophagy는 1963년에 비필수적이거나 손상된 세포 구성요소에 대한 리소좀 매개 분해 과정으로 발견되었습니다
거대자가포식(macroautophagy), 미세자가포식(microautophagy), 샤페론 매개 자가포식(chaperone-mediated autophagy, CMA)이라는 세 가지 주요 자가포식 경로가 포유류 세포에 공존하는 것으로 나타났습니다.
거대자가포식은 리소좀과 융합하여 분해를 위해 내강 함량을 전달하는 자가포식소체라고 하는 이중막 구조의 형성을 포함합니다.
Microautophagy는 세포질 단백질이 리소좀에 의해 직접적으로 삼켜지는 과정을 말합니다[ 7 ].
CMA는 이름에서 알 수 있듯이 세포질 샤페론을 활용하여 단백질을 리소좀 표면으로 전달하여 리소좀이 펼쳐져 리소좀 막을 가로지릅니다.
이 검토의 주제는 고도로 보존된 거대자가포식 과정이며, 여기서는 이를 "자가포식"이라고 합니다.
다양한 유형의 선택적 자가포식이 확인되었습니다. 예를 들어, mitophagy, pexophagy 및 lipophagy는 각각 mitochondria, peroxisome 및 lipid의 리소좀 분해를 나타냅니다.
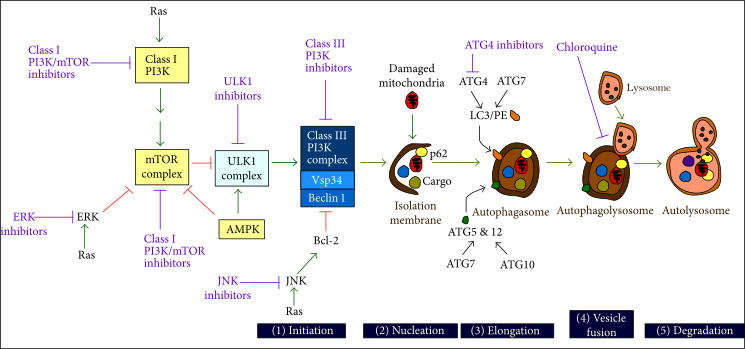
그림 1
위에서 언급했듯이 autophagy는 정상적인 생리적 조건과 외인성 자극에 대한 반응으로 세포 항상성을 유지합니다.
결함이 있는 미토콘드리아에서 주로 발생하는 세포 내 활성 산소 종(ROS)의 수준 증가도 자가포식을 유발합니다.
차례로, 증가된 자가포식 플럭스는 손상된 소기관의 소비에 의해 ROS를 감소시킵니다(그림 2 ).
따라서 과도한 ROS는 자가포식 플럭스를 상향 조절하고, 차례로 이 이화 세포 과정은 생리학적 ROS 수준을 복원합니다.
따라서 자극 유발 자가포식은 세포 보호 기능을 통해 스트레스에 대한 적응 반응의 기초가 되고 유지합니다.
그러나 ROS 수준이 압도적으로 높아지면 autophagy와 RCD 경로가 밀접하게 연결되어 있음을 시사하는 nonautophagic regulated cell death(RCD) 반응이 시작됩니다.
이 전환이 어떻게 이루어지는지는 현재 불분명합니다.

2. 자가포식의 과정
영양소와 산소 결핍에 대한 중요한 세포 반응으로 작용하는 다단계 이화 과정입니다.
그 후, 유리 아미노산, 유리 지방산 및 ATP는 생체 분자 합성을 위해 세포질로 다시 재순환됩니다.
포유동물에는 5가지 주요 제어점, 즉 개시, 핵형성, 신장, 리소좀 융합 및 자가포식소체 내용물의 분해가 있습니다.
자가포식소체의 내용물은 단백질 및 기타 거대분자 합성 및 대사를 위한 아미노산과 지질을 생성하는 리소좀 가수분해효소에 의해 분해됩니다.
3. ROS 밸런스
세포가 ROS 스트레스에 따라 세포 항상성에서 세포 사멸 경로로 전환하기로 결정하는 방법은 잘 알려져 있지 않습니다.
많은 유형의 암, 특히 확립된 종양이 불리한 환경에서 생존하기 위한 메커니즘으로 향상된 자가포식을 채택했기 때문에 이를 이해하는 것이 중요합니다.
결과적으로 autophagic 억제는 세포를 조절된 세포 사멸(RCD) 경로로 유도하는 새로운 치료 도구를 나타냅니다.
그러나 이 접근 방식에 대한 주의 사항은 드물지만 일부 상황에서는 자가포식 기구의 구성요소가 자가포식 세포 사멸 경로에 사용된다는 것입니다.
현재까지 autophagic 세포 사멸의 세 가지 유형이 더 엄격한 기준인 autosis, ferroptosis 및 최근에는 necroptosis를 충족했습니다
역설적으로 autophagy의 손실은 악성 변형을 방지하는 유전독성 물질을 제거하기 위해 autophagy가 필요하기 때문에 새로운 종양 형성에도 기여합니다
Autophagy가 종양 형성의 시작을 억제하지만 확립된 종양의 생존을 촉진합니다
3.1. ROS
이것은 주로 전자 수송 사슬에서 정상적인 호흡 동안 전자 누출의 결과로 미토콘드리아에서 발생합니다
O2 -는 다른 출처에서도 생성됩니다.
퍼옥시좀 에서 지방산의 β- 산화 및 플라빈 산화효소 활성을 통해 ;
산소 분자의 단백질 산화 소포체 (ER)에서;
크산틴/크산틴 산화효소를 통한 분자 산소의 효소적 환원,
결합되지 않은 산화질소 합성효소(NOS),
시토크롬 P-450 이소형 및 NADPH 의존성 산화효소(NOX)가 주요 기여자입니다 .
O2-는 독성 OH- 라디칼로 전환하는 능력과 반응성이 높기 때문에 보다 안정적이고 막 확산성이 있는 ROS H2O2로 빠르게 전환됩니다
이것은 자발적으로 또는 슈퍼옥사이드 디스뮤타아제(SOD1 및 SOD 2)의 작용을 통해 발생합니다..

활성 산소 종(ROS) 형성 및 제거와 관련된 메커니즘의 개략도.
내인성 형태의 ROS는 NADPH 산화효소(NOX)와 표시된 소기관에서 발생합니다.
세포질 슈퍼옥사이드(O 2 - )는 슈퍼옥사이드 디스뮤타제(SOD)에 의해 과산화수소(H 2 O 2 )로 전환됩니다.
H 2 O 2 에는 세 가지 운명이 있습니다.
그것은 글루타티온 퍼옥시다제(GPX) 퍼옥시레독신(PRx), 티오레독신(TRX) 및 카탈라제(CAT)에 의해 물로 해독될 수 있습니다.
환원된 형태의 글루타티온(GSH)은 이 반응을 촉진하는 반면 글루타티온 이황화물 GSSH로의 산화는 세포내 산화환원을 초래합니다.
H2O2는 Fenton 반응을 통해 세포독성 하이드록실 라디칼(OH-)로 전환되어 지질, 단백질 및 DNA에 돌이킬 수 없는 손상을 일으킬 수 있습니다.
마지막으로, H 2 O 2 는 수많은 생물학적 과정을 조절하기 위해 단백질 내의 중요한 티올을 산화시켜 신호 분자로 사용할 수도 있습니다.
3.2. 항산화제
세포가 세포 내 H 2 O 2 를 처리하는 방법 은 세포 운명과 복잡하게 연결되어 있습니다.
다른 효소에 의해 물(ROS 해독) 또는 유전독성 하이드록실 라디칼로 전환될 수 있습니다.
마지막으로, 산화 환원 신호 전달 과정에서 신호 분자로 사용할 수 있습니다(그림 3 ).
ROS 해독은 다양한 효소에 의해 실행되며, 주요 역할은 카탈라제, 글루타티온 퍼옥시다제(GPX), 퍼옥시레독신, 글루타티온 퍼옥시다제(GSH-Px 또는 GPx) 및 티오레독신(TXN)입니다.
PRX가 H2O2 소거와 관련이 있는 반면, GPX 계열의 단백질(GPX1–8)은 환원된 글루타티온(GSH)을 이황화 글루타티온(GSSG)으로 산화시켜 H2O2를 H2O로 환원시키는 것을 촉매합니다.
이와 일관되게, GSSG로의 GSH 산화는 감소된 GSH:GSSG 비율에 의해 반영되는 세포내 산화환원 불균형을 초래합니다.
다른 항산화제는 비타민 C, 비타민 E, 카로티노이드입니다.
H 2 O 2 가 유해한 자유 히드록실 라디칼로 전환 되는 것은 자유 철(Fe 2+ )이 H 2 O 2 와 반응하는 Fenton 반응에 의해 발생합니다 .
이 불용성 라디칼은 강력한 산화 가능성을 가지고 있으며 생산 부근에 있는 거의 모든 세포 거대분자에 비가역적인 산화 손상을 일으킵니다
따라서 H2O2와 OH-의 세포 수준은 산화제와 항산화제 반응 사이의 균형에 의해 유지됩니다.
3.3. 전사 인자의 역할
전사인자 Nrf2(nuclear factor erythroid 2-related factor 2)는 ROS 해독, OH- 생성 방지 및 산화환원 균형 모두에서 핵심적인 역할을 합니다.
산화제 또는 친전자체에 노출된 후 Nrf2는 핵에 축적되어 해독 및 항산화 효소를 암호화하는 4가지 유전자 그룹을 상향 조절합니다.
여기에는 GSH, 세포질 thioredoxin(TXN), thioredoxin reductase(TXNRD) 및 sulfiredoxin(SRXN) 의 생합성 및 유지에 필요한 것들이 포함 되며, 이들 모두는 산화된 단백질 티올을 환원시킵니다.
또한 게놈 연구에 따르면 Nrf2가 600개 이상의 유전자를 조절한다는 것이 밝혀졌습니다.
염증 억제 및 손상된 단백질의 복구 또는 제거에 필요한 것들을 포함합니다.
이로 인해 Nrf2가 "항산화 반응의 마스터 레귤레이터"로 명명되었습니다.
이 주요 역할에 적합하게 Nrf2 자체는 산화 스트레스에 따라 억제되는 유비퀴틴 매개 단백질 분해에 의해 엄격하게 제어됩니다(자세한 내용은 아래 참조).
언급할 가치가 있는 것은 Nrf2가 유리 Fe(II) 항상성을 조절하여 ROS 수준을 조절하는 데 간접적으로 도움이 된다는 것입니다.
이것은 Fe(II)를 Fe(III)로 전환하여 해독하는 페리틴 복합체의 구성원을 암호화하는 유전자의 상향 조절에 의해 달성됩니다.
이 복합물은 또한 철을 자체 구조 내에서 격리하여 Fenton 반응에 의해 접근되는 것을 방지 하여 ROS에서 OH - 라디칼 생성을 감소시킵니다
이러한 역할을 고려할 때 철분 과잉이 종양 형성을 크게 촉진할 수 있다는 것은 놀라운 일이 아닙니다
이것은 암을 치료하기 위해 철 킬레이트화 또는 트랜스페린 수용체-중화 항체를 사용하는 출현으로 이어졌습니다
그러나 철 과잉이 종양 형성을 촉진하는 분자 메커니즘은 아직 불분명합니다.
마지막으로, (FOXO) 와 (NF- κ B)는 또한 항산화 유전자 발현을 조절한다
4. 신호 분자로서의 ROS
산화환원의 가역성은 신호에 필수적인 특성인 온/오프 스위치를 제공합니다.
항산화 단백질이 산화 환원 신호 전달에도 적극적으로 참여합니다
예를 들어, 그들은 산화된 단백질의 환원과 신호 전달 중간체에 대한 결합을 촉매하여 p38 MAPK 및 c-Jun N-말단 키나제(JNK)와 같은 다운스트림 이펙터를 활성화합니다
그러나 ROS 수준이 항상성에 도달할 수 없는 경우 가역적 SOH 유도체는 비가역적이고 손상을 주는 SO 2 H 유도체로 과산화 될 수 있다.
5. 신호 분자로서의 RNS
ROS 외에도 세포에는 대부분 산화질소(NO - ) 형태의 반응성 질소 종(RNS)이 포함되어 있습니다 .
산화질소는 미토콘드리아에서 생성되며 미토콘드리아 생합성 및 생체 에너지를 포함한 많은 생리학적 과정에서 세포 신호 분자로 작용합니다
종합하면, 이 데이터는 RNS와 ROS가 모두 번역 후 변형을 통해 미토콘드리아 형태를 조절함을 시사합니다.
6. 자가포식에 대한 ROS의 직접적인 영향
ROS가 자가포식을 유도할 수 있다는 것은 잘 알려져 있습니다.
이는 불필요한 세포 ROS를 제거하는 데 사용되는 주요 메커니즘이기 때문입니다.
차례로, 자가포식은 ROS의 주요 공급원인 손상된 미토콘드리아를 소모함에 따라 ROS 수준을 낮추게 됩니다.
이 "pas de deux"(흔히 발레에서, 두 사람이 추는 춤)는 autophagy가 산화 스트레스의 원인을 제거하고 산화 손상으로부터 세포를 보호하는 미세 조정된 부정적인 피드백 메커니즘을 나타냅니다.
증가된 자가포식 흐름과 함께 증가된 세포 내 ROS는 기아, 저산소증, TNF α (종양 괴사 인자 α ) 및 NGF(신경 성장 인자) 결핍을 포함한 많은 요인에 의해 유발됩니다
이와 일치하게, 연구에 따르면 ROS 제거제 N-아세틸 시스테인(NAC)으로 세포 만들기를 처리하면 세포 ROS 생성과 자가포식이 모두 감소하여 산화환원 티올 신호가 자가포식의 중요한 조절자임을 암시합니다.
그러나 ROS가 autophagic 기계와 어떻게 상호작용라는지에 대한 정확한 분자 세부 사항은 여전히 불분명합니다. 지난 몇 년 동안 산화 환원 불균형이 프로세스를 주도하는 데 중추적인 역할을 한다는 것이 밝혀졌습니다.
이와 일관되게 autophagy를 촉진하거나 억제하는 데 각각 반대 역할을 하는 두 개의 단백질 Atg4와 Keap1이 산화환원 신호에 의해 조절됩니다.
마지막으로 기아에 대한 반응으로 자가포식의 주요 유도물질인 AMPK도 간접적으로 역할을 할 수 있습니다(그림 4 참조 ).
6.1. ATG4
Atg4는 산화 환원 조절이 자가포식의 진행에 필요한 것으로 밝혀진 유일한 포유동물 단백질입니다
6.2. AMPK
AMPK는 자가포식의 확립된 간접 조절자입니다.
정상적인 생리적 조건에서 ATP의 생성과 소비를 엄격하게 일치시켜 세포의 항상성을 유지합니다.
ATP 수준이 낮아지면 잘못 접힌 단백질, 과잉 또는 결함이 있는 세포 소기관과 같은 불필요한 세포질 물질의 자가포식 재활용에 의해 보충됩니다.
AMPK는 ADP와 AMP의 증가된 수준에 의해 활성화되는 에너지 센서이기 때문에 이 프로세스에 중요합니다.
이 AMP:ATP 불균형은 아미노산 기아, 포도당 금단, 저산소증 및 H 2 O 2를 포함한 여러 스트레스에 의해 자극될 수 있습니다..
활성화되면 AMPK는 여러 가지 방법으로 자가포식을 시작할 수 있습니다. 이는 mTOR 신호 전달 캐스케이드의 구성요소를 부정적으로 조절 하고 ULK1 키나제를 직접 활성화합니다 (그림 1).
ROS 노출 후 autophagy의 매우 빠른 유도는 빠른 on/off 분자 스위치가 autophagy의 시작을 조절할 수 있음을 시사합니다. 일부 연구에서는 AMPK가 저산소증 후에 AMP:ATP와 무관한 방식으로 활성화되는 역할을 할 수 있다고 암시했습니다
또한 화학적으로 산화된 GSH는 자가포식 자극이 없을 때 자가포식을 유도할 수 있습니다
이 결과는 산화 환원 항상성이 자가포식 참여에서 수행하는 핵심 역할을 강화하는 역할을 합니다.
6.3. 기타
다른 단백질도 증가된 세포 ROS에 간접적으로 반응합니다. 여기에는 고이동성 그룹 상자 1(Hmgb1, 사이토카인에 반응하여 세포 외로 방출되는 핵 단백질), Ras 및 다양한 키나제, Atm, Akt, Erk, JNK 및 Perk가 포함됩니다
6.4. Keap1 및 p62
Atg4와 달리 Kelch-like ECH-associated protein 1(Keap1)은 ROS에 반응하여 자가포식을 간접적으로 부정적으로 조절하는 산화환원 민감성 단백질입니다[ 99 ].
Keap1은 산화제에 노출되면 구조적 변화를 일으켜 편재화 및 분해를 위해 Nrf2를 포획하는 능력을 손상시키는 반응성 시스테인 잔기를 갖추고 있습니다
또한 Keap1의 Nrf2 결합 부위에 p62의 경쟁적으로 결합힐 수 있습니다.
p62는 기능 장애 미토콘드리아를 phagosome으로 가져오는 autophagic 어댑터 단백질입니다
따라서 증가된 유리 p62 수준은 Nrf2 경로를 활성화합니다.
p62는 또한 NF- κ B 및 mTor1을 포함한 다른 신호 전달 단백질의 발현을 촉진하여 신호 허브로 악명을 얻었습니다 .
7. 자가포식과 세포자멸사 - 죽음이 우리를 갈라놓을 때까지
autophagy와 apoptosis는 비슷한 스트레스에 반응합니다. 그러나 세포 운명을 결정하는 분자 메커니즘은 이제 막 등장하고 있습니다.
놀라운 것은 원래 한 경로에만 필요한 것으로 생각되었던 단백질이 이제 두 경로 모두에서 역할을 하는 것으로 나타났습니다.
따라서 스트레스 후 세포 자살을 결정하는 결정은 단순한 분자 전환과는 반대로 많은 요인에 의해 제어될 수 있습니다.
autophagy가 apoptosis로부터 보호하는 많은 예가 문헌에 있기 때문에 이것은 다소 놀라운 일입니다.
최근의 압도적인 데이터 폭발은 모든 결혼과 마찬가지로 관계가 복잡하다는 점을 강조하는 역할을 했습니다.
그러나 분명한 것은 자기애적 방식으로 각 경로가 다른 경로에서 단백질을 훔치고 적응시켜 자체 메커니즘을 촉진한다는 것입니다.
'Ferroptosis' 카테고리의 다른 글
| 유방암에서 ferroptosis를 목표 전략 (0) | 2023.03.22 |
|---|---|
| ferroptosis의 바이오 마커 및 기여자로서의 ACSL4 (0) | 2023.03.22 |
| 암세포에서 선택적으로 세포자멸사를 유발하는 미토콘드리아 취약성의 이용 (0) | 2021.11.20 |
| 표적으로서의 VDAC1: 세포자멸사에서의 역할에 초점 (0) | 2021.11.19 |
| 암 화학 요법을 보완하는 천연물질: 자가포식-아폽토시스 경로의 약리학적 조절 (0) | 2021.11.19 |

