2016
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5140697/
Targeting cancer metabolism: dietary and pharmacological interventions
Most tumors display oncogene-driven reprogramming of several metabolic pathways, which are crucial to sustain their growth and proliferation. In recent years, both dietary and pharmacological approaches that target deregulated tumor metabolism are beginnin
www.ncbi.nlm.nih.gov
https://aacrjournals.org/cancerdiscovery/article/6/12/1315/5172/Targeting-Cancer-Metabolism-Dietary-and
Targeting Cancer Metabolism: Dietary and Pharmacologic Interventions
Abstract. Most tumors display oncogene-driven reprogramming of several metabolic pathways, which are crucial to sustain their growth and proliferation. In recent years, both dietary and pharmacologic approaches that target deregulated tumor metabolism are
aacrjournals.org
Targeting cancer metabolism: dietary and pharmacological interventions
대부분의 종양은 종양의 성장과 증식을 유지하는 데 중요한 여러 대사 경로의 종양유전자 주도 재프로그래밍을 나타냅니다.
식이 요법은 영양소가 제한된 조건이 광범위한 생물학적 효과를 발휘하여 정상 세포, 기관 및 시스템을 보호하는 동시에 다양한 암세포를 세포독성 요법에 민감하게 만드는 능력을 이용합니다.
반면에 중요한 대사 경로의 효소나 대사산물을 표적으로 하는 약물은 매우 특이적이고 효과적일 수 있지만 빠르게 적응할 수 있는 반응성 종양과 일치해야 합니다.
지난 수십 년 동안 종양의 시작, 진행 및 전이의 기본이 되는 몇 가지 생물학적 메커니즘이 밝혀졌습니다.
종양유전자 및 종양 억제 유전자의 발견은 억제되지 않은 증식, 성장 인자 자극으로부터의 독립성, 세포자멸사에 대한 내성을 포함하여 암의 일부 특징의 생화학적 기반을 밝혀냈습니다
다른 한편으로, 이러한 발견의 영향은 오랫동안 종양 성장의 대사적 측면의 중요성을 흐리게 했습니다.
대사는 에너지 단위(ATP 또는 환원 등가물의 형태)를 생성하는 이화 과정과 단백질, 지질 및 DNA와 같은 복잡한 생체 분자의 합성으로 이어지는 동화 과정을 포함하여 세포 내에서 발생하는 일련의 생화학적 변형입니다.
역사적으로 암 치료에서 집중적으로 연구되고 성공적으로 표적화된 유일한 대사 경로는 뉴클레오타이드와 데옥시뉴클레오타이드의 합성입니다
다른 주요 대사 경로는 최근에야 집중적인 연구의 초점이 되었습니다.
고도로 증식하는 건강한 세포와 유사하게, 암세포는 DNA 합성 및 복구, 단백질 및 지질 합성, 단백질의 번역 후 변형, 막 및 소기관 형성 및 재조립, 소포체 형성, 세포내 물질의 수송 및 세포내이입을 비롯한 중요한 생화학적 과정을 유지하기 위해 ATP 및 동화작용 전구체의 지속적인 공급이 필요합니다.
포도당 유래 피루브산의 미토콘드리아 산화가 건강한 세포 증식을 위한 ATP의 선호되는 공급원이지만, 많은 암세포가 해당작용 유래 피루브산의 대부분을 미토콘드리아 산화에서 젖산 합성으로 전환시킵니다(참조 5 ; 그림 1).
최근 연구에 따르면 해당 과정뿐만 아니라 많은 다른 대사 경로가 종양 세포에서 탈조절될 수 있습니다.
더욱이, 종양유전자/종양 억제 유전자와 대사 재프로그래밍 사이의 긴밀한 연결은 조절되지 않은 대사가 암의 억제되지 않은 증식에 결정적으로 기여한다는 것을 시사합니다
건강한 세포와 신생물 세포 사이의 큰 대사 차이를 감안할 때 종양 대사를 선택적으로 표적화하면서 정상 조직에 대한 독성을 제한할 수 있다는 희망이 있습니다.
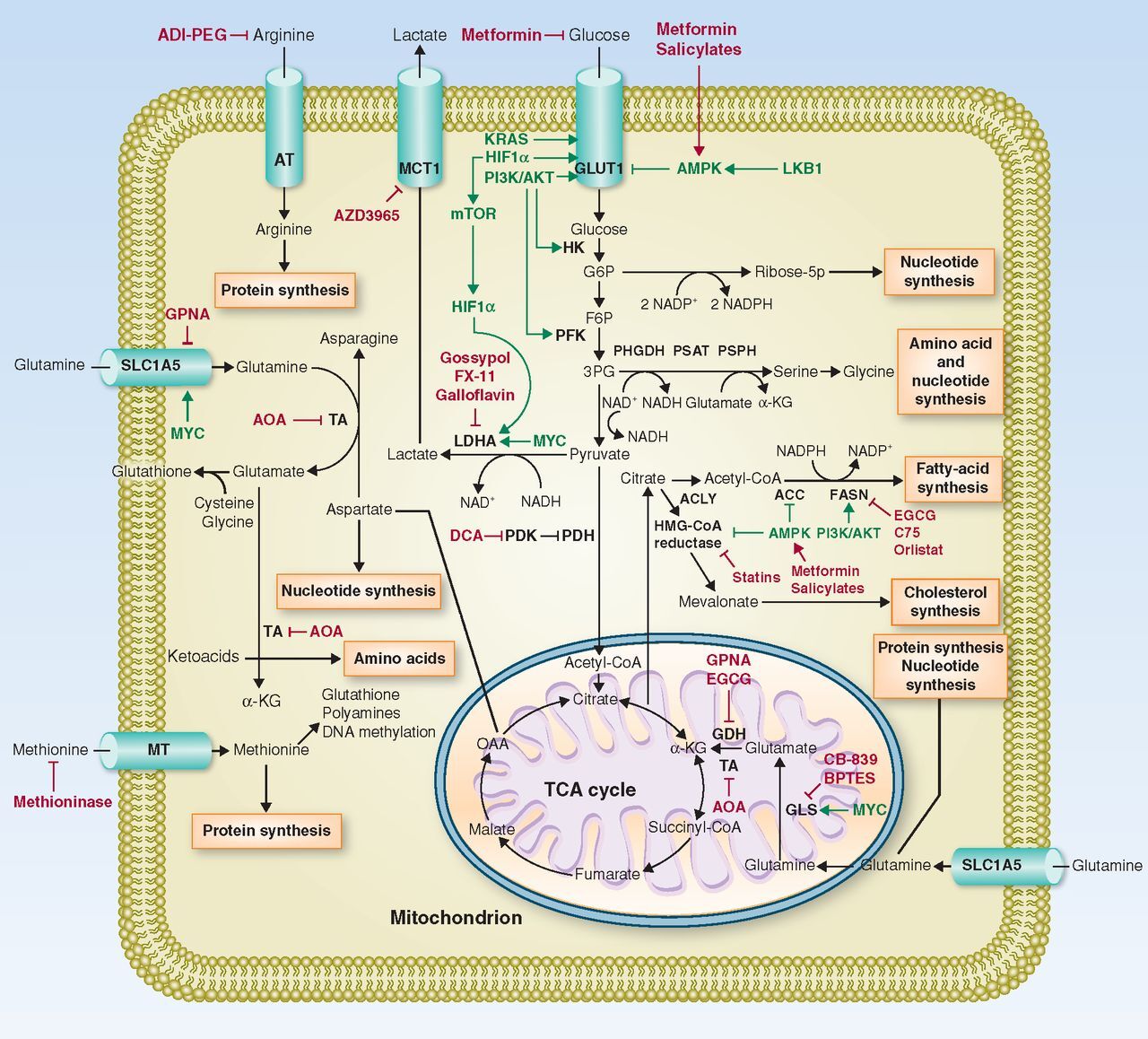
암 및 해당 표적 약물에서 조절이 완화된 주요 대사 경로.
암세포는 이화작용과 동화작용 경로를 모두 상향 조절하여 에너지와 거대분자 생산을 최적화합니다.
포도당과 글루타민은 성장과 증식에 필요한 대부분의 에너지와 대사산물을 암세포에 제공하는 중심 생체 분자입니다.
포도당은 GLUT1 수송체를 통해 종양 세포에 의해 흡수되고 해당과정에 들어갑니다.
해당 중간체 G6P는 5탄당 인산 경로로 전환되어 리보스-5P(뉴클레오티드 합성)를 형성하고 NADPH(단백 동화 과정)의 형태로 등가물을 환원할 수 있습니다.
또 다른 해당 중간체인 3-PG는 단백질 또는 뉴클레오티드에 통합되거나 다른 생체 분자의 전구체로 사용될 수 있는 세린 및 글리신의 합성으로 전환될 수 있습니다.
포도당 유래 피루브산은 LDHA에 의해 젖산으로 전환되고 미토콘드리아 TCA 회로에서 산화되거나 시트르산으로 전환되어 FA 및 콜레스테롤 합성에 연료가 될 수 있습니다.
FA 합성에는 ACC 및 FASN 효소가 필요한 반면 HMG-CoA 환원효소는 콜레스테롤 합성의 핵심 효소입니다. 글루타민은 SLC1A5 수송체를 통해 종양 세포에 들어가 단백질 또는 뉴클레오티드 합성에 사용되거나 글루타메이트 및 α-KG로 전환될 수 있으며, 이는 미토콘드리아 TCA 회로에서 산화되거나 환원 대사를 거쳐 시트르산을 형성하여 FA 및 콜레스테롤 합성에 기여할 수 있습니다. .
세포질 글루타민은 또한 해당 케토산으로부터 아미노산을 형성하기 위해 아미노기를 전이시킬 수 있습니다. 아르기닌과 메티오닌은 특정 수송체를 통해 외부 환경에서 흡수되어 단백질 합성 또는 기타 목적으로 사용됩니다.
ACC, acetyl-CoA carboxylase; ACLY, ATP citrate lyase; ADI-PEG, PEGylated arginine deiminase; AMPK, AMP-activated protein kinase; AOA, aminooxyacetate; AT, arginine transporter; DCA, dichloroacetate; FASN, fatty acid synthase; F6P, fructose 6 phosphate; GDH, glutamate dehydrogenase; GLS, glutaminase; GLUT1, glucose transporter 1; G6P, glucose-6 phosphate; HIF1α, hypoxia-inducible factor 1α HK, hexokinase; LDHA, lactate dehydrogenase A; LKB1, liver kinase B1; MT, methionine transporter; mTOR, mammalian target of rapamycin; NAD, nicotinamide adenine dinucleotide; NADP, nicotinamide adenine dinucleotide phosphate; OAA, oxaloacetate; PDH, pyruvate dehydrogenase; PDK, pyruvate dehydrogenase kinase; PFK, phosphofructokinase; PHGDH, phosphoglycerate dehydrogenase; PI3K, phosphatidylinositol 3-kinase; PSAT, phosphoserine aminotransferase; PSPH, phosphoserine phosphatase; ribose 5-P, ribose 5-phosphate; TA, transaminase; TCA, tricarboxylic acid; α-KG, α-ketoglutarate; 3-PG, 3-phosphoglycerate.
이 검토의 첫 번째 부분에서는 종양에서 규제가 완화되는 주요 대사 캐스케이드를 분석합니다.
이러한 경로와 종양 세포 증식 및 생존에서의 역할에 대한 명확한 이해는 효과적인 치료법의 표적을 식별하는 데 필수적입니다.
기사의 두 번째 부분과 세 번째 부분에서는 이용 가능한 전임상 증거를 기반으로 종양 대사를 성공적으로 표적화할 가능성이 있는 식이 및 약리학적 전략을 각각 검토합니다.
암세포의 생존과 증식을 유지하는 대사 경로
포도당
상향 조절된 호기성 해당작용은 암세포에 몇 가지 이점을 제공합니다
첫째, 생리학적 혈액 농도에서 포도당은 에너지 수요를 충족시키기 위해 충분히 빠른 ATP 생산을 보장하는 동시에 바이오매스 생산을 통해 동화 과정에 연료를 공급합니다.
둘째, 피루브산 유래 젖산염은 배설될 때 대식세포와 다른 면역 세포를 모집하는 세포외 산 환경을 만들어 전이를 촉진합니다.
셋째, 피루브산은 단백질 또는 기타 생체 분자의 합성에 참여하는 옥살로아세테이트와 아미노산(AA) 알라닌 및 아스파르테이트를 생산하는 데 사용할 수 있습니다.
요약하면, 호기성 해당작용은 질소기(일반적으로 글루타민에서 유래)의 적절한 공급원이 제공될 때 AA 생합성을 포함하여 고도로 증식하는 암세포의 에너지 및 대사 요구의 대부분을 충족할 수 있습니다.
종양에서 호기성 해당작용은 종종 PI3K 및 RAS를 포함한 종양유전자에 의해 자극되는데, 이는 포도당 수송 유전자 GLUT1 과 해당 효소인 hexokinase 및 phosphofructokinase의 발현을 유도하고 동시에 피루브산의 미토콘드리아 산화를 억제합니다( 그림 1 ).
종양에 대한 최근 의 생체 내 연구에 따르면 포도당 유래 피루브산의 일부가 미토콘드리아 트리카르복실산(TCA) 회로로 전환되어 지방산(FA) 또는 글루타메이트 및 글루타민과 같은 기타 비필수 AA 합성을 위한 중간체 또는 추가 에너지를 생성할 수 있습니다.
빠르게 증식하는 종양 세포에 대한 주요 에너지원 및 동화작용 전구체로서의 호기성 해당작용의 우세를 감소시키면서, 이러한 연구 는 생체내 악성 종양에 대한 주요 대사 기질로서 포도당을 확인합니다.
전임상 증거는 조절되지 않은 포도당 대사를 표적으로 하는 것이 잠재적으로 효과적인 항암 접근법임을 시사합니다.
실제로, 2-deoxy- d -glucose를 통한 세포외 포도당 감소 또는 해당 작용 억제 는 여러 암세포주에서 증식 정지를 유도하고 세포독성 치료와 상승작용을 일으켜 세포자멸사를 활성화합니다
이러한 효과는 미토콘드리아 산화적 인산화가 손상된 세포에서 특히 강력합니다
LDHA(lactate dehydrogenase A) 효소에 의한 젖산 생성 억제는 해당과정 이 높은 암세포에 유독한 NADH로부터 NAD + 재생을 방지 함으로써 해당과정 진행을 중단시키는 또 다른 방법입니다
더욱이, 혈당을 감소시키는 식이 요법은 또한 화학요법의 항종양 활성을 향상시키고 인간 종양 세포로 이종이식된 마우스의 생존을 연장합니다
마지막으로, 고혈당/당뇨병 상태는 다형성 교모세포종(GBM), 결장직장암 또는 급성 백혈병 환자에서 더 나쁜 예후와 관련이 있습니다.
암 치료에서 호기성 해당작용을 표적화하기 위해 두 가지 다른 접근법이 이용될 수 있습니다:
혈당 감소(전신적 접근법) 또는 해당 과정의 특정 효소 억제(세포 자율적 접근법).
전자의 전략은 혈당 상태(고혈당 대 정상 혈당), 18 FDG-PET를 통해 감지된 포도당에 대한 종양 결합력 또는 분자 종양 프로필(예: RAS 또는 PI3K 활성화)을 기반으로 하는 환자 하위 그룹을 신중하게 선택해야만 혜택을 받을 가능성이 더 높습니다.
세포 자율 접근 방식에서는 가장 적합한 분자 표적을 식별하고 강력하고 선택적인 억제제를 합성해야 합니다.
아미노산
억제되지 않은 종양 증식은 FA, 기타 AA, 뉴클레오티드 및 항산화제 글루타티온을 포함한 필수 생화학적 성분의 전구체로서, 또는 마지막으로 모노카본 단위 공여자로서 구조 및 효소 단백질의 빌딩 블록으로 사용되는 AA의 지속적인 보충을 필요로 합니다.
정상 조직과 유사하게 암세포는 일반적으로 일부 AA("비필수" AA라고 함)를 합성할 수 있지만 나머지 "필수" AA의 혈액 공급에 의존합니다.
그러나 일부 종양은 하나의 특정 비필수 AA를 합성하는 능력을 상실하여 외부 공급에 의존하게 될 수 있습니다.
이 현상을 "요구성=auxotrophy"이라고 합니다.
종양에서 AA 대사를 표적으로 하는 한 가지 잠재적 전략은 식이 또는 약리학적 개입을 통해 순환 혈액 AA를 고갈시키는 것입니다.
그러나 필수 AA를 빼면 정상 조직에 독성이 나타날 수 있으므로 이 전략은 영양요구성 종양에만 합리적으로 이용할 수 있습니다.
한 가지 대체 전략은 혈중 농도에 영향을 주지 않으면서 특정 AA의 대사에 관여하는 세포내 효소를 표적으로 삼는 것입니다.
글루타민은 식이 공급원, 근육 세포의 단백질 분해 또는 새로운 합성에서 얻을 수 있는 비필수 AA 입니다 .
유방암 및 폐 종양에서 유래된 일부를 포함하여 여러 유형의 암 세포주는 생존 및 증식을 위해 글루타민 공급에 의존합니다.
암세포는 원형질막에 위치한 글루타민 수송체 SLC1A5를 통해 세포외 환경(예: 혈액)에서 글루타민을 직접 내재화할 수 있습니다.
대안적으로, 글루타민과 다른 AA는 거대음세포작용(macropinocytosis)을 통해 내재화되는 세포외 단백질의 리소좀 분해에서 파생될 수 있습니다.
이 후자의 메커니즘은 RAS 에 설명되어 있습니다.-돌연변이된 췌장암과 방광암은 세포외 글루타민에 의존하지만 충분한 양의 세포외 알부민과 리소좀에서 분해될 다른 단백질이 제공되면 글루타민 비의존성이 됩니다
종양에서 글루타민은 단백질 또는 뉴클레오타이드 합성, 포도당 흡수 자극, 라파마이신의 포유동물 표적 활성화(mTOR)에 참여합니다.
그러나 대부분의 세포내 글루타민은 글루타미나제(GLS) 효소에 의해 글루타메이트로 전환되며, 이는 글루타티온의 전구체로 사용되거나 효소 글루타메이트 탈수소효소(GDH) 또는 트랜스아미나제(TA)에 의해 촉매되는 반응을 통해 알파-케토글루타레이트(α-KG)를 생성합니다. 그림 1 ).
글루타민 유래 α-KG는 미토콘드리아 TCA 회로에서 산화 대사를 겪을 수 있습니다
또는 환원 대사를 통해 "역 TCA 회로"에서 이소시트레이트와 시트레이트를 형성하여 FA 및 콜레스테롤 합성에 기여합니다( 그림 1 ).
발암성 단백질 MYC는 글루타민 수송 유전자 SLC1A5 와 GLS 의 발현을 유도하여 글루타민의 이화 대사를 직접 자극합니다.
참고로, GLS 억제 및 글루타민 결핍은 MYC 과발현 종양 세포의 증식을 중단시킵니다.
최근의 한 논문에서는 PIK3CA 돌연변이에서 글루타민의 산화 대사가 증가 했지만 PIK3CA 야생형(WT) 결장직장암에서는 그렇지 않은 것으로 나타났습니다.
다른 한편으로, 다른 연구에서는 글루타민 섭취가 생체 내 GBM 및 폐 종양에 필수적이지 않을 수 있음을 시사하며, 여기서 포도당 이용은 에너지 및 보충 에너지 요구를 모두 충족시키기에 충분할 것 같습니다.
글루타민 세포 내 이용률은 시험관 내에서 자란 암세포와 원래의 미세 환경에 묻혀 있는 종양 사이에 크게 다를 수 있으므로 종양 의존성은 생체 내 종양에서 글루타민 흡수 및 이용률을 측정하여 평가해야 합니다(예: 정맥내 투여된 방사성 표지된 글루타민의 운명)
식이 중재를 통해 글루타민 혈중 농도를 재현 가능하게 수정하는 것이 어렵기 때문에 글루타민 수송체 또는 글루타민 대사 효소를 표적으로 하는 약리학적 전략은 글루타민 중독 종양을 표적으로 하는 가장 유망한 접근법인 것 같습니다.
메티오닌은 단백질 합성, DNA 및 단백질 메틸화, 글루타티온 및 폴리아민 합성에 참여하는 필수 AA입니다.
정상 세포는 다른 AA에서 메티오닌을 합성할 수 없지만 호모시스테인에서 메티오닌을 생성할 수 있습니다.
반대로 결장, 유방, 전립선을 포함한 여러 종양 세포주는 메티오닌이 없으면 증식할 수 없고 생존할 수 없습니다.
메티오닌은 GBM에서 발암성 경로를 활성화하는 데 기여하고 메티오닌 결핍은 종양 세포 증식에 부정적인 영향을 미칩니다.
시험관 내 데이터 와 일치 하며 메티오닌의 식이 섭취를 줄이면 생체 내 에서 종양 성장이 억제됩니다.
마우스 및 쥐 모델, 또한 세포독성 치료와 함께 상승적으로 종양 크기를 감소시킵니다.
따라서 메티오닌의 식이 제한은 향후 연구에서 추가 조사가 필요한 유망한 항암 접근법입니다.
아르기닌은 단백질 합성에 사용되거나 산화질소, 폴리아민, 크레아틴, 글루타민 및 프롤린이 부족한 경우 프롤린의 전구체로 사용되는 비필수 AA입니다.
또한, 아르기닌은 특히 격렬한 신체 운동 후 mTOR 활성화 및 성장 호르몬(GH), 인슐린 및 인슐린 유사 성장 인자 1(IGF1) 분비에 관여 합니다.
순환하는 아르기닌의 공급원에는 식이, 단백질 분해 및 새로운 합성이 포함되며, 이는 아르기니노숙시네이트 합성효소 1(ASS1) 효소에 의해 시작됩니다.
그것의 식이 섭취는 증가된 조직 성장 조건(예: 어린 시절) 또는 특정 스트레스(염증과 같은, 참조 41 )에서만 필수적이 됩니다.
ASS1 억제 종양 에서 아르기닌 가용성을 감소시키는 것은 강력하고 선택적인 항암 전략으로서 가능성이 있습니다.
세린과 글리신은 비필수 AA이며, 해당 중간체 3-포스포글리세레이트로부터 PHGDH(phosphoglycerate dehydrogenase) 효소에 의해 시작된 생화학적 캐스케이드를 통해 합성될 수 있습니다( 그림 1 ).
그들은 산화 환원 균형과 퓨린과 글루타티온의 새로운 합성에 참여하여 단백질, DNA 및 지질 합성에 기여합니다
세포내 세린은 또한 mTOR 활성화를 통해 세포 증식을 자극합니다
이러한 다중 기능으로 인해 고도로 증식하는 암세포는 세린과 글리신 모두를 지속적으로 보충해야 합니다.
일부 종양은 외부 환경에서 세린을 흡수하고, 세린 함유 식품의 식이 제한에 민감할 수 있습니다.
인간 피험자에 대한 데이터가 부족함에도 불구하고 쥐에 대한 실험은 세린의 식이 섭취를 제한하는 것이 안전하고 세린과 글리신 혈중 농도를 약 50% 낮추고 종양 발달을 지연시킬 수 있음을 보여줍니다.
또한, 세린 제한은 메트포르민과 상승 작용하여 이미 확립된 암의 성장을 억제합니다.
다른 악성 종양, 특히 삼중 음성 유방암(TNBC) 및 흑색종은 PHGDH 유전자의 증폭을 통해 세린 합성 효소, 특히 PHGDH를 과발현하여 외부 세린 공급으로부터 완전히 독립적이 됩니다.
PHGDH를 억제하면 PHGDH를 과발현하는 종양의 증식을 억제하고 매우 공격적인 악성 종양을 표적으로 삼을 가능성이 있습니다.
세린 독립성을 위해 PGHDH를 과발현하는 세포가 지불하는 대가는 해당 중간체의 고갈입니다.
결과적으로, 포도당 결핍 또는 메트포르민 유도 미토콘드리아 산화적 인산화 억제는 포도당 의존적 세린 합성에 의존하는 암세포에 특히 독성을 나타낼 수 있습니다( 그림 1 , 참조 50 ).
지질
지질은 세포막의 필수 구성요소로서 유동성과 막 고정 신호 전달 효소의 활성화에 기여합니다.
암세포는 새로운 막과 세포 소기관을 형성하기 위해 FA의 지속적인 보충에 의존합니다.
그러나 대부분의 정상 세포가 자유 FA 또는 지단백질의 일부로 혈류를 순환하는 식이 또는 지방 조직 유래 FA를 내재화하지만, 대부분의 암세포 는 영양소 가용성 및 호르몬 자극과 독립적으로 FA를 합성 합니다 .
FA 합성은 시트르산이 아세틸-CoA로 전환된 다음 아세토아세틸-CoA로 전환되는 것으로 시작되며, 이는 최종적으로 연장되어 팔미테이트 및 기타 FA를 형성합니다.
이 과정에서 중요한 효소는 캐스케이드의 제한 단계 반응을 촉매하는 아세틸-CoA 카르복실라제(ACC)와 다중 소단위 FA 합성효소(FASN) 효소입니다( 그림 1 ).
FA 합성에 사용되는 구연산염의 주요 공급원은 포도당과 글루타민 유래 α-KG이며, 특히 저산소 상태 또는 미토콘드리아 산화 기계의 붕괴에서 발생합니다.
결정적으로, FASN은 유방암, 난소암, 폐암, 결장암, 자궁내막암, 위암, 두경부암을 포함한 대부분의 종양에서 과발현됩니다
참고로, MAPK/PI3K 발암 경로와 FASN은 세포 증식을 대사 과정과 연결하는 양성 피드백 루프를 통해 서로를 활성화할 수 있습니다.
마지막으로 cerulenin, C75, 항비만제 orlistat 및 에피갈로카테킨-3-갈레이트(EGCG)와 같은 녹차 폴리페놀을 사용한 FASN의 약리학적 억제는 높은세포외 농도 FA에 의해 구제될 수 있는 상당한 시험관내 및 생체내 항암 효과를 초래합니다.
간접적으로(예: 해당과정/글루타민 대사 억제) 또는 직접(ACC/FASN 억제) FA 합성을 표적으로 하는 것은 종양 세포에서 FA 대사에 선택적으로 영향을 미칠 가능성이 있습니다.
그러나 최근 데이터에 따르면 일부 종양은 혈류에 존재하거나 종양 미세 환경의 인근 세포에 의해 생성되는 세포외 지질, 특히 리소인지질을 흡수할 수 있습니다.
치료적 관점에서 이것은 새로운 FA 합성의 억제가 종양 세포내 지질을 완전히 고갈시키기 위해 세포외 지질 흡수의 억제와 결합되어야 함을 의미합니다.
콜레스테롤
콜레스테롤은 생물학적 막의 또 다른 필수 성분이며 이소프레노이드와 스테로이드 호르몬의 전구체입니다.
일련의 생화학적 반응을 통해 아세틸-CoA로부터 합성되며, 첫 번째 단계는 3개의 아세틸-CoA 분자를 축합하여 3-히드록시-3-메틸글루타릴-CoA(HMG-CoA)를 형성하는 것입니다.
캐스케이드의 속도 제한 단계 반응은 HMG-CoA 환원효소(HMGCR) 효소에 의해 촉매되는 HMG-CoA로부터 메발로네이트의 형성으로 구성됩니다.
흥미롭게도 HMGCR은 여러 종양에서 과발현되어 포도당 또는 글루타민에서 파생된 아세틸-CoA에서 콜레스테롤과 이소프레노이드의 생성을 증가시킵니다.
더욱이, 스타틴(예: 심바스타틴 또는 아토르바스타틴)에 의한 HMGCR 억제는 화학요법제와 상승적으로 여러 종양 세포주에서 증식을 중단하거나 세포자멸사를 유도합니다.
따라서 콜레스테롤 대사를 표적으로 하는 것은 종양 대사 분야에서 유망한 연구 주제입니다.
케톤체
저혈당증 또는 감소된 포도당 흡수 하에서, 간세포는 FA β-산화로부터 유도된 과잉 아세틸-CoA를 케톤체, 특히 acetoacetate 및 β-hydroxybutyrate로 전환하며, 이는 혈류로 방출되고 말초 세포에서 아세틸-CoA를 생성하고 에너지 및 생합성 요구 사항를 충족시키기 위해 사용됩니다.
따라서 FA 유래 케톤체는 포도당이 부족한 상태에서 정상 조직에 필수적입니다.
건강한 세포와 달리 대부분의 암세포는 주로 케톤을 아세틸-CoA로 전환하는 효소를 발현하지 않고 에너지 및 생합성 요구를 위해 포도당에 중독되어 있기 때문에 케톤체를 주요 에너지원으로 사용할 수 없습니다.
더욱이, 종양 세포가 미토콘드리아에서 아세틸-CoA를 산화시키도록 함으로써 케톤체는 해당 과정을 지연시키고 고도로 해당하는 종양에 독성을 나타낼 수 있습니다.
시험관 내 데이터 와 일관되게 , 마우스 모델을 사용한 생체 내 연구는 특정 식이 중재를 통해 순환 케톤체 농도를 증가시킨 후 종양 성장 감소 및 동물 생존 증가를 입증했습니다.
전임상 증거에 기초하여, 혈액 내 케톤체 증가는 포도당 감소 또는 약리학적 해당작용 억제와 상승작용을 일으킬 수 있습니다.
인슐린
인슐린은 말초 세포에서 포도당 흡수와 간에서 FA 합성을 자극하여 탄수화물과 지질 대사를 조절하는 필수 췌장 호르몬입니다.
인슐린 수용체(IR)에 결합하여 IR 자극/RAS/RAF/MEK/MAPK 및 RAS/PI3K/AKT/mTOR 신호 전달 캐스케이드를 활성화합니다(참조: 69 , 그림 2 ).
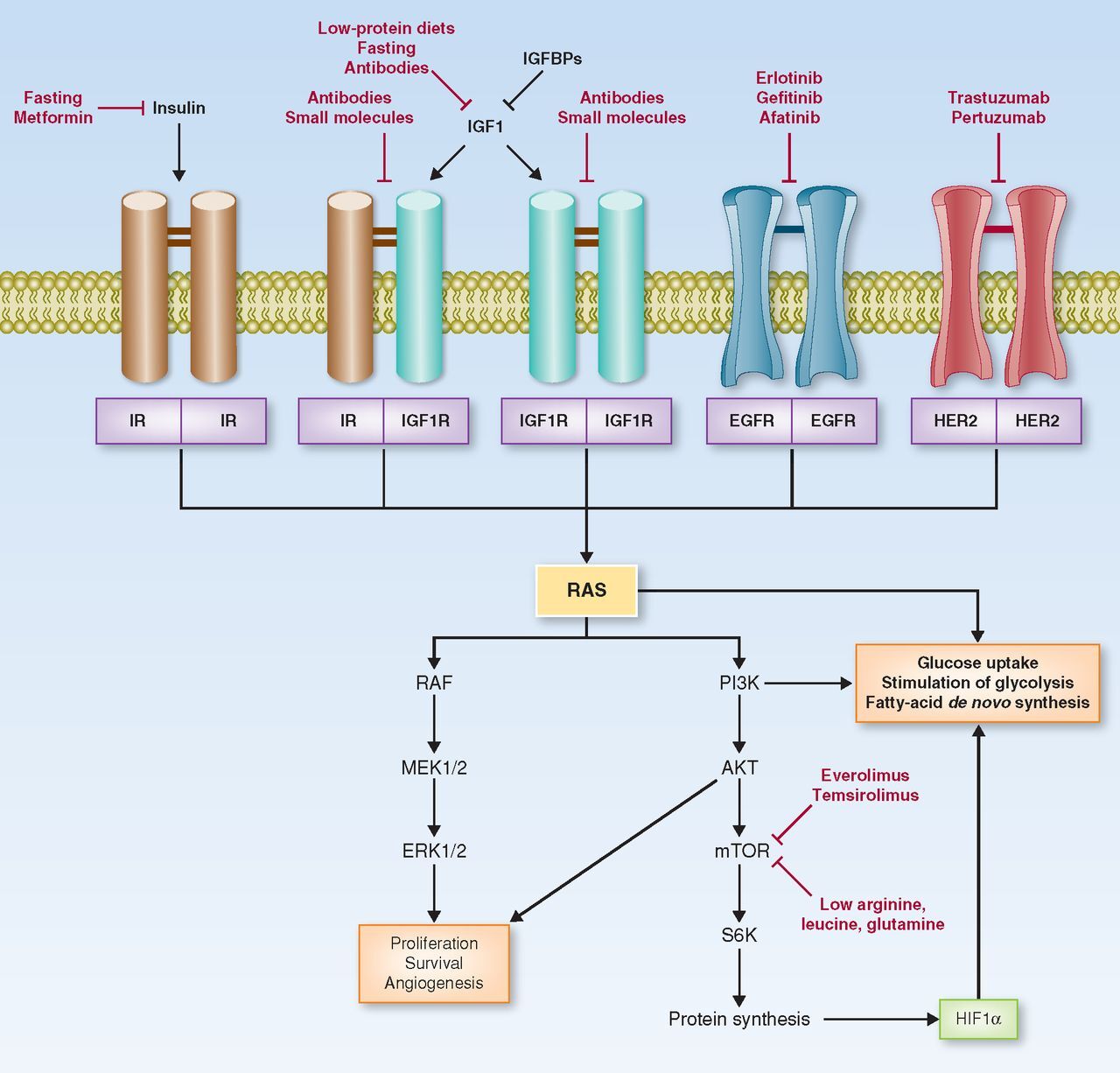
종양 세포에서 인슐린/인슐린 유사 성장 인자 1 신호 및 대사 경로 간의 연결.
인슐린 수용체(IR) 및 IGF1R은 동종이량체화 또는 이종이량체화되어 TK 도메인을 활성화할 수 있습니다.
이것은 다운스트림 RAS/RAF/MEK/ERK 및 RAS/PI3K/AKT/mTOR 신호 전달 경로를 자극하여 HIF1α를 포함한 여러 단백질의 생존, 증식, 혈관신생 및 리보솜 합성을 유도합니다.
PI3K, RAS 및 HIF1α는 포도당 흡수 및 호기성 해당과정뿐만 아니라 지방산의 새로운 합성을 포함하여 신생물 세포에서 중요한 대사 변형을 촉진합니다.
RAS/RAF/MEK/ERK 및 RAS/PI3K/AKT/mTOR 캐스케이드는 EGFR 및 HER2를 포함한 다른 막 수용체에 의해 활성화될 수 있기 때문에 IGF1/IGF1R 경로의 억제와 다른 TK 수용체 또는 이들의 다운스트림 매개체(예: mTOR)의 표적화를 결합하면 암 세포 증식 및 생존을 상승적으로 억제할 수 있습니다.
EGFR, epidermal growth factor receptor; HER2, human epidermal growth factor receptor 2; HIF1α, hypoxia-inducible factor-1α; IGF1, insulin-like growth factor 1; IGFBP, IGF1 binding protein; IGF1R, IGF1 receptor; IR, insulin receptor; mTOR, mammalian target of rapamycin; PI3K, phosphoinositide 3-kinase; S6K, S6 kinase.
세포 성장 배지에 첨가하면 생리학적 인슐린 농도가 암세포 증식을 자극합니다.
더욱이, 외인성 인슐린 및 고인슐린혈증은 동물의 종양 성장 및 전이를 가속화하는 반면, IR 억제는 이러한 효과를 역전시킵니다.
인슐린 매개 발암 활성을 담당하는 메커니즘에는 다음이 포함 됩니다 .
(ii) 간세포에 의한 인슐린 자극 IGF1 생산;
(iii) 인슐린에 의한 IGF1 수용체(IGF1R)의 직접적인 활성화.
후향적 연구에 따르면 고인슐린혈증 환자는 공격적인 종양이 발병하고 암으로 사망할 가능성이 더 높습니다.
그러나 혈중 인슐린 수치를 낮추는 것이 이미 확립된 종양에 영향을 미칠 수 있는지 여부는 현재 알려지지 않았습니다.
더욱이, 고혈당/고인슐린혈증 환자에서 식이요법(예: 탄수화물 제한 요법) 또는 약리학적(예: 메트포르민) 접근을 통해 혈중 인슐린을 감소시킬 수 있지만, 정상 혈당 환자는 인슐린 의존성 당뇨병을 유발하여 혈당을 증가시키고 종양 세포에 과잉 공급할 수 있는 위험 때문에 이 전략의 이점을 거의 얻지 못할 것입니다.???
IGF1
펩티드 호르몬 IGF1은 GH, 인슐린및 단백질이 풍부한 식이에 의해 자극될 때 간세포 및 기타 세포 유형에 의해 생성됩니다 .
IGF1 은 뼈 연골을 포함한 여러 조직의 성장을 촉진하는 청소년기에 주요 생리학적 역할을 합니다 .
IGF1은 종양 세포의 IGF1 티로신 키나제(TK) 수용체(즉, IGF1R 및 IGF2R)에 결합하고 이를 활성화하여 RAS/RAF/MEK/MAPK 또는 RAS/PI3K/AKT/mTOR 신호 전달 경로에 수렴하는 인산화 캐스케이드를 활성화합니다.
세포 증식을 자극하고 세포 사멸을 억제합니다.
IGF1 신호전달을 표적으로 하는 것은 종양 성장에 영향을 미치면서 동시에 IGF1 유도 면역억제를 방해하고 효과적인 항종양 반응을 자극할 수 있습니다.
안타깝게도 지금까지 전이성 유방암, 췌장암, 폐암 환자를 대상으로 한 연구에서는 IGF1/IGF1R 축 억제제의 효능을 입증하지 못했습니다.
순환하는 IGF1 수준 또는 IGF1R의 다운스트림 생화학적 캐스케이드의 활성을 기반으로 한 더 나은 환자 선택은 IGF1R 억제의 효과를 향상시킬 수 있습니다.
더욱이, IGF1R의 하류(예, mTOR) 또는 EGFR과 병행하여 작용하는 키나제의 동시 표적화는 IGF1/IGF1R 억제제와 상승작용을 일으킬 수 있습니다(참고 문헌 83, 84 ; 그림 2). ).
마지막으로, IGF1 축 억제에 의해 유도될 수 있는 고혈당증을 감소시키는 식이/약리학적 개입은 IGF1R 억제제의 효능을 상당히 향상시킬 수 있습니다.
인간 암에서 TCA 주기 효소의 규제 완화
TCA 주기 효소 탈조절이 종양 성장에 어떻게 영향을 미치는지 조사하는 것은 IDH 억제제 또는 티로신 키나제 억제제를 포함한 효과적인 항종양 전략을 설계하는 데 중요할 것입니다(TKI ).
식이 요법
전임상 연구에 따르면 이 식단은 건강한 조직에 큰 영향을 미치지 않으면서 종양 세포의 대부분의 규제 완화된 대사 경로를 표적으로 해야 합니다.
이 개요에서 우리는 표 1 에 요약된 바와 같이 안전성 및 항종양 활성에 대한 확실한 전임상 증거가 있는 접근법에 초점을 맞출 것입니다 .
1 번 테이블.
임상 조사 중인 식이 중재의 주요 특성
| 단기 단식 |
|
|
|
|
| 케톤 생성 식단 |
|
|
|
|
| FMD |
|
|
|
|
약어: CT, chemotherapy; FMD, fasting-mimicking diet.
단식
"단기 단식" 또는 STF=short-term fasting라고도 하는 연속 평균 3~5일 동안 칼로리 섭취를 피하면 다음을 포함하여 암 성장을 방해할 수 있는 여러 전신 대사 변화가 유발됩니다.
(ii) 말초 인슐린 감작으로 인한 인슐린혈증 감소;
(iii) IGF1의 감소 및 증가된 IGFBP 수준; 및
(iv) 증가된 혈액 케톤체.
상대적 혈당 감소는 기준 혈당 농도에 의존하고 정상혈당 환자에서는 부족할 수 있지만, IGF1 및 IGFBP는 STF 동안 각각 더 일관되게 감소(약 50%) 및 증가(5배)됩니다.
따라서 단식은 종양 대사와 순환 성장 인자 모두에 영향을 줄 수 있습니다.
그러나 순환 AA에 미치는 영향은 아직 명확하지 않습니다.
건강한 지원자에서 4~5일 동안의 단식은 메티오닌, 발린, 류신 및 이소류신 혈중 농도의 적당한 증가를 유도한 반면, 다른 AA에는 영향을 미치지 않거나 약간 감소시켰습니다.
그러나 건강한 개인과 암 환자 사이의 전신 AA 대사의 상당한 차이로 인해 이러한 결과는 진행성 종양이 있는 대상 집단으로 직접 번역될 수 없습니다.
시험관 내 실험에서 STF는 세포 성장 배지에서 포도당과 성장 인자의 감소로 구성된 단기 기아(short-term starvation=STS)에 의해 만들어집니다.
STS는 정상 세포를 상대적으로 보호하면서 여러 암 세포주를 다른 화학 요법 약물에 민감하게 만듭니다. .
이러한 차별적 스트레스 반응(DSR)은 영양이 제한된 건강한 세포가 증식 및 동화 과정을 중단하고 이화 과정(예: 자가포식)과 DNA 및 단백질 복구와 같은 보호 기능을 활성화하는 능력에 따라 달라질 수 있습니다.
대조적으로, 대부분의 암세포는 영양이 부족한 상황에서도 증식과 동화작용을 멈출 수 없습니다.
그러나 구성적으로 활성인 PI3K/AKT 경로를 가진 특정 종양은 IGF1 및 인슐린 자극과 독립적으로 성장하고 따라서 시험관 기아 및 생체 내 칼로리 제한 둘 다에 둔감하기 때문에 영양소 및 성장 인자 결핍에 대한 종양 세포 민감성은 일반적인 규칙이 아닙니다.
여러 종양의 생체 내 마우스 모델 에서 STF는 화학 요법과 유사하게 암 성장을 억제합니다.
더욱이, 단식은 여러 정상 조직에 대한 화학요법 유발 독성을 감소시키고 종양 세포를 죽이기 위해 화학요법 또는 방사선 요법과 상승 작용을 합니다.
이러한 효과는 화학 요법 동안 금식하는 동물에서 상당한 생존 연장으로 해석됩니다.
따라서 정상 조직과 암 조직 사이의 DSR은 정상 조직을 보존하면서 암세포를 특이적으로 표적으로 하는 치료 창을 만듭니다.
최근에, STS와 STF는 또한 폐, 유방암 및 결장직장 인간 암의 성장을 억제하는 광범위한 TKI와 함께 시험관내 및 생체내 항종양 효과를 상승적으로 나타내었습니다
예비 데이터는 STF가 안전하고 치료 효능을 명백히 손상시키지 않으면서 여러 유형의 종양이 있는 인간의 화학요법 유발 부작용을 줄이는 데 잠재적으로 유용하다는 것을 나타냅니다.
환자는 STF 동안 체중의 10%까지 감소하지만 체중 감소는 일반적으로 되돌릴 수 있습니다.
최근 한 연구에서 (신)보조 화학요법 동안 STF를 받은 II/III기 유방암 환자는 규칙적인 식이요법을 따르는 환자에 비해 혈액학적 독성과 림프구를 포함한 순환 혈액 세포에 대한 화학요법 유도 DNA 손상이 더 적다고 보고했습니다.
억제 면역 세포 집단과 항종양 면역 세포 집단 사이의 균형에 대한 금식의 잠재적 영향은 여러 암의 치료에서 새로운 면역 요법의 결과에 극적인 결과를 초래할 수 있기 때문에 집중 연구의 또 다른 분야입니다.
이와 관련하여 유망한 것은 단식이 마우스와 인간에서 화학요법으로 유발된 림프구감소증을 감소시키고, 단식으로 매개된 항종양 효과는 마우스에서 T 림프구의 존재에 의존한다는 예비 발견입니다.
케톤 생성 다이어트
지방이 풍부하고 단순 및 복합 탄수화물이 부족한 식단은 유기체가 탄수화물에서 FA 대사로 전환하도록 하며, 증가된 FA 산화가 케톤체의 혈액 수준을 상승시키기 때문에 "케톤 생성 식단"(KD)이라고 합니다.
다량 영양소 구성(지방:단백질:탄수화물), 지방 기원(동물 대 식물성) 및 총 칼로리 함량의 특정 비율에 따라 다른 KD는 상당히 다른 대사 효과를 생성할 수 있습니다.
가장 효과적인 KD를 찾고 있습니다.
종양 대사에 대한 KD의 영향에 잠재적으로 영향을 미칠 수 있는 두 가지 중요한 변수는 총 칼로리 함량과 다량 영양소 구성 비율입니다.
금식으로 얻은 포도당, IGF1 및 인슐린혈증의 빠른 감소는 빠르게 증식하는 암에서 대사 위기를 유도하는 데 필수적일 수 있습니다.
대조적으로, 동일한 대사 산물의 느린 감소는 종양이 신진 대사에 더 쉽게 적응하고 어려움을 피할 수 있도록 합니다.
단식 모방 다이어트
표준화된 식물성 저칼로리(500–1,000Kcal/day), 저단백 KD인 STF(따라서 "단식 모방 다이어트" 또는 FMD라고 함)와 비교하여 전신 대사를 수정하는 견딜 수 있는 식단을 설계하려고 합니다. 지방:탄수화물:단백질 비율이 약 50:40:10으로 최근에 개발되었습니다
FMD는 STF에 대한 더 안전하고 수용 가능한 대안이며 완전한 금식에 필적하는 대사 및 항종양 효과를 생성하는 동시에 잠재적으로 효과적인 항종양 면역을 향상시킵니다
STF의 경우 순환하는 AA에 대한 FMD의 영향은 여전히 불분명합니다. 그러나 AA는 종양 성장에 중요하기 때문에 FMD에 대한 향후 연구에서는 이 측면을 우선시해야 합니다.
단백질 및 AA 제한 식단
단백질 제한 식단은 종양 세포에 대한 AA 공급을 감소시키고 결과적으로 단백질 합성, AA 매개 mTOR 활성화 및 기타 대사 과정에 영향을 미쳐 종양 성장을 잠재적으로 억제할 수 있습니다.
전임상 실험에 따르면 단백질 제한은 흑색종의 생체 내 종양 성장을 억제하지만 유방암 모델은 억제하지 않으므로 그 효능이 종양 의존적일 수 있음을 나타냅니다
진행성 종양에서 단백질 제한에 대해 세 가지 다른 주요 문제가 제기될 수 있습니다.
첫째, 안전성과 유효성에 대한 임상자료가 부족하다.
둘째, 비필수 AA는 새로 만들 수 있습니다 .
혈액을 순환하는 전구체로부터 종양 및 정상 세포에 의해 합성되므로 일반적인 단백질 제한이 필요하지 않습니다.
마지막으로, 장기간의 단백질 결핍은 근육 세포 단백질의 종양 유발 분해를 자극하여 한쪽에서는 근감소증을 유발하고 다른 쪽에서는 종양에 근육 세포 유래 AA를 과다 공급할 수 있습니다.
단일 AA의 식이 제한은 특정 종양 영양요구성을 이용하기 위해 더 안전하게 사용될 수 있습니다.
전임상 데이터에 기초하여, 메티오닌 제한 식이요법은 진행성 암 환자 집단에서 테스트되었으며 양호한 내약성 프로파일을 보여주었습니다
전반적으로, 순환 혈액 메티오닌은 메티오닌 제한 시 약 60% 감소하고 항종양 활성의 일부 예비 증거도 보고되었습니다.
그러나 메티오닌은 다른 AA에 대해 예외적이지만 식이 부족이 지속적으로 빠르고 예측 가능한 혈중 농도 감소와 관련이 없고 안전성 문제가 제기됩니다
더욱이, 섬유아세포, 내피 세포 및 면역 세포를 포함한 종양 미세 환경의 정상 세포는 단백질의 자가포식 분해에서 유래하는 AA를 종양 세포에 공급할 수 있으므로 잠재적으로 식이 제한의 영향을 제한할 수 있습니다
장내 미생물과 식이요법
설명할 수 있는 가능한 메커니즘에는 면역 세포 활동 및 대사 조절의 박테리아 매개 조절이 포함됩니다.
실제로 장내 세균은 복합 탄수화물 및 단백질과 같은 식이와 함께 도입된 거대분자를 대사하여 단쇄 지방산과 AA를 생성하고 혈류로 방출합니다.
약리학적 중재
식이 요법의 광범위한 적용은 심각한 제한으로 인해 방해받을 수 있습니다.
첫째, 일부 피험자는 급격한 식단 변화, 특히 단식을 받아들이지 않을 수 있습니다.
둘째, 칼로리를 심하게 제한하는 요법은 모든 암 사망의 최대 20%를 유발하는 종양 또는 화학요법으로 인한 치명적인 증후군인 영양실조 또는 악액질 환자에게 피해를 줄 수 있습니다.
악액질은 전신 염증, 정상 조직 손상 및 체중 감소를 특징으로 하며 특히 진행 단계에서 상당한 칼로리 제한과 양립할 수 없습니다.
셋째, 식이는 표준화하기 어려울 수 있으며 식이 구성이나 환자 순응도의 다양성은 임상 시험에서 재현성 문제를 일으킬 수 있습니다.
마지막으로, 일부 종양은 하나의 대사 경로에 특이적으로 중독될 수 있으며, 특정 식이요법에 의해 유도되는 다면발현 효과는 충분히 강하지 않거나 선택적이지 않을 수 있습니다.
대사를 표적으로 하는 약물 요법은 식이 접근법에 대한 귀중한 대안이며 하나의 특정 대사 경로를 선택적으로 표적으로 삼는 것을 목표로 합니다.
약리학적 접근법의 잠재적인 이점은 환자에게 심각한 생활 방식 변화를 일으키지 않고 체중 감소를 유도하지 않아야 한다는 사실을 포함합니다.
이 섹션에서는 표 2 에 요약된 대로 진행 중인 임상 시험을 정당화하기 위해 생화학적 메커니즘과 내약성 및 효능에 대한 전임상/임상 데이터를 기반으로 가장 유망한 것으로 보이는 분자에 초점을 맞춥니다 .
표 2.
임상시험 중인 대사표적제의 주요 대사효과 및 임상적 특징
| 메트포르민 |
|
|
|
폐 : NCT02019979, NCT02285855, NCT02115464; 전립선 : NCT02640534; 가슴 : NCT01310231; 자궁내막 : NCT02755844, NCT01797523; 난소 : NCT02312661, NCT02122185; WDNET : NCT02294006, NCT02823691 |
| 아스피린 |
|
|
|
전립선 : NCT02420652; 결장직장: NCT02607072 , NCT00565708; 가슴 : NCT02602938, NCT02804815; 폐 : NCT01707823; 식도 : NCT02326779 |
| DCA |
|
|
|
H&N : NCT01386632 |
| 고시폴 |
|
|
|
NSCLC : NCT01977209; B-CLL : NCT01003769 |
| AZD3965 |
|
|
|
여러 진행성 종양 : NCT01791595 |
| CB-839 |
|
|
|
유방, 폐, 신장 : NCT02771626, NCT02071862; 백혈병 : NCT02071927 |
| ADI-PEG |
|
|
|
간, 폐, 포도막 흑색종, 신경교종 및 중피종 : NCT02029690; 전립선 및 NSCLC : NCT01497925; 위장 : NCT02102022; 중피종: NCT02709512 |
| EGCG/녹차 추출물 |
|
|
|
가슴 : NCT00949923; 요로피 : NCT01993966 ; SCLC : NCT01317953 |
| 스타틴 |
|
|
|
직장 : NCT02161822; NCT02569645; 전립선 : NCT01992042; 가슴 : NCT02483871, NCT02416427; 방광 : NCT02360618 |
| 라팔로그 |
|
|
|
유방, 신장 및 췌장 : NCT02077933; 자궁내막 및 난소 : NCT02188550; WDNET : NCT01648465, NCT02294006 |
약어: WDNET, well-differentiated neuroendocrine tumor; H&N, head and neck; NSCLC, non–small cell lung cancer; B-CLL, B-cell chronic lymphocytic leukemia; SCLC, small cell lung cancer; CT, chemotherapy; RT, radiotherapy.
메트포르민
제2형 당뇨병 치료를 위한 대조약인 메트포르민은 장내 포도당 흡수와 간 신생 포도당 생성을 억제하고 또한 말초 조직(주로 근육 및 지방 조직)을 인슐린 활성에 민감하게 합니다.
이러한 방식으로 메트포르민은 고혈당/당뇨병 환자에서 혈당 및 인슐린혈증을 감소시키지만 정상혈당 환자에서는 감소시키지 않습니다.
아스피린
가장 자주 사용되는 비스테로이드성 항염증제인 아스피린은 흥미로운 대사 및 항종양 특성을 보여주었습니다. 당뇨병 지원자에 대한 한 연구에서 2주 동안 고용량(6.7g/일) 아스피린을 복용하면 공복 혈당, C 반응성 단백질, 총 콜레스테롤, 중성지방 및 FA를 유의하게 감소시켰으며, 가장 흔한 부작용은 가역성 난청 및 이명
저용량(75-160mg)의 매일 아스피린은 전향적 시험에서 암 발병률 및 사망률 감소와 확실하게 연관되어 있습니다.
마지막으로, 후향적 연구에서 아스피린 사용과 PIK3CA 돌연변이, 수술로 절제한 결장직장암의 재발 감소와 상관관계가 있었습니다( 144 ).
아스피린의 추정되는 항종양 기전은 다음과 같습니다.
전신 활성 : 저용량 아스피린은 혈소판에서 사이클로옥시게나제 1(COX1) 효소와 트롬복산 A 생성을 비가역적으로 억제하여 혈소판 응고 형성 및 종양 세포 이동 및 전이를 방지합니다.
고용량에서 아스피린은 전신 및 국소 염증을 감소시키고 특히 당뇨병 환자에서 전신 탄수화물 및 지질 대사에 잠재적으로 영향을 미칠 수 있습니다.
세포 자율 효과 : 인간 혈액의 주요 아스피린 대사 산물인 살리실산 나트륨은 AMPK를 활성화하고 암세포주에서 mTOR 및 FA 합성을 억제합니다.
아스피린의 또 다른 제안된 항암 메커니즘은 COX2의 억제로, 이는 발암을 유발할 수 있으며 대장암을 포함한 인간 암에서 종종 과발현됩니다.
참고로, 살리실산염의 시험관 내 항종양 효과는 고용량 아스피린 투여 후 얻을 수 있는 약물 농도로 달성됩니다.
고용량 아스피린을 암 환자에게 장기간 안전하게 투여할 가능성은 매우 낮지만 짧은 노출은 견딜 수 있으며 화학 요법, 메트포르민 또는 특정 식이 중재와 함께 강력한 상승적 항암 효과를 나타낼 수 있습니다.
확립된 암에서 저용량 아스피린의 역할은 더 불확실하며, 진행 중인 전향적 연구에서 근치적 수술 후 보조 요법으로 이를 조사하고 있습니다.
호기성 해당 분해 표적화
종양에서 과장된 호기성 해당작용을 표적으로 하는 가장 직접적인 방법은 식이 또는 약리학적(예: 메트포르민) 중재를 통해 달성할 수 있는 암세포에 대한 포도당 가용성을 줄이는 것입니다.
그러나 당뇨병 환자가 치료적으로 적절한 혈당 감소를 합리적으로 얻을 수 있지만 정상 혈당 환자는 이러한 중재로부터 거의 이익을 얻지 못할 것입니다.
왜냐하면 장기간 혈당을 60~70mg/dL 미만으로 낮추면 심장과 뇌를 포함한 정상 조직에 돌이킬 수 없는 손상을 줄 수 있기 때문입니다. .
디클로로아세테이트. (DCA)
피루브산 탈수소효소 키나제(PDK) 효소는 여러 종양에서 과발현되어 피루브산 탈수소효소를 억제하고 피루브산을 젖산으로 전환하여 해당 표현형에 기여합니다( 148 ).
PDK를 억제함으로써 디클로로아세테이트(DCA)는 피루브산을 아세틸-CoA로 전환하고 아세틸기의 미토콘드리아 산화를 자극합니다( 그림 1 , 참조 149 ).
또한, 미토콘드리아 탈분극을 유도하고 활성 산소 종의 생성을 증가시킵니다.
흥미롭게도 DCA는 시험관 내 및 생체 내 (마우스 모델) 종양 성장을 억제하고 메트포르민과 상승 작용을 일으켜 호기성 해당 작용 및 미토콘드리아 산화적 인산화를 공동 표적화할 수 있습니다.
표준 용량에서 안전한 것으로 간주됩니다.
LDHA 억제제.
글루타민 대사 표적화
글루타민의 α-KG로의 전환은 중간 대사산물로서 글루타메이트를 포함하는 2단계 과정입니다( 그림 1 ).
BPTES 및 CB-839를 포함한 GLS 억제제;
GPNA 또는 EGCG와 같은 GDH;
또는 aminooxyacetate(AOA)와 같은 TA는 모두 세포 내 글루타민 대사의 첫 번째 단계를 표적으로 할 수 있습니다
메티오닌효소
메티오닌 제한 식이요법은 단 하루 만에 혈장 메티오닌 농도를 50% 이상 감소시키지만, 근육 단백질 분해가 메티오닌 감소를 보상할 수 있고 결과적으로 식이 부족의 효과를 제한할 수 있기 때문에 더 긴 제한은 추가 감소와 관련이 없습니다.
메티오닌 고갈을 최적화하기 위한 약리학적 접근에는 특히 세포독성 치료와 결합하여 결장, 폐 및 뇌종양 마우스 모델의 성장을 억제하는 세균성 메티오닌 분해 효소 메티오니나제가 포함됩니다
ADI-PEG
순환하는 아르기닌을 고갈시키는 것은 ASS1 억제 악성 종양 에 치명적일 것으로 예측됩니다 .
그러나 식이 아르기닌 섭취를 제한하는 것은 간과 신장이 이를 합성하여 혈류로 방출할 수 있기 때문에 효과적이지 않을 수 있습니다.
ADI-PEG는 아르기닌을 시트룰린과 암모니아로 분해하는 마이코플라스마 분리형 아르기닌 탈이미나제(ADI) 효소의 페길화된(폴리에틸렌 글리콜 접합) 형태로 유망한 아르기닌 고갈 요법입니다.
반복적인 ADI-PEG 투여는 잘 견디며 신속하고 지속적인 혈장 아르기닌 감소를 유도합니다.
FA 대사 표적화
대부분의 종양 은 세포내 중간체로부터 FA를 새로 합성하기 때문에( 그림 1 ), 식이 또는 약리학적 개입으로 혈장 트리글리세리드 및 콜레스테롤 수치를 감소시키는 것은 종양의 지질 대사를 효과적으로 표적화하지 않을 것입니다.
대신, FA 합성의 약리학적 억제가 잠재적으로 더 효과적인 전략입니다.
Cerulenin과 C75는 FASN의 잘 연구된 억제제이지만 거식증과 다량의 지방분해로 인한 지방량 감소와 같은 심각한 부작용을 일으켜 암 환자에게 투여할 수 없습니다.
반면에 EGCG, 일부 합성 유도체 및 일부 플라보노이드(예: 케르세틴 및 루테오닌)는 더 안전한 FASN 억제제인 것으로 보입니다.
ACC는 FA 합성을 억제하는 또 다른 가능한 약리학적 표적입니다( 174 ).
메트포르민과 살리실산은 모두 종양 세포주에서 인산화 및 ACC 억제를 유도하며, 이들의 잠재적인 생체내 항종양 활성은 부분적으로 FA 합성의 억제와 관련이 있을 수 있습니다.
마지막으로, 식이 또는 약리학적 전략과 함께 호기성 해당작용 및 글루타민 대사의 결합된 억제는 세포내 FA 전구체를 고갈시키는 또 다른 방법입니다.
스타틴
시험관 내 및 전임상 생체 내 활성을 기반 으로 스타틴으로 알려진 콜레스테롤 저하제가 항암제로 평가되었습니다 .
전향적 연구에 따르면 특히 진행성 악성 종양 환자에서 친유성 스타틴의 경우 일부 항종양 활성이 나타났습니다.
그러나 선택되지 않은 암 집단의 임상적 이점은 지금까지 전 세계적으로 미미했습니다.
스타틴의 이점(예: RAS/PI3K/AKT 경로의 활성화 또는 HMGCR의 발현 수준)을 예측하는 병리학적/생물학적 종양 특성을 식별하고 효과적인 동시 세포독성/대사 요법을 조사하는 것은 이러한 약물로 항종양 요법을 최적화하는 중요한 단계가 될 것입니다.
결론 및 전망
식이 및 약리학적 개입은 산화 및 대사 스트레스를 유발하는 고전적인 세포독성 치료법 또는 중요한 신호 전달 경로를 억제하는 분자 표적 치료법과 시너지 효과를 낼 수 있는 잠재적으로 매우 효과적인 전략입니다.
두 가지 접근법(식이 요법 또는 약리학) 중 어느 것이 표준 치료법에 대한 보조제로 더 효과적인지 불분명하며 집중적인 미래 연구의 초점이 될 것입니다.
두 전략 모두 상당한 장점과 단점을 가지고 있습니다( 표 3).
식이 요법은 다양한 대사 경로에 다면발현 효과를 일으키며, 더 광범위한 항종양 활성이 있을 수 있습니다.
또한, 그들은 저렴하고 이미 사용 가능합니다.
극도의 칼로리 제한 요법의 주요 제한 사항은 일부 피험자에게 열악한 수용도 또는 악액질 환자에게 적용할 수 없다는 것입니다.
악액질은 일반적으로 최신 종양 단계에서 발생하고 대부분의 전이성 암 환자는 진단 시 악액질이 아니기 때문에 과감한 식이 요법이 1차 치료 환경에서 사용될 때 허용되고 효과적일 가능성이 더 큽니다.
종양 대사를 표적으로 하는 식이 및 약리학적 중재의 주요 장점과 단점
| 식단(단식, 케톤 생성 식단, FMD) |
|
|
| 약리학 |
|
|
인지된 종양간 및 종양내 이질성으로 인해, 대사 요법을 개선하기 위해서는 기껏해야 단일 종양에서 중요한 대사 변경의 식별이 필요할 것입니다.
개별 종양이 중독되는 대사 경로의 약리학적 표적화와 식이 중재의 다면발현 효과를 결합하면 두 전략 모두의 항종양 효능을 향상시키면서 동시에 종양 적응을 방지할 수 있습니다( 그림 3 ).
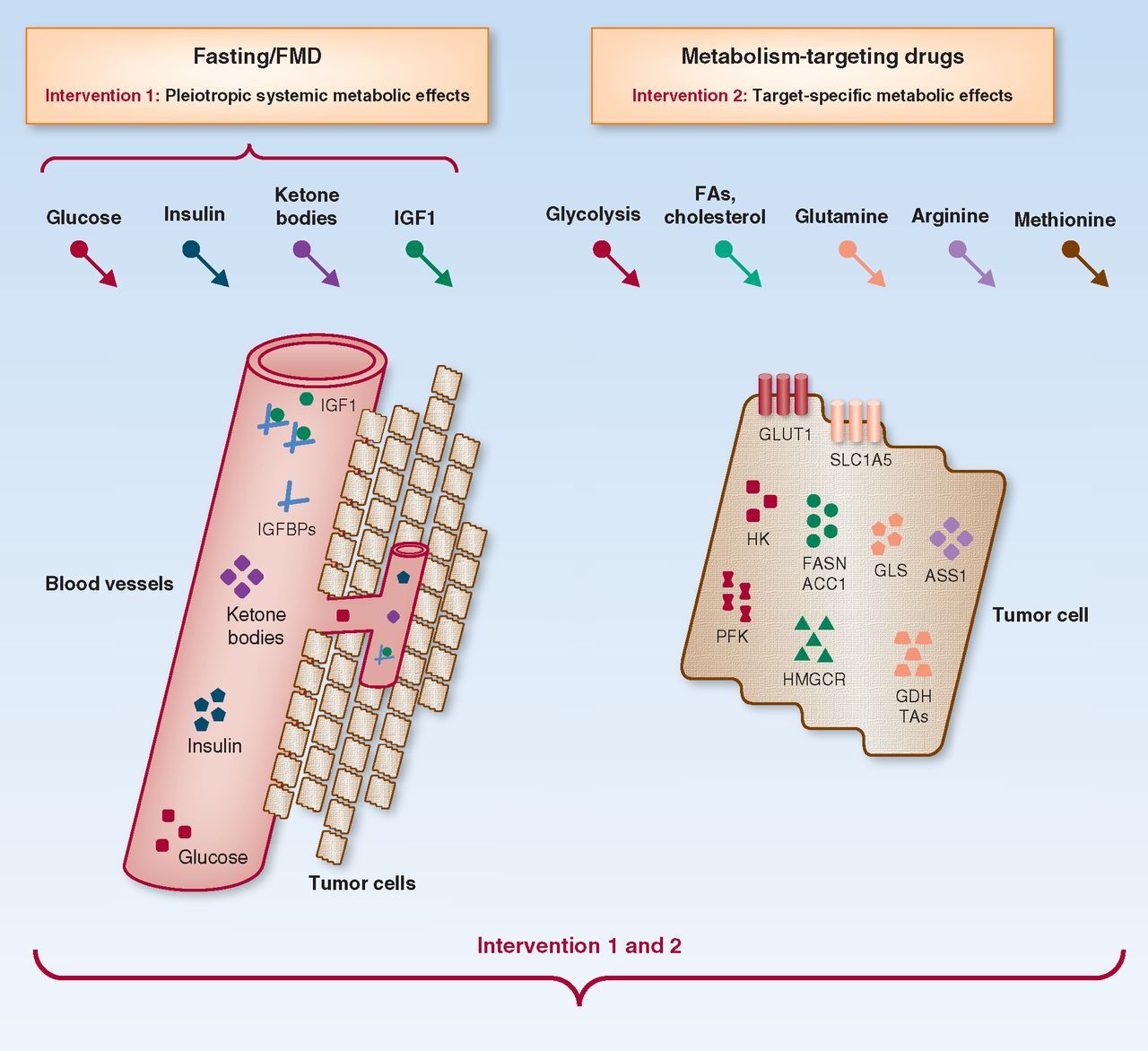
암의 특정 대사 경로를 표적으로 하는 식이 요법과 약물을 결합하는 근거.
단식과 FMD(왼쪽)는 혈당, 인슐린, IGF1 수치 감소, 케톤체 및 IGFBP 증가를 포함한 다면성 대사 효과의 유도를 통해 전신 대사에 영향을 미칩니다.
반면에, 약리학적 접근(오른쪽)은 단일 종양이 중독될 수 있는 해당과정, 글루타민, 아르기닌, 메티오닌, FA, 콜레스테롤 대사와 같은 특정 대사 경로를 선택적으로 억제할 수 있는 잠재력이 있습니다.
두 가지 전략을 결합하면 시너지 효과와 선택적 항암 효과를 얻을 수 있습니다.
IGF1, insulin-like growth factor 1; FA, fatty acid; GLUT1, glucose transporter 1; HK, hexokinase; PFK, phosphofructokinase; FASN, fatty acid synthase; ACC1, acetyl-CoA carboxylase; HMGCR, hydroxymethylglutaryl-CoA reductase; GLS, glutaminase; GDH, glutamate dehydrogenase; TA, transaminase; ASS1, argininosuccinate synthase 1.
'암치료' 카테고리의 다른 글
| 종양학에서의 영양 및 식이 중재 검토 (0) | 2022.10.07 |
|---|---|
| 식이와 암세포 대사의 분자적 연관성 (0) | 2022.10.07 |
| 암 치료를 위한 식이 요법 (0) | 2022.10.07 |
| 아미노산 고갈 요법: 암 세포가 굶어서 사망 (0) | 2022.10.05 |
| 글루타민 대사를 표적으로 하는 암 치료 발전 (0) | 2022.10.05 |