2021
https://www.cell.com/trends/endocrinology-metabolism/fulltext/S1043-2760(21)00049-7
Amino Acid Depletion Therapies: Starving Cancer Cells to Death
Targeting tumor cell metabolism is an attractive form of therapy, as it may enhance treatment response in therapy resistant cancers as well as mitigate treatment-related toxicities by reducing the need for genotoxic agents. To meet their increased demand f
www.cell.com
Amino Acid Depletion Therapies: Starving Cancer Cells to Death
종양 세포 대사를 표적으로 하는 것은 치료 저항성 암의 치료 반응을 향상시킬 뿐만 아니라 유전 독성 물질의 필요성을 줄여 치료 관련 독성을 완화할 수 있기 때문에 매력적인 치료 형태입니다. .
아미노산 가용성을 방해하는 것은 종양 세포에 선택적으로 치명적일 수 있으며 암에 특정한 아킬레스건인 것으로 입증되었습니다.
증가된 증식을 수용하기 위해 종양 세포는 대사율을 증가시켜 충분한 세포 구성 요소(단백질, DNA, RNA 및 지질), 에너지 및 환원제를 제공합니다.
종양 세포는 종종 외인성 아미노산 공급에 의존합니다. 놀랍게도 이것은 신체가 합성할 수 없는 유형의 필수 아미노산(EAA)에 해당될 뿐만 아니라 몇몇 비필수 아미노산(NEAA)도 종양 세포의 성장을 제한하는 것으로 나타납니다.
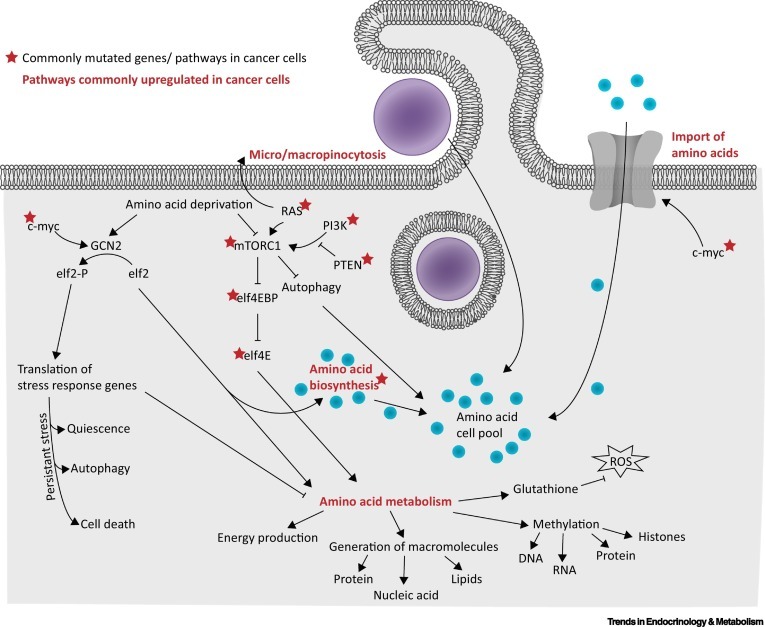
그림 1 암 세포에서 아미노산 항상성과 대사를 제어하는 일반적으로 규제가 완화된 유전자/경로.
암 치료를 위한 치료 표적으로서의 아미노산 가용성
암세포가 아미노산 합성 또는 회수( 그림 1 ) 를 촉진하여 아미노산 항상성을 유지하려고 노력하지만, 아미노산의 외인성 공급에 더 의존하게 되는 것은 놀라운 일이 아닙니다.
아미노산에 대한 이러한 증가된 수요는 NEAA에 대한 영양요구성(즉, 특정 영양소가 없을 때 성장을 지속할 수 없음)을 유발할 수도 있습니다.
후자는 종양 진행 중에 획득되거나 백혈병 세포 및 그 기원인 미성숙 림프구에서 아스파라긴 합성효소(ASNS)의 불충분한 발현과 같은 기원 세포와 관련될 수 있습니다( 박스 2 ).
아미노산 대사의 중요성은 이러한 영양소의 가용성을 제한하는 것이 종양 세포에 선택적으로 치명적일 수 있다는 사실에 의해 강조됩니다.
상자 1
아미노산 가용성 센서
단백질을 구성하는 구조 단위로 가장 잘 알려진 아미노산은 다른 거대 분자, 호르몬 및 신경 전달 물질의 생성, 에너지 생산 및 메틸화를 비롯한 다양한 기타 주요 세포 과정의 자원으로도 사용됩니다.
아미노산의 충분한 공급을 보장하기 위해 정상 세포와 형질전환 세포 모두 아미노산 흡수, 생합성 및 이화작용을 조정함으로써 제한된 영양 가용성 조건을 감지하고 반응할 수 있습니다( 본문에서 그림 1 참조).
라파마이신 복합체 1(mTORC1)의 포유동물 표적과 일반 대조군 비억제성 2(GCN2)는 낮은 아미노산 가용성에 대한 세포 반응을 제어하는 경로에서 가장 두드러진 두 노드입니다.
아미노산 가용성에 대한 반응으로 mTORC1 활성화는 주로 RAG GTPase에 의해 매개되며, 이는 차례로 세포막을 통해 아미노산을 운반하는 용질 운반체를 비롯한 여러 아미노산 센서에 의해 활성화됩니다.
동시에, 활성화 전사 인자 4(ATF4)의 CAP 독립적 번역이 증가합니다.
이 스트레스 유도 전사 인자는 아미노산 반응(AAR) 경로 내에서 광범위한 적응 유전자의 발현을 제어합니다.
여기에는 아미노산 수송체, 아미노산의 새로운 합성을 촉진하는 효소 , 항상성을 회복하기 위해 함께 작용하는 자가포식 활성화제가 포함됩니다.
그러나 지속적인 스트레스 조건에서 ATF4는 세포자멸사 유도에 유리한 전사 프로그램을 촉발할 것입니다.
영양소 감지가 종양 세포의 생존과 증식에 중요하기 때문에 필수 센서와 효과기가 자주 돌연변이되거나 상향 조절된다는 것은 놀라운 일이 아닙니다.
아스파라기나아제, 표적 아미노산 가용성의 주요 예
종양 세포 대사는 오랫동안 잠재적인 치료 표적으로 인식되어 왔지만 수십 년 전에 메토트렉세이트 및 5-플루오로우라실(5-FU)과 같은 항대사제가 성공적으로 항암 요법으로 도입되었습니다.
이러한 화합물의 대부분은 종양과 피부, 장 상피 및 골수와 같은 빠르게 분열하는 정상 조직을 구별하지 못합니다.
그러나 일부 대사 요법, 예를 들어 특정 아미노산의 선택적 고갈을 포함하는 요법은 종양 세포 특이적일 수 있습니다.
신체의 다른 세포 유형과 달리 백혈병 모세포를 포함한 림프구는 선택적으로 Asn에 의존합니다.
결과적으로 소아 급성 림프모구성 백혈병의 치료에 Asn 고갈 효소인 아스파라기나제(ASNase)를 도입하면 완치율이 크게 향상되었습니다.
표적 아미노산 대사는 여러 각도에서 접근할 수 있습니다.
아미노산 생합성, 또는 아미노산의 고갈에 의해. 증가된 수요를 충족시키기 위해 암 세포에서 아미노산 수송체의 상향 조절된 발현이 사용되지만, 아미노산 수송체 사이의 기능적 중복은 이러한 치료 표적을 다소 매력적이지 않게 만듭니다.
대조적 으로, 예를 들어 세린(Ser) 생합성 경로의 일부인 포스포글리세레이트 탈수소효소(PHGDH)와 같은 아미노산 합성의 새로운 및/또는 구제 경로에 관여 하는 효소의 억제 또는 글루타미나제(GLS)는 더 많은 가능성을 보여줍니다.
아미노산 고갈은 또한 혈류에서 특정 아미노산의 분해에 의해 달성될 수 있습니다.
종양 세포가 특정 아미노산의 외인성 공급에 선택적으로 의존하는 경우, 이는 아미노산 기아, 성장 정지 및 궁극적으로 세포자멸사 유도로 이어질 것입니다.( 그림 2 ).
여기에서 우리는 아미노산 결핍 치료의 표적이 되는 다양한 아미노산에 대해 논의할 것입니다.

아스파라긴
현재까지 아스파라긴(Asn)은 암 치료에서 아미노산 고갈 요법을 위한 가장 성공적이고 가장 잘 문서화된 표적입니다( 박스 2 ).
특히 소아 급성 림프구성 백혈병(ALL)에서 박테리아 유래 효소 ASNase는 ALL 치료의 필수 요소가 되었습니다.
일부 고형 종양에서의 치료 효능은 임상 연구 중입니다.
두 개의 독립적인 연구에 따르면 Asn은 새로운 글루타민(Gln) 생합성을 자극할 수 있으며 높은 수준은 전이를 유도하는 일련의 사건에서 중요한 사건인 상피에서 중간엽으로의 전이(EMT)를 촉진할 수도 있습니다.
따라서 Asn의 ASNase 매개 제한은 Asn의 종양을 박탈함으로써뿐만 아니라 Gln을 고갈시키는 프록시에 의해 원발성 종양 성장과 전이의 진행을 모두 억제합니다.
글루타민
Gln 가용성이 종양 세포 증식을 제한할 수 있다는 발견은 혈청에서 가장 풍부한 아미노산이며 포도당 다음으로 가장 많이 소비되는 영양소라는 사실을 고려할 때 놀라운 것일 수 있습니다.
단백질 생성 아미노산으로서의 역할 외에도 Gln은 트리카르복실산(TCA) 회로에서 α-케토글루타레이트의 주요 공급원입니다.
또한 모든 NEAA의 생합성에 활용됩니다.
높은 소비의 결과로 Gln은 조건부 EAA로 간주되며 앞서 논의한 바와 같이 종양 성장을 제한하는 속도일 수 있습니다.
Gln 의 새로운 생합성과 글루타민분해는 c-Myc 및 p53을 포함한 일반적인 종양유전자/종양 억제제를 통해 여러 암에서 상향 조절됩니다.
증가된 Gln 합성은 종종 Gln 합성효소(GS)의 상향 조절로 인해 발생합니다.
c-Myc 또는 KRAS에 의해 유발되는 종양은 특히 외인성 Gln에 의존합니다.
치료 표적으로서 Gln 대사의 확인은 Gln 모방체의 개발로 이어졌습니다. 시험관 내에서 인상적인 효능에도 불구하고 , 그들의 높은 독성으로 인해 더 이상의 개발이 불가능했습니다.
GLS의 약리학적 억제는 더 많은 가능성을 보여줍니다. 특히 CB-839는 삼중음성유방암(TNBC)을 포함하여 시험관 내 및 생체 내 에서 다양한 암 유형에서 종양 세포 증식을 억제하여 고무적인 결과를 보여주었습니다 .( 그림 3 ).
앞에서 언급했듯이 Asn은 ASNase의 주요 표적이지만 이 효소도 GLS 활성을 나타냅니다.

아르기닌
아르기닌(Arg)도 준필수 아미노산입니다. Gln 또는 프롤린에서 합성되지만 그러나식이 섭취에 대한 조건부 의존성이 있습니다.
Arg는 하전된 아미노산으로서 단백질 구조의 안정화에 필수적입니다.
또한 TCA 회로에 의해 소비되며 크레아틴, 폴리아민 및 산화질소(NO)와 같은 화합물의 전구체입니다.
Arg의 공급원으로 오르니틴을 사용하는 Arg 회수 경로에 관여하는 효소도 규제 완화 대상이 됩니다.
영양요구성 종양에서 Arg 고갈은 자가포식과 세포자멸사를 유도합니다.
대조적으로, 정상 세포는 정지 상태에 들어가 장기간 기아 상태에서 생존할 수 있습니다.
ARGase는 정상적인 요소 순환의 일부이며 Arg를 오르니틴과 요소로 전환합니다.
비면역원성이며 독성을 나타내지 않습니다.
그러나 ARGase의 항종양 효과는 다소 실망스러웠는데, 아마도 Arg 구제 경로가 오르니틴을 다시 Arg로 전환하여 기아로부터 세포를 효과적으로 구제하는 항상성 피드백의 결과일 수 있습니다.
메티오닌
단백질 합성에서의 역할과 시스테인(Cys) 및 폴리아민 합성의 전구체로서 EAA 메티오닌(Met)은 DNA, 히스톤의 메틸화를 위한 유일한 메틸 공여체인 S-아데노실메티오닌(SAM)및 기타 단백질 생성에 필수적입니다. , Met는 Met 아데노실트랜스퍼라제 2A(MAT2A)의 상향 조절의 결과로 종양 세포에서 종종 과활성화되는 Met 주기로 알려진 일련의 반응에서 이화됩니다.
다른 아미노산과 달리 Met 대사는 악성 형질전환에 적극적인 역할을 할 수 있습니다.
사용 가능한 모든 SAM을 효과적으로 소비함으로써 이 효소는 DNA와 히스톤 메틸화를 방지하여 암세포의 후성 유전적 형성에 영향을 미칩니다.
Met 회수 경로는 외인성 공급을 제외하고 Met의 유일한 공급원입니다.
이 회수 경로는 MTAP(methylthioadenosine phosphorylase)와 MS(Met synthase)의 활성을 필요로 합니다.
Met는 EAA이고 메틸화에서 중심 역할을 하므로 특히 TET 및 IDH 단백질 및 메틸 트랜스퍼라제와 같은 후성 유전적 변형자의 돌연변이에 의해 유도되는 종양에서 치료 표적화를 위한 주요 후보입니다.
실제로, 종양이 있는 쥐의 Met-free 식단은 TNBC, 결장직장암, 육종, 신경교종 및 혼합계통 백혈병(MLL) 재배열 백혈병의 종양 성장을 방해하고 전이 형성을 억제했습니다.
인간에 대한 가능성을 조사한 연구에서는 식이 Met 제한이 체중 감소를 제외하고 제한된 부작용과 함께 8-17주의 기간 동안 비교적 잘 견디는 것으로 나타났습니다.
세린과 시스테인
다른 아미노산에 대한 선택적 의존성이 보고되었지만, 치료 전략에 대한 이러한 잠재적인 종양 취약성의 발전은 이전에 논의된 아미노산보다 뒤쳐져 있습니다.
Ser은 NEAA이며 단백질, 인지질 및 글리신의 생합성에서 역할 옆에 있으며, 뉴클레오티드 생산을 위한 엽산 회로에 공급됩니다.
Ser 생합성 경로를 이용하여 관련 효소의 발현을 제어함으로써 외인성 공급에 덜 의존하게 됩니다.
초기 전임상 연구에 따르면 Ser 및 글리신의 조합 식이 제한은 장암 및 림프종의 마우스 모델에서 종양 세포 증식을 억제합니다.
몇 안 되는 황 함유 아미노산 중 하나이자 글루타티온의 구성 요소 중 하나인 Cys는 산화환원 항상성에 중요합니다.
Cys는 호모시스테인을 통해 Met에서 생성될 수 있지만, 이는 종종 수요를 충족시키기에 충분하지 않아 Cys 영양요구성 및 Cys 고갈 요법에 대한 감수성을 초래합니다.
아미노산 개입의 효과는 상황에 따라 매우 다릅니다.
항종양 전략으로서의 아미노산 보충
암 치료에서 아미노산 고갈 요법의 광범위한 적용에도 불구하고, 어떤 경우에는 특정 아미노산의 풍부함이 항종양 효과를 가질 수 있습니다.
이것은 종양 세포에 고유하거나 항종양 면역 반응의 자극과 같은 외부 기전을 포함할 수 있습니다.
예를 들어, 식이 Gln 보충은 후성유전학적 재프로그래밍에 영향을 미침으로써 형질전환 마우스 모델에서 흑색종 종양 성장을 차단하고 생존을 연장하는 것으로 나타났습니다.
반면 히스티딘(His)의 보충은 메토트렉세이트(MTX)에 대한 백혈병 이종이식편의 감수성을 증가시켰습니다.
종양의 위치
아미노산 가용성을 이용한 치료적 개입의 효능은 암세포 자체뿐만 아니라 종양의 위치 및 면역 감시에 대한 영향을 포함한 외부 요인에 의해 결정됩니다( 그림 4 )
따라서 동일한 종양 세포가 원발성 또는 전이 부위에서 다른 대사 및 영양소 요구 사항을 나타낼 수 있다는 것은 놀라운 일이 아닙니다.
예를 들어, 유방암 세포는 폐로 전이될 때 포유동물 표적 라파마이신 복합체 1(mTORC1) 성장 신호를 지원하기 위해 Ser 생합성을 상향 조절하는 것으로 나타났지만 일차 위치에서는 그렇지 않습니다.
수송체 xCT를 통한 Cys 흡수는 원발성 종양에 비해 유선 전이에 더 중요한 것으로 보입니다.
더욱이, 뇌에서 Ser 및 Gly의 제한된 가용성은 이 조직의 전이된 세포가 Ser 생합성을 상향 조절하도록 하여 이들을 PHGDH 억제제에 민감하게 만들지만 두개외 성장 종양은 만들지 않습니다.
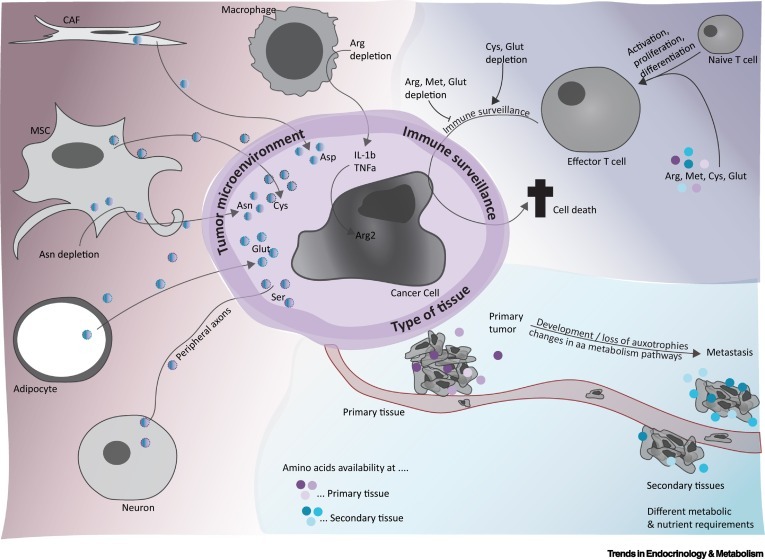
면역 감시
항종양 면역과 관련하여 아미노산 고갈은 주로 T 세포를 포함한 면역 세포의 항종양 활성을 억제합니다.
암세포를 표적으로 하는 이펙터 T 세포를 생성하는 데 필요한 클론 확장 및 성숙 과정은 포도당과 아미노산에 대한 증가된 대사 요구를 필요로 합니다.
암세포는 특정 아미노산에 대해 면역 세포를 능가함으로써 면역 세포 기능을 억제할 수 있으며, 분명히 아미노산 고갈 전략은 면역 반응을 방해할 수 있습니다.
T 세포 기능에서 Arg, Cys, Gln 및 Met의 역할은 비교적 잘 연구되었습니다.
Arg는 T 세포 증식, 활성화 및 효과기 기능을 위한 가장 필수 아미노산 중 하나이며 Arg의 보충은 따라서 Arg 비요구성 종양에 임상적으로 유익할 수 있습니다.
실제로, Arg 보충은 T 세포 매개 항종양 활성을 지원함으로써 면역 감시를 촉진하고 다양한 암 모델에서 (화학) 면역 요법과 시너지 효과를 발휘합니다.
또한, arginase Arg1의 억제는 T 세포 증식의 골수 세포 매개 억제 억제를 통해 항종양 면역을 유도하는 것으로 나타났습니다.
또한 Met는 T 세포 생존에 중요하며 Met 기아는 T 세포 기능을 손상시키는 히스톤 메틸화의 변화를 일으킵니다.
Met의 식이 보충제는 종양이 있는 쥐와 결장암 환자에서 후성 유전적 변화를 회복하고 T 세포 면역을 증가시킬 수 있습니다.
Cys와 Gln은 각각 T 세포 확장과 활성화에 필수적입니다.
그러나 다른 보고서에서 아미노산 고갈은 면역 자극 효과가 있는 것으로 나타났습니다.
CYSase를 사용한 단일 치료는 항종양 T 세포 반응을 유도하는 것으로 나타났으며 면역 요법[프로그램된 사멸 리간드 1(PD-L1) 차단]에 의해 유도된 인터페론 γ의 T 세포 매개 방출에 의해 종양 세포에 대한 세포 독성이 더욱 증가할 수 있습니다.
Gln 차단은 종양 세포와 T 세포에서 영양 고갈을 유도하고 두 세포 유형에서 서로 다른 분자 반응을 유발하는 것으로 나타났습니다.
T 세포는 산화 대사를 상향 조절하여 수명이 길고 고도로 활성화된 T 세포를 생성하는 반면, 종양 세포는 그렇게 하지 못하고 결국 죽습니다.
면역 감시에 대한 아미노산 가용성의 효과의 다양성을 감안할 때, 면역 적격 모델에서 아미노산 고갈 요법의 효능을 조사하는 것이 중요할 것입니다.
요약하면, 아미노산 결핍을 임상적으로 적용하기 전에 특정 암 유형의 대사 의존성을 조사할 필요가 있을 뿐만 아니라 면역 세포를 포함한 다른 세포 유형과의 위치 및 대사 누화와 같은 외적 요인도 고려해야 합니다. ( 그림 4 ).
또한 아미노산 고갈이 다른 치료법의 효능에 미치는 영향을 주의 깊게 조사해야 하며 일정과 투여량을 최적화해야 합니다.
아미노산 고갈 요법에 대한 미래 전망 및 과제
다른 요법과 아미노산 고갈의 시너지 효과
아미노산 고갈과 함께 시너지 효과가 화학 요법과 표적 요법 모두에서 보고되었습니다( 표 1 ).
이러한 시너지 효과의 근간이 되는 메커니즘은 종종 해명되지 않은 채 남아 있지만, 일부 조합의 경우 (상호)작용 방식이 더 명확합니다.
또한, Met 제한은 DNA에서 알킬기를 제거하는 효소인 O6-alkylguanine-DNA alkyltransferase(AGT)의 하향 조절로 이어집니다.
이에 의해 알킬화제의 효과를 향상시킨다.
흥미롭게도, 기존의 화학요법제와 달리 아미노산 고갈은 주로 DNA 손상을 유발하여 작용하지 않지만 아미노산 고갈은 돌연변이 시그니처에 영향을 줄 수 있는 뉴클레오티드 불균형을 초래할 수 있습니다.
이러한 변화의 긍정적인 효과는 면역치료의 표적으로 종양 세포에 대한 신항원의 생성이 될 수 있습니다.
표 1 아미노산 고갈 요법과의 약물 조합
| 글루타민 | 베네토클락스 | [ ] |
| FLT3 티로신 키나제 억제제 | [ ] | |
| 노치 억제 | [ ] | |
| 포도당 대사 | [ , ] | |
| 통합 응력 응답의 변조기 | [ ] | |
| mTORC1 | [ , ] | |
| 메트포르민 | [ ] | |
| 아스파라긴 | 독소루비신 | [ ] |
| BH3 모방체 | [ ] | |
| KRAS 경로 억제 | [ ] | |
| 클로로퀸 | [ ] | |
| Gln 대사 표적화 | [ ] | |
| GCN2 억제 | [ ] | |
| GLS 억제 | [ , ] | |
| ZBTB1 | [ ] | |
| Wnt/STOP 신호 | [ ] | |
| 메트포르민 | [ ] | |
| 아르기닌 | 시타라빈 | [ ] |
| 히스톤 탈아세틸화효소 억제제(SAHA) | [ ] | |
| 클로로퀸 | [ ] | |
| Gln 대사 표적화 | [ , ] | |
| 메티오닌 | 플루오로우라실 | [ ] |
| 독소루비신 | [ ] | |
| 빈크리스틴 | [ ] | |
| BCNU | [ ] | |
| 테모졸로마이드 | [ ] | |
| 시스플라틴 | [ ] | |
| TRAIL-R2 작용제 | [ ] | |
| 류신 | 표피 성장 인자 수용체(EGFR) 억제제 | [ ] |
| 타목시펜 | [ ] | |
| 시스테인 | BSO | [ ] |
| 커큐민 | [ ] |
대안으로, 증감제의 설계 및 사용이 대부분 전임상 단계에 있지만, 아미노산 고갈의 효과를 향상시키는 전략은 기존 화학 요법의 필요성을 줄이는 데 도움이 될 수 있습니다.
명백한 접근은 치료 저항의 세포 고유 메커니즘을 중화하는 것입니다.
영양요구성 종양 세포가 저항성을 획득하는 가장 직접적인 메커니즘은 고갈된 아미노산의 세포 생산을 담당하는 효소를 상향 조절하는 것입니다.
예를 들어, 종양은 ADI 치료 시 ASS1 발현을 유도할 수 있습니다.
반면 ARGase 처리는 오르니틴 재활용을 Arg로 촉진할 수 있습니다.
ASNase 민감성 NCSLC 세포주는 KRAS 의존적 방식으로 ASNS 발현을 유도함으로써 저항성이 됩니다.
시험관 내 및 생체 내 에서 ASNase 치료와 KRAS 경로 억제 를 결합하여 ASNase 유도 세포 사멸에 대해 세포를 재민감하게 합니다.
에너지와 영양소를 보존하고 재활용하기 위해 거대 분자 및 심지어 완전한 세포 소기관의 스트레스 활성화된 이화작용인 자가포식은 세포가 제한된 자원 가용성 기간을 극복할 수 있는 강력한 구조 메커니즘입니다.
ASNase는 난소암, 만성 골수성 백혈병(CML) 및 ALL에서 세포 보호 자가포식을 유도하는 것으로 알려져 있습니다.
또한 ADI 요법은 시험관 내에서 자가포식소체 형성을 촉진합니다 .
클로로퀸(CG)과 같은 자가포식 억제제는 이러한 아미노산 고갈 요법에 대해 세포를 재감작시킬 수 있습니다.비록 이것이 정상 세포에서도 이 세포 보호 과정을 박탈할 수 있지만. 세포가 저항을 획득할 수 있는 많은 메커니즘은 대사 의존성의 전환과 관련이 있으며 종종 또 다른 아킬레스건을 형성합니다.
예를 들어, GLS 억제제 CD-839에 내성이 있는 유방암 세포주는 Gln 소비가 하향 조절되지만 외인성 Asn에 대한 의존성은 증가합니다.
반대로, 번역 후 변형을 통한 Gln 수송체의 증가된 활성은 ASNase에 대한 Gln 의존적 내성을 유도하면, 유사한 메커니즘이 ADI 내성 세포주에서 발견되었습니다.
둘 다 ASNase및 ADI 내성 종양 세포는 Gln 대사를 표적으로 하여 재민감화될 수 있습니다.
종양 세포 대사에 대한 이해가 높아짐에 따라 복합 요법의 합리적인 설계도 가능합니다.
두 가지 이상의 영양소를 동시에 표적으로 삼는 것은 세포가 하나의 중독을 다른 중독으로 보상하는 것을 방지할 수 있습니다.
또한, 통합 스트레스 반응의 조절자를 표적화 mTORC1 산화환원 항상성 또는 산화적 인산화 아미노산 고갈 요법의 항종양 반응을 향상시킬 수 있습니다.
번역 연장을 차단함으로써 eEF2 키나아제의 상향 조절과 같은 영양소 고갈 요법에 대한 반응으로 발생하는 다른 내성 메커니즘이 관찰되었습니다.
또는 GLS-K325A와 같은 약물 내성 돌연변이로 인해 GLS 억제제(BPTES, CD-839)에 대한 내성이 생깁니다.
남은 과제
내성은 앞서 설명한 바와 같이 세포의 자율적 요인에 의해서만 발생하는 것이 아니라 종양 환경과 같은 외적 요인에 의해서도 유발될 수 있다.
최적이 아닌 아미노산 고갈은 세포 사멸을 유도하기 보다는 종양 세포를 세포 정지 상태로 유지하기에 충분할 수 있으며, 치료가 중단되면 재발 가능성이 증가합니다.
이것은 아미노산 고갈 효소가 중추신경계나 골수와 같은 소위 성역(聖域) 부위에서 약물의 투과성이 좋지 않아 종양 세포에 도달할 수 없을 때 발생할 수 있습니다.
또한, 아미노산은 종양 미세 환경에 존재하는 세포에 의해 제공될 수 있습니다( 그림 4 ).
백혈병의 경우 골수 틈새에 있는 중간엽 줄기 세포(MSC)가 ASNase 유도 세포독성으로부터 백혈병 아세포를 보호하는 것으로 나타났습니다.
반면 골수 기질 세포는 CLL 세포에 Cys를 제공합니다.
또한, 비만은 지방세포가 Gln을 방출하여 ASNase에 대한 백혈병 세포 내성을 유발할 수 있기 때문에 ALL에서 치료의 효능을 손상시키는 것으로 알려져 있습니다.
유사하게, 암 관련 섬유아세포(CAF)는 암종 세포에 Asp를 제공하여 고형 종양 성장을 지원합니다.
흥미롭게도 이 모델에서 종양 세포는 CAF가 산화환원 상태의 균형을 유지할 수 있도록 하는 글루타메이트를 제공하여 도와줍니다.
또한 Ser이 결핍된 췌관 선암종은 Ser을 분비하는 말초 축삭을 종양으로 유인하는 것으로 나타났습니다.
반면 신경모세포종에서 종양 관련 대식세포는 Arg 고갈에 대한 반응으로 인터루킨 1β와 종양 괴사 인자 α를 방출하여 신경모세포종 세포에서 Arg2의 상향 조절을 유도하여 면역 억제 환경을 만들어 나쁜 결과와 관련이 있습니다.( 그림 4 ).
따라서 종양 환경 내에서 종양 세포와 세포 사이에는 긴밀한 상호 작용이 있어 치료 시 아미노산 가용성을 변경합니다.
비인간 기원의 치료 효소를 사용하는 치료법의 또 다른 주요 과제는 이러한 치료 단백질을 비자기(non-self)로 인식한 후 발생하는 면역 반응입니다.
억제 항체의 발달은 효소의 제거를 증가시켜 아미노산 농도가 기준선 수준으로 빠르게 돌아갈 수 있도록 합니다.
또한 경미한 과민 반응에서 아나필락시성 쇼크에 이르는 알레르기 반응이 치료의 지속을 방해할 수 있습니다.
반감기를 증가시키고 면역원성을 감소시키기 위해 치료 효소는 폴리에틸렌 글리콜(PEG)에 접합하여 변형되었습니다.
나노입자 캡슐화 또는 적혈구 캡슐화, 치료는 프레드니손 및 덱사메타손과 같은 면역억제제와 병용할 수 있습니다.
또한 in silico 및 in vitro 면역원성 예측 도구를 사용하여 단백질 약물의 면역원성 가능성을 사전에 평가할 수 있습니다.
끝 맺는 말
아미노산 고갈 전략은 암 치료에 큰 가능성을 보여줍니다.
다른 치료법에 비해 주요 이점은 제한된 독성과 DNA 손상의 결과로 인한 후기 효과가 없다는 것입니다.
그러나 아미노산 고갈이 임상에서 보다 광범위하게 적용될 수 있기 전에 특정 암 유형과 종양 환경의 대사 의존성을 자세히 조사하여 올바른 아미노산 표적을 선택할 수 있어야 합니다.
또한 대사 억제제를 포함한 치료제는 아미노산 기아에 노출된 종양 세포의 대사 변화가 치료에 내성을 갖게 할 수 있기 때문에 단일 제제로는 효과적이지 않을 수 있습니다.
따라서 아미노산 고갈 요법의 향후 적용에는 내성 기전이 발생하는 것을 방지하기 위해 (표적) 약제와의 조합이 포함될 가능성이 있습니다.
잔류 암세포의 지속에 의한 종양 재성장을 방지하기 위해서는 깊은 초기 반응이 이루어져야 합니다.
이것은 암 세포 내에서 다른 (대사) 경로를 동시에 억제하고 종양 미세 환경과의 상호 상호 작용을 고려하는 다중 약물 전략을 의미합니다.
따라서, 반응의 효율성과 내구성을 모두 증가시키는 아미노산 고갈 증감제가 개발될 필요가 있을 것입니다.
'암치료' 카테고리의 다른 글
| 암 대사 표적화: 식이 및 약리학적 개입 (0) | 2022.10.07 |
|---|---|
| 암 치료를 위한 식이 요법 (0) | 2022.10.07 |
| 글루타민 대사를 표적으로 하는 암 치료 발전 (0) | 2022.10.05 |
| 암 치료를 위한 글루타민 대사 표적화 (0) | 2022.10.05 |
| 암 치료에서 글루타민 대사 (0) | 2022.10.05 |