https://www.sciencedirect.com/science/article/pii/S1550413113002076
Cellular Fatty Acid Metabolism and Cancer
Cancer cells often have characteristic changes in metabolism. Cellular proliferation, a common feature of all cancers, requires fatty acids for synthe…
www.sciencedirect.com
Cellular Fatty Acid Metabolism and Cancer
소개
암은 유형과 병인이 매우 다양하지만 암세포는 종종 대사 이상이라는 속성을 공유합니다. 예를 들어, 포도당 대사 는 일반적으로 피루브산 산화 (Warburg 효과) 에서 해당 분해 를 분리하도록 변경되어 높은 산소 가용성에도 불구하고 미토콘드리아 호흡을 통한 최대 ATP 생성에 탄수화물이 사용되지 않습니다 . 이러한 대사 변화에 대한 더 나은 이해는 암 치료에 대한 새로운 접근 방식을 촉발했습니다
암세포에서 지방산(FA) 대사의 변화는 덜 주목받았지만 점점 더 인식되고 있습니다.
FA는 말단 카르복실기 와 탄화수소 사슬 로 구성되며 , 대부분 짝수개의 탄소에서 발생하며 포화되거나 불포화될 수 있습니다.
그들은 에너지 저장, 막 증식 및 신호 분자 생성에 필요합니다.
여기에서 우리는 FA 합성 및 저장 경로에 초점을 맞춘 암세포의 대사에 대한 간략한 검토를 제공합니다. 또한, 우리는 FA 대사를 조작하여 FA 가용성을 감소시켜 암세포 증식 및 전이 를 약화시키는 모델을 조사합니다 .
암세포의 에너지 대사 변화
암은 기본적으로 핵산 , 단백질, 지질과 같은 세포 구성 요소를 필요로 하는 세포 성장 및 증식의 장애입니다 . 암세포는 종종 이러한 구성 요소의 원천으로 대사 중간체 를 축적할 수 있도록 하는 교란된 대사를 가지고 있습니다 .
암세포에서 가장 잘 알려진 대사 변화는 와버그 효과(Warburg effect)로 , 암세포가 포도당 대사에 에너지적으로 낭비적인 변화를 일으키며, 이는 암세포가 포도당을 이산화탄소로 완전히 산화시키는 대신 다른 분자를 만들기 위해 포도당의 탄소를 사용합니다( Warburg, 1956 ).
산소가 있는 상태에서 정상적인 세포 대사 과정에서 포도당은 세포질에서 해당과정을 거쳐 피루브산을 생성합니다. 미토콘드리아로 유입된 후 피루브산은 아세틸-CoA로 산화되어 크렙스 회로 에 들어가 산화적 인산화 를 위한 환원 당량을 생성합니다 ( 그림 1).
산소가 제한되면 세포질에서 과량의 피루브산이 발효되어 젖산이 됩니다. 분화된 세포는 일반적으로 효율성 때문에 산화적 인산화를 사용하며, 혐기성 해당과정 에서 얻어지는 2ATP에 비해 1개의 포도당 분자가 완전한 산화를 거쳐 ~36개의 ATP 분자를 생성 합니다.
Warburg 효과는 산소가 있는 상태에서도 발효를 사용하는 것으로 포도당 섭취 및 소비 증가, 산화적 인산화 감소, 젖산 생성이 특징입니다.

그림 1 . 세포 지방산 대사 개요
묘사된 경로에 대한 설명은 텍스트를 참조하십시오. 효소는 굵게 표시되어 있습니다. 주위에 상자가 있는 효소는 막에 국한됩니다.
암에서 흔히 관찰되는 또 다른 대사 변화는 글루타민 대사의 증가입니다. 포유동물 세포에서 글루타민은 대사를 통해 α-케토글루타레이트를 생성하는 주요 에너지 기질이며, 이는 크렙스 회로에 공급됩니다.
글루타민 유래 α-케토글루타레이트는 크렙스 회로를 통한 순방향 플럭스와 피루브산의 말산 효소malic enzyme-dependent 의존적 생산에 의한 시트르산 생산에 기여합니다( DeBerardinis et al., 2007 ).
글루타민은 또한 이소시트레이트 탈수소효소 및 아코니타 제에 의해 촉매되는 크렙스 회로 반응의 역전으로 인해 시트레이트로 전환될 수 있습니다
구연산염은 FA 합성을 위한 아세틸기 생산에 사용될 수 있습니다(아래 참조).
지질 대사 는 빠르게 증식하는 세포에서도 변경됩니다. 여기서 우리는 암과 FA 대사에 초점을 맞춥니다.
암세포에서 탄소는 막과 신호 분자의 생합성 을 위해 에너지 생산에서 FA로 전환되어야 합니다 .
FA 빌딩 블록은 외인성 소스 또는 새로운 FA 합성에서 비롯됩니다.
대부분의 정상 인간 세포는 외인성 공급원을 선호하지만 종양 은 FA를새로합성하고 ( Medes et al., 1953) 종종 FA 합성으로의 전환을 나타냅니다(Ookhtens et al., 1984 ).
생물 활성 풀에 들어가기 위해 FA는 지방 아실-CoA 합성 효소 를 통한 CoA에 의한 공유 변형에 의한 "활성화"가 필요합니다 . 활성 풀에 들어가면 FA는 글리세롤 또는 스테롤 백본으로 에스테르화되어 각각 트리아실글리세롤 (TG) 또는 스테롤 에스테르 (SE)를 생성 한 다음 지질 방울 (LD)에 저장할 수 있습니다.그림 1 ).
세포 내에서 FA는 막, 저장 또는 신호 지질 에 통합되거나 에너지원으로 이산화탄소로 산화 되는 것을 포함하여 많은 운명을 가질 수 있습니다 .
세포 배양 실험을 위한 시험관 내 조건은 일부 암에서 외인성 흡수가 더 중요할 수 있는 생체 내 조건과 다를 수 있다는 점에 주목해야 합니다.
암세포 증식을 제한하기 위한 지방산 공급 제한
FA는 암세포 증식에 필수적이기 때문에 가용성을 제한하는 것이 치료 전략을 제공할 수 있습니다. 지질 대사의 관점에서 FA 가용성을 제한하는 것은 (1) FA 합성 차단, (2) 산화를 통한 FA 분해 증가, (3) FA를 저장으로 전환 또는 (4) 저장에서 FA 방출 감소와 같은 여러 가지 방법으로 달성할 수 있습니다. ( 그림 2 ). 이러한 메커니즘을 통해 FA를 제한하는 것은 개별적으로 또는 조합 방식으로 수행될 수 있습니다. 이를 프레임워크로 사용하여 이 모델과 관련된 증거를 검토합니다.
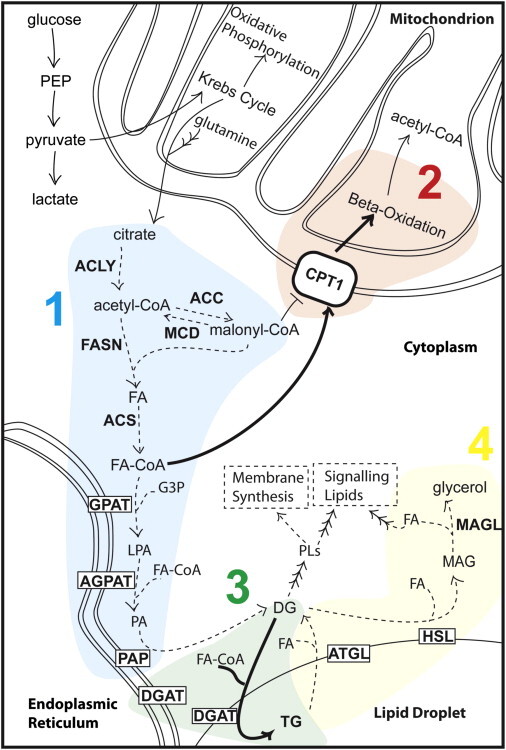
그림 2 . 세포의 지방산 제한이 암세포 증식을 제한할 수 있는 방법을 보여주는 모델
이것은 (1) FA 합성 차단, (2) FA 분해 속도 증가, (3) 중성 TG에서 FA 저장 증가, 및/또는 (4) 저장에서 FA 방출 감소에 의해 수행될 수 있습니다.
지방산 합성 차단
FA 수준을 줄이는 가장 간단한 방법은 합성을 차단하는 것입니다. 포도당 대사는 Krebs 주기의 중간체인 구연산염 지점에서 FA 대사로 들어갑니다( 그림 1 참조 ). 탄소를 구연산염에서 생리활성 지방산으로 전환하려면 여러 단계가 필요합니다. 이러한 단계에는 ATP 시트르산 분해효소 (ACLY, ACL 또는 ATPCL), 아세틸-CoA 카르복실라제(ACC), 지방산 합성효소 (FASN 또는 FAS), 지방산-CoA 리가아제 (ACS, ACSL) 라고도 알려진 아실-CoA 합성효소가 포함됩니다. , 또는 FACL). FA 가용성 감소 모델에서 이러한 효소를 억제하면 암세포 성장이 제한됩니다. 이러한 전략의 임상적 중요성에 대해 중요한 것은 이러한 효소의 많은 억제제가 비암 세포에 최소한의 영향을 미친다는 것입니다.
구연산염 의 세포내 위치 는 대사 운명을 결정합니다. 미토콘드리아 구연산염은 크렙스 회로에 공급되고 세포질 구연산염은 FA 합성에 공급됩니다. 구연산염은 수송 단백질 CIC(구연산염 운반체)에 의해 조절되어 세포질에서 사용하기 위해 내부 미토콘드리아 막을 가로질러 수송됩니다.
CIC 수준은 불량한 결과와 상관관계가 있는 방식으로 다양한 암 세포주 및 종양에서 상승하고, 벤젠-트리카르복실레이트 유사체(BTA)에 의한 수송 억제는 다양한 종양 유형 및 생체내 이종이식 마우스에서 항종양 효과를 나타냅니다
ACLY
포도당 대사와 FA 대사를 연결 합니다. ACLY의 녹다운은 뮤린 림프 세포의 shRNA ( Bauer et al., 2005 ) 및 인간 선암종 세포의 siRNA ( Hatzivassiliou et al., 2005 ) 에서 볼 수 있듯이 포도당을 지질로 대사하는 세포의 능력을 감소시킵니다 .
ACLY는 유망한 치료 표적이지만, 이의 산물인 아세틸-CoA는 많은 분자의 중요한 대사산물 이며 단백질과 핵산 의 아세틸화 를 위한 기질입니다 ( Wellen et al., 2009 ).
따라서 그 생산을 억제하면 다른 대사 경로 에도 영향을 미칠 수 있습니다 .
ACC
ACC는 아세틸-CoA를 카복실 화하여 말로닐 -CoA를 형성 하고, 수임 단계를 촉매하며, 지방산 합성 경로 에서 가장 고도로 조절되는 효소입니다
ACC는 AMP 활성화 단백질 키나아제에 의한 인산화에 의해 비활성화됩니다.(AMPK) 및 잠재적으로 다른 많은 키나제에 의해 조절됩니다.
인간 게놈에는 ACC1(ACCα 또는 ACACA)과 ACC2(ACCβ 또는 ACACB)의 두 가지 ACC가 있습니다.
ACC1은 지방 생성 조직에서 매우 풍부하고 ACC2는 산화 조직에서 발생합니다. 그들은 주로 다른 전문 조직에서 발견되기 때문에 ACC1과 ACC2는 대사 역할이 다릅니다.
ACC1에 의해 만들어진 말로닐-CoA는 FA 합성의 기질 역할을 하는 것으로 생각되는 반면,
ACC2에 의해 만들어진 말로닐-CoA는 CPT1(다음 섹션 참조)을 억제하여 FA 분해를 방지하는 역할을 합니다.
siRNA에 의한 ACC1의 녹다운 은 전립선암( Brusselmans et al., 2005 ) 및 유방 종양( Chajès et al., 2006 ) 세포 에서 세포자멸사 를 유도 하지만 대조군 비악성 세포에서는 그렇지 않습니다. 소라펜-A에 의한 ACC1 및 ACC2의 화학적 억제는 전립선암 세포에서 유사한 결과를 나타냈다( Beckers et al., 2007 ).
ACC1 또는 ACC2의 침묵이 NADPH 의존적 산화환원 균형을 촉진함으로써 폐암 세포에서 종양 성장을 가속화한다는 관찰에 의해 더욱 복잡해졌습니다( Jeon et al., 2012 ).
암세포에서 ACC의 역할에 대한 일부 측면은 여전히 해명되어야 하지만 ACC 활성은 ACC 인산화를 촉진하여 제어할 수 있습니다.
AMPK는 이미 당뇨병 치료에 널리 사용되는 메트포르민 과 같은 약물에 의해 활성화됩니다 . 메트포르민 치료가 항종양 활성 을 갖는다는 마우스와 인간, 주로 고형 종양 모델 에서 시험관내 및 생체내 실험적 증거 가 있으며 , 효능을 추가로 조사하기 위한 임상 시험이 진행 중입니다( Pollak, 2012 ).
MCD
말로닐 -CoA 탈탄산효소 (MCD)는 말로닐-CoA를 아세틸-CoA로 탈탄산시켜 본질적으로 ACC에 의해 촉매되는 반응을 역전시킵니다. 따라서, MCD 억제가 ACC와 유사한 데이터를 산출한다는 것은 놀라운 일입니다.
FASN
FASN은 malonyl-CoA 및 acetyl-CoA 기질로부터 지방산을 형성하기 위해 연속적인 축합 반응을 촉진하여 주로 16-탄소 팔미테이트를 생성 합니다. 아마도 암과 관련 하여 가장 많이 연구된 FA 대사 효소일 것 입니다. FASN의 증가된 수준으로 인한 증가된 지방산 합성은 다수의 암에서 관찰되었으며 많은 경우에 불량한 예후와 강한 상관관계가 있습니다( Menendez 및 Lupu, 2007 에서 검토됨 ).
FASN은 대부분의 암세포가 FASN 매개 드 노보 FA 합성에 의존하는 반면, 대부분의 비암 세포는 외인성 FA를 선호하기 때문에 특히 매력적인 치료 표적입니다. 그러나 FASN 억제 후 유도된 세포 사멸은 FA의 결핍보다는 malonyl-CoA의 독성 축적 때문일 수 있습니다( Pizer et al., 2000 ).
더욱이 FASN의 일부 억제제는 동물 모델에서 급격한 체중 감소를 포함하여 심각한 부작용을 나타내며 ( Loftus et al., 2000 ), FASN은 성체 신경 줄기 세포 기능에 필요합니다(Knobloch et al., 2013 ).
ACS
FA가 생리 활성 풀에 들어가려면 FA-CoA를 생성하는 ACS 효소에 의해 활성화되어야 합니다.
포유류는 5개의 ACS isoform(ACSL1, ACSL3, ACSL4, ACSL5 및 ACSL6)을 가지고 있으며 또한 아실-CoA 합성효소 활성을 갖는 지방산 수송 단백질을 가지고 있습니다.
여러 티아졸리딘디온-듀비에 (TZD)은 시험관 내에서 쥐 ACSL4(ACSL1 또는 ACSL5 제외)에 직접 결합하여 억제합니다( Kim et al., 2001 ).
TZD는 퍼옥시좀 증식자 활성화 수용체를 활성화합니다.(PPARs), 특히 PPARγ는 당뇨병 치료에 이미 널리 사용되고 있습니다. TZD 사용은 PPARγ와 무관한 방식으로 당뇨병 환자의 특정 암 발병률 감소와 상관관계가 있습니다( Weng et al., 2006 ). ACS의 비활성화를 통한 치료를 고려할 때, 서로 다른 약물이 서로 다른 isoform 특이성을 가지고 있으므로 다양한 isoform이 다른 조직 특이성, 영양 상태에 대한 반응을 가지기 때문에 다른 효과를 가질 수 있다는 점에 유의하는 것이 중요합니다( Mashek et al., 2006 ), 및 선호되는 기질(특히, ACSL4는 AA를 선호함).
SCD
SCD 기능의 억제는 아마도 불포화 지방산 의 축적을 유도함으로써 암세포에서 세포 사멸을 유발합니다 ( Ariyama et al., 2010 ). SCD의 약리학적 억제는 전임상 암 모델에서 종양 성장을 제한합니다(Fritz et al., 2010 ) 전체 체중에 영향을 미치지 않습니다( Roongta et al., 2011 ). 암세포는 de novo FA 합성에 상당히 의존하기 때문에 SCD 억제는 어느 정도 선택성을 보일 것입니다.
FA는 또한 스핑고지질 합성을 위한 기질입니다.
스핑고지질 대사는 이 리뷰의 초점이 아니지만, 세라마이드 및 스핑고신-1-포스페이트와 같은 특정 스핑고지질이 각각 일반적으로 종양을 억제하거나 촉진하는 생리활성 신호전달 분자라는 점은 주목할 만합니다.
또한, 세라마이드의 축적은 암의 다양한 화학 요법 치료의 치료 효과와 관련이 있습니다.
지방산 합성 유전자의 발현 차단
FA 합성의 효소를 직접 표적화하는 것 외에도 전사 수준을 감소시켜 활성을 감소시킬 수 있습니다.
FA 합성의 마스터 전사 조절자는 스테롤 조절 요소 결합 단백질 1 (SREBP-1) 전사 인자입니다( Horton et al., 2002 ). SREBP-1 에는 두 가지 isoform이 있습니다. SREBP-1a 는 대부분의 배양된 세포주에서 우세한 isoform이고 SREBP-1c는간과 대부분의 조직에서 우세합니다.
정상 수준에서 SREBP-1c는 ACLY, ACC, FAS, SCD-1 및 GPAT를 포함한 반응성 유전자로 FA 생합성 경로를 활성화합니다.
따라서 암세포에서 SREBP-1을 억제하면 FA 합성 유전자 발현을 감소시키고 암세포 증식을 예방할 수 있습니다.
흥미롭게도 최근 연구에서는 암세포 증식을 방지하는 SREBP-1 억제 메커니즘이 SCD-1의 손실과 FA 불포화 를 통해 비정상적으로 높은 수준의 포화 FA로 인해 지방독성 을 유발 한다고 제안합니다 ( Williams et al., 2013 , Griffiths et al. ., 2013 ).
또 다른 전사 인자인 간 X-활성화 수용체(LXR)는 SREBP-1c를 유도하여 지방산 합성을 활성화합니다( Liang et al., 2002 ). 따라서 LXR 활성화를 방지하여 암세포 증식을 약화시킬 수 있습니다. 그러나 특히 T0901317을 통한 LXR의 활성화, 유방암, 결장암 및 전립선암에서 암세포 증식을 억제합니다( Viennois et al., 2012 ). 이러한 발견은 FA 합성을 조절하는 것 이외의 LXR의 기능을 반영하는 것 같습니다.
지방산 분해 증가
활성화된 FA는 미토콘드리아 β-산화에 의해 분해됩니다 . FA-CoA는 카르니틴 팔미토일 트랜스퍼라제 1 (CPT1)에 의해 FA 카르니틴 으로 전환된 후 외부 미토콘드리아 막을 가로질러 세포질에서 수송됩니다 .
미토콘드리아 내에서 FA는 반복적으로 절단되어 Krebs 회로에 공급되는 아세틸-CoA를 생성하고 산화적 인산화를 위한 환원 당량을 생성합니다.
FA 풍부함을 제한하기 위해 FA 산화를 증가시키는 것은 이론적으로 유익할 수 있지만 이 아이디어를 테스트하는 실험의 데이터는 혼합되어 있습니다.
CPT1
CPT1은 이산화탄소로의 산화를 위해 미토콘드리아로 지방산을 수송하는 첫 번째이자 속도 제한 단계입니다.
malonyl-CoA에 의해 억제됩니다.
ACC의 직접 산물인 malonyl-CoA의 고갈로 인해 ACC2가 억제되면 FA의 β-산화가 증가합니다.
따라서 ACC 억제에 의한 암세포 증식의 약화(이전에 논의됨)는 부분적으로 FA의 분해 증가 때문일 수 있습니다.
암세포에서 증가된 FA 산화가 증식을 차단할지 여부는 아직 불분명합니다. 암 유형은 에너지 요구 사항 및 ACC 동형 발현 패턴에 따라 FA 산화 증가에 대한 임상 반응이 다를 수 있습니다.
일부 유형에서 증가된 FA 산화는 FA 가용성을 감소시키고 유익할 수 있습니다.
반면에 CPT1의 억제제인 에토목시르와 FA 산화의 간접적인 억제제인 라놀라진은 암세포를 죽일 수 있습니다
FA 산화율 증가에 대한 추가 경고는 세포 ATP 수준을 증가시켜 추가 세포 증식을 위한 에너지를 제공할 수 있다는 것입니다. 실제로, CPT1의 뇌 동형인 CPT1C는 에너지 스트레스 하에서 암세포의 생존에 중요합니다( Zaugg et al., 2011 ).
PPARα는 산화를 유도하는 활성화와 함께 FA 산화의 주요 전사 조절자입니다.
그러나 PPARα 작용제를 복용하는 인간은 유사한 암을 발병하지 않으며 실제로 PPARα 활성화는 여러 모델에서 종양 성장을 억제합니다( Yokoyama and Mizunuma, 2010 에서 검토 ).
지방산을 저장으로 전환
일단 만들어지면 FA는 막 지질 합성 , 분해 또는 저장에 사용될 수 있습니다 .
TG 또는 스테롤 에스테르와 같은 중성 지질에서 FA의 증가된 저장은 막 빌딩 블록 또는 신호 지질로 사용 가능한 FA를 감소시키고 세포 증식을 억제할 수 있습니다.
대부분의 세포는 주요 기능이 지질 저장인 세포 소기관인 세포질 지질 방울(LD)의 TG에 FA를 저장합니다.
주요 TG 합성 경로는 Kennedy 또는 glycerol-phosphate 경로 로 알려져 있습니다.
그것은 효소 글리세롤-3-포스페이트 아실트랜스퍼라제 (GPAT), 아실글리세롤 포스페이트 아실 트랜스퍼라제(AGPAT), 포스파티 드산 포스포하이드롤라제(리핀 또는 PAP) 및 디아실글리세롤 아실트랜스퍼라제(DGAT)를 사용하여 글리세롤 3-포스페이트와 FA를 축합합니다 . 가장 말단 효소(DGAT)를 제외한 모든 산물은 PL 합성에 공급됩니다. 따라서 GPAT, AGPAT 및 lipin은 PL 생산을 제한하기 위해 억제될 수 있으며 FA 저장을 늘리려는 노력은 DGAT 활성화에 중점을 둘 것입니다. 또한, FA 저장 증가의 잠재적인 이점은 저장에서 FA 방출을 동시에 억제하는 동안에만 실현될 수 있습니다.
보관 시 지방산 방출 차단
일단 저장되면, FA는 특정 리파아제에 의해 사용하기 위해 방출될 수 있습니다 .
지방분해 를 방지함으로써 암세포 증식에 사용할 수 있는 활성 FA 풀이 감소할 수 있습니다.
지방분해에서 파생된 FA는 중요한 신호 전달 지질의 전구체 역할도 할 수 있습니다( Wymann and
MAGL
MAGL 은 MG의 최종 FA를 가수분해 하여 글리세롤 백본을 남깁니다. MAGL 발현 및 활성은 여러 공격적인 암 세포주 및 원발성 종양에서 증가합니다
ATGL 및 HSL
암 세포 증식에서의 역할은 불분명하지만, ATGL과 HSL은 암 악액질 , 암 의 불리한 예후 인자인 소모 증후군 에서 중요한 역할을 합니다.
Table 1. Examples of Chemical Inhibitors of Lipid Enzymes that Could Reduce Fatty Acid Availability
EnzymeInhibitorCommentsSelected References
| ACC | Soraphen-A | Beckers et al., 2007 | |
| TOFA (5-(tetradecyloxy)-2-furoic acid) | Pizer et al., 2000, Guo et al., 2009a | ||
| A-769662 | Göransson et al., 2007 | ||
| Metformin | Indirect, activates AMPK, FDA approved | Pollak, 2012 | |
| AICAR | Indirect, activates AMPK | Jose et al., 2011, Swinnen et al., 2005 | |
| ACLY | SB-204990 | Hatzivassiliou et al., 2005, Ros et al., 2012 | |
| LY294002 | Indirect, PI3K inhibitor | Migita et al., 2008 | |
| ACS | Triacscin C | Mashima et al., 2005 | |
| Thiazolidinediones (TZDs) | ACSL4 specific, also activates PPARγ, FDA approved | Kim et al., 2001 | |
| AGPAT | CT-32501 | AGPAT2 specific | Takeuchi and Reue, 2009 |
| CKα | TCD-717 | Currently in phase I trials | http://clinicaltrials.gov/show/NCT01215864 |
| MN58B | Glunde et al., 2011 | ||
| CIC | Benzene-tricarboxylate analog (BTA) | Catalina-Rodriguez et al., 2012 | |
| CPT1 | Etomoxir | Samudio et al., 2010, Pike et al., 2011 | |
| Ranolazine | FDA approved | Samudio et al., 2010 | |
| FASN | Cerulenin and its derivative C75 | Lupu and Menendez, 2006, Ros et al., 2012 | |
| Orlistat | FDA approved | Lupu and Menendez, 2006 | |
| Flavonoids | Naturally occurring | Lupu and Menendez, 2006 | |
| Epigallocatechin-3-gallate (EGCG) | Found in green tea | Lupu and Menendez, 2006 | |
| MAGL | JZL184 | Nomura et al., 2010 | |
| SCD | BZ36 | Fritz et al., 2010 | |
| A939572 | Roongta et al., 2011 | ||
| SREBP | Fatostatin | Inhibits processing of SREBP-1 and SREBP-2 | Williams et al., 2013 |
| FGH10019 | Inhibits processing of SREBP-1 and SREBP-2 | Williams et al., 2013, Kamisuki et al., 2011 |
Shown are selected inhibitors for enzymes mentioned in text.
Cancers are diverse in type and underlying genetic alterations. Lipid metabolism is complex, with many different feedback mechanisms and points of regulation. Additionally, most of the lipid metabolic enzymes have multiple isoforms, and these may be coupled to different lipid metabolic processes and can have different cellular localization or tissue distribution. Therefore, successful therapies may be dependent upon understanding the specific metabolic abnormalities for a particular type of cancer.
암은 유형과 근본적인 유전적 변화가 다양합니다. 지질 대사는 다양한 피드백 메커니즘과 조절 지점으로 인해 복잡합니다. 또한, 대부분의 지질 대사 효소는 여러 개의 isoform을 가지며, 이들은 서로 다른 지질 대사 과정에 결합될 수 있으며 서로 다른 세포 국소화 또는 조직 분포를 가질 수 있습니다. 따라서 성공적인 치료법은 특정 유형의 암에 대한 특정 대사 이상을 이해하는 데 달려 있습니다.
'대사' 카테고리의 다른 글
| 암에서 지방산 대사의 재프로그래밍 (0) | 2021.08.16 |
|---|---|
| ATP 생산은 췌관 선암종에서 해당과정보다 지방산 산화에 의존 (0) | 2021.08.15 |
| 지방산 합성효소: 암의 새로운 표적 (0) | 2021.08.13 |
| 대사성 질환 및 암 치료에서 지방 생성 표적화 (0) | 2021.08.13 |
| 암의 잠재적인 치료 표적으로서의 지방산 합성효소 (0) | 2021.08.13 |