https://link.springer.com/article/10.1186/s40880-019-0412-6
<Targeting mitochondria as an anticancer strategy>
미토콘드리아 대사 및 암 발생
미토콘드리아는 아데노신 삼인산(ATP) 생성, 산화 환원 항상성, 대사 신호 및 세포 사멸 경로를 제어하는 소기관입니다.
해당과정은 전통적으로 암세포의 주요 에너지원으로 간주되었지만, 소위 "바르부르크 효과"에 따라 미토콘드리아는 종양 발생에서 핵심적인 역할을 하는 것으로 인식되었습니다[ 1 ].
암세포는 세포 활동을 고유하게 재프로그래밍하여 빠른 증식과 이동을 지원할 뿐만 아니라 암이 진행되는 동안 대사 및 유전독성 스트레스에 대응합니다[ 2 ].
또한, 미토콘드리아는 높은 에너지 수요 및 고분자 합성의 도전에 맞게 대사 표현형을 전환 할 수 있습니다.
따라서 암 미토콘드리아는 생존을 위해 해당과정과 산화적 인산화(OXPHOS) 사이를 유연하게 전환할 수 있는 능력이 있습니다.
전자 수송 사슬(ETC) 기능은 미토콘드리아 호흡에 중추적이며, 이는 새로운 피리미딘 합성에 필수적인 디하이드로오로테이트 탈수소효소(DHODH) 활성에도 필요합니다[ 4 ].
최근 연구에 따르면 미토콘드리아 DNA(mtDNA)가 결여된 암세포는 종양 발생 가능성이 부족하며, 전체 미토콘드리아의 수평 이동을 통해 숙주 기질 세포로부터 건강한 mtDNA를 획득하여 이 능력을 다시 얻습니다.
치료적 항암 접근법으로 미토콘드리아 표적화
전자 수송 사슬과 OXPHOS 기능, 해당 작용, 트리카르복실산(TCA) 주기, 세포자멸사 경로, 반응성 산소종(ROS) 항상성, 투과성 전이 기공 복합체, 미토콘드리아 DNA 및 DHODH 연결 피리미딘 합성 [ 8 , 9 ].
이 연구 하이라이트에서 우리는 암 치료에서 가장 관련성이 높은 미토콘드리아 표적 중 일부를 보여줍니다.
미토콘드리아 대사 표적화
(i) ETC 타겟팅
기능성 ETC는 OXPHOS 활성과 종양 형성에 필수적인 ATP(아데노신 삼인산) 생성을 지원합니다.
metformin, tamoxifen, α-tocopheryl succinate(α-TOS) 및 3-bromopyruvate(3BP)와 같은 많은 ETC 억제제는 ETC의 호흡 복합체의 기능을 방해하고 암세포를 죽이기 위해 높은 수준의 ROS를 유도함으로써 작용합니다
(ii) 해당과정 및 OXPHOS 표적화
해당 대사 경로는 미토콘드리아 대사를 위해 피루브산과 같은 주요 대사 중간체를 제공함으로써 미토콘드리아 기능에 직접적인 영향을 미칩니다.
더욱이, 해당과정과 산화적 인산화 사이를 유연하게 전환하는 악성 세포의 능력은 발암 억제에 대한 다양한 저항성 모드에서 중요한 역할을 하는 것으로 보입니다
따라서 해당 작용과 OXPHOS 기능을 모두 표적으로 하는 약제는 이상적인 항암 치료 접근법으로 유망합니다.
해당 작용 억제제와 결합된 미토콘드리아 표적 치료제는 상승적으로 종양 세포 증식을 억제합니다 Hexokinase II(HKII)는 암세포에서 과발현되는 효소의 주요 isoform이며 해당 활성을 유지하는 데 중요한 역할을 합니다.
또한 미토콘드리아 외막의 전압 의존성 음이온 채널(VDAC)에도 결합합니다.
따라서 HKII의 억제는 해당과정을 억제할 뿐만 아니라 HKII-VDAC 상호작용의 항-세포자멸사 효과도 억제합니다.
최근 보고에 따르면 메트포르민은 폐암 세포에서 HKII를 억제하여 포도당 흡수와 인산화를 감소시키는 것으로 나타났습니다.
메트포르민과 해당과정 억제제인 2-DG(2-deoxyglucose)를 병용하면 상승적으로 ATP를 고갈시키고 췌장암 세포에서 병용 치료에 강력한 시너지를 보였다. 미토콘드리아 표적 약물인 미토콘드리아 표적 카복시-프록실(Mito-CP)과 2-DG는 상당한 종양 퇴행을 초래했으며, 이는 미토콘드리아 생체 에너지 대사 및 해당 억제제의 이중 표적이 유망한 화학요법 전략을 제공할 수 있음을 시사합니다[ 15 ].
(iii) TCA 주기 목표
TCA 주기는 ATP 생성에 필요한 전기화학적 양성자 기울기를 구동하기 위해 ETC에 공급되는 전자의 소스입니다.
이소시트레이트 탈수소효소 1 및 2(IDH1, IDH2)는 이소시트레이트를 α-케토글루타레이트로 전환하는 것을 촉매하여 종양 형성에 중요한 역할을 합니다[ 9 ].
IDH1과 IDH2의 돌연변이는 서로 다른 인간 암에서 발견되어 항암 치료의 유망한 표적이 됩니다.
3BP와 디클로로아세테이트는 광범위한 암 유형에서 높은 항암 잠재력을 가지고 있습니다.
세포 사멸 경로 및 ROS 항상성 표적화
(i) Bcl-2 계열 단백질 표적화
Bcl-2, Bcl-xL, Bax 및 Bak은 고유한 세포자멸사 경로에서 중요합니다.
Gossypol, Navitoclax, ABT-737 및 α-TOS와 같은 화합물은 Bcl-2 상동성-3 도메인의 모방체로 작용하여 미토콘드리아 후 세포자멸사 신호의 활성화를 통해 암세포를 죽입니다[ 17 ].
(ii) 산화환원 조절 효소 및 ROS 생성 표적화
전자 수송 사슬은 ROS 생산의 주요 부위이며 ECT 복합체의 간섭으로 인해 방출되는 높은 수준의 ROS는 세포 손상을 유발합니다.
옥시마트린은 높은 수준의 ROS를 생성하여 인간 흑색종 세포를 효율적으로 죽이는 것으로 보고되었습니다.
캡사이신, 카스티신 및 미리세틴은 ROS 생성을 증가시켜 암세포에서 미토콘드리아 막횡단 가능성을 파괴함으로써 항암 활성을 나타냅니다[ 8 ].
암세포 사멸을 유도하기 위해 미토콘드리아 ROS 생성을 촉진하면 화학 요법의 활성이 향상될 수 있습니다.
요약하면, 미토콘드리아는 세포 생존과 세포 사멸에 중요한 역할을 합니다. 미토콘드리아 호흡은 ATP 생산을 지원하며 종양 형성에도 필수적입니다.
*********************************************************************
Targeting mitochondria for cancer therapy
키 포인트
- 미토콘드리아는 생리학적 및 병리학적 조건에서 중요하고 치명적인 기능을 모두 발휘합니다. 미토콘드리아는 에너지 생산과 진핵 세포의 생존에 필수 불가결할 뿐만 아니라 세포 사멸의 고유(미토콘드리아) 경로의 중요한 조절자이기도 합니다.
- 미토콘드리아 기능은 암에서 자주 변경됩니다. 대부분의 고전적인 항암제는 미토콘드리아의 상류에 있는 신호 전달 경로에 관여하고 이러한 세포 소기관에 수렴하여 세포 사멸을 유발합니다. 따라서 미토콘드리아를 직접 표적으로 하는 약물은 약물 내성을 우회하는 독특한 도구를 구성합니다.
- 대사 재프로그래밍은 미토콘드리아와 복잡하게 연결되어 있고 암의 아킬레스건을 표적으로 하는 약물 개발을 위한 독특한 기회를 제공하는 암세포의 핵심 기능입니다.
- 미토콘드리아 막의 투과화는 미토콘드리아 세포자멸사 동안 중심적인 사건을 구성합니다. B-세포 림프종 단백질 2(BCL-2) 단백질 패밀리의 조절제, 대사 억제제, 전압 의존성 음이온 채널(VDAC) 표적화 및 아데닌 뉴클레오티드 트랜스로카제를 포함하여 미토콘드리아 막 투과성에 영향을 미치는 여러 부류의 약리학적 화합물이 확인되었습니다. (ANT)-표적제, 산화환원 활성 분자, 레티노이드, 열충격 단백질 90(HSP90) 억제제 및 독특한 작용 기전을 가진 천연 화합물.
- 항암 활성을 가진 여러 미토콘드리아 표적 제제는 천연 화합물에서 파생되며 고처리량 스크리닝 방법보다는 우연에 의해 확인되었습니다. 따라서 천연 물질의 대규모 라이브러리에 대한 체계적인 스크리닝은 항암 약물 발견을 위한 보물창고일 가능성이 높습니다.
- 미토콘드리아는 세포 내 활성 산소 종(ROS)의 가장 두드러진 공급원이며 낮은 수준의 ROS는 암세포 줄기와 관련이 있습니다. 따라서 미토콘드리아를 표적으로 하는 산화환원 활성제는 암 줄기 세포를 선택적으로 표적으로 하는 새로운 전략을 제공할 수 있습니다
미토콘드리아는 세포의 발전소일 뿐만 아니라 자살 무기 저장소이기도 합니다.
수십 개의 치명적인 신호 전달 경로가 미토콘드리아에 수렴하여 미토콘드리아 외막의 투과성을 유발하여 세포자살 촉진 단백질의 세포질 방출 및 미토콘드리아의 생체 에너지 기능 손상을 초래합니다.
암 세포의 미토콘드리아 대사는 동화작용에서 원래 산화적 인산화를 위해 예정되어 있는 해당 중간체의 사용으로 인해 조절되지 않습니다
따라서 미토콘드리아 대사의 종양 특이적 변경을 억제하거나 미토콘드리아 막 투과성을 자극함으로써 암세포에서 세포 사멸 기구를 활성화하는 것은 유망한 치료 접근법이 될 수 있습니다.



미토콘드리아 대사
정상적인 산소 장력 조건에서 비악성 세포는 주로 ATP 생산을 위한 산화적 인산화에 의존하는 반면 암세포는 높은 산소 조건에도 불구하고 향상된 해당 작용을 나타냅니다.
따라서 호흡 사슬을 통한 전자 흐름은 정상 세포보다 악성 세포에서 훨씬 더 낮습니다.
호기성 해당작용에 의한 ATP 생산(이는 직접적으로 젖산 생성 증가로 이어짐)은 다양한 산소 조건에서 더 잘 생존할 수 있게 해주기 때문에 암세포에 유리합니다.
hexokinase (HK) isoforms (HK1 및 HK2)는 비 암새포보다 암세포의 미토콘드리아 외막에서 투과성 전이 공극 복합체 (PTPC)의 구성 요소인 전압 의존성 음이온 채널 (VDAC)에 더 밀접하게 결합되어 있습니다.
따라서 미토콘드리아로부터의 잔여 ATP 생산 및 내보내기를 해당 과정의 속도 제한 단계(즉, 포도당(Glu)를 포도당-6-인산(G6P)로 전환)로 연결합니다.
PTPC는 또한 아데닌 뉴클레오티드 트랜스로카제(ANT)와 사이클로필린 D(CYPD)를 포함합니다.
더욱이, 정상 세포에서는 피루브산(해당 분해의 최종 산물)이 미토콘드리아로 유입되어 트리카르복실산(TCA) 회로에 들어가는 반면, 암세포에서는 세포질에서 젖산 탈수소효소(LDH)에 의해 우선적으로 젖산으로 전환되어 산성화됩니다. 그림 참조).
대사 재프로그래밍
악성 세포를 특징짓는 동화작용의 전반적인 증가는 적어도 부분적으로는 광범위한 대사 프로그래밍에 기인합니다.
발암성 키나아제 신호전달은 지방산 합성효소와 ATP 시트르산 분해효소 활성화를 통해 지방산 생합성과 스테로이드 생성을 증가시키고, 포스포에놀피루브산의 피루브산(마지막 단계해당)으로 탈인산화를 촉매하는 효소인 피루브산 키나아제의 배아 M2 이소폼의 활성을 억제함으로써 동화작용을 향한 증가된 해당작용 흐름을 벗어납니다.
p53 기능의 암 관련 손실은 해당 작용과 활성 산소 종의 생성을 억제하는 6-phosphofructo-2-kinase의 isoform인 TIGAR와 미토콘드리아에 필요한 미토콘드리아 단백질인 (시토크롬 c 산화효소와 적절한 조립을하여 효율적인 미토콘드리아 호흡을 위해필요한 미토콘드리아 단백질)의 불완전한 transactivation을 통해 해당 작용 증가에 기여합니다.
전사 인자 hypoxia-inducible factor 1(HIF1)은 호기성 대사에 관여하는 많은 유전자, 예를 들어 pyruvate를 억제하여 pyruvate가 acetyl-CoA로 전환되는 것을 부정적으로 조절하 pyruvate dehydrogenase kinase를 전사 활성화합니다.
이로서 탈수소효소를 억제하여 산화적 인산화를 방해합니다.
TCA 회로 효소 fumarate hydratase 및 succinate dehydrogenase의 Germline mutations(생식선 돌연변이)는 HIF1의 분해를 억제하는 중간 대사 산물의 축적을 통해 HIF1를 유도합니다
암세포의 비정상적인 미토콘드리아 대사를 표적으로 하는 가능한 치료 전략에는 해당과정의 억제, HK-VDAC 상호작용의 파괴 및 LDH의 억제가 포함됩니다.

****************************************************************************
https://www.mdpi.com/1422-0067/21/19/6992/htm
Natural Agents Targeting Mitochondria in Cancer
Mitochondria are the key energy provider to highly proliferating cancer cells, and are subsequently considered one of the critical targets in cancer therapeutics. Several compounds have been studied for their mitochondria-targeting ability in cancer cells.
www.mdpi.com
2020
<Natural Agents Targeting Mitochondria in Cancer>
암세포는 건강한 세포에 비해 대사 요구와 항산화 방어가 더 높습니다[ 10 ].
산화적 해당작용과 함께 미토콘드리아는 암세포의 증식에도 중요합니다. [ 11 ].
또한, ATP 요구에 대한 산화적 인산화(OXPHOS)에 대한 일부 암의 과도한 의존은 암에서 미토콘드리아의 중요성을 더욱 강조합니다[ 12 , 13 , 14 ].
미토콘드리아 표적 치료제는 OXPHOS 기계를 방해하고 암세포 사멸을 초래할 수 있습니다. [ 14].
최근 보고서에 따르면 미토콘드리아는 대사 재프로그래밍, 미토콘드리아 탈분극, 산화 신호 전달, ROS 생성 및 종양 형성을 향상시키는 대사 산물 생산 과정을 통해 종양 형성에 중요한 기여자임을 나타냅니다
에너지 요구를 충족시키기 위해 암세포는 산화적 해당과정에 크게 의존하며, 이는 또한 포도당 수송체의 상향 조절로 이어집니다[ 20 , 21 ].
상향 조절된 포도당 수송체는 포도당을 과도하게 공급하여 암세포의 과증식을 조장합니다.
높은 해당 속도는 젖산 및 피루브산과 같은 많은 대사산을 생성합니다.
그러나 암세포는 세포 내 pH가 더 높고(≥7.4) 세포 외 pH가 더 낮습니다(~6.7–7.1)[ 22 ].
암세포의 이러한 pH 조건은 정상 세포와 비교하여 pH 구배의 완전한 역전일 뿐입니다[ 23 , 24 , 25].
암세포의 이러한 특징은 양성자를 밀어내고 다른 이온을 침입하는 원형질막 이온 펌프와 수송체의 과활성화에 있습니다.
암세포에서 발현되는 가장 흔한 수송체는 H + /Na + 교환체이며; 전압 개폐 양성자 채널; H + /K + ATPase; H + /모노카르복실레이트 공동수송체 및 Na + /HCO 3- 공동수송체 [ 26 ].
젖산 이온은 H + /모노카르복실레이트 공동수송체에 의해 암세포 외부로 빠르게 압출 됩니다.
높은 세포 내 pH로 인해 이 세포는 세포 증식에 관대하고 세포 사멸을 피합니다 [ 25].
이러한 pH 구배의 역전은 암 세포의 전이 진행을 더욱 돕습니다[ 24 ].
암세포의 미토콘드리아는 정상 세포에 비해 과분극되어 있습니다[ 21 ].
이 과분극은 세포 내 Ca 2+ 수준 의 증가 와 암세포에서 항-세포자멸사 Bcl-2 단백질의 상향 조절 때문일 수 있습니다 [ 27 , 28 ].
암세포에서 다양한 아데닌 뉴클레오티드 트랜스로카제(ANT)의 발현 수준의 변화도 미토콘드리아의 과분극에 기여할 수 있습니다[ 29].
따라서 세포질의 산성화 변화를 포함하여 더 높은 미토콘드리아 막 전위가 암세포의 다른 미토콘드리아 관련 특징으로 관찰됩니다.
암세포에서 미토콘드리아 막 전위의 과분극은 다양한 미토콘드리아 표적 약물이 암세포로 선택적으로 전달되는 것을 향상시켜 암세포의 세포자멸사를 유도할 수 있습니다.
암세포 대사의 또 다른 특징은 건강한 세포보다 종양 세포에서 관찰되는 상대적으로 높은 ROS 수준입니다.
세포의 과도한 ROS 수치는 독성이 있으며 세포 사멸을 일으킵니다 [ 31 , 32].
그러나 암세포에서 이 더 높은 ROS 수준은 종양 세포의 형질전환, 증식, 생존, 이동, 침습 및 전이에 기여합니다[ 33 ].
최근 연구자들은 이러한 취약성과 ROS 수준의 차이를 활용하여 암세포에서 세포자멸사를 유발하고 질병을 제거할 수 있는 새로운 치료제를 개발하는 데 집중하고 있습니다.
미토콘드리아는 몇 가지 pro-apoptotic 요인을 포함하고 프로그램된 세포 사멸 경로를 유발할 수 있습니다
서로 다른 종류의 미토칸이 서로 다른 방식으로 미토콘드리아를 표적으로 삼도록 제안 되었지만 [ 38 ] 궁극적으로 암세포의 미토콘드리아 매개 세포자멸사를 유도하는 것을 목표로 합니다.
------------------------------------
암세포에서 에너지 생산 과정은 해당 에너지 요구를 충족시키기 위해 해당 작용을 통해 길을 만듭니다.
따라서 암의 초기 단계에서 해당 비율이 극적으로 높은 것으로 관찰됩니다.
해당 과정이 연결되어 미토콘드리아 활성에 의존하기 때문에, 미토콘드리아는 암의 병인학에서 중요한 용의자 중 하나로 제안되었습니다.
또한 미토콘드리아 대사는 다양한 유형의 단백질과 생화학적 과정에 의존합니다.
예를 들어, Bcl-2 계열 단백질은 미토콘드리아 투과성 전환(MPT) 기공 개방을 조절한 후 미토콘드리아에서 세포질로의 세포자멸사 생성 단백질의 방출과 세포자멸사를 조절합니다[ 45 , 46 , 47 ].
유사하게, 미토콘드리아 내에서 발생하는 전자 수송 사슬(ETC) 및 트리카르복실산 회로(TCA 회로)의 결함도 ATP 및 ROS 수준에 영향을 미칩니다.
그들은 결국 암세포 대사에 영향을 미칠 수 있습니다 [ 48 , 49].
따라서 이러한 단백질/과정의 결함은 암세포에 세포 스트레스를 유발하고 미토콘드리아 매개 세포자멸사를 유발할 수 있습니다[ 7 ].
( 그림 1 ).
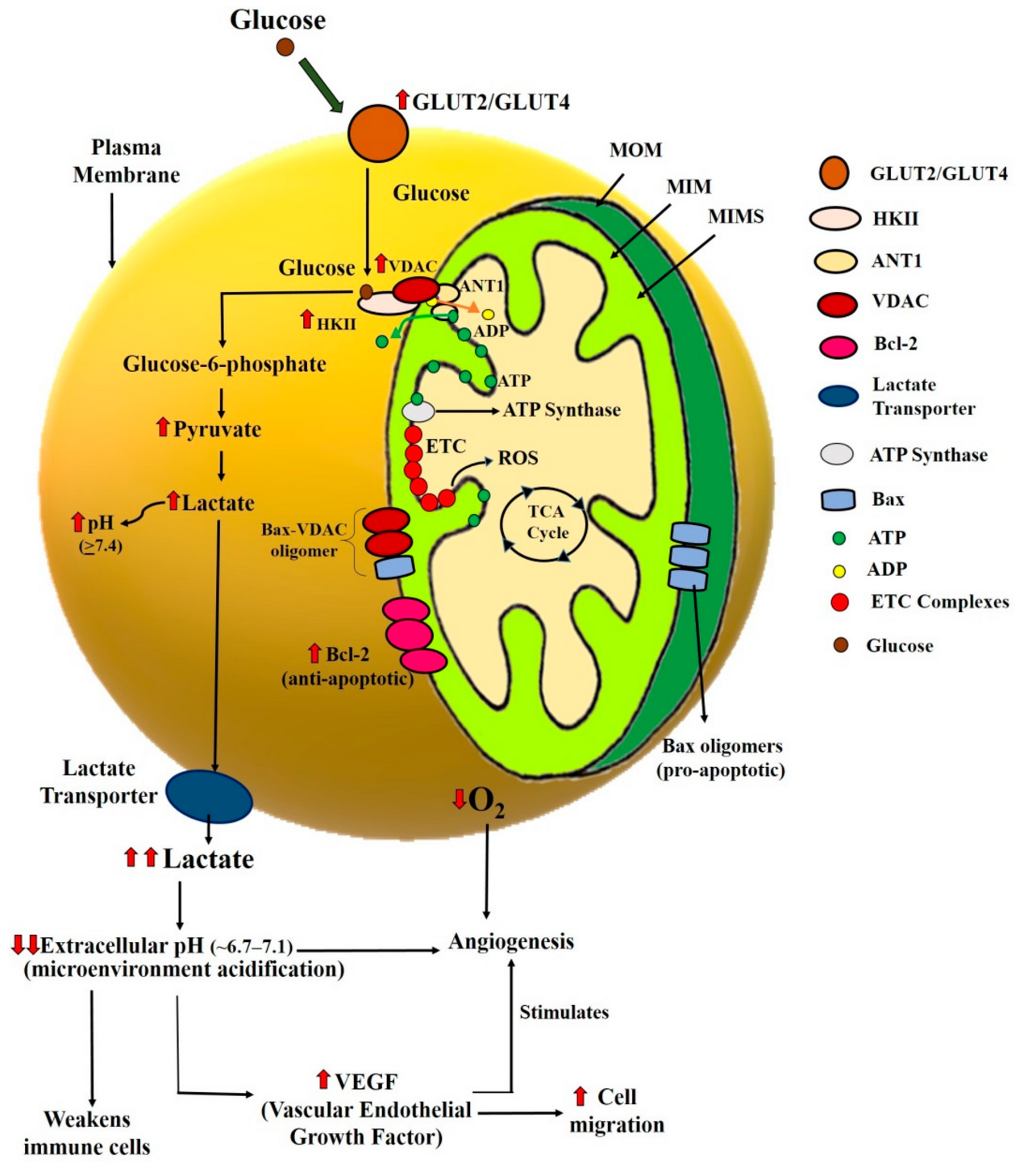
그림 1. 암세포의 생체 에너지 메커니즘과 암세포의 중요한 체크포인트.
포도당은 포도당 수송체(GLUT2/GLUT4)를 통해 세포에 들어가고 포도당을 포도당 6인산(G6P)으로 전환하기 위한 또 다른 기질로 ATP를 사용하는 HK-II에 기질로 결합합니다.
G6P는 해당과정에 추가로 사용되며 OXPHOS는 ATP 생산에 사용됩니다.
해당 과정을 통한 ATP 생산 과정은 최종 생성물인 피루브산에서 젖산을 생산합니다.
암세포에서 해당 작용의 지속적인 활동은 암세포 환경의 pH를 낮추는 젖산염의 증가로 이어집니다.
이 전체 현상의 전반적인 결과는 혈관 신생의 자극, VEGF 증가 및 암세포 이동의 증가에 의해 암세포에 유리합니다. 또한 면역 세포를 약화시킵니다.
MOM: 미토콘드리아 외막; MIM: 미토콘드리아 내막; MIMS: 미토콘드리아 막간 공간.

그림 2. 다양한 종류의 미토칸과 분자 표적의 그림.
클래스 1: 헥소키나제 억제제;
클래스 2: 항세포자멸사 Bcl-2 계열 단백질의 기능을 손상시키는 BH3 모방체 및 관련 제제;
클래스 3: 티올 산화환원 억제제;
클래스 4: 전압 의존성 음이온 채널(VDAC) 및 아데닌 뉴클레오티드 트랜스로카제(ANT)를 표적으로 하는 제제;
클래스 5: 미토콘드리아 전자 수송 사슬을 표적으로 하는 화합물;
클래스 6: 미토콘드리아 내막(MIM)을 표적으로 하는 소수성 양이온;
클래스 7: 트리카르복실산(TCA) 주기에 영향을 미치는 화합물; 및
클래스 8: mtDNA를 방해하는 물질.
각 클래스의 예는 해당 연구에 해당하는 그림에 언급되어 있습니다.
Table 1. (a) List of synthetic mitocans and their current status in clinical trials.
(b) List of synthetic mitocans, and their current status in preclinical and in vitro studies.
(a)S. No.Synthetic CompoundMode of ActionMitocan Class *Current StatusReferences
| 1. | ABT-263 (Navitoclax) |
Inhibits anti-apoptotic Bcl-2 family proteins (Bcl-XL, Bcl-2, and Bcl-w). Induces translocation of Bax, release of cytochrome c. | 2 | Phase II of the clinical trial | [71,117,118] |
| 2. | 1-methyl-4-phenyl-pyridinium | Affects the overall function of mitochondria by inhibiting ATP generation | 8 | Failed to cross the blood-brain barrier | [119] |
| 3. | Vitamin K3 or Menadione | Inhibits DNA polymerase γ and increased ROS generation | 8 | Failed in phase II of the clinical trial (https://clinicaltrials.gov) | [93,120] |
| 4. | Dichloroacetate, (DCA) | Unbalance the redox homeostasis and overproduction of ROS | 7 | Terminated from phase II clinical trial (https://clinicaltrials.gov | [90,121] |
| 5. | Mito-Tam (a mitochondrial-targeted derivative of tamoxifen.) | Inhibits complex I- driven respiration | 5 | Phase I of the clinical trial | [83,122] |
| 6. | α-TOS | Targets Complex II and accumulation of ROS | 5 & 2 | Completed Phase III of clinical trial | [123,124,125] |
| 7. | 2-Deoxy-D-glucose (2DG) | Increased levels of glucose transporter expression and glucose uptake. Inhibits hexokinase and hexose phosphate isomerase | 1 | Terminated after phase I clinical trial Study for combination with other drugs. |
[64,126,127] |
| 8. | F16 | Accumulation in cancer cell mitochondria leading to apoptosis | 6 | Terminated from phase II clinical trial (https://clinicaltrials.gov) | [88,128,129] |
| 9. | Arsenic trioxide | Induces oxidative stress, DNA damage, change in mitochondrial membrane potential, translocation, and upregulation of apoptotic proteins |
3 | Phase II of a clinical trial (https://clinicaltrials.gov) | [76,130,131] |
| 10. | Benserazide | Reduce the uptake of glucose, production of lactate, level of ATP and causes apoptosis | 1 | Phase IV of the clinical trial | [65] |
| 11. | Metformin | Target mitochondrial ETC; Exerts oxidative stress | 5 | Phase I of clinical trials | [83,84,132] |
| 12. | Sorafenib | Inhibition of ATP synthase | 5 | Phase III of the clinical trial | [82] |
| (b) | |||||
| S. No. | Synthetic Compound | Mode of action | Mitocan Class * | Current status | References |
| 1. | Antimycin A | Inhibits succinate, nicotinamide adenine dinucleotide (NADH) oxidase, and electron transport between cytochrome b & c | 2 & 5 | Preclinical studies | [133,134] |
| 2. | MKT-007 | Targets mtDNA, a metabolic inhibitor | 8 | Preclinical studies and in vitro studies | [96,135] |
| 3. | Adaphostin | Inhibits complex II and III of ETC and accumulation of ROS | 5 | Preclinical stage and combinatorial study with other drugs. | [136,137,138] |
| 4. | 3 Bromopyruvate (3BP) | Inhibition of HK II, glyceraldehyde-3-phosphate dehydrogenase and LDH, Induces the mitochondrial protein leakage and block the electron transport system | 1 & 5 | Under research to improve its specificity, sensitivity & efficacy by combining with other anticancer agents or formulating with targeted liposomes to enhance its delivery. | [63,139,140] |
| 5. | Rhodamine-123 | Accumulation in mitochondria | 6 | No current update as a mitocan | [85,141] |
| 6. | (KLAKKLAK)2 (Pro-apoptotic Peptide) |
Disrupt mitochondrial membrane | 6 | Understudy for improving its efficacy | [87,142,143] |
| 7. | Mito-LND | Inhibition of mitochondrial complexes I and II, and stimulation of ROS production | 5 | Pre-clinical studies | [112,114,115] |
| 8. | Danshensu-Tetramethylpyrazine (DT-010) | Inhibition of mitochondrial complex II | 7 | Preclinical studies | [144,145] |
| 9. | NSC13062 | Target mitochondrial ETC | 5 | Preclinical studies and in vitro studies | [113,116] |
| 10. | Mito-K3 (derivative of Menadione) | Accumulates in mitochondria, interferes with redox property, and causes mitochondrial dysfunction | 8 | Preclinical studies | [146] |
| 11. | MitoVE11S (CNC332) | Targets mitochondrial complex II | 5 & 8 | Preclinical and in vitro studies | [50,147,148] |
* For all the compounds in Table 1a and 1–6 compound of Table 1b, the mitocan class has already been justified and published. However, for the rest of the compounds (7–11) in Table 1b, we have proposed the suitable mitocan class based on their known molecular mechanism.
Table 2. Categorization of natural agents into different classes of mitocans.
S. No.Natural Agent (Source)Mode of actionMitocan ClassCurrent statusReferences
| 1. | Phenethyl isothiocyanates (cruciferous vegetables) |
Induction of oxidative stress and triggering of Ca2+ flux, which leads to mitochondrial cell death mechanisms | 3 | Phase I clinical trial (https://clinicaltrials.gov) | [154,155,156] |
| 2. | Benzyl isothiocyanate (brassicas) |
Intrinsic apoptosis is mediated via ROS production and mitochondrial dysfunction. | 3 | In vitro studies going on | [154,155] |
| 3. | Gossypol (cotton plant) |
Inhibits Bcl-2, Bcl-XL, Bcl-W, Mcl-1 | 2 | Phase II of the clinical trial (https://clinicaltrials.gov) | [70,153] |
| 4. | Andrographolide (Andrographis paniculata) | Targets Bcl-2 family protein and cyclophilin D; Increased ROS production | 2 | In vitro study | [157,158,159] |
| 5. | Asiatic acid (Centella asiatica) | Increases mitochondria membrane permeability, ROS generation, alteration of Bax/Bcl-2 ratio, and activation of caspase-3 | 2 | In vitro study | [160,161,162] |
| 6. | Berberine (Coptidis rhizoma) | Increases expression of Bax; Decreases Bcl-2 expression level; Induces ROS and Ca2+ production; Loss of mitochondria membrane permeability | 2 | In vitro study | [163,164,165] |
| 7. | Bezielle (Scutellaria barbata) |
Inhibits Glycolysis and OXPHOS by increasing the ROS level | 3 | In vitro study | [166,167] |
| 8. | Curcumin (Curcuma longa) |
Downregulation of expression and activity of HK II; Loss of mitochondria membrane potential | 1 and 2 | In vitro study | [168,169] |
| 9. | Flavokawain A (Piper methysticum) |
Induces mitochondrial-dependent apoptosis by increasing the expression of Bax | 2 | In vitro and in vivo study | [170,171] |
| 10. | Methyl jasmonate (most of the plants) |
Detaches HKII from VDAC and causes loss of mitochondrial function; | 1 | In vitro and in vivo study in mice model | [172,173] |
| 11. | Withanone (Withania somnifera) |
Acts as a ROS-producing agent causing DNA and mitochondrial damage | 3 | In vitro study | [174] |
| 12. | Xanthones (Garcinia mangostana) | Causes loss of mitochondria membrane potential | 6 | In vitro and in vivo study | [175,176] |
Table 3. Categorization of plant extracts into different classes of mitocans.
S. No.Anticancer PlantExtractCancer Type/ Cell LinesMode of ActionProposed ClassReferences
| 1. | American Ginseng (Panax quinquefolis) |
Steamed and extracted by ethanol | Colon cancer (SW-480) | Decreases the expression of Bcl-2 and induce mitochondrial-mediated apoptosis | 2 | |
| 2. | Ashwagandha (Withania somnifera) |
Methanolic | Breast cancer (MCF-7) | Acts as a ROS-producing agent causing DNA and mitochondrial damage | 3 | |
| 3. | Barbed skullcap (Scutellaria barbate) |
Aqueous | Primary liver cancer mouse hepatoma cells (H22) | Apoptosis via loss of mitochondrial transmembrane potential, the release of cytochrome c, and activation of caspase-3 | 6 | |
| 4. | Bitter gourd (Momordica charantia) |
Methanolic | Human nasopharyngeal carcinoma cells (Hone-1), gastric adenocarcinoma cells (AGS), colon cancer cells (HCT-116), and lung adenocarcinoma cell (CL1-0) | Increased Bax/Bcl-2 ratio and mitochondria-dependent apoptosis | 2 | |
| 5. | Cape gooseberry (Physalis peruviana) |
Ethanol | Human hepatocellular carcinoma (Hep G2 cells) + mouse model | Apoptosis mediated through a mitochondrial signaling transduction pathway | 2 | |
| 6. | Cinnamon (Cinnamomum cassia) |
Aqueous | Cervical cancer (SiHa) | Induces apoptosis by loss of mitochondrial membrane potential (MMP) | 6 | |
| 7. | Fish mint (Houttuynia cordata) |
Ethanol | Human colon adenocarcinoma (HT-29 cells) | Loss of mitochondria membrane potential increased ROS production and alterations ofmitochondrial proteins such as cytochrome c, Apaf-1, AIFand pro-caspase-9 | 6 | |
| 8. | Ginger (Zingiber officinale) |
Methanol | Prostate cancer | Altered Bax/Bcl-2ratio and collapse of mitochondrial membrane potential | 2 | |
| 9. | Gotu Kola (Centella Asiatica) |
Methanol | Breast cancer (MCF-7) | Loss of mitochondria membrane potential due to increased expression of Bax and decreased expression of Bcl-2 | 2 | |
| 10. | Huaier (Trametes robiniophila murr) |
Aqueous | Breast cancer (MCF-7 and MDA-MB-231) | Suppresses the Bcl-2 expression and up-regulate Bax expression and leads to mitochondrial-mediated apoptosis | 2 | |
| 11. | Ironwood (Memecylon edule) |
Ethyl acetate | Human gastric carcinoma | Apoptosis by decreasing the expression of anti-apoptotic protein Bcl-2 | 2 | |
| 12. | Pupa grass (Cordyceps militaris) |
Aqueous | Breast cancer (MDA-MB-231 cells) | Activation of caspase-3 and mitochondria dysfunctions | 2 | |
| 13. | Slender red seaweed (Gracilaria tenuistipitata) |
Ethanol | Oral squamous cell cancer (Ca9-22 cell) | Inhibition and apoptosis by increased ROS level, GSH depletion, caspase activation, and mitochondrial depolarization | 6 | |
| 14. | Veldt grape (Cissus quadrangularis Linn) |
Acetone | Skin cancer (A431) | Altered Bax/Bcl-2ratio, release of cytochrome c from mitochondria | 2 |
2. HKII를 억제하는 천연 물질
포도당은 세포 호흡의 첫 번째 기질이며 세포 유형에 따라 다양한 유형의 포도당 수송체(GLUT1-GLUT5)를 통해 세포에 들어갑니다[ 54 , 55 ].
에너지의 형태로 접근할 수 있게 하려면 포도당을 분해해야 합니다.
포도당에서 에너지를 생성하기 위해 포도당 분자를 산화시키고 피루브산(피루브산), ATP 및 환원된 NADH를 생성하는 첫 번째 세포 호흡 경로인 해당과정을 거칩니다.
첫 번째 효소 또는 호기성 해당과정의 중요한 매개체는 HKII입니다[ 190 ].
정상 세포에서 들어오는 포도당과 또 다른 기질인 ATP는 HKII에 결합하여 G6P를 생성하고 해당 작용과 HMP(육탄당 일인산) 단락을 위해 분배됩니다[ 191].
HMP 션트는 두 가지 주요 기능, 즉 니코틴아미드 아데닌 디뉴클레오티드 인산 수소(NADPH) 생성 및 리보스 5-포스페이트(R5P) 제공과 관련이 있습니다.
그러나 암 세포 환경에서 관찰되는 개인차가 있습니다.
그것은 암세포에서 HKII의 과발현으로 시작하여 포도당 흡수율도 더 높습니다[ 55 ].
높은 해당과정은 이들 세포에서 ATP와 젖산의 과잉 생산으로 이어질 수 있습니다.
ATP 양의 증가는 세포 증식에 도움이 될 수 있으며, 더 많은 양의 젖산은 적절한 수송 단백질(위에서 설명한 대로)에 의해 이러한 세포 외부로 내보내집니다. 더 높은 젖산 수치는 세포 외 pH를 감소시켜 차례로 암세포의 이동과 침입을 돕습니다.
HKII의 더 높은 발현과 활성으로 인해 HMP shunting을 통한 R5P의 생산도 증가하여 암세포에서 핵산 합성을 돕습니다.
HKII가 높을수록 NADPH 수준이 증가하여 ROS에 대한 민감도가 감소합니다.
따라서 HKII의 억제는 ATP 생산과 DNA 복제를 감소시켜 암세포에 세포 증식 억제 효과를 나타낼 수 있습니다.
또한 암세포에서 ROS 및 미토콘드리아 매개 세포자멸사에 대한 감수성을 증가시켜 세포독성 효과를 입증할 수 있습니다.
따라서 HKII의 억제는 암 치료제의 중요한 측면 중 하나입니다.
천연 물질인 메틸 자스모네이트(MJ)와 커큐민이 HKII를 표적으로 하여 암세포에 대한 세포독성을 나타내는 것으로 관찰되었습니다.
흥미롭게도 어떤 연구도 정상 세포에서 심각한 독성을 보고하지 않았습니다.
유사하게, Wang et al. (2015)는 다양한 농도(10, 20, 40μmol/L)의 커큐민으로 처리하고 24시간 동안 배양한 인간 대장암 세포(HCT116 및 HT29)에 대한 연구를 수행했습니다.
HKII가 커큐민 처리된 HCT116 및 HT29 세포의 미토콘드리아에서 분리되는 것이 관찰되었습니다[ 168 ].
따라서 이러한 연구는 커큐민과 MJ가 미토콘드리아에서 HKII의 해리를 강화하여 포도당 흡수와 젖산 생성을 억제하여 암세포 에너지 대사를 억제하고 세포 사멸을 유발함을 시사합니다( 그림 3 ).

그림 3. HKII에 대한 허브 미토칸의 억제 효과의 도식적 표현.
HKII의 억제는 포도당의 G6P로의 전환을 억제하고 해당 과정과 HMP 션트를 방해하여 암세포에 대한 세포 증식 억제/세포독성 효과를 유발할 수 있습니다.
메틸 자스모네이트와 커큐민은 세포 증식을 감소시켜 세포 증식을 억제하고 암세포를 죽임으로써 세포 독성을 나타낼 수 있습니다.
3. Bcl-2 계열 단백질을 표적으로 하는 천연 물질
Bcl-2 계열 단백질은 세포의 세포자멸사 반응에 있어 눈에 띄게 필수적인 게이트키퍼입니다. 이 단백질 군은 세 그룹으로 구성됩니다:
항-세포자멸 단백질(Bcl-2, Bcl-XL, Bcl-W),
세포자멸 촉진 효과자(Bax, Bak 및 BOK) 및
세포자멸 촉진 활성자(BH3- 단백질만: BAD, BAD, BIK, BIM, BMF, HRK, NOXA, PUMA 등) [ 61].
Bcl-2 계열 단백질의 이 세 그룹은 세포의 세포자멸사 과정을 조절하는 다양한 작용 메커니즘을 통해 기능합니다.
세포자살 자극(세포 스트레스, 즉 지질, 단백질, DNA 및 RNA에 대한 손상)에 대한 반응으로, 세포자멸사 단백질이 활성화됩니다.
지난 몇 년 동안 암 치료제는 암 세포를 죽이는 pro-apoptotic protein을 시작하거나 anti-apoptotic protein을 억제하는 것으로 개념화되었습니다[ 70 , 71 , 72 , 87 ].
다양한 실험 연구에서 플라보카와인 A, 베르베린, 아시아트산 및 안드로그라폴라이드가 Bcl-2 계열 단백질의 작용을 통해 매개되는 세포자멸사를 유도하는 천연 물질이라는 것이 밝혀졌습니다.
Flavokawain A는 Piper methysticum 의 생리 활성 화합물이며 항증식 활성이 다양한 암세포에서 연구되었습니다. 유방암 세포(MCF-7 및 MDA-MB231)에 대해 수행된 연구는 플라보카와인 A가 Bax의 발현을 증가시키고 미토콘드리아 막 전위의 변화를 증가시킨다는 것을 시사했습니다.
Coptidis rhizoma 의 생리 활성 화합물인 Berberine 의 항암 특성은 유방암 세포(MCF-7), 간암 세포(HUH-7) 및 구강암 세포(HSC)에서도 연구되었습니다.
그 결과, 베르베린이 플라보카와인 A와 유사한 항암 기전을 나타내는 것이 분명했다[ 163 , 164 , 165 ].
또한, 정상 유방암 세포(MCF-12F)에서 연구된 베르베린의 영향은 정상 유방 세포에 대한 베르베린의 무독성을 드러냈습니다[ 164 ].
Centella asiatica 의 생리활성 화합물인 Asiatic acid 는 다양한 in vitro 및 in vivo 모델 시스템에서 연구되었습니다. 다양한 연구 결과에 따르면 asiatic acid는 암세포에서 미토콘드리아 매개 세포자멸사를 유발합니다.
Andrographis paniculata 에서 분리된 Andrographolide 는 G0/G1 단계에서 세포 주기 정지를 유도하고 인간 백혈병 HL-60 세포에서 미토콘드리아 매개 세포 사멸을 유도하는 것으로 보고되었습니다[ 157 ].
Curcumin은 또한 B-전구체 급성 림프모구성 백혈병의 다른 세포주(RS4;11 및 SupB1)에서 연구되었습니다. 결과는 처리된 세포에서 Bax 발현을 증가시키고 Bcl-2 단백질을 감소시키는 데 커큐민이 관여함을 시사합니다. 결과적으로, 미토콘드리아 막 투과성을 방해하고 미토콘드리아 막 전위의 손실을 초래했습니다. 감소된 미토콘드리아 막 전위는 세포자살의 고유 경로를 유도합니다. 추가 조사에서 ROS의 용량 의존적 생성이 밝혀졌고 암세포에서 세포자멸사 유도에서 ROS 수준의 역할이 더욱 강조되었습니다[ 169 ].
아시아트산, 안드로그라폴라이드 및 커큐민도 ROS 수준을 상승시켰습니다.
그들은 폐암 세포(A549 및 H1299), 결장암 세포(T84 및 COLO 205) 및 B-전구체 급성 림프모구성 백혈병 세포(697, REH, RS4;11 및 SupB15)에서 각각 아폽토시스를 촉발했습니다.
이러한 관찰은 Bax/Bcl-2 비율뿐만 아니라 ROS의 엘리베이터로서의 역할을 제안할 수 있습니다.
표 3에 따라 암세포의 미토콘드리아를 표적으로 하는 것으로 보고된 대부분의 항암 허브 조추출물이 Bcl-2 계열 단백질의 영향 인자임을 검토하고 관찰했습니다.
다음 여덟 개 허브의 다양한 천연 추출물의 항암 효과, 여주, 동충하초의 militaris, 금땅 꽈리, Memecylon의 edule, Trametes robiniophila MURR, 학명은 Panax quinquefolius가, Cissus은 린은 quadrangularis , 생강 민들레 , 삼백초 , 그리고 센 텔라 아시아 티카,
이러한 연구는 이러한 모든 항암 허브의 조추출물이 공통적인 작용 메커니즘을 공유하고 있음을 시사했습니다.
이 모든 천연 추출물은 Bax 단백질의 발현을 유의하게 증가시켰고 개별 암세포에서 Bcl-2 단백질의 수준도 감소시켰습니다.
결과적으로 Bax/Bcl-2 비율이 증가하고 미토콘드리아 막의 투과성이 증가합니다 .
세포질에서 방출된 시토크롬 c는 내인성 경로에 의해 세포 사멸 신호를 추가로 유도합니다.
암 세포에서 예시된 메커니즘의 도식적 표현은 그림 4에 나와 있습니다.

그림 4. pro-apoptotic Bax의 수준을 증가시키고 anti-apoptotic Bcl-2/Bcl-XL의 수준을 감소시켜 apoptosis를 유도하는 천연 물질의 역할의 도식적 표현.
DNA 손상으로 인한 죽음의 자극은 Bax를 활성화시킵니다.
활성화된 Bax는 호모/헤테로올리고머를 형성하며, 그 기공과 같은 구조는 시토크롬 c의 방출을 채널화합니다.
미토콘드리아 막 투과성이 증가하여 시토크롬 c 방출이 증가합니다.
시토크롬 c, ATP, Apaf-1 및 카스파제-9는 카스파제-3을 추가로 활성화하고 세포자멸사를 유도하는 세포자살 복합체를 형성합니다.
가능한 천연 미토칸 플라보카와인 A, 베르베린은 Bcl-XL을 하향 조절하고 Bax를 상향 조절했습니다.
반면에 asiatic acid와 andrographolide는 Bcl-2의 발현을 감소시켰고 Bax의 발현과 ROS 수치를 증가시켰다.
조 추출물모모르디카 카란티아, 동충하초, 피살리스 페루비아나, 메메실론 edule, Trametes robiniophila murr, Panax quinquefolius, Cissus quadrangularis Linn, Zingiber officinale, Houttuynia cordata 및 Centella asiatica 는 BAX 단백질의 발현을 감소 시켰고 Baxcl -2의 발현을 감소시켰습니다.
.4. ROS 엘리베이터로서의 천연 에이전트
ROS는 OXPHOS의 부산물이며 높은 수준은 단백질, 지질, 탄수화물 및 DNA와 같은 다양한 생체 분자에도 산화 손상을 일으킬 수 있습니다.
ROS는 주로 미토콘드리아에서 생성되며 더 높은 농도에서는 가장 가까운 곳에 존재하는 생체 분자에 직접적인 영향을 미칠 수 있습니다.
상승된 수준의 ROS는 결국 미토콘드리아 막과 mtDNA를 손상시키는 것으로 알려져 있습니다.
더 높은 농도의 ROS는 세포에 손상 효과를 나타내는 것으로 알려져 있습니다.
그러나 더 낮은 농도에서 ROS는 잠재적인 유사분열원으로 작용하고, 세포 분열을 촉진하고, 세포 생존력을 개선하고, MAPK, PI3-AKT, NF-카파 B 및 Nrf-2와 같은 다양한 세포 신호 전달 경로를 통해 세포 분화를 돕 것으로 알려져 있습니다.
암세포의 산화 환원 환경은 정상 세포와 다릅니다.
통제할 수 없는 증식 속도와 더 높은 에너지 요구량을 따라잡기 위해 암세포는 대사율을 높입니다.
결과적으로, 호흡 기능 장애 및 ETC의 손상된 결합 효율로 이어질 수 있으며, 이는 전자 누출을 증가시켜 더 높은 ROS 수준을 유발할 수 있습니다.
증가된 ROS 수치는 암세포를 산화 스트레스를 더욱 증가시킬 수 있는 약제에 더 취약하게 만듭니다.
산화 스트레스로 인한 손상은 단백질 아미노산 잔기와 ROS 간의 반응을 통해 단백질의 변형에 기여합니다.
예를 들어, 단백질의 시스테인 잔기(일반적으로 티올레이트 형태로 존재)는 ROS 산화 변형을 겪습니다.
더 높은 수준의 ROS에서 산화된 티올레이트 음이온은 이황화 형성(SS-), S-글루타티오닐화(단백질-SSG), S-니트로실화(-SNO), 설펜산 형성(-SOH)을 포함하는 다양한 시스테인 산화 생성물을 형성합니다. ),199 ].
이러한 산화 생성물은 표적 단백질을 영구적으로 손상시킬 수 있는 추가 산화로부터 표적 단백질을 보호할 수 있습니다.
따라서, 이러한 산화적 변형은 단백질 기능을 향상시키고 암세포에서 세포 생존 및 증식에 대한 신호를 향상시킬 수 있습니다.
따라서 상승된 ROS 수준은 산화 변형을 촉진하고 생존과 암세포의 활발한 증식을 촉진할 수 있습니다.
그러나 암의 경우 ROS 수준이 상대적으로 훨씬 높지만 추가 증가는 이러한 세포에 대한 산화적 손상을 유발할 수 있습니다[ 200 ].
ROS 수준을 증가시키는 그러한 화합물은 "산화촉진제"로 알려져 있습니다[ 201].
따라서 ROS의 수준을 더욱 높이는 것은 암 치료제의 중요한 측면으로 사용될 수 있습니다.
Scutellaria barbata 에서 추출한 천연 제제 베자이유(bezeille) 는 ROS 수준을 높여 암세포의 미토콘드리아를 표적으로 삼을 가능성이 있는 것으로 관찰되었으며 , 이는 차례로 해당 작용인 OXPHOS를 억제할 수 있습니다.
이러한 과정의 억제는 세포를 더 낮은 에너지 상태로 만들고 더 나아가 세포 사멸 단계로 이어질 수 있습니다.
실험적 증거는 bezeille(ROS 엘리베이터)가 세 가지 다른 방식으로 유방암 세포(MDAMB231)의 세포자멸사를 유발할 수 있음을 시사합니다[ 167].
첫째, 높은 수준의 ROS는 산화 스트레스로 인한 DNA 손상을 유발할 수 있습니다. 그 후 DNA 손상에 대한 반응으로 DNA 손상 복구 효소인 폴리(ADP-리보스) 중합효소(PARP)가 활성화됩니다. NAD + 는 PARP에 대한 알려진 기질이므로 PARP가 과도하게 활성화 되면 MDAMB231 세포에서 NAD + 수준이 감소하는 것으로 관찰되었습니다.
그 후 과도한 DNA 손상에 대한 반응으로 DNA 손상 복구 효소인 폴리(ADP-리보스) 중합효소(PARP)가 대량으로 활성화됩니다. 활성화된 PARP는 MDAMB231 세포에서 NAD + (PARP가 NAD +를 소비함에 따라 ) 및 ATP 모두의 낮은 수준과 잘 상관관계가 있는 것으로 관찰되었습니다 .
PARP가 과도하게 활성화되면 기질인 NAD + 가 소진되면 미토콘드리아에서 전자전달(ETC)과 해당과정이 모두 일어나지 않아 ATP 수준이 낮아질 수 있다.
둘째, 더 높은 ROS 수준으로 인한 산화 손상은 GSSG를 GSH로 산화시키는 데 필요한 NADPH를 고갈시킬 수 있으며 따라서 세포의 산화환원 환경을 유지하는 데 중요한 GSH/GSSG 비율을 감소시킬 수 있습니다.
따라서 NADPH와 GSH의 고갈은 세포의 산화환원 균형을 무너뜨릴 수 있습니다.
셋째, 상승된 ROS 수준은 OXPHOS에서 전자 전달을 방해할 수도 있습니다.
OXPHOS의 간섭으로 인해 ETC에서 전자가 누출됩니다.
그것은 미토콘드리아 막 투과성을 증가시켜 시토크롬 c를 세포질로 방출하고 세포자멸사를 통해 프로그램된 세포 사멸을 유발할 수 있습니다.
전체적으로 Chen et al.에 의해 관찰된 이 세 가지 메커니즘. bezielle은 ROS 수준을 높이고 암세포 환경에서 산화 환원 불균형을 유도한다고 제안합니다 [ 167 ].
Withania somnifera 잎 의 조 추출물 과 그 생리 활성 화합물 withanone은 유방암 세포(MCF-7)와 결장암 세포(HCT116)에서도 연구되었습니다. 그 결과, withanone과 Withania somnifera 의 메탄올성 잎 추출물은 모두 ROS 생성제로 작용하는 것으로 관찰되었다.
베자이유, 비타논, 위타니아 솜니페라 조추출물에 근거암 세포에서 미토콘드리아 매개 세포 사멸을 유도하는 중요한 요인인 세포 산화 환원의 평형에 영향을 미치는 산화 스트레스 수준을 높이는 것으로 설명되는 미토칸 클래스 3에 분포할 수 있습니다( 그림 5 ).

그림 5. 암세포의 ROS 수준에 영향을 미치는 일부 선택된 천연 제제 또는 추출물의 항암 효과에 대한 도식적 표현.
Bezielle은 암세포에서 ROS의 수준을 높이고 산화 환원 불균형을 유발할 뿐만 아니라 해당 작용과 OXPHOS를 억제합니다.
유사하게, Withania somnifera 의 메탄올 추출물 과 withanone의 생리 활성 화합물은 암세포의 ROS 수준을 증가시켜 세포 성장 정지와 미토콘드리아 손상을 유발했습니다.
산화환원 불균형의 결과로, 에너지 생성 경로(해당 분해 및 OXPHOS) 및 미토콘드리아 손상의 억제는 에너지 붕괴 및 세포자멸사를 유발할 수 있습니다.
5. 미토콘드리아 막 잠재력을 감소시키는 천연 물질
미토콘드리아는 미토콘드리아 안팎으로 이동할 수 있는 특정 화합물의 투과성에 대해 선택적인 이중막 소기관입니다.
미토콘드리아의 외막은 세포 생존 및 사멸과 관련된 조절 신호에 중요한 다양한 수용체 효소를 유의하게 조절합니다.
산화 스트레스와 pro-apoptotic protein이 활성화되면 미토콘드리아 막의 다공성이 증가하여 사이토크롬 c가 세포질로 과도하게 빠져나가 세포를 사멸시킵니다.
반면에 미토콘드리아 내부 막은 OXPHOS를 위한 장소입니다.
ETC를 통한 호기성 호흡 과정은 호흡 사슬의 효소 복합체 I, II, III 및 IV를 통한 전자의 순차적 전달을 보여줍니다[ 202].
이 4개의 복합체를 통한 전자의 이동은 에너지를 생성하며, 이는 미토콘드리아 기질에서 막간 공간으로 양성자를 펌핑하는 데 사용됩니다.
그러나 미토콘드리아 막이 이온의 통과를 허용하지 않기 때문에 막 사이 영역에서 펌핑된 양성자는 이동할 수 없습니다.
결과적으로 막간 공간이 더 높은 농도의 H + 이온을 보유하고 매트릭스가 더 낮은 농도의 H + 이온을 포함 하는 전기화학적 구배를 생성합니다 .
이 전기화학적 구배는 미토콘드리아 막 전위를 유발합니다.
이것은 ADP와 인산염(Pi)으로부터 ATP를 합성하는 효소 ATP 합성효소를 통해 막간 공간에서 기질 로 H + 이온의 역류를 유도합니다 [ 203].
전체적으로 세포는 내부 미토콘드리아 막을 가로질러 과분극된 전압을 유지해야 합니다.
이 과분극이 소멸되면 전압에 민감한 PTP는 세포자살 촉진제(예: 시토크롬 c)를 열어 세포질로 방출하여 세포자살을 유도합니다[ 30 ].
암세포는 정상 세포에 비해 대사율이 높습니다.
암세포의 더 높은 에너지 요구량은 ETC의 활발한 활동으로 이어지며, 이는 차례로 H + 의 펌핑을 증가시킵니다.
이온이 막간 공간으로 유입되어 전기화학적 기울기가 증가합니다.
이러한 전기화학적 구배의 증가는 비악성 세포보다 과분극된 미토콘드리아 막 전위로 이어집니다.
미토콘드리아 막 전위의 과분극은 정상 세포보다 암세포에서 >50% 더 클 수 있습니다.
따라서 암세포를 선택적으로 표적화할 수 있는 암세포의 특징으로 작용한다.
클래스 6의 미토칸은 미토콘드리아의 내막을 상당히 표적으로 하는 친유성 양이온입니다.
그러나 가능한 허브 미토칸에 대한 우리의 검토는 Garcinia mangostana 의 생리 활성 화합물인 크산톤이 인간 결장직장암 세포(HCT 116) 및 인간 백혈병 세포(HL60)의 미토콘드리아 막 잠재력의 손실을 초래 한다는 것을 관찰했습니다.175 , 176 ].
마찬가지로, 다른 원유 추출물도 있습니다 항암 약초 센 텔라 아시아 티카 , 어성초의 thunb, 계피, 및 Gracilaria의 tenuistipitata 인간 자궁 경부암, 간암 세포 (H22) 구강 편평 세포암(Ca9-22), 인간 결장 선암 세포(HT-29) 및 유방암 세포(MCF-7) 의 미토콘드리아 막 전위 손실,
이러한 미토콘드리아 막 전위의 손실은 사이토크롬 c와 같은 다양한 세포자멸 인자의 방출을 투과화하여 추가로 암세포의 세포자멸사를 유도합니다.
그러나 관찰된 미토콘드리아 막 전위의 손실이 미토콘드리아의 내막 또는 외막에 대한 것인지의 메커니즘에 대해서는 아직 명확하지 않습니다.
'대사' 카테고리의 다른 글
| ?대사를 표적으로 한 암 치료 (0) | 2021.08.30 |
|---|---|
| 암 치료를 위한 미토콘드리아 대사 억제제 (0) | 2021.08.18 |
| 대사 요법이 암을 치료하지 못하는 이유는 무엇입니까? (0) | 2021.08.18 |
| 암 대사의 Emerging Hallmarks (0) | 2021.08.18 |
| 암 대사 표적화 - Revisiting the Warburg Effects (0) | 2021.08.18 |