New insights into molecules and pathways of cancer metabolism and therapeutic implications
https://onlinelibrary.wiley.com/doi/full/10.1002/cac2.12112
New insights into molecules and pathways of cancer metabolism and therapeutic implications
Cancer cells are abnormal cells that can reproduce and regenerate rapidly. They are characterized by unlimited proliferation, transformation and migration, and can destroy normal cells. To meet the n...
onlinelibrary.wiley.com
Warburg 효과(호기성 해당작용)는 종양 세포가 생존 요구를 충족시키기 위해 고활성 해당작용을 선호함을 나타냅니다[ 1 ].
획기적인 발견에 따르면 주요 대사 효소인 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 4(PFKFB4)가 해당과정 스테로이드 수용체 coactivator-3(SRC-3) 전사 활성을 활성화하고 기능적으로 5탄당 인산 경로(PPP)를 향하여 포도당 흐름을 유도합니다
이는 종양이 활성 미토콘드리아 대사 활성을 나타내지 않는 이유를 설명합니다.
높은 종양 관련 포도당 소비는 종종 분자 및 세포 수준 모두에서 변화를 수반하며,
이는 고형 종양의 악성 특징을 유발합니다. 따라서 이러한 대사 경로는 유망한 임상 표적을 제공합니다.
암세포는 여러 주요 대사 신호 전달 경로를 갖고 있으며, 때때로 포도당 플럭스 소비를 다른 대사 경로로 재지정하여 종양의 호기성 미세 환경을 유지하는 데 기여합니다.
예를 들어, 세포 호흡을 호기성 해당과정으로 전환하는 증식하는 백혈병 세포 집단과 달리
백혈병 줄기 세포(LSC)의 산화적 인산화 및 증식 경로는 아미노산 대사에 크게 의존합니다[ 3].
우리는 이전에 암세포에서 대사 네트워크의 조절 변경이 Warburg 효과와 개별 대사 플럭스를 넘어 확장된다고 보고했습니다.
따라서 임상 개입과 관련된 특성을 설명하기 위해 종양의 대사체를 조사하는 것이 필수적입니다.
이 리뷰에서는 다양한 신호 축을 통해 발생하는 종양 세포의 고유한 대사 변화를 요약합니다.
이러한 대사 변화를 기반으로 암 진단 및 임상 치료에 사용할 수 있는 다양한 양상을 제시하고 항종양 치료제 개발을 위한 제안을 제공합니다.
2 포도당 대사
2.1 인산화
인산화는 암 대사와 암 관련 대사 산물의 생합성을 조정하는 데 중요합니다.
Ma et al . [ 4 ]는 polo-like kinase 1(Plk1)과 인산화된 포도당-6-인산 탈수소효소(G6PD)의 활성 이합체가 PPP의 지속적인 활성화를 유발하고 HeLa 세포(경부암 세포에서 배양된 자궁경부암 세포)에서 거대분자의 생합성을 증가시키는 것으로 나타났습니다 시험관내) (표 1).
또한, 대사 효소 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3(PFKFB3)는 인산화에 의해 고도로 조절됩니다.
유방암 세포에서 유사분열 정지의 연장은 PFKFB3의 AMP 활성화 단백질 키나제(AMPK) 의존적 인산화를 유발하여 유사분열 관련 번역을 유도하는 것으로 보고되었습니다.
그 결과 유방암에서 산화적 호흡을 대체하는 해당과정이 증가합니다(표 1 )[ 5 ].
인산화는 종종 암 침습과 전이를 가속화합니다. Wang et al . [ 6 ]
전이성 폐암에서 표피 성장 인자 수용체(EGFR)의 활성화가 티로신 473에서 UDP-글루코스 6-탈수소효소(UGDH)의 인산화를 유도하고 SNAI1 mRNA의 발현을 자극한다는 것을 발견했습니다.
활성화된 EGFR은 또한 상피-중간엽 전이(EMT)를 촉진했습니다(표 1 ).
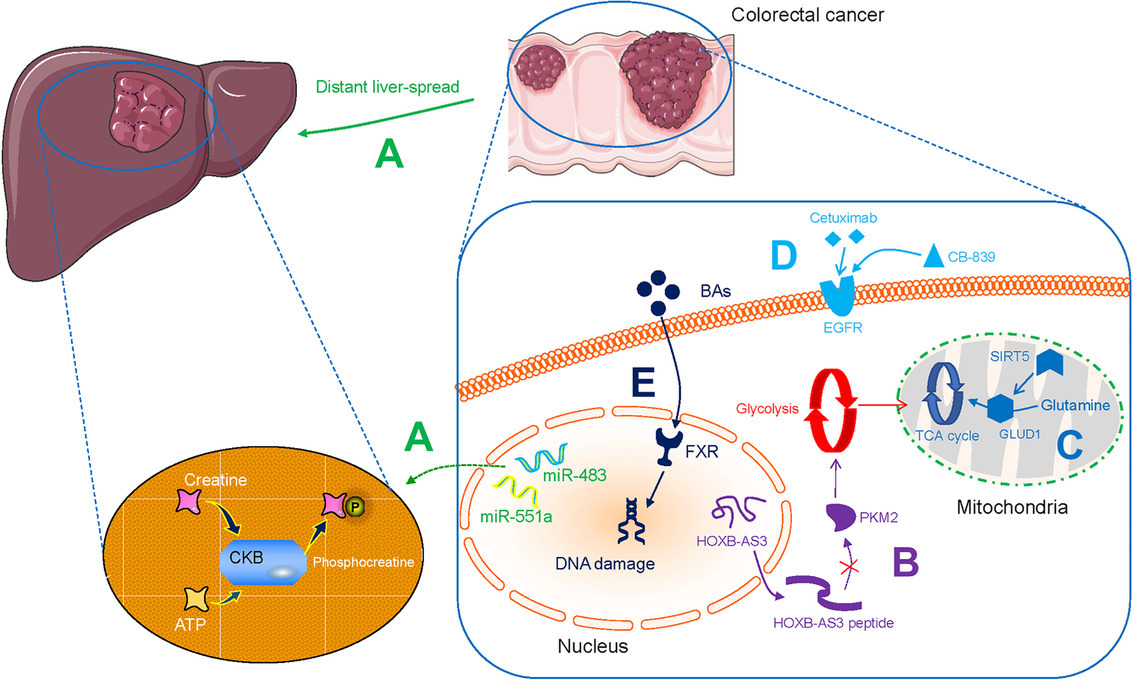
결장직장암의 대사 변화.
A. miR-551a 및 miR-483은 CKB 유도 크레아틴 인산화 및 ATP 지속 간 집락화를 유도합니다.
B. LncRNA HOXB-AS3로 인코딩된 펩타이드는 PKM2의 형성을 완화하고 해당 과정을 하향 조절합니다.
C. SIRT5는 GLUD1을 활성화하고 Gln이 TCA 주기에 통합되도록 합니다.
D. CB-839와 조합된 EGFR 표적 세툭시맙은 치료 효능을 향상시킬 수 있습니다.
E. BA는 장내 FXR을 손상시키고 후속 DNA 손상을 유도합니다.
약어: CKB, 크레아틴 키나제 뇌형; LncRNA, 긴 비코딩 RNA; PKM2, 피루베이트 키나제 M2; SIRT5, 시르투인5; GLUD1, 글루타메이트 탈수소효소 1; Gln, 글루타민; TCA, 트리카르복실산; EGFR, 표피 성장 인자 수용체; BA, 담즙산; FXR, 파르네소이드 X 수용체;
인산화는 또한 생리학적 신호 인자를 암 촉진 인자로 전환시키는 것과 관련이 있습니다.
인산화 의존성 네트워크는 대사 이상을 유발하고 악성 종양을 유발하므로 잠재적인 치료 표적을 식별하기 위해 탐색할 수 있습니다.

간암의 대사 변화.
A. WTp53은 PUMA 비활성화 MPC를 유발하여 피루브산 유도 산화 인산화를 하향 조절합니다.
B. CUEDC2는 GR-GLUT3 펩티드 축과 14-3-3ζ-LDHA 경로를 유발하여 젖산을 생성합니다.
C. Lin28A 및 Lin28B는 비정상적으로 발현되는 반면 let-7은 PDK1을 TCA 주기로 활성화하는 데 기여합니다.
D. CD147은 PI3K/Akt/mTOR 축을 통해 Warburg 효과를 유지합니다.
E. TKT는 R5P 및 후속 뉴클레오티드 생성을 활성화합니다.
F. mTORC2-AKT 축은 OXCT1을 트리거하여 케톤분해를 TCA 주기로 유도하고 AMPK를 비활성화합니다.
G. SNS는 간 염증과 분비 IL-6 및 TGF-β 생산을 조절하여 간암 발생을 유발합니다.
약어: WTp53, 야생형 p53; PUMA, p53 세포자멸사의 상향조절 조절제; MPC, 미토콘드리아 피루베이트 운반체; CUEDC2, CUE 도메인 함유 단백질 2; GR, 글루코코르티코이드 수용체; GLUT3, 포도당 수송체 3; LDHA, 젖산 탈수소효소 A; PDK1, 피루베이트 탈수소효소 키나제 1; TCA, 트리카르복실산; TKT, 트랜스케톨라제; R5P, 리보스 5-포스페이트; PPP, 오탄당 인산 경로; mTORC2, mTOR 복합체 2; OXCT1, 3-옥소산 CoA-트랜스퍼라제 1; AMPK, AMP 활성화 단백질 키나제; SNS, 교감신경계; IL-6, 인터루킨-6; TGF-β, 변형 성장 인자-베타
2.2 아세틸화
다양한 표적의 아세틸화는 암 발병을 촉진하고 포도당 소비에 대한 반응으로 발생하는 것으로 생각됩니다.
Li et al . [ 11 ] 시스플라틴이 세포질에 축적된 PFKFB3의 아세틸화를 유발하여 해당 HeLa 세포에서 DNA 분해 방지에 기여함을 입증했습니다(표 1 ).
Li et al . [ 12]은 라이신 254에서의 아세틸화가 글리세르알데히드-3-포스페이트 탈수소효소(GAPDH) 활성을 증가시키고 폐암에서 세포내 포도당 소비에 반응한다고 제안했습니다(표 1 ).
따라서 아세틸화는 암세포 증식과 공격적인 침입을 크게 지원합니다.
2.3 효소 촉매
종양 조직에서 해당과정 관련 효소의 비정상적인 과발현은 일반적이며 바르부르크 효과와 관련이 있습니다.
인간 다형성 교모세포종(GBM)에서 헥소키나제 2(HK2)는 화학요법 내성 GBM 세포의 중추 신경계로의 이동을 촉진하며, 이 효과는 단백질 키나제 B(PKB) 자극 해당 작용 및 미토콘드리아 전위와 관련이 있습니다(표 1 ) [ 13 ].
난소암에서 피루베이트 키나제 M2(PKM2)는 해당 속도를 조절하는 것으로 나타났습니다(표 1 )[ 14 ].
백혈병에서 골수의 피루브산 탈수소효소 키나제 동종효소 2(PDK2)는 해당 과정을 조절하고 백혈병 개시 세포(LICs)를 모집하여 대칭적인 세포 분열을 유발합니다(표 1 ).15 ].
여러 해당 효소가 함께 Warburg 효과를 조정합니다.
예를 들어, Zhong et al . [ 16 ]은 CUE 도메인 함유 단백질 2(CUEDC2)가 글루코코르티코이드 수용체(GR)-글루코스 수송체 3(GLUT3) 펩타이드 축과 14-3-3ζ-락테이트 탈수소효소 A(LDHA) 경로에 의해 조절된다고 제안했습니다. ,
그리고 HCC에서 젖산으로 전환되는 피루베이트의 전환을 촉진합니다(표 1 , 도 2B 및 도 3 ).
또한, 종양 미세 환경(TME)의 산소 농도는 해당 효소에 간접적으로 영향을 미칩니다.
저산소 상태에서 전립선암 세포에서 해당 유전자 활성을 상향 조절하기 위해 저산소증 유도 인자-1 알파(HIF-1α)를 조절한다는 것을 발견했습니다(표 1 ).
또한 Ma et al . [ 18 ]은 Lin28A와 Lin28B를 비정상적으로 발현하고 let-7을 감소시키면 HIF-1 독립 경로에서 PDK1(피루브산 탈수소효소 키나제 1)을 상향 조절하고 HCC의 호기성 종양 환경에서 트리카르복실산(TCA) 주기를 조절한다고 보고했습니다(표 1및 그림 2C ).
증식하는 종양은 해당 작용 관련 유전자 및 효소를 통해 주변 산소 수준과 혐기성 TME 모두에서 Warburg 효과를 가능하게 합니다. 이전에는 이 부분에 대한 관심이 거의 없었습니다.

종양 세포에서 포도당 대사와 아미노산 대사 사이의 상관관계.
호기성 해당작용은 세린 대사에 기여하고 글루타민 대사와 바르부르크 효과는 전구체를 TCA 회로로 전달합니다.
아르기닌은 분해되어 요소와 오르니틴을 생성합니다.
오르니틴은 미토콘드리아에서 시트룰린 생합성을 지원하고 이후에 아르기닌 재생을 지원하며 이러한 일련의 반응을 요소 회로라고 합니다.
그리고 요소 회로 장애와 오탄당 인산 경로는 핵산 수준을 변경합니다.
약어: G6PD, 글루코스-6-포스페이트 탈수소효소; PHGDH, 포스포글리세르산 탈수소효소; SDH, 세린 탈수효소; LDHA, 젖산 탈수소효소 A; IDO, 인돌아민 2,3-디옥시게나제; IDH1, 이소시트레이트 탈수소효소 1; GLUD1, 글루타메이트 탈수소효소 1; GPT2, 글루탐산 피루베이트 트랜스아미나제 2; ASNase1, 아스파라기나아제 1; ASS1,
2.4 해당과정과 긴 비암호화 RNA(lncRNA): Glycolysis and long non-coding RNAs (lncRNAs)
lncRNA는 단백질로 번역되지 않는 RNA 분자입니다.
그러나 CRC와 같은 암의 대사 특성을 조절합니다.
유방암 항에스트로겐 저항성 4(BCAR4)를 상향 조절하고 Hedgehog 신호 전달을 조정하고 HK2 및 PFKFB3의 전사를 향상시켜 분비성 젖산을 생성한다는 것을 발견했습니다(그림 4A ).
이러한 관찰은 lncRNA가 잠재적인 임상적 가치가 있는 종양의 조절자임을 입증할 뿐만 아니라 종양 증식 및 에너지 대사를 제어하기 위한 조절 메커니즘을 보여줍니다.

유방암의 대사 변화.
A. YAP로 상향 조절된 lncRNA BCAR4는 HK2와 PFKFB3의 전사를 향상시켜 젖산을 생성합니다.
B. TAM에서 파생된 EV는 PHD2와 HIF-1α의 결합을 길항하는 HISLA를 전달합니다.
C. 이소시트레이트/시트레이트는 CTP를 통해 미토콘드리아에 들어가고 ROS 스트레스 하향조절을 가능하게 합니다.
D. PHGDH는 세린 수치를 개선하고 퓨린 및 뉴클레오티드 생합성을 유지합니다.
E. ADI-PEG20은 ASS1 결핍을 유도하고 미토콘드리아 손상으로 아르기닌 합성을 약화시킵니다.
F. UC 장애는 CAD를 활성화하고 후속 핵산 합성에 기여합니다.
G. SNS는 LDHA를 유발하고 Myc를 안정화시키기 위해 에피네프린을 방출하고, 이어서 SLUG를 유발하고 E-cadherin을 비활성화합니다.
약어: YAP, 예 관련 단백질; LncRNA, 긴 비코딩 RNA; BCAR4, 유방암 항에스트로겐 저항성 4; HK2, 헥소키나제 2; PFKFB3, 6-포스포프룩토-2-키나제/프룩토스-2,6-비포스파타제 3; TAM, 종양 관련 대식세포; EV, 세포외 소포; HISLA, HIF-1알파 안정화 lncRNA; PHD2, 프롤릴 하이드록실라제 2; HIF-1α, 저산소증 유발 인자-1 알파; CTP, 시트레이트 수송체 단백질; ROS, 활성산소종; IDH2, 이소시트레이트 탈수소효소 2; PHGDH, 포스포글리세르산 탈수소효소; ADI-PEG20, 페길화된 아르기닌 데이미나제; ASS1, 아르기니노숙시네이트 합성효소 1; UC, 요소 순환; CAD, 카르바모일-포스페이트 합성효소 2, 아스파르테이트 트랜스카르바밀라제 및 디히드로오라타제; SNS, 교감신경계; LDHA, 젖산 탈수소효소 A 활성산소종; IDH2, 이소시트레이트 탈수소효소 2; PHGDH, 포스포글리세르산 탈수소효소; ADI-PEG20, 페길화된 아르기닌 데이미나제; ASS1, 아르기니노숙시네이트 합성효소 1; UC, 요소 순환; CAD, 카르바모일-포스페이트 합성효소 2, 아스파르테이트 트랜스카르바밀라제 및 디히드로오라타제; SNS, 교감신경계; LDHA, 젖산 탈수소효소 A 활성산소종; IDH2, 이소시트레이트 탈수소효소 2; PHGDH, 포스포글리세르산 탈수소효소; ADI-PEG20, 페길화된 아르기닌 데이미나제; ASS1, 아르기니노숙시네이트 합성효소 1; UC, 요소 순환; CAD, 카르바모일-포스페이트 합성효소 2, 아스파르테이트 트랜스카르바밀라제 및 디히드로오라타제; SNS, 교감신경계; LDHA, 젖산 탈수소효소 A
2.5 해당과정과 미토콘드리아
암세포의 독특한 대사 프로파일은 억제된 미토콘드리아 포도당 산화를 특징으로 합니다.
감소된 미토콘드리아 포스포에놀피루베이트 카르복시키나아제 2(PCK2)가 옥살로아세트산(OOA)-말레이트-피루베이트 및 아세틸-CoA-지방산 축을 통한 포도당 탄소 흐름을 유도하고 흑색종에서 산화적 인산화를 억제한다는 것을 입증했습니다(표 1 ).
디클로로아세테이트는 미토콘드리아 산화를 자극하고 바르부르크 효과를 감소시켜 결과적으로 종양 세포의 대사를 방해할 수 있음을 발견했습니다(표 2).
미토콘드리아 산화 억제를 역전시키는 것은 대사 종양학에서 약속을 유지합니다.
표 2. 암 대사를 표적화하는 항종양 효과기
항종양 효과기분자 메커니즘참조
| 디클로로아세테이트 | 바르부르크 효과를 줄입니다. | Shen et al ., 2020 [23] |
| 2DG | 2DG와 라파마이신을 결합하면 해당 작용이 억제됩니다. | Zhao et al ., 2016 [ 37 ] |
| 클로미펜 | 돌연변이 효소 하향 조절을 유도하고 돌연변이의 알로스테릭 부위를 차지합니다. | Zheng et al ., 2017 [ 47 ] |
| 에나시데닙 | 급성 골수성 백혈병에서 분자 완화를 강화하고 조혈 분화 손상을 완화합니다. | Stein et al ., 2019 [ 48 ] |
| AGI-5198 | 연골육종에서 D2HG를 감소시키고, 전이를 억제하고, 세포 순환을 손상시키고, 세포자멸사를 활성화합니다. | Li et al ., 2015 [ 49 ] |
| 폴리다틴 | 포도당-6-인산 탈수소효소 억제로 작용하고 오탄당 인산 경로를 차단합니다. | 멜레 외 , 2018 [ 54 ] |
| EDP | 혈관 신생뿐만 아니라 내피 세포 전달 및 혈관 내피 성장 인자 수용체 2 유도 프로테아제 생성을 차단합니다. | Zhang et al ., 2013 [ 68 ] |
| Hakai | E-cadherin 유비퀴틴화 억제 및 EMT 억제 | Martinez-Iglesias et al ., 2020 [ 78 ] |
| CB-839 | 세툭시맙 내성 결장직장암에서 치료 효능을 향상시킵니다. | Cohen et al ., 2020 [ 86 ] |
| 삼산화비소 또는 호모해링턴닌을 CB-839와 결합하면 글루타티온 합성을 감소시키고 미토콘드리아 활성 산소 종을 상향 조절합니다 | 그레고리 외 , 2019 [ 87 ] | |
| 1-MT | 암 치료에서 독소루비신의 치료 효능을 향상시킵니다. | Lan et al ., 2020 [ 102 ] |
| ADI-PEG20 | argininosuccinate synthetase 결핍을 유도합니다. | Huang et al ., 2013 [ 104 ] |
| 완화된 아르기니노숙시네이트 합성효소로 전립선암 세포에 민감하고 조기 보호 자가포식을 억제합니다. | Kim et al ., 2009 [ 105 ] | |
| argininosuccinate synthetase 1의 손실로 유방암 세포의 autophagy 의존적 사멸을 유도합니다. | Qiu et al ., 2014 [ 106 ] | |
| 비타민 D/25-하이드록시비타민 D | 대장암의 위험을 줄이고 면역 반응을 유도합니다. | 송 등 , 2016 [ 110 , 111 ] |
| 유방암에서 T 세포 기능을 촉진하고 종양 미세 환경의 염증을 감소시킵니다. | Karkeni et al ., 2019 [ 112 ] | |
| 프로프라놀롤 | 암 면역치료제에서 항암백신과 시너지 효과 | Daher et al ., 2019 [ 123 ] |
- 약어: 2DG, 2-데옥시글루코스; EDP, 에폭시도코사펜타엔산; EMT, 상피-중간엽 전이.
2.6 해당과정과 T세포
호기성 해당작용은 T 세포 매개 종양 제거 효과기 기능을 제한하는 것으로 알려져 있습니다. Li et al . [ 24 ]
CD147은 T 세포 면역억제와 상관관계가 있는 포스포이노시티드 3-키나제(PI3K)/Akt/라파마이신(mTOR) 축의 포유동물 표적을 통해 HCC에서 바르부르크 효과를 지속한다고 보고했습니다(그림 2D ).
프로그램된 사멸 리간드 1(PD-L1)이 HK2를 유발하여 비소세포폐암(NSCLC)에서 와버그 효과를 촉진한다는 것을 발견했으며, CD8 + T 세포 기능 관련 유전자 의 낮은 발현 이 관찰되었습니다(그림 5A 및 표 1).
그러나, 호기성 해당작용은 TME에 의해 유발된 면역병리학적 손상으로부터 이펙터 T 세포를 촉진합니다.
T 세포에 대한 대사 체크포인트에 대한 추가 탐구는 새로운 형태의 종양 면역을 설명하는 데 기여할 수 있습니다.

비소세포폐암 진행 및 전이의 대사 변화.
A. PD-L1은 HK2를 유발하여 면역억제와 함께 Warburg 효과를 촉진합니다.
B. 젖산은 MCT1을 통해 TCA 주기로 유도됩니다.
C. PP1은 AXIN을 탈인산화하고 Wnt/β-카테닌 축을 자극합니다.
D. Nrf2는 HMOX1을 통한 Bach1의 heme 유도 및 Fbxo22 유도 분해를 억제합니다.
약어: PD-L1, 프로그램된 사멸 리간드 1; HK2, 헥소키나제 2; TCA, 트리카르복실산; MCT1, 모노카르복실레이트 수송체-1; PP1, RIF1은 단백질 포스파타제 1을 유발합니다. AXIN, 축 억제 단백질; HMOX1, 헴 옥시게나제 1
2.7 해당과정과 대식세포
TME는 종양 관련 대식세포(TAM)를 포함하여 풍부한 침투성 면역 세포를 포함합니다[ 27 ]. Chen et al . [ 28 ]
유방암에서 바르부르크 효과를 유지하기 위해 세포외 소포(EV)가 HIF-1α를 안정화시키기 위해 프롤릴 하이드록실라제 2(PHD2)와 HIF-1α의 결합을 길항하는 HIF-1알파 안정화 lncRNA(HISLA)를 전달한다고 보고했습니다. (그림 4B ).
이것은 결과적으로 TAM이 호기성 해당 작용을 유지하고 항-세포자멸사 능력을 나타내도록 한 반면, 분비성 젖산염은 TAM에서 HISLA를 현저하게 상향 조절했습니다.
또한 전이성 폐 선암종 유래 젖산은 mTORC1/전사 인자 EB(TFEB)/ATP6V0d2/HIF-2α를 자극하고 혈관 내피 성장 인자(VEGF)의 발현을 촉진합니다.29 ].
TME 내에서 변경된 TAM은 호기성 해당작용과 관련될 수 있는 침습적 특성을 획득합니다.
2.8 해당과정과 암줄기세포(CSC)
CSC는 자가 재생 특성과 다양한 종양 세포 하위 집단으로 분화할 수 있는 능력을 가지고 있습니다[ 30 ].
Warburg 효과로 인해 TME에서 높은 수준의 포도당 고갈이 관찰됩니다.
종양 세포는 미세 환경 변화에 적응하기 위해 줄기 세포 표현형을 증가시키는 경향이 있습니다[ 31 ].
중요하게도, Warburg 효과는 CSC의 침습적 활동과 관련이 있습니다.
Luo et al . [ 32 ]은 유방 CSC의 중요한 역할을 확인했으며, 이들 세포에서 해당 작용은 휴면 상태에서 활성인 반면 항산화 반응은 증식 상태에서 나타남을 보여주었습니다.
이러한 관찰은 CSC의 대사 취약성이 암세포를 표적으로 하는 새로운 방법을 제공할 수 있음을 시사합니다.
2.9 해당과정과 젖산 대사
최근에는 Warburg 효과를 목표로 하는 많은 접근이 시도되었지만 유효한 치료 결과는 얻지 못했습니다.
Flores et al . [ 33 ]은 젖산 탈수소효소(LDH) 활성이 결핍된 편평 세포 암종(SCC) 세포가 감소된 포도당 흡수 및 해당 대사 산물 생성을 보였다고 보고하였다(표 1 ).
종양 형성이 활성 호기성 해당 작용을 필요로 하지 않을 가능성이 있으며, 이는 종양이 대사적으로 높은 포도당에 의존해야 한다는 교리를 무시합니다.
Faubert et al . [ 34 ] 포도당과 비교할 때 젖산염이 NSCLC에서 TCA 회로의 주요 탄소원이며 모노카르복실레이트 수송체-1(MCT1; 그림 5B ).
Hensley et al . [ 35 ] 관류가 잘되는 종양 영역에서 사용 가능한 비포도당 탄소원으로서 젖산염의 값을 관찰하고 추가로 확인했습니다.
이러한 연구는 종양이 생체 내 연료 로 젖산염을 사용할 수 있으며 호기성 해당 작용에만 의존하지 않을 수 있음을 강력하게 나타냅니다 .
2.10 포도당 대사-해당 분해 억제의 약속
호기성 해당작용을 표적으로 하는 것은 임상에서 유망한 화학요법 전략이 되었습니다.
해당과정 억제제 2-deoxyglucose(2DG)는 강력한 항암제이며 화학요법에서 보조제로 기능할 수 있습니다.
Zhao et al . [ 37 ]은 라파마이신이 LDHA 하향 조절로 mTORC1을 억제하고, 라파마이신과 2DG의 조합이 악성 종양에서 해당 작용에 강력한 영향을 미친다고 보고했습니다(표 2 ). 그럼에도 불구하고, 2DG를 포함한 해당과정 억제제는 종양 조직으로의 비특이적 분포 및 낮은 생체이용률로 인해 임상 응용에서 사용되지 않았습니다.
나노 규모의 기능성 물질을 사용하여 해당과정 억제제를 전달하는 것은 악성 종양의 정확한 치료에서 중요한 단계를 나타냅니다.
2.11 돌연변이 이소시트레이트 탈수소효소 (IDH) 의존성 경로
이전에는 이소시트레이트 탈수소효소 1( IDH1 ) 돌연변이 하위 집합이 전립선암에서 보고되었습니다.
IDH1이돌연변이는 피루브산 탈수소효소(PDH) 인산화를 억제하고, 교모세포종 세포에서 HIF-1 및 피루브산 탈수소효소 키나제-3을 상향 조절하고, 글루타메이트 생성을 돕기 위해 피루브산 대사를 재프로그래밍했습니다(표 1 ).
IDH1 돌연변이 억제제인 클로미펜 이 용량 의존적 비경쟁적 방식으로 돌연변이의 알로스테릭 부위를 점유하여 돌연변이 효소의 하향 조절 을 유도함을 보여주었다 (표 2 ).
또 다른 경구 IDH2 돌연변이 억제제인 Enasidenib은 AML 환자에서 분자 완화를 향상시키고 조혈 분화 손상을 완화하는 것으로 보고되었습니다(표 2 ) [48 ].
IDH 돌연변이는 연골육종에도 존재합니다.
즉, 새로운 돌연변이의 치료 효과 IDH의 억제제는 IDH 돌연변이를 표시하는 암 환자들에게 매우 유용합니다.
2.12 PPP
PPP는 G6PD를 통해 생리학적으로 산화환원 항상성을 조절하여 포도당-6-인산을 변형시키고 리보스-5-인산 및 NADPH 생성에 기여합니다(그림 3 )[ 50 ].
PPP는 Warburg 효과와 관련이 있지만 암 대사에서의 정확한 역할은 불분명합니다.
중요하게도 PPP는 암의 국소적 확산과 원격 전이에도 중요한 역할을 합니다.
맥도날드 외 . [ 53]은 PPP의 산화 분지가 췌관 선암종(PDAC)에서 염색질 재배선, 발암성 유전자 활성 및 종양 형성을 부분적으로 완화하는 동안 지역 이동을 추진하는 것으로 밝혀졌습니다.
이는 PPP 플럭스의 증가가 대사-후생적 신호전달 경로를 통해 종양 증식을 촉진한다는 것을 나타냅니다.
임상 분석에 따르면 PPP 차단은 신뢰할 수 있는 항종양 도구로 인식될 수 있으며 G6PD 억제제 폴리다틴은 혀암과 같은 암의 새로운 항 PPP 제제로 기능합니다[ 54 ](표 2 ).
3 지질 대사
3.1 발암 효과
지질 대사는 악성 종양의 생존에 중요한 사건입니다[ 55 - 57 ].
Serol 조절 요소 결합 단백질(SREBP)은 역사적으로 지질 대사에서 중요한 요소로 인식되어 왔습니다.
HCC에서 고수준의 새로운 지방 생성을 활성화하여 SREBP의 유비퀴틴-프로테아좀 매개 분해를 방지한다고 제안했습니다(표 1 ).
Xu et al . [ 60]는 활성화된 PCK1이 INSIG1/2가 세포 내 지질과 복합체를 형성하는 것을 방지하고 HCC에서 지방 생성과 관련된 SREBP 신호를 유발하여 SREBP가 지질 대사에서 중심 역할을 한다는 것을 시사한다고 보고했습니다(표 1 ).
Huang et al . [ 62 ]는 영양 스트레스를 받는 HCC 세포에서 미토콘드리아 케톤분해 촉진제 3-옥소산 CoA-트랜스퍼라제 1(OXCT1)이 혈청 기아로 자극된 mTOR 복합체 2(mTORC2)-AKT 축에 의해 활성화되고 케톤 대사를 TCA 회로로 유도한다는 것을 발견했습니다. , AMPK도 비활성화합니다.
이 관찰은 영양 상태가 좋지 않은 HCC 세포가 생존을 지원하기 위해 케톤체에 의존할 수 있음을 시사합니다(표 1 및 그림 2F ).
인간의 원발성 흑색종 및 털이 많은 세포 백혈병 세포도 대사성 케톤 생성을 나타냅니다.
케톤 분해와 케톤 생성은 암세포 활동에 중요하며 케톤체 대사를 표적으로 하는 것은 악성 종양에 대한 약물 후보를 개발하는 새로운 전략이 될 수 있습니다.
3.2 항암효과
지방산이 항암 특성을 가지고 있음을 보여주는 풍부한 증거가 있습니다.
지방산은 CD8 + T 세포에 의해 에너지원 으로 사용될 수 있음이 밝혀졌습니다 .
따라서 세포가 저산소 환경과 저혈당 환경에 동시에 노출되었을 때 항종양 효과가 관찰되었습니다.
Zhang et al . [ 66 ] 또한 CD8 +종양 침윤 T-림프구(TIL)는 저혈당 및 저산소 상태에서 과산화소체 증식자 활성화 수용체(PPAR)-알파 신호 전달 및 지방산 분해를 개선했습니다.
지방산 이화작용을 더욱 강화하면 T 세포의 이펙터 기능이 유지되고 항종양 효능이 향상됩니다.
지방산 대사는 암 환자 집단에서 큰 치료적 관심 대상입니다.
식단에 포함된 오메가-3 다중불포화 지방산은 CRC 발달을 부분적으로 억제할 수 있습니다[ 67 ].
Zhang et al . [ 68 ]은 오메가-3 지방산에서 파생된 에폭시도코사펜타엔산(EDP)이 혈관신생뿐만 아니라 내피 세포 이동 및 VEGF 수용체 2 유도 프로테아제 생성을 차단할 수 있음을 발견했습니다(표 2 ).
오메가-3 지방산은 또한 특정 항암 대사 경로에 관여할 수 있으며 암에서 잠재적인 예방 및 억제 효과를 나타낼 수 있습니다.
4 단백질 변형
4.1 탈인산화
세린/트레오닌-단백질 포스파타제 매개 탈인산화는 생리학적 조건의 핵심 과정이지만 포스파타제의 돌연변이가 악성 진행을 지속시키는 것으로 밝혀졌습니다
또 다른 포스파타제인 단백질 포스파타제 2A(PP2A)는 별개의 조절 소단위에 의해 세포에서 대부분의 단백질 탈인산화 사건을 조절합니다.
최근 Liu et al . [ 74]은 PP2A 억제제가 화학요법제와 상승작용을 일으켜 암에서 비정상적인 신호 전달을 억제한다는 것을 확인했습니다.
비정상적인 단백질 포스파타제를 표적으로 하는 것은 암 치료에서 유망한 치료 전략을 나타냅니다.
4.2 유비퀴틴화
E3 유비퀴틴 리가제 유도 유비퀴틴화는 종양 유지에서 단백질 번역 후 변형을 유의하게 조절합니다
5 아미노산 대사
5.1 글루타민 대사
혈액 내 높은 수준의 글루타민(Gln)은 암세포 활동을 지원하기 위해 쉽게 이용할 수 있는 탄소와 질소 공급원을 제공합니다.
유사하게, 결장암 유래 미토콘드리아 글루탐산 피루브산 트랜스아미나제 2(GPT2) 조절 Gln 이화작용은 Gln이 TCA 회로에 대한 지배적인 탄소원 Gln이라는 사실을 이용하는 Warburg 효과에 관여합니다(그림 3 및 표 1) [80].
발암성 전사 인자 c-MYC는 메닌 유전자에 의해 조절되며, 시험관 내 및 생체 내 에서 암세포 증식 및 대사 를 유도합니다 [ 81 ].
신장암, 전립선암 및 버킷 림프종에서 c-MYC는 또한 Gln으로부터 P5C 합성효소 및 P5C 환원효소 1 매개 프롤린 생합성을 증가시켜 종양 성장을 촉진하기 위해 글루타민분해의 상향 조절을 촉발합니다.
Gln 대사의 변경은 뉴클레오티드 생합성에 기여하고 DNA 손상을 약화시킵니다.
이는 기존의 방사선 치료 내성을 증가시킵니다[ 83 ].
글루타민분해와 같은 Gln 대사 경로를 표적으로 삼는 것은 종양 세포를 죽이는 치료 전략을 제공할 수 있습니다.
5.2 세린 대사
정상 조직과 비교하여 암세포는 글루코스-6-포스페이트에서 유래된 3-포스포글리세르산을 세린으로 전환시키는 PHGDH(포스포글리세레이트 탈수소효소)와 같은 세린 합성 경로 효소의 과발현으로 변경된 대사를 나타냅니다[ 88 ](그림 3 ).
Sullivan et al . [ 89 ]는 PHGDH의 과발현이 세린 수준을 개선하고 퓨린 및 뉴클레오티드 생합성을 지속하여 세린 결핍 하에서 흑색종 및 유방암 성장을 지원한다는 것을 발견했습니다(표 1 및 그림 4D).
세린 합성의 활성화는 세린 탈수효소(SDH)를 통해 포도당을 피루브산으로 전환하고 췌장암 세포에서 피루브산 키나제와 무관한 방식으로 해당과정을 재연결했습니다[ 90 ](표 1 및 그림 3 ).
Pacold et al . [ 91 ] PHGDH 억제는 외인성 세린이 존재하는 경우에도 해당 작용 세린의 1탄소 단위에서 파생된 뉴클레오티드 생성을 억제한다고 보고했으며, 이는 세린이 퓨린 및 데옥시티미딘 합성을 위한 1탄소의 중요한 공급원임을 입증했습니다.
유방암(표 1). 따라서 PHGDH는 새로운 대사 취약성이 될 수 있으며 PHGDH 억제제의 전임상 평가는 추가 치료 적용에 기여할 수 있습니다[ 92 ].
5.3 메티오닌 대사
포유류 세포의 경우 메티오닌 대사는 후성적 재프로그래밍과 세포 성장에 필수적입니다[ 93 ].
메티오닌 순환 플럭스는 또한 종양 세포의 후성 유전 상태에 영향을 미칩니다.
단백질체 및 게놈 분석은 메틸트랜스퍼라제 니코틴아미드 N-메틸트랜스퍼라제(NNMT) 발현이 암 관련 섬유아세포(CAF) 표현형에 기여하고 난소암 전이에 중요한 S-아데노실 메티오닌의 고갈을 유발하는 것으로 나타났습니다[ 95 ](표 1 ).
가오et al . [ 96 ]은 메티오닌 제한이 화학요법에 내성이 있는 RAS-유도 CRC 및 연조직 육종의 병리학적 모델에서 임상 반응을 유도함을 밝혔습니다. 메티오닌 섭취를 표적으로 하는 것은 암 대사에 부분적으로 영향을 미칠 수 있으며, 이는 궁극적으로 암의 치료 결과의 여러 측면을 조절합니다.
5.4 아스파르트산 대사
다른 아미노산과 달리 아스파르테이트는 혈액에서 쉽게 이용할 수 없기 때문에 종양 세포와 같은 증식하는 세포는 스스로 아스파르트산을 생성합니다.
예를 들어, TCA 주기 유래 OOA는 세포 과정에서 중추적인 역할을 하는 아스파테이트 생합성을 매개합니다[ 97 ](그림 3 ).
놀랍게도, 미토콘드리아 호흡은 아스파르테이트 생산을 유지하기에 충분한 전자 수용체를 생성합니다
그러나 aspartate는 세포 투과성이 좋지 않은 반면 아미노산 아스파라긴은 종양에서 사용할 수 있습니다.
Sullivan et al . [ 99 ]는 아스파라기나제 1(ASNase1)이 143B 세포( 시험관 내 인간 골육종 세포) 에서 아스파라긴과 아스파르테이트 간의 상호 전환을 허용한다는 것을 발견했습니다.), 후속적으로 충분한 내생성 아스파르트산염을 제공하여 종양 성장의 상당한 가속을 유도합니다(표 1 및 그림 3 ).
이러한 연구는 대사성 아스파르테이트 고갈을 촉진하는 것이 암 치료에 도움이 될 수 있음을 보여주었습니다.
5.5 트립토판 대사
종양 세포의 인돌아민 2,3-디옥시게나제(IDO)는 트립토판(Trp)을 대사하고 키누레닌(KYN) 생합성을 촉발하여 T 세포 증식 성장을 억제하고 면역 억제 TME를 촉진합니다[ 100 ].
특히, 종양 내 대사 산물은 다른 종양 관련 세포 집단을 선동하여 Trp 이화 작용을 자극하고 면역 기능을 손상시킵니다.
다발성 골수종(MM)에서 종양 세포는 IL-32를 방출하고 TAMS를 유발하여 IDO를 생성합니다. 이는 CD4 + T-세포 증식 성장을 더욱 길항하여 항종양 생리활성 물질 분비를 감소시킵니다[ 101 ](표 1). IDO는 Trp의 고갈과 KYN의 축적을 통해 면역억제 기능을 조절합니다. 따라서 1-메틸 트립토판(1-MT)을 포함한 IDO 억제제와 독소루비신을 포함하는 화학요법제의 조합이 잠재적인 치료 옵션으로 고려될 수 있습니다[ 102 ](표 2 ).
5.6 아미노산 대사 - 아르기닌 결핍
아르기닌은 시트룰린과 아스파테이트로부터 아르기니노숙시네이트 합성을 촉매하고 아르기닌 생합성에서 속도 제한 효소인 아르기니노숙시네이트 합성효소 1(ASS1)을 통해 종양 형성을 촉진합니다[ 103 ](그림 3 ).
ADI-PEG20은 또한 ASS1의 소실과 함께 유방암 세포의 자가포식 의존적 사멸을 유도했고, 아스파르테이트와 시트룰린에서 파생된 새로운 아르기닌 합성을 약화시켰으며, 아르기닌 결핍은 또한 암세포에서 미토콘드리아 손상과 세포독성 자가포식을 유발했습니다[ 106 ](표 2및 도 4E ).
따라서 강력한 아르기닌 결핍 요법은 암을 치료하기 위한 잠재적인 치료 전략으로 탐구할 가치가 있습니다.
6 기타 대사 경로
6.1 담즙산 대사
산발성 CRC의 대부분의 경우, 장 담즙산(BA)은 더 나쁜 임상 결과와 관련된 위험 요소입니다.
APC 돌연변이가 BA의 구조를 변화시켜 tauro-beta-muricholic acid(T-betaMCA) 및 deoxycholic acid(DCA)와 같은 BA를 생성할 수 있음을 보여주었습니다.
이것은 장 파르네소이드 X 수용체(FXR) 기능의 손상으로 이어질 수 있으며, 그 결과 CRC에서 DNA 손상 및 선종에서 선암으로의 변형이 발생할 수 있습니다(그림 1E ).
6.2 비타민 D 대사
역학 데이터에 따르면 비타민 D는 CRC 위험 감소와 관련이 있기 때문에 항암 기능이 있습니다.
Maalmi et al . [ 109 ]은 혈장 25-하이드록시비타민 D(25-(OH)-D3) 수준이 30 nmol/L 미만인 CRC 환자의 사망률이 매우 높았고 25-(OH)-D3 결핍으로 인해 임상 예후가 좋지 않았다고 보고했습니다.
CRC 외에도 비타민 D는 CD8 + T 세포 기능을 향상시키고 유방암 조직에서 TME의 염증을 감소시킵니다
항염증 및 항종양 특성으로 인해 비타민 D는 표준 암 면역 요법에서 보조제로 사용하기에 유망한 후보가 될 수 있습니다.
6.3 미량원소 대사
미량 원소의 대사 불균형은 여러 암 유발 병리학적 상태와 관련이 있습니다.
예를 들어, 아연 항상성 손상은 암 환자의 근육 소모를 유발합니다.
Wang et al . [ 113 ]은 전이성 암세포에서 활성화된 아연 수송체 ZRT 및 IRT 유사 단백질 14(ZIP14)가 근육 전구 세포에서 아연 흡수를 촉진하고 MyoD 및 Mef2c를 억제하여 근육 세포 분화를 완화한다는 것을 발견했습니다.
또 다른 미량 원소인 구리는 특히 원발성 췌장암에서 암세포 증식을 가능하게 합니다. Ishida et al . [ 114 ]는 종양 촉진제 구리가 시토크롬 c 산화효소와 상호작용하고 산화적 인산화 및 ATP 생산을 매개한다는 점을 강조했습니다(표 1).
TME의 미량 요소는 종양 대사 표현형을 부분적으로 변경할 수 있습니다.
6.4 요소 순환 대사
아르기닌은 요소의 주요 공급원입니다.
아르기닌은 분해되어 요소와 오르니틴을 생성합니다.
오르니틴은 미토콘드리아에서 시트룰린 생합성을 지원하고 이어서 아르기닌 재생을 지원하며 이 일련의 반응을 요소 회로(UC)라고 합니다[ 115 ](그림 3 ).
UC 조절 장애는 여러 암 유형의 일반적인 대사 기능입니다.
6.5 스트레스 매개 아드레날린 대사
스트레스는 신경화학적 및 내분비학적 변화를 매개하고 전이성 종양 개시에서 아드레날린 수치를 증가시킵니다[ 118 ].
Cui et al . [ 120]은 스트레스 활성화 SNS가 LDHA를 유발하여 젖산을 생성하고 Myc를 안정화시킨 에피네프린 생성을 자극하고, 이어서 SLUG를 유발하고 유방암 줄기 유사 특성을 추가로 지속시킨다는 것을 입증했습니다(그림 4G ).
활성화된 SLUG는 E-cadherin을 비활성화하고 유방암 세포 전이를 가속화합니다(그림 4G )
중요한 것은 Daher et al . [ 123 ]은 β-차단제가 CD8 + T-세포 반응을 향상 시키고 프로프라놀롤이 암 면역 요법에서 항암 백신과 시너지 효과를 낼 수 있음을 확인했습니다(표 2).
따라서 만성 스트레스 유발 아드레날린 신호는 암 진행에서 대사 재배선을 조절하며 이는 베타 차단으로 기존 치료 전략을 보완합니다.
6.6 HMOX1 의존성 경로
암 발병에서 산화 스트레스 반응의 초유도는 종종 종양 억제인자의 고갈을 유발하며,
헴의 센서이자 효과기인 헴 옥시게나제 1(HMOX1)과 Bach1의 축적이 수반됩니다[ 124 ].
HMOX1은 종양 개시를 촉진하는 미세 환경을 만드는 데 기여합니다.
또한 HMOX1과 Nrf2는 악성 종양의 특정 장기 집락화와 유의한 상관관계가 있습니다[ 125 ].
6.7 자가포식 경로
7 대사 프로파일링
대사 프로파일링은 HCC와 같은 암의 개별 종양과 관련된 분자 메커니즘을 이해하는 데 도움이 됩니다.
TABLE 3. Diagnostic metabolic biomarkers in cancer
Metabolic biomarker Cancer typeReference
| Taurocholic acid, lysophosphoethanolamine and lysophosphatidylcholine | Hepatocarcinoma | Tan et al., 2013 [131] |
| CRP, IL-6, non HMW adiponectin, and C-peptide | Aleksandrova et al., 2014 [132] | |
| AEA and PEA | Hepatocarcinoma infected with HCV | Zhou et al., 2012[133] |
| Ethanolamine, lactic acid, phenylalanine, and ribose | Hepatocarcinoma after surgical resection. | Ye et al., 2012 [134] |
| Chain lengths ceramides and sphingomyelins | Epithelial ovarian cancer | Kozar et al., 2018 [135] |
| N-oleoyl taurine | Prostate cancer | Huang et al., 2019 [136] |
| Acetate | Colorectal cancer | Lin et al., 2019 [137] |
| 2-hydroxyisobutyrate, 3-indoxylsulfate, and alanine | Gastric cancer | Chan et al., 2016 [138] |
- Abbreviations: AEA, endocannabinoids anandamide; CRP, C-reactive protein; HCV, hepatitis C virus.; HMW, high-molecular-weight; IL-6, interleukin-6; NSE, neuron-specific enolase; PEA, palmitylethanolamide.
대사체 프로파일링은 다양하고 유연하며 다른 암 유형에서 대사 마커를 식별할 수 있는 기회를 제공합니다.
Kozar et al . [ 135 ] 혈청 대사체 프로파일링을 활용하고 상피성 난소암의 진단 마커로서 특정 사슬 길이의 세라마이드 및 스핑고미엘린 화합물을 확인했습니다(표 3 ).
또한, 혈청 대사체학에서는 N-올레오일 타우린이 대사 장애와 상관관계가 있으며 전립선암 사전 진단에 기여하는 것으로 나타났습니다[ 136 ](표 3).
또한, HNMR에 기반한 대사체학은 위암의 소변에서 추출한 2-hydroxyisobutyrate, 3-indoxylsulfate, alanine과 CRC 환자의 대변 대사물에서 나온 acetate가 해당 검체에서 다른 대사물보다 더 높은 진단적 우월성을 나타냄을 밝혔습니다(표 3 ) [ 137 , 138 ].
대사 신호는 종양 조직 미세 환경을 반영하고 대사체학은 임상 환경에서 악성 종양에 대한 민감한 진단 바이오마커의 식별을 가능하게 할 수 있습니다.
8 결론 및 전망
세포 대사는 세포 외 환경과 세포 내 과정 사이의 핵심 연결 고리이며 암 특이적 대사 재배선은 종종 단백질 변형 및 다양한 효소 반응과 같은 정상적인 생리적 대사 과정을 종양 증식에 필요한 보호 장벽으로 전환시킵니다 [ 139 - 141].
종양 세포 집단은 포도당을 놓고 정상 조직과 경쟁하고, 이어서 속도 제한 자극기가 바르부르크 효과를 조정합니다.
또한, 증가된 혐기성 해당작용은 동등하게 중요한 다른 대사산물과 함께 퓨린 및 피리미딘을 포함한 생리활성 물질의 충분한 빌딩 블록을 제공합니다.
포도당 결핍 상태에서는 에너지 공급을 제공할 뿐만 아니라 발암성 변화를 자극하는 다른 대사산물이 대사됩니다.
따라서 종양 세포의 대사 노드를 식별하고 추가로 표적화하는 것은 악성 종양 환자에서 유망한 치료 개입입니다.
나노 물질에 의해 로딩되는 증가하는 소분자 대사 억제제는 대사 억제제의 생물학적 안전성을 향상시킬 수 있는 기존의 항종양제와 함께 보조제로 사용됩니다. 또한, 나노플랫폼은 종양 성장을 억제하는 ROS 생성을 향상시켜 암세포의 세포자멸사를 유도합니다[ 144 ].
나노 규모의 기능성 물질은 운반 약물의 항종양 기능을 달성할 뿐만 아니라 암 치료를 향상시킵니다.
간단히 말해서, 종양 세포는 높은 대사 활동과 에너지 소비를 나타내어 암 환자에게 피로를 유발합니다.
따라서, 발암성 돌연변이로 인한 암성 표현형을 감소시키기 위해 종양 세포의 대사율을 감소시키는 치료 전략을 설계하는 것이 필요할 수 있습니다.
'대사' 카테고리의 다른 글
| 포도당 이용 및 지질 합성을 차단하는 파이토케미컬 (0) | 2021.09.12 |
|---|---|
| 암 치료를 위한 암 대사 표적의 새로운 역할 (0) | 2021.09.10 |
| Nutritionist and obesity (0) | 2021.09.08 |
| 암에서 대사 재프로그래밍을 표적으로 하는 파이토케미칼 (0) | 2021.09.05 |
| G6PD: A hub for metabolic reprogramming and redox signaling in cancer (0) | 2021.09.02 |