2017
The use of natural products to target cancer stem cells
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5523038/
된 NP에 대한 간략한 검토도 제공됩니다.
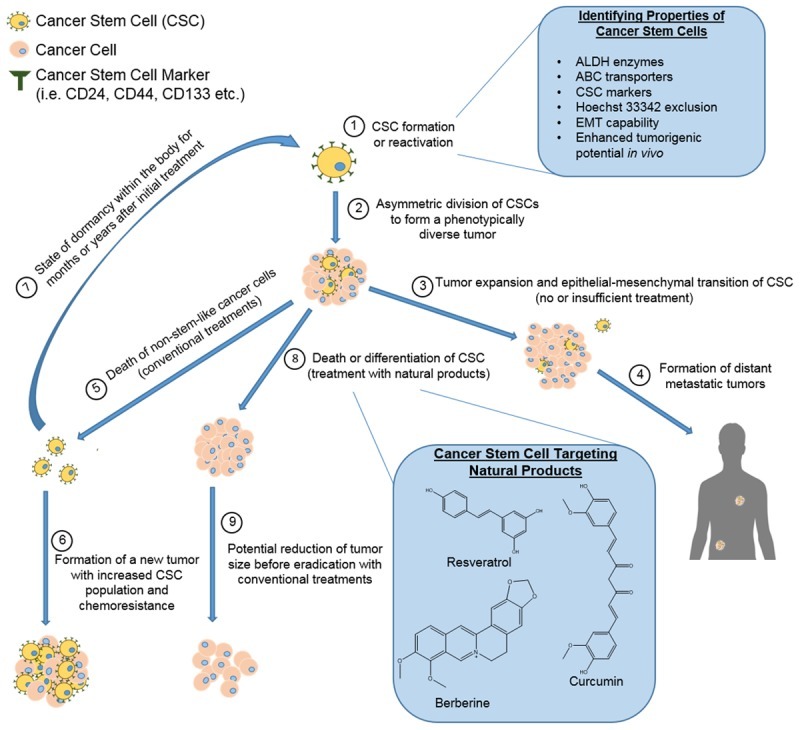
암 줄기 세포 모델의 종양 형성, 전이 및 재발에 대한 설명과 천연물의 치료 가능성에 대한 그림.
암 줄기 세포(CSC)는 체세포 또는 줄기 세포의 발암 시에 형성되거나 휴면 기간 후에 활성화됩니다(1).
그런 다음 이러한 CSC는 비대칭적으로 분열하여 CSC와 비줄기 유사 세포로 구성된 표현형이 다양한 종양을 생성합니다(2).
치료하지 않으면 종양이 계속 성장하여 주변 조직을 침범하게 되며, EMT를 받는 CSC는 원래 종양에서 떨어져 나와 먼 장기로 이동할 수 있습니다(3).
몸 전체에 다시 부착되는 CSC는 새로운 종양을 시작하여 전이를 일으킬 수 있습니다(4).
대량의 종양 세포에서 세포 사멸을 유도할 수 있는 현재의 치료 방법을 사용하여, CSC는 정지 및 ALDH 효소 및 ABC 수송체의 발현과 같은 향상된 생존 특성으로 인해 파괴되지 않습니다(5).
나머지 CSC는 계속해서 원래 종양을 재생성할 수 있으며, 때로는 종양 내 CSC의 비율을 증가시키고 다중 약물 내성 종양을 형성합니다(6).
다른 경우에, 남아 있는 CSC는 신체 내에서 휴면 상태에 들어가고 새로운 종양의 형성을 재활성화하고 개시하기 전에 오랜 기간 동안 감지되지 않은 채로 남아 있어 암이 없다고 생각되는 환자에서 암 재발을 초래합니다(7) .
이러한 문제의 결과로, CSC를 표적으로 할 수 있는 새로운 치료법이 조사되고 있습니다. 천연물은 CSC에서 세포 사멸을 유도하거나, CSC가 분화되도록 하거나, CSC를 기존의 화학 요법 치료에 민감하게 할 가능성을 보여주었습니다(8).
암줄기세포를 표적으로 하는 천연물
다양한 유기체의 활성 화합물은 의약품으로서 큰 성공을 거두었습니다. 이것은 특히 암 화학 요법의 경우에 해당됩니다. 1981년과 2006년 사이에 사용된 항암제의 63%가 NP에서 유래하거나 NP에서 영감을 받거나 천연 약전에서 합성되었습니다[ 66 ].
역사상 가장 수익성이 높은 화학 요법 약물인 탁솔(또는 파클리탁셀)은 태평양 주목 나무의 껍질에서 추출한 천연 제품입니다[ 67 ]. 탁솔은 약 15,000종의 식물을 무작위로 선별하여 발견되었습니다. [ 43],
그러나 항암 특성에 대한 알려진 약용 식물의 표적 스크리닝도 역사적으로 성공적이었습니다. 예를 들어, 빈카 알칼로이드인 빈크리스틴과 빈블라스틴은 50년 넘게 암 치료에 임상적으로 사용되었습니다[ 68 ]. 이 화합물은 중국 전통 의학과 아유르베다 의학에서 모두 사용되는 장미빛 대수리, Catharanthus roseus 에서 분리되었습니다 .
박테리아는 또한 성공적인 항암제의 원천이었습니다. 독소루비신과 같은 안트라사이클린은 특정 스테토마이세스 박테리아 에서 분리되어 수십 년 동안 유방암 치료에 사용되어 왔습니다[ 69 ].
표적치료제의 제한된 수의 성공적인 약물 후보, 새로운 치료법으로 성공적으로 치료된 상대적으로 적은 수의 암, 치료에 대한 내성이 발달하는 암의 높은 위험은 2000년대 후반 천연물 신약 발견에 대한 새로운 관심을 불러일으켰습니다. 46 ]. 표적 요법의 제한된 효능은 합의된 보편적 CSC 마커의 부족과 이들이 사용하는 많은 생존 메커니즘으로 인해 CSC에서 가능성이 증가할 가능성이 있습니다.
수많은 NP와 그 파생물이 초기 임상적 성공을 보여주거나 최근 갱신된 이후 암 치료에 대한 FDA 승인을 받았습니다[ 46 , 72]. HTS를 사용하여 NP를 스크리닝하는 데 직면한 장애물에도 불구하고 합성 화학 물질에 비해 많은 이점을 보여주었습니다.
천연물은 생물학적 표적과 상호작용하여 여러 세포 경로에 동시에 영향을 줄 수 있도록 특수화된 "특권 구조"를 갖고 있는 것으로 생각됩니다. 암의 강력한 생존 가능성은 종종 다양한 메커니즘의 결과이기 때문에 이 능력은 암 및 CSC와 싸우는 데 중요합니다.
또한 NP의 화학적 특성과 다양성은 합성 분자보다 유리합니다. 합성 라이브러리와 비교할 때 NP 라이브러리는 더 많은 키랄 중심, 더 높은 입체적 복잡성, 더 적은 중원자, 더 많은 용매화된 수소 결합 공여체 및 수용체, 더 다양한 분자 특성을 갖는 경향이 있습니다[ 48]. 게다가, NP가 분리된 약용 식물의 역사적 사용은 인간이 섭취할 수 있는 화합물의 안전성과 부작용을 제한할 가능성을 말할 수 있습니다.
몇 가지 유망한 NP가 생체 내 및 시험관 내 에서 CSC를 표적화하는 데 활용되었습니다 .그림 1는 그러한 NP가 암 전이 및 재발을 예방하는 데 역할을 할 수 있음을 보여줍니다. 이러한 화합물은 CSC를 기존 치료에 민감하게 하고, CSC에서 세포 사멸을 직접 유도하고, CSC가 분화되도록 하거나, CSC가 휴면 및 내성 상태로 들어가는 것을 방지할 가능성이 있습니다.
1.폴리페놀
의약품으로 사용되는 많은 천연물은 폴리페놀로 분류될 수 있습니다.
폴리페놀은 히드록실기에 결합된 방향족 벤젠 고리의 존재에 의해 구조적으로 정의되지만 구조적으로 다양한 화합물을 포함합니다.
이러한 하위 그룹에는 특히 플라보노이드, 스틸벤, 탄닌, 리그난 및 페놀산이 포함됩니다.
다양한 그룹의 폴리페놀은 시험관 내에서 염증, 혈관신생, 세포 성장, 침습성 및 세포자멸사를 조절하는 것으로 입증되었습니다 [ 75].
폴리페놀 레스베라트롤과 커큐민은 CSC에 세포독성 효과를 나타내는 것으로 나타난 NP의 주목할만한 예입니다.
레스베라트롤
레스베라트롤은 포도와 열매의 껍질에서 가장 흔히 발견되는 폴리페놀릭 스틸벤 유도체입니다.
다른 많은 유용한 생물학적 특성 외에도 항염 및 항산화 특성에 대한 광범위한 검사를 거쳤습니다.
이러한 특성은 레스베라트롤에게 암 화학 예방제로 작용할 수 있는 매력적인 잠재력을 제공합니다.
레스베라트롤은 세포 사멸을 유도하고 선택된 암세포의 S기 정지를 촉진하는 것으로 나타났습니다.
이 가능성은 10~50μM 범위의 농도에서 생체 내 Hep G2 간세포 암종 세포에서 입증되었습니다[ 76 ].
그러나 50μM보다 높은 농도에서 레스베라트롤은 G 1 /G 0 정지를 유도 했으며 이는 다수의 난소암 세포주를 사용한 별도의 연구에서 확인되었습니다[ 76 ,77 ].
레스베라트롤은 난소암 세포주에서 50~100μM 농도에서 비-세포사멸 메커니즘을 통해 세포 사멸을 유도하는 것으로 추가로 나타났습니다[ 77 ].
이러한 다양한 메커니즘은 다른 NP와 마찬가지로 레스베라트롤이 수많은 생물학적 메커니즘에 동시에 영향을 주어 매력적인 항암제로 만드는 능력을 보여줍니다.
레스베라트롤은 또한 종양에서 CSC 집단을 제거할 수 있습니다.
이 화합물은 Shankar et al의 연구에서 CD44 + /CD24 + /ESA + 에서 카스파제-3/7 활성화 세포자멸사를 유도하는 것으로 나타났습니다.10 ~ 30 μM 농도의 췌장 CSC.
이 연구는 또한 10~20μM 레스베라트롤이 Nanog 및 Oct-4와 같은 줄기 세포 유지 인자와 췌장 CSC에서 Bcl-2 계열의 항-세포자멸 단백질을 모두 억제할 수 있음을 발견했습니다.
또한 Snail 및 Slug와 같은 EMT 단백질과 비 부착 조건에서 췌장 CSC의 EMT 기능은 10~20μM의 레스베라트롤에 반응하여 억제되었습니다.
또한, 약물 유출 펌프 ABCG2의 발현은 10~30μM의 레스베라트롤 투여 후 억제되어 잠재적으로 세포를 기존의 화학 요법 치료에 민감하게 만들었습니다.
CSC를 표적으로 하고 화학 예방 및 항염증제로 작용하는 레스베라트롤의 명백한 능력은 마우스 종양 모델을 사용하여 추가로 입증되었습니다.
Kras의 종양 형성 빈도자발적 췌장 종양 형성 돌연변이인 G12D 마우스는 10개월 동안 레스베라트롤로 치료했을 때 유의하게 감소했습니다[ 78 ].
CSC에서 세포자멸사를 유도할 뿐만 아니라 생체내 종양발생 가능성을 감소시키는 레스베라트롤의 능력은 CD24 - /CD44 + /ESA +유방암 줄기세포 모델에서 증명.
이 연구에서는 50 또는 100 μM 레스베라트롤과 함께 배양한 후 FAS 매개 경로를 통해 유방 CSC에서 세포자멸사를 유도했습니다. .
레스베라트롤은 생체 내 및 시험관 내 전임상 연구에서 매우 유망한 항암 효과를 나타내지만 레스베라트롤은 이러한 성공을 임상 시험으로 전환하는 데 실패했습니다. 이는 대부분 극히 낮은 생체이용률, 높은 유효 용량, 레스베라트롤이 글루쿠로나이드, 황산염 및 하이드록실레이트 접합체로 빠르게 대사되기 때문입니다. 이러한 접합체는 일단 혈류에 흡수되면 무료 레스베라트롤과 동일한 건강상의 이점을 제공하지 못합니다.
결과적으로, 레스베라트롤의 생체이용률을 증가시키는 것을 목표로 하는 레스베라트롤 제형 또는 약물 전달 시스템을 조작하려는 노력이 있어 왔습니다. 여기에는 체내에서 레스베라트롤을 안정화시키는 제제, 레스베라트롤의 수용해도를 증가시키는 제제, 지속, 농축 및/또는 표적 방출을 목적으로 다양한 지질, 미셀 또는 고분자 구조에 레스베라트롤을 캡슐화하는 것이 포함됩니다.
커큐민
커큐민은 항암 특성에 대해 철저히 조사된 또 다른 폴리페놀입니다. 이 화합물은 인도 및 많은 중동 요리에 널리 사용되는 향신료인 강황의 주요 성분입니다.
커큐민은 항염증 효과를 나타내고 암세포에서 세포자멸사를 촉진하는 것으로 나타났습니다[ 82 ].
낮은 생체이용률에도 불구하고 고용량에서의 안전성과 인간 환자의 췌장 신생물에 대한 활성을 입증하는 임상 시험에 사용되었습니다
커큐민은 각각 5μM 및 10μM 농도를 사용하여 시험관 내에서 유방암 맘모스피어의 형성을 50% 및 100% 억제하는 데 사용되었으며, 이는 EMT를 받는 CSC의 능력을 억제하는 커큐민의 능력을 보여줍니다.
커큐민은 또한 현재의 화학 요법 치료에 대한 보충제로 제안되었습니다.
류코보린 칼슘, 플루오로우라실 및 옥살리플라틴의 일반적으로 처방되는 조합인 FOLFOX와 함께 Curcumin은 FOLFOX 단독보다 생존력을 감소시키고 결장 CSC의 EMT를 더 높은 정도로 감소시킬 수 있었습니다.
커큐민은 항암제로서 큰 잠재력을 보여 암에 대한 여러 임상 시험에 사용되었지만 레스베라트롤과 유사한 단점을 가지고 있습니다. 즉, 커큐민의 빠른 대사 및 배설은 소수성과 함께 낮은 생체 이용률을 초래하며 이는 마우스 모델을 사용하여 입증되었습니다.
대사를 방해하는 보조제의 사용, 리포솜 및 나노입자의 캡슐화, 보다 안정적인 구조적 유사체의 사용을 포함하여 커큐민의 생체이용률을 증가시키기 위한 수많은 약물 전달 연구가 수행되었습니다.
2.플라보노이드
플라보노이드는 수많은 약용 식물에서 발견되는 주요 부류의 폴리페놀 2차 대사 산물입니다.
그들은 두 개의 페닐 고리와 하나의 헤테로 고리를 포함하는 플라본에서 파생됩니다.
플라보노이드는 식물계 전체에서 흔히 발견되는 화합물이며 결과적으로 인간의 식단 전체에 널리 퍼져 있습니다. 과일, 야채, 견과류, 향신료 및 허브가 풍부하기 때문에 플라보노이드가 풍부한 식단은 암 화학 예방의 실현 가능한 수단으로 제안되었습니다.
케르세틴과 캠페롤을 포함한 특정 플라보노이드는 세포자멸사 유도제, 항산화제, 염증 조절제 및 혈관신생 억제제와 관련이 있습니다.
또한 특정 플라보노이드는 열 충격 단백질, 다중 약물 내성, 접착, 전이 및 혈관 신생에 영향을 미치는 것으로 나타났습니다.
케르세틴
케르세틴은 많은 종의 식물에서 발견되는 플라보놀 2차 대사 산물입니다.
케르세틴은 많은 악성 암 세포주에서 예정된 세포 사멸을 유도하는 것으로 입증된 알려진 항염증제 및 항산화제입니다.
케르세틴은 P53 하향 조절, 티로신 키나제 억제, 열 충격 단백질 억제, II형 에스트로겐 수용체 발현 유도를 포함하여 인간 암의 형성 및 유지와 관련된 여러 세포 경로를 방해하는 것으로 나타났습니다[ 92 ].
케르세틴은 잠재적인 CSC 표적 치료제로 더욱 주목받고 있습니다.
케르세틴은 75μM 농도에서 CD133 + 결장 CSC 의 증식을 억제하는 것으로 나타 났을 뿐만 아니라 독소루비신(Adriamycin)에 대한 이들 세포의 감수성을 증가시킵니다. 50μM 퀘르세틴과 결합했을 때, 독소루비신 용량은 퀘르세틴이 없을 때 3배 더 농축되어 있는 독소루비신 용량보다 시험관 내 CSC 증식 억제에 더 효과적이었습니다.
이 발견은 케르세틴 및 기타 천연 제품이 CSC 집단을 제거하기 위해 다른 화학 요법의 사용을 향상시킬 가능성을 보여줍니다.
케르세틴과 같은 천연물과 함께 저용량의 화학요법제를 사용하면 표적 독성이 감소하는 동시에 CSC에서 세포자멸사를 유도하고 환자 결과를 개선하며 암 재발 위험을 낮추고 전이 형성을 예방할 수 있습니다.
다른 CSC 모델은 CD44 + /CD133 + 전립선 CSC를 포함한 케르세틴을 사용하여 표적화되었습니다 .
20 µM 농도에서 케르세틴은 비접착 플라스크에서 성장한 전립선 종양 회전 타원체의 생존력을 낮출 뿐만 아니라 CD44 + /CD133 + 전립선 암 줄기 세포의 이동성, 침습성 및 집락 형성 가능성을 감소시킵니다. .
이 동일한 간행물에서 케르세틴은 차에서 발견되는 카테킨인 에피갈로카테킨 갈레이트와 상승 작용을 하여 이러한 전립선 암 줄기세포에 대한 위의 효과를 상승적으로 증폭시키는 것으로 나타났습니다.
그러나 다른 많은 NP의 경우와 마찬가지로 케르세틴의 낮은 용해도, 낮은 투과성 및 불안정성은 생체 이용률을 감소시킵니다. 이러한 문제와 함께 생물학적 반응을 이끌어내는 데 필요한 상대적으로 높은 용량의 케르세틴은 신생물 부위에서 화합물의 수명과 농도를 증가시키기 위한 추가 약물 전달 노력이 필요합니다.
3.알칼로이드
알칼로이드는 화학 구조에서 질소와 방향족 고리의 존재로 구별되는 약리학적 활성 유기 화합물의 한 종류입니다.
알칼로이드는 식물계 전체에서 생산되지만 일반적으로 고등 식물에서 발견됩니다[ 96 ].
많은 알칼로이드는 말라리아 치료를 위한 퀴닌(quinine)에서 다발성 암종 치료를 위한 빈블라스틴(vinblastine)에 이르기까지 의료 분야에서 역사적으로 사용되어 왔습니다.
몇몇 알칼로이드는 암 치료에 임상적으로 큰 성공을 거두며 사용되어 이 분야에서 그 중요성을 입증했습니다.
알칼로이드 화합물의 작은 그룹은 심지어 건강한 DNA와 암적인 DNA를 구별하여 체외 암 DNA 합성을 억제하는 동시에 건강한 DNA는 영향을 받지 않고 부작용 감소와 함께 잠재적인 암 치료를 유발하는 것으로 나타났다
알칼로이드에 대한 새로운 조사가 여전히 진행 중이며 추가적인 항종양, 항전이 및 MDR 억제 가능성을 보여줍니다. 이러한 결과는 알칼로이드가 CSC를 제거할 가능성을 시사하며, 실제로 알칼로이드 계열에 속하는 많은 화합물 이 시험관 내 및 생체 내에서 CSC를 표적으로 삼는 것으로 나타났습니다 .
디히드로캡사이신
캡사이신은 많은 종의 고추의 매운맛을 담당하는 이차 대사 산물이자 알칼로이드입니다.
이 화합물의 포화 유도체인 디히드로캡사이신(DHC)은 수많은 항종양 특성을 나타냈습니다.
DHC는 50~400μM 사이의 농도에서 사용될 때 결장암과 유방암 세포에서 용량 의존적이고 카탈라아제 조절 자가포식 세포 사멸을 유도하는 것으로 나타났습니다 [ 98].
세포 사멸의 개별 모드를 촉진하는 이러한 능력은 CSC에서 활성인 많은 세포 사멸 회피 경로로 인해 CSC를 표적화하는 데 유용한 도구입니다. 이 능력은 다중 세포 메커니즘에 영향을 미치고 암세포에 강력한 세포독성 효과를 생성하는 NP의 잠재력을 더욱 강조합니다.
CSC 관련 특허에 대한 검토는 DHC가 신경 CSC에 대한 세포독성 효과를 나타내는 것으로 추가로 가정됨을 밝혔습니다[ 73 ].
DHC는 이 특허에서 CD133 + 신경 CSC 를 표적으로 하는 능력을 보여주는 여러 납 화합물 중 하나로 확인되었습니다 .
높은 IC 50그러나 DHC의 값은 특히 많은 NP에 공통적인 낮은 생체 이용률을 고려할 때 효과적인 화학 치료제로서의 사용을 제한합니다. DHC 또는 유사체가 제시된 것보다 더 높은 효능으로 CSC의 표현형을 표적화할 수 있는지 여부를 결정하기 위한 추가 연구가 필요합니다.
피페린
피페린은 검은 후추와 긴 후추에서 발견되는 유망한 항종양성 알칼로이드입니다.
피페린의 사용은 이전에 암 화학 예방제로 제안되었지만 75~150μM 농도의 생체 내 에서 결장암에 노출되었을 때 세포 주기 정지, 소포체 스트레스 및 세포 사멸을 유도하는 능력도 입증 되었습니다 [ 99 ]. 결장암 세포를 피페린으로 처리하면 세포가 비접착성 구체와 집락을 형성하는 능력을 감소시키는 것으로 나타났으며, 이는 CSC에 대한 피페린의 억제 효과를 시사합니다.
피페린의 세포자멸사 효과는 전립선암 세포를 사용하여 추가로 확인되었습니다[ 100 ].
특히 줄기 세포를 표적으로 하는 피페린의 능력은 유방 조직 모델에서 조사되었습니다.
5~10μM 피페린으로 전처리한 후, 분류되지 않은 유방 조직의 맘모스피어 형성 가능성, ALDH 발현 및 Wnt 신호가 유의하게 감소했습니다[ 84].
흥미롭게도, 이들 세포의 분화된 집단은 피페린 처리에 의해 영향을 받지 않는 것으로 보입니다. 다른 세포에 영향을 주지 않고 CSC를 표적으로 하는 피페린의 잠재력은 양성 부작용만 부여하면서 분자 경로에 영향을 미치는 NP의 강력한 능력의 환상적인 예입니다.
피페린은 대사 경로를 억제하는 능력으로 인해 레스베라트롤 또는 커큐민과 같은 화합물과의 병용 요법에 사용하도록 추가로 제안되었습니다. 피페린은 이러한 화합물의 글루쿠론산화를 늦춤으로써 나노입자의 신진대사와 제거를 억제하고 생체이용률을 증가시킵니다[ 101 ]. CSC에 대한 세포독성 효과를 유도하고 다른 화합물의 효능을 증가시킴으로써 피페린은 다른 NP 화학요법에 대한 이상적인 보완 약물로 작용합니다.
베르베린
베르베린은 수많은 식물의 뿌리와 줄기에서 발견되는 사환식 이소퀴놀린 알칼로이드입니다.
베르베린을 생산하는 약용 식물은 수년간 아유르베다 의학에서 항염증제로 사용되어 왔으며 화합물은 광범위한 암에서 활성 산소 종 생성에 의해 시작된 용량 의존적 세포자멸사를 유도하는 것으로 나타났습니다.
베르베린에 의해 유도된 세포자멸사는 내부 카스파제-9 의존성 경로를 거쳐 미토콘드리아 막 완전성의 손실을 초래합니다.
많은 천연 제품과 마찬가지로 베르베린의 생체 이용률은 체내에서 낮아 약물로서의 베르베린의 잠재력을 제한합니다. 이 장애물은 약물 전달 시스템으로 표적화 리포좀의 사용을 통해 극복되고 있습니다.. 이 전달 시스템은 CD44 + /CD24 - 유방암 줄기 세포 의 미토콘드리아에 화합물을 직접 전달하도록 조작된 리포솜으로 베르베린을 캡슐화했습니다 .
이 시스템을 사용하여 1-50 μM의 베르베린이 유방 CSC에서 용량 의존적 세포자멸사를 생성할 수 있었습니다.
이 약물은 추가로 세포자멸사 단백질 Bax의 발현을 유도하고 caspase-9와 caspase-3를 활성화하여 MCF-7 맘모스피어에서 분리된 CSC에서 세포자멸사를 유도할 수 있었습니다.
또한 베르베린은 CSC에서 MDR을 담당하는 ABC 수송체의 발현을 억제하는 데 사용되었습니다.
10 mg/kg의 베르베린 리포솜과 10 mg/kg의 파클리탁셀 리포솜의 혼합물은 단 21일 만에 대조군에 비해 이들 마우스의 평균 종양 크기를 85.5%까지 감소시킬 수 있었습니다[ 104]. 이러한 방식으로 베르베린은 CSC를 단독으로 또는 기존의 화학요법제와 함께 표적화하는 데 사용할 수 있습니다.
4.그외 다른 것들
폴리페놀, 플라바노이드 또는 알칼로이드의 분류에 맞지 않는 많은 다른 천연 화합물이 CSC를 표적으로 하는 가능성을 보여주었습니다.
레티노이드는 이러한 화합물의 예입니다.
레티놀이라고도 하는 비타민 A는 ATRA(All-Trans Retinoic Acid)를 비롯한 여러 생물학적 활성 레티노이드를 생성합니다.
ATRA는 트레티노인이라는 상표명으로 급성 전골수구성 백혈병의 치료에서 임상적 성공을 발견했습니다. 이 약물은 비교적 경미한 부작용과 함께 성공적인 관해 유도가 특징입니다[ 105 ].
ATRA가 사용하는 작용 기전은 백혈병 및 조혈 세포의 세포 분화 유도를 통한 것이며, 이러한 분화 유도는 다른 유형의 줄기 세포에서 더 관찰되었습니다 [ 106].
레티노이드의 분화 잠재력은 암 치료를 위한 독특한 잠재력, 즉 CSC를 고전적인 화학요법 요법에 더 민감한 세포 집단으로 분화시키는 잠재력을 나타냅니다.
또한 ATRA는 ALDH 활성의 억제제로 작용하여 잠재적으로 CSC에서 MDR의 원인을 역전시킵니다[ 58 ].
따라서 ATRA는 생체 내에서 유방암 세포의 종양구 형성 능력과 CSC 비율을 제한하는 데 사용되었습니다.
락톤 항생제인 Brefeldin A는 폴리페놀, 플라보노이드 또는 알칼로이드로 분류될 수 없는 또 다른 NP입니다.
p53 독립적인 기전을 통해 백혈병, 결장암, 전립선암을 포함한 여러 암 유형에서 항암 가능성을 보여주었습니다.
Brefeldin A는 특정 곰팡이 유기체에 의해 생성되며 단백질 수송 억제제로 작용하여 단백질이 소포체(ER)에서 골지체로 이동하는 것을 방지합니다.
결과적으로 brefeldin A는 ER 스트레스를 유발하여 잠재적으로 세포 사멸 효과를 일으킬 수 있습니다.
최근에, 브레펠딘 A는 인간 유방 선암종 라인 MDA-MB-231의 부착 배양물보다 현탁 배양물에서 세포 사멸을 우선적으로 유도하는 것으로 나타났습니다. 동일한 간행물에서 brefeldin A는 또한 CD44의 발현을 하향 조절하고 부드러운 아가로스에서 집락을 형성하는 세포의 능력을 감소시키며 EMT를 역전시켰습니다.
인간 대장암 계통 Colo 205에서 추정되는 CSC의 우선적 사멸 및 집락 형성 가능성의 억제가 유사하게 보고되었습니다. 이는 CSC 집단을 감소시키면서 일반적으로 화학요법과 관련된 부작용을 제한할 가능성이 있습니다
'줄기세포' 카테고리의 다른 글
| 암 치료를 위한 암 줄기 세포 경로 표적화 (0) | 2021.10.09 |
|---|---|
| 암 줄기 세포를 표적으로 하는 천연물 2 (0) | 2021.10.08 |
| ⚡국내 줄기세포 링크 (0) | 2021.10.07 |
| 암 줄기 세포에 대한 치료 도구로서의 파이토케미칼 (0) | 2021.09.26 |
| 비독성 요법으로 암 줄기 세포 표적화 (0) | 2021.09.26 |