Flavonoids Targeting HIF-1: Implications on Cancer Metabolism
https://www.mdpi.com/2072-6694/13/1/130/htm-2020년
Flavonoids Targeting HIF-1: Implications on Cancer Metabolism
Tumor hypoxia is described as an oxygen deprivation in malignant tissue. The hypoxic condition is a consequence of an imbalance between rapidly proliferating cells and a vascularization that leads to lower oxygen levels in tumors. Hypoxia-inducible factor
www.mdpi.com
HIF-1 및 Warburg 효과에 기여하는 중요한 효소의 표적화를 통해 플라보노이드로 알려진 식물성 페놀 화합물의 항암 효과에 대해 논의합니다.
HIF-1과 대사 재프로그래밍 사이의 연결은 암 진행에 중요한 역할을 하는 것으로 보입니다.
제시된 논문의 핵심은 호기성 해당작용 및 HIF-1 활성에 대한 플라보노이드의 시험관내 및 생체내 효능에 대한 현재 지식을 요약합니다.
임상 증거가 부족함에도 불구하고 우리는 예측, 예방 및/또는 개인 맞춤 의료 접근 방식을 고려하여 임상 연구에 플라보노이드(HIF-1 표적)를 도입할 가능성을 강조합니다.
종양 저산소증은 악성 조직의 산소 결핍으로 설명됩니다.
저산소 상태는 빠르게 증식하는 세포와 종양의 산소 수준을 낮추는 혈관 형성 사이의 불균형의 결과입니다.
저산소증 유발 인자 1(HIF-1)은 저산소증 관련 유전자의 조절에 기여하는 필수 전사 인자입니다.
이들 유전자 중 일부는 바르부르크 효과 및 이에 수반되는 경로와 관련된 분자 캐스케이드를 조절하므로 암 치료의 유망한 표적이 됩니다.
치료 접근법 개발의 현재 진행은 HIF-1의 몇 가지 유망한 억제제를 가져옵니다.
다양한 식물에 널리 존재하는 플라보노이드는 인간의 건강에 광범위한 유익한 효과를 발휘하며 잠재적으로 강력한 암 치료 도구입니다.
최근 증거에 따르면
피루브산 키나제 M2(PKM2),
젖산 탈수소효소(LDHA),
포도당 수송체(GLUT),
헥소키나제 II(HKII)
포스포프럭토키나제-1(PFK-1) 및
피루베이트 탈수소효소 키나제(PDK)를 포함하여 암세포에서 중요한 해당 성분의 조절과 관련된 HIF-1의 억제제로 수많은 천연 플라보노이드 및 그 유도체가 확인되었습니다.
여기에서 우리는 Warburg 표현형에 기여하는 중요한 효소의 조절과 함께 HIF-1에 대한 플라보노이드의 영향을 평가하는 가장 최근 연구의 결과에 대해 논의합니다.
게다가, HIF-1 활성 조절을 통한 포도당 대사에 대한 플라보노이드 효과는 암 관련 연구에서 유망한 방법을 나타냅니다.
피루브산 키나제 M2(PKM2),
젖산 탈수소효소(LDHA),
포도당 수송체(GLUT),
헥소키나제 II(HKII),
포스포프룩토키나제-1(PFK-1),
피루브산 탈수소효소키나제(PDK)를
포함한 암세포의 중요한 해당 성분의 조절과 관련이 있습니다. .
1. 소개
암은 종양 세포가 제어되지 않는 증식, 세포자멸사 회피, 침습성 및 신생혈관 생성 촉진과 같은 특정 능력을 획득하는 다단계 과정을 특징으로 합니다[ 3 ].
종양 세포의 통제되지 않고 급속한 증식과 새로운 혈관의 불충분한 형성은 종양 조직에 부적절한 산소 공급을 초래합니다.
따라서 악성 조직이 발달하여 저산소 및 괴사 영역을 갖는 것은 드문 일이 아닙니다[ 4].
저산소 지역에서 낮은 수준의 산소에 대한 세포의 적응은 여러 생존 경로의 활성화를 동반합니다[ 5 ].
저산소증 유발 인자 1(HIF-1)은 저산소 반응의 조절을 담당하는 중요한 전사 인자입니다.
최근 증거에 따르면 HIF-1 수치가 상승하면 암 환자의 전이, 혈관신생, 화학/방사선 내성 발생 및 전반적으로 불량한 예후와 관련된 예후 마커로 작용할 수 있습니다[ 6 , 7].
산화적 인산화(OXPHOS)에서 호기성 해당과정으로의 전환을 유도하는 대사 재프로그래밍은 저산소 환경에 대한 세포 적응에 중요합니다.
OXPHOS보다 호기성 해당작용의 선호(Warburg 효과로 알려짐)는 정상 산소 수준에서도 많은 고형 종양에서 자주 관찰됩니다[ 8 ].
저산소증과 독립적으로 HIF-1의 안정화는 정상산소 조건에서 해당과정의 가속을 설명할 수 있습니다.
실험 연구는 최근 Warburg 표현형에 기여하는 중요한 해당 단백질을 조절하는 HIF-1의 중요한 역할을 제안했습니다.
따라서 HIF-1은 암세포의 대사 재프로그래밍에 대한 잠재적 표적을 나타냅니다[ 9 ].
암 발생의 중요한 역할로 인해 여러 HIF-1 억제제가 최근 임상적으로 추적되었습니다.
그러나 HIF-1의 활성을 억제하는 새로운 치료 도구를 제공하기 위해서는 HIF-1에 대한 추가 연구가 필요합니다.
자연적으로 발생하는 식물 유래 화합물의 일종인 플라보노이드는 많은 유익한 인체 건강 특성을 발휘합니다. [ 10].
플라보노이드는 시험관 내 및 생체 내에서 암 개시, 촉진 및 진행과 관련된 다양한 신호 전달 경로를 조절합니다[ 4 , 11 , 12 , 13].
HIF-1 및 포도당 대사에 연결된 조절 캐스케이드에 대한 플라보노이드의 효과는 해당 작용의 중요한 구성 요소뿐만 아니라 HIF-1 활성의 조절을 통해 대사 재프로그래밍을 억제하는 유망한 방법을 구성합니다.
따라서 이 리뷰에서는 HIF-1 및 Warburg 효과에 직접적으로 기여하는 단백질에 대한 플라보노이드의 억제 효과를 평가하는 최근 연구에 대한 포괄적인 논의를 제공합니다.
식이 페놀의 항암 효과는 전임상 및 임상 연구에서의 적용을 지원하지만 플라보노이드의 부작용을 제거하려면 생체 이용률 및 안전성과 관련된 여러 합병증을 극복해야 합니다.
플라보노이드는 독립적으로 또는 기존 요법과 결합하여 암을 표적으로 하는 강력한 치료 도구로 작용할 수 있지만, 플라보노이드 기반 접근 방식의 이점을 얻을 수 있는 개인을 식별하고 추가 기계론적 평가는 암 환자에게 희망을 제공할 수 있습니다.
2. 저산소 상태
저산소증은 조직에 산소 공급이 제대로 이루어지지 않는 산소 결핍으로 정의됩니다.
낮은 산소 수준은 암 조직의 특징입니다.
급속한 종양 성장은 불충분한 혈관 발달로 인해 특정 암 조직 영역으로의 산소 공급 감소로 이어집니다[ 9 ].
암 세포가 산소 및 영양 결핍에 적응하는 데 필요한 신생혈관 형성에서 저산소증의 역할 외에도 저산소 상태는 대사 변화,
세포 수명 연장,
세포 부착 및 세포외 기질 생성의 변화와
같은 다른 종양 특징과 관련이 있습니다[ 14 , 15].
따라서 저산소증은 고형 종양의 특징이며 화학 내성, 방사선 내성 또는 전이를 초래하는 보다 공격적인 형태의 질병의 발달로 인한 불량한 임상 예후와 강력하게 연결됩니다[ 16 , 17 ].
저산소 상태에 대한 종양 적응의 메커니즘은 저산소 수준에 반응하여 특정 유전자를 표적으로 하는 전사 인자인 저산소 유도 인자(HIF)에 의해 매개됩니다
Warburg 표현형에 대한 간략한 소개
종양 세포 대사의 변화는 비악성 세포에 비해 암의 근본적인 측면입니다[ 20 ].
건강한 세포에서 포도당은 해당 과정을 통해 피루브산으로 대사되고 이어서 산화 적 인산화를 통해 미토콘드리아에서 CO 2 로 산화됩니다.
이 대사 과정은 포도당 분자당 36분자의 ATP를 생성합니다.
설명된 경로는 건강한 세포의 정상 산소 상태에서 발생합니다[ 60 ].
저산소 상태에서는 미토콘드리아 OXPHOS가 제한되어 호기성 해당작용이라고 하는 과정에서 피루브산이 젖산으로 전환됩니다[ 61 ].
특히, 호기성 해당과정의 전체 수율은 포도당 분자당 2ATP에 불과합니다.
흥미롭게도, 정상산소 조건과 미토콘드리아가 완전히 기능하는 상태에서도 호기성 해당작용에 대한 선호가 다양한 암 유형에서 관찰됩니다[ 62 ].
암세포에서 대사 재프로그래밍 현상은 거의 100년 전에 Otto Warburg[ 62 ]에 의해 처음 기술되었습니다 .
관찰 결과 암세포는 주변의 비악성 조직에 비해 엄청난 양의 포도당을 섭취하는 것으로 나타났습니다.
암세포 호흡의 억제와 젖산으로의 포도당 발효의 향상도 확인되었습니다 [ 11 , 63].
최근의 증거는 OXPHOS에서 호기성 해당과정으로의 전환을 담당하는 특정 분자 메커니즘을 밝혀냈습니다.
PI3K/Akt/mTOR를 포함한 분자 경로의 변경, cMYC 및 p53 과 같은 특정 유전자 , 후성 유전 기계의 변화는 암 대사 조절에 직접적으로 참여합니다[ 11 , 64 , 65 , 66 , 67 ].
HIF-1은 Warburg 표현형으로 이어지는 변화의 조절에 필수적인 역할을 합니다.
그것은 포도당 대사와 세포 증식의 중앙 조절자 역할을 합니다.
암 대사 조절에서 HIF-1의 구현
이전 섹션에서 주로 설명한 바와 같이 암세포의 대사 재프로그래밍은 HIF-1 조절 경로와 같은 다양한 분자 이벤트에 의해 조절되는 OXPHOS에서 덜 효율적인 호기성 해당작용으로의 전환을 허용합니다( 그림 2 )[ 11 , 68 ].
두 HIF 소단위(α 및 β)의 이량체화는 증가된 포도당 흡수 및 젖산 생산과 관련된 유전자의 전사를 시작합니다.
이종이량체 HIF-1은 저산소 반응 요소(HRE)에 결합하고 저산소 반응 유전자를 발현하기 시작합니다[ 8 , 69 ].
포도당 수송체(GLUT)는 포도당을 세포로 운반하는 역할을 하며, 저산소증은 GLUT1과 GLUT3의 상향 조절로 이어집니다[ 70].
GLUT의 과발현은 암세포에 충분한 포도당을 보장합니다.
증가된 HIF-1 활성과 GLUT1 및 GLUT3의 과발현 사이의 상관관계는 신경교종[ 71 ]과 췌장 신경내분비 종양[ 72 ] 에서 각각 관찰되었습니다 .
포스포에놀피루브산(PEP)을 피루브산으로 전환시키는 효소인 피루브산 키나제(PK)는 4개의 동형(PKL, PKR, PKM1 및 PKM2)을 포함합니다.
특히 PKM2 isoform은 암세포에서 선호되는 반면 PKM2 유전자 전사는 HIF-1에 의해 조절됩니다
PKM2는 산소 결핍 또는 종양유전자 활성화로 인해 HIF-1α 서브유닛과의 상호작용을 통해 보조 활성화제 역할을 합니다[ 74 ].
이 상호작용은 HIF-1에 의해 조절되는 표적 유전자의 전이활성화를 촉진한다[ 75].
향상된 포도당 대사와 관련된 또 다른 해당 효소인 Hexokinase(HK)는 종종 잘 분화되지 않고 고도로 증식된 종양 조직에서 상향 조절됩니다[ 76 ].
최근 B 세포 림프종에서 비정상적으로 유발된 핵 인자-κB(NF-κB), HIF-1 및 헥소키나아제 II(HKII) 발현 사이의 연결이 관찰된 반면, NF-κB 억제제는 HIF-1 및 HKII를 억제했습니다[77] .
유사하게, 글리세르알데하이드-3-인산 탈수소효소(GAPDH)는 글리세르알데하이드-3-인산을 1,3-비포스포글리세르산으로 전환하는 것을 촉매하는 효소입니다.
특히, 이 효소는 결장직장암[ 78 ] 및 결장종양[ 79 ] 및 흑색종[ 80]. GADPH에 대한 심층 분석은 또한 유방암에서 효소의 활성과 HIF-1 발현 사이의 연관성을 밝혀냈습니다[ 81 ].
또한 HIF-1α 수치가 높아지면 miR-548a가 감소하여 해당 작용과 종양 성장이 촉진됩니다
저산소 분자 캐스케이드의 조절과 바르부르크 효과에서 플라보노이드의 유익한 효과
플라보노이드는 특정 페놀 구조를 가진 식물의 2차 대사 산물입니다.
이러한 생리 활성 화합물은 다양한 과일, 채소, 뿌리, 나무 껍질, 약용 식물의 꽃, 그리고 와인과 차와 같은 음료에서 발견됩니다[ 10 , 11 , 99 ].
플라보노이드는 플라바논, 플라보놀, 칼콘, 플라바놀, 안토시아니딘, 플라본 및 이소플라보노이드의 7가지 구조적 분류로 분류됩니다( 그림 3 ) [ 12 ].
플라보노이드는 항혈관신생[ 13 ] 및 항증식[ 108 ] 효과를 발휘하고 발암과 관련된 후성유전적 메커니즘을 조절할 수 있습니다[ 109 ].
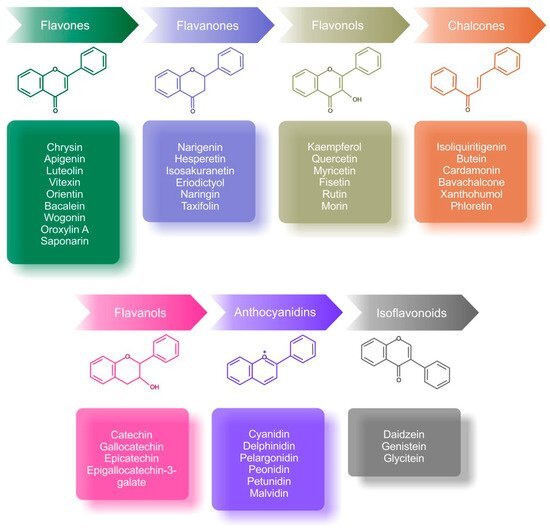
그림 3. 플라보노이드의 주요 하위 그룹의 분류 및 화학 구조와 예 [ 99 , 114 , 115 , 116 , 117 ].
위에서 논의한 바와 같이 저산소증은 다양한 신생물 과정과 직접적으로 연결되어 있습니다.
HIF-1은 혈관신생[ 110 ], 전이[ 111 ], 세포 생존, 증식[ 112 ] 및 세포자멸[ 113 ]을 담당하는 유전자의 조절과 밀접하게 관련된 중요한 전사 인자를 나타냅니다 .
더욱이, Warburg 표현형을 초래하고 OXPHOS에서 호기성 해당작용으로의 전환을 나타내는 암 대사의 변화도 HIF-1에 의해 조절됩니다.
HIF-1 활성 [ 8]. 따라서 HIF-1은 암 발생을 줄이고 종양 발달을 억제하는 임상 개입을 위한 유망한 표적을 나타냅니다.
이러한 개입은 발현을 조절하고, 단백질 합성을 조절하고, 단백질 이량체화에 영향을 미치거나, 표적 DNA 서열에 결합하는 HIF-1의 능력을 감소시킬 수 있습니다.
저산소증 관련 캐스케이드의 조절에서 플라보노이드의 유망한 효과는 암세포에서 호기성 해당작용으로 이어지는 경로를 억제할 수 있는 독특한 기회를 나타냅니다.
플라보노이드에 의한 HIF-1 활성 조절
플라보노이드의 항암 활성은 부분적으로 HIF-1의 억제를 통해 매개됩니다.
HIF-1은 Warburg 표현형에 기여하는 필수 유전자를 표적으로 하는 중요한 전사 인자입니다.
케르세틴은 항염증 및 항산화 특성을 가진 일반적으로 발생하는 플라보놀입니다.
케르세틴은 HIF-1의 활성에 대한 효과를 포함하여 다양한 암 신호 전달 경로의 조절을 통해 유망한 항종양 효과를 발휘합니다[ 118 ].
케르세틴은 HCT116 결장암 세포주에서 HIF-1 전사 활성을 억제했습니다.
게다가, HIF-1 활성의 감소는 AMP-활성화 단백질 키나제(AMPK) 활성의 억제와 관련되어 시험관 내 저산소 조건에서 케르세틴-유도 세포자멸사를 초래했습니다.
또한 생체 내 케르세틴 투여는 이종이식 모델에서 종양 성장을 약화시켰습니다[ 119].
유사하게, 케르세틴은 LNCaP 전립선암 세포, SkBr3 유방암 세포 및 CX-1 결장암 세포를 포함한 여러 암세포주에서 저산소 조건에서 HIF-1α 단백질 합성뿐만 아니라 HIF-1α 축적을 억제하고 HIF-1α를 억제합니다. 농도 의존적 방식으로 단백질 합성[ 120 ].
흥미롭게도 cycloheximide(HIF-1 단백질 억제제)는 HIF-1α 합성에 케르세틴과 동일한 효과를 나타냅니다[ 120]. 다른 연구에서 Du et al. 4T1 유방암 세포에 대한 안트라사이클린계 항생물질인 독소루비신(DOX)의 치료지수 향상을 통해 케르세틴의 항암 역할을 확인했습니다.
케르세틴은 4T1 세포에서 종양 내 HIF-1α를 저산소증 의존적으로 억제했습니다.
반대로 케르세틴은 건강한 세포에서 HIF-1α의 축적을 증가시켰습니다.
수집된 데이터에 따르면 케르세틴은 건강한 세포와 암세포에서 HIF-1α에 대한 반대 효과를 통해 DOX의 치료 지수를 촉진했습니다[ 121 ].
에피갈로카테킨-3-갈레이트(EGCG)는 가능한 항암 활성을 포함하여 수많은 건강상의 이점이 있는 녹차에서 발견되는 생리 활성 페놀입니다[ 122 ].
PANC-1 췌장암 세포주에서 EGCG는 HIF-1α의 증식을 억제하고 용량 의존적으로 HIF-1α의 발현을 억제하였다[ 123 ].
HeLa 자궁경부암과 HepG2 간암 세포에서 EGCG 처리 후 암 진행과 혈관신생 억제가 관찰되었습니다.
EGCG는 이들 세포에서 HIF-1α 단백질 축적을 유의하게 억제했지만 HIF-1α mRNA 발현에는 영향을 미치지 않았다.
EGCG의 HIF-1 억제 특성의 기초가 되는 메커니즘은 PI3K/Akt/mTOR 경로 및 번역 메커니즘에 대한 간섭으로 설명됩니다[ 124 ].
Deguelin, Derris trifoliata Lour 와 같은 식물에서 추출한 로테논 플라보노이드 . 및 Mundulea의 sericea (Willd.) A. 체브., 다수의 변조 신호 경로 [ 125 ]. Deguelin은 폐암(H1299), 인간 편평세포암(UMSCC38), 전립선암(PC3), 위암(MKN-45) 및 유방암(MCF-7) 세포주에서도 HIF-1α의 발현을 감소시켰습니다.
혈관 내피 세포에서와 같이. 특히 deguelin은 de novo HIF-1α 합성을 억제 하고 프로테아좀 분해를 촉진했습니다[ 126 ].
유사하게, deguelin에 의한 HSP90 활성의 억제는 방사선 내성 폐암(H1299 및 H226B) 세포에서 HIF-1α의 억제로 이어졌습니다.
게다가, H1299 및 H226B 이종이식편을 보유하는 흉선이 없는 누드 마우스를 사용하여 HSP90 안정성에 대한 deguelin의 억제 효과를 결정했습니다.
방사선과 데겔린의 조합은 분석된 이종이식편에서 종양 성장을 유의하게 감소시키고 HIF-1α 발현을 감소시켰습니다[ 128 ].
Scutellaria baicalensis Georgi와 그 글루쿠로니드 바이칼린(glucuronide baicalin) 에서 분리된 플라본인
바이칼레인은 수많은 연구에서 입증된 항암 효과를 포함하여 인체 건강에 다양한 유익한 특성을 가지고 있습니다[ 129 , 130 , 131 , 132 ].
바이칼레인은 마우스의 동소 U87 신경교종에서 뇌내 종양 성장 및 증식을 유의하게 감소시키고 세포자멸사 및 세포 주기 정지를 촉진했습니다.
흥미롭게도, 바이칼레인은 U87 신경교종에서 HIF-1α의 단백질 발현을 감소시켰습니다[ 133 ]. 또한, 바이칼레인에 의한 HIF-1α의 억제는 난소암(OVCAR-3 및 CP-70) 세포주에서 세포 생존력의 감소에 기여했습니다[ 134 ].
Chrysin은 프로폴리스와 꿀에서 흔히 볼 수 있는 플라본입니다[ 135 , 136 ]. Chrysin은 HIF-1α 프롤릴-하이드록실화를 증가시켜 유비퀴틴화 및 후속 분해를 일으키고 HSP90/HIF-1α 연결을 방해하여 인간 전립선암(DU145) 세포주에서 HIF-1α 안정성을 감소시킵니다.
게다가, chrysin은 PI3K/Akt 신호 전달 경로를 통해 HIF-1α의 발현을 조절했습니다[ 137 ].
일반적인 플라본 루테올린은 저산소 조건에서 M2 유사 종양 관련 대식세포(TAM) 내에서 HIF-1 활성화를 억제했습니다[ 138 ].
예를 들어 차, 야채 및 과일에서 얻은 일반적인 플라보놀인 Kaempferol도 항암 효과를 나타냅니다[ 139 ].
Kaempferol은 p44/p42 MAPK 비활성화로 인해 HIF-1이 세포질로 잘못 국소화되어 Huh7 간세포 암종 세포에서 HIF-1 활성에 대한 강력한 억제 효과를 입증했습니다.
이것은 저산소 조건에서 세포 생존력을 감소시킵니다. [ 140].
또한 케르세틴, 바이칼레인, 루테올린 및 피세틴은 HIF-1 전사 활성과 HeLa 세포의 핵 축적을 조절했습니다.
플라보노이드는 부분적으로 HIF-1α의 안정화를 통해 저산소 반응 경로에 영향을 미쳤습니다.
다른 한편으로, 이들 화합물은 동일한 암 세포주에서 HIF-1의 전사 활성을 감소시켰다.
추가 분석은 플라보노이드가 MAPK 경로에 영향을 미치므로 HIF-1α 핵 축적을 손상시키는 것으로 나타났습니다[ 141 ].
위에서 언급한 바와 같이 플라보노이드는 HIF 활성 감소를 통해 강력한 항암 효과를 나타냈습니다.
흥미롭게도 최근의 증거에서는 HIF-1 활성의 유도를 통해서도 플라보노이드의 항암 활성을 시사하고 있습니다.
Quercetin은 정상산소와 저산소 상태에서 HepG2 간암 세포에서 HIF-1α 발현과 HIF-1 활성을 유도하여 증식을 억제했습니다.
추가 분석은 케르세틴 매개 증식 억제가 p21WAF(세포 주기 억제제)의 발현과 관련이 있으며 HIF-1α의 녹다운이 이러한 효과를 손상시키는 것으로 밝혀졌습니다[ 142 ].
유사하게, 케르세틴은 HeLa 세포주에서 킬레이트화를 통해 세포내 철 농도를 감소시켜 HIF-1α를 유도하고 세포 증식을 억제한다[ 143].
또한 케르세틴은 다양한 인간 전립선 선암종 세포주에서 HIF-1α/2α 축적을 유도했습니다.
케르세틴은 HIF-1α/2α PHD 활성에 필요한 철을 킬레이트화하여 HIF-1α/2α 유비퀴틴화를 억제할 수 있었습니다[ 144 ].
표 2 는 플라보노이드가 HIF-1에 미치는 영향을 조사하는 전임상 연구의 개요를 제공합니다.
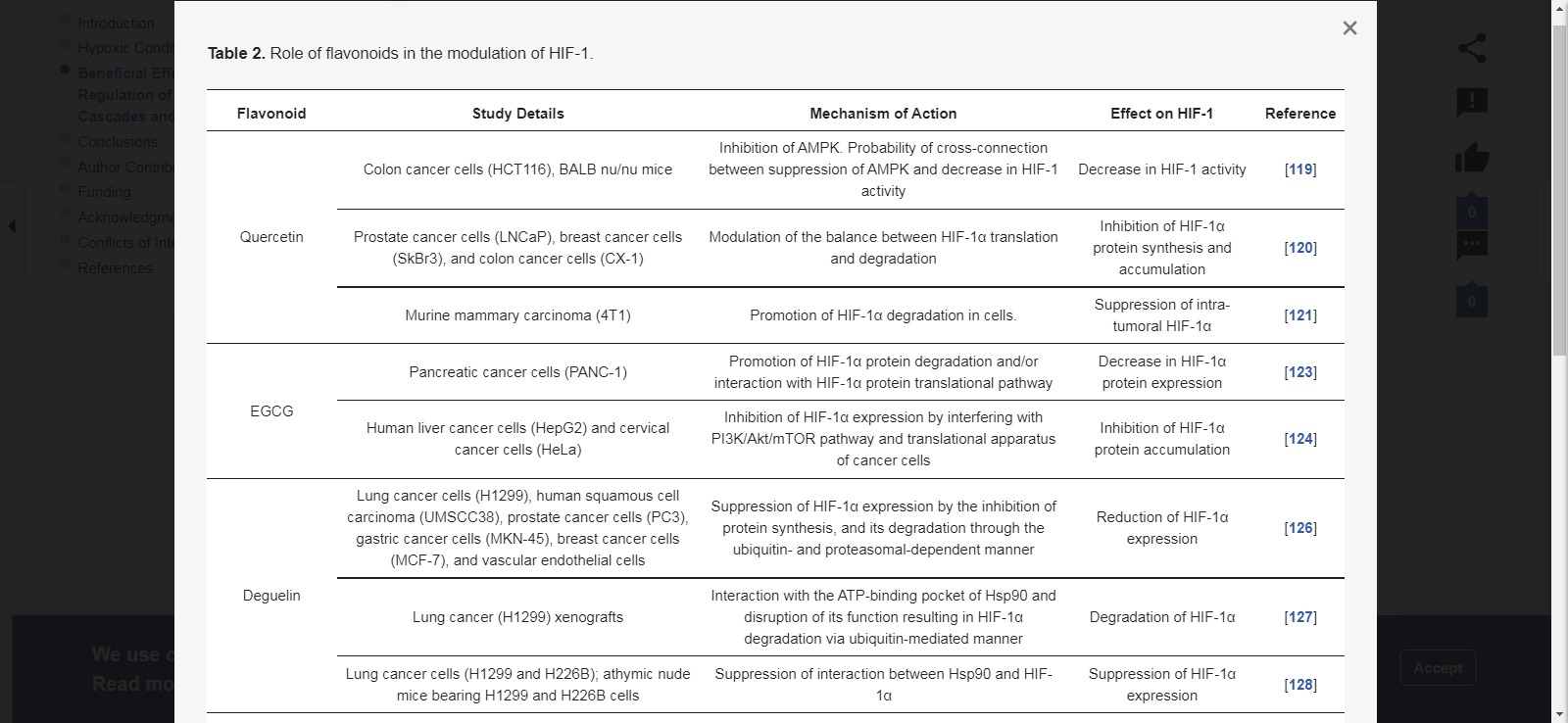
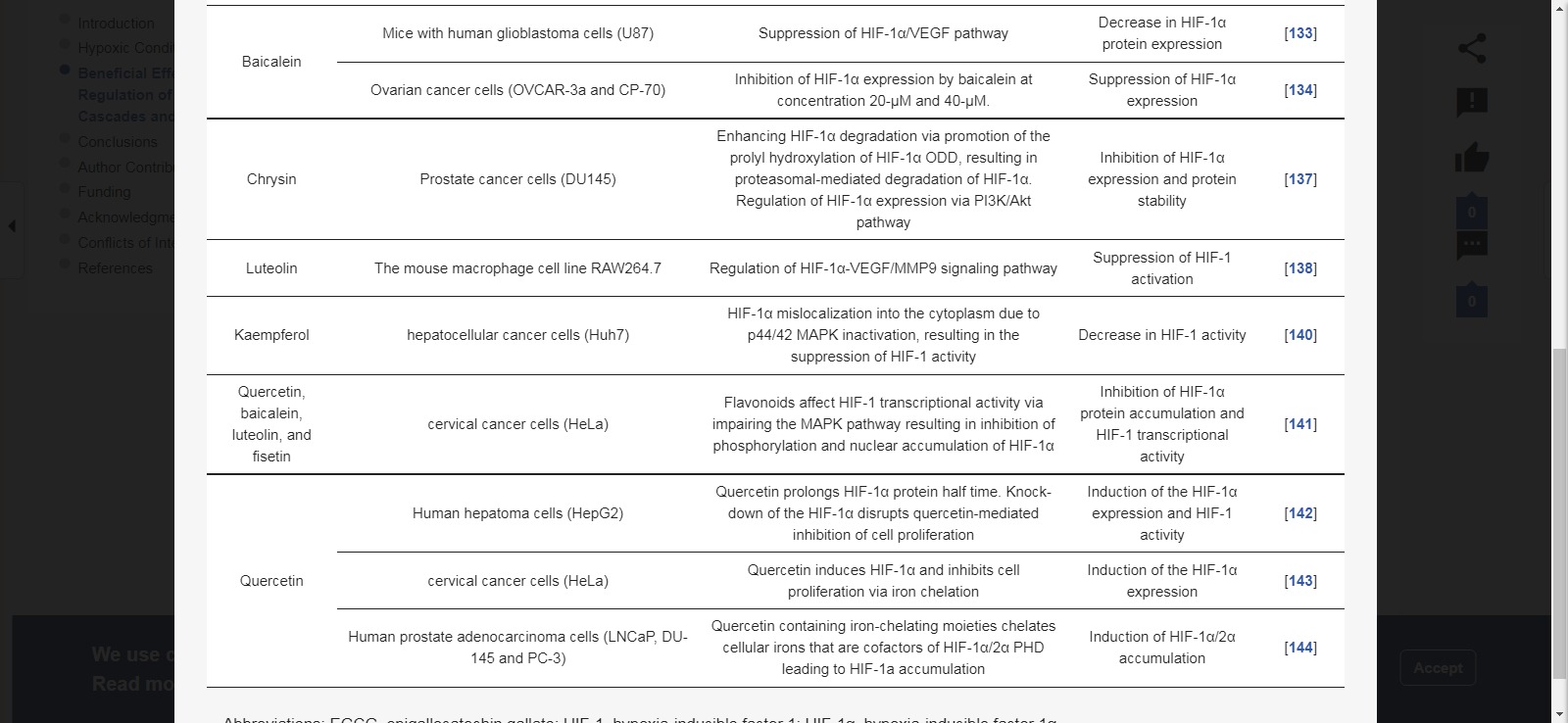
HIF-1 및 포도당 대사를 표적으로 하는 플라보노이드: 저산소증과 바르부르크 효과 사이의 연결
여러 연구에서 HIF-1과 관련된 Warburg 효과를 조절하는 플라보노이드의 역할을 확인했습니다[ 145 ].
이와 관련하여 우리는 HIF-1과 해당 성분 간의 연결을 조절하여 플라보노이드의 항암 효능을 강조합니다.
아피게닌은 수많은 야채와 과일에서 발견되는 플라본입니다[ 146 ].
인간 췌장 세포주(S2-013 및 CD18)에서 입증된 바와 같이, 아피제닌은 정상산소 및 저산소 조건에서 증식 및 혈관신생을 감소시키고 HIF-1α, VEGF 및 GLUT1의 mRNA 및 단백질 발현을 유의하게 억제했습니다
바이칼레인은 신경교종과 난소암 세포에서 HIF-1α 발현에 영향을 미쳤습니다[ 133 , 134 ].
또한, 바이칼레인은 저산소 조건에서 5-플루오로우라실(5-FU)에 대한 위암 세포(AGS)의 민감도를 증가시켰습니다.
또한, 바이칼레인은 Akt 인산화 억제를 통해 HKII, PDK1 및 LDHA를 포함한 해당과정 관련 효소의 발현을 억제하여 HIF-1α 억제를 유도했습니다[ 148 ].
유사하게, 프레닐화 플라바논인 바바키닌은 KB(HeLa 유도체) 및 골육종(HOS) 세포에서 HIF-1α를 표적으로 하여 항종양 효과를 발휘했습니다.
또한, 세포 대사에 대한 억제 효과는 GLUT1 및 HKII를 포함한 유전자의 전사 감소와 관련이 있습니다.
Bavachinin은 또한 생체 내에서 종양 성장을 유의하게 감소시켰습니다[ 149 ].
Spatholobus suberectus Dunn 또는 녹차의 카테킨 유도체인 Epigallocatechin(EGC) 은 HIF-1을 통해 포도당 대사를 조절하여 항암 능력을 나타냈습니다.
EGC는 유방암(MCF-7 및 MDA-MB-231) 세포주에서 LDHA 활성을 감소시켰습니다.
특히, LDHA 억제는 HIF-1α에서 HSP90이 해리되어 HIF-1α 프로테아좀 분해를 초래합니다.
생체 내 분석을 통해 EGC가 종양 성장을 억제하고 LDHA 및 HIF-1α 발현을 억제하며 감지된 부작용 없이 세포자멸사를 유발하는 역할을 확인했습니다[ 150 ].
prenylated isoflavones alpinumisoflavone(ALP)과 4'-O-methylalpinumisoflavone(4'-OM)은 in vitro에서 HIF-1을 표적으로 하여 항암 효과를 보였다.
두 화합물 모두 4T1 유방암 세포에서 HIF-1 활성화를 억제했습니다.
흥미롭게도, 4'-OM은 HIF-1 활성화를 억제하는 동일한 농도에서 GLUT1의 저산소 유도를 억제했습니다.
추가 분석은 HIF-1 억제가 핵 HIF-1α 단백질 유도의 차단을 통해 발생했음을 시사했다[ 151 ].
자몽 및 기타 감귤류의 주요 플라바논인 Naringin은 항산화 및 항암 활성을 비롯한 여러 유익한 특성을 보여줍니다[ 152 , 153 , 154 , 155 ].
Naringin은 농도 의존적으로 A375 흑색종 세포에서 포도당 대사를 억제했습니다.
나린진의 대사 조절 특성은 PKM2, LDHA 및 HIF-1α 발현의 억제로 설명됩니다. 추가 연구에 따르면 naringin은 c-Src 인산화 를 감소시켜 흑색종 세포에서 Warburg 표현형을 억제했습니다 [ 156 ].
바이칼레인( S. baicalensis ) 과 같은 식물에서 분리된 플라본인 Oroxylin A 는 암세포의 해당 작용을 조절합니다.
Oroxylin A는 Sirtuin3 매개 불안정화 및 결과적인 HIF-1α 불안정화를 통해 MDA-MB-231 세포에서 해당 작용 의존적 증식을 억제했습니다.
따라서, HIF-1α 불안정화는 HKII의 발현 감소와 해당과정의 억제를 초래하였다. 생체 내 분석은 oroxylin A 중재 후 해당 작용 억제와 관련된 종양 성장 억제를 감지했습니다 [ 157 ].
Wogonin은 수많은 질병의 치료에 널리 사용되는 S. baicalensis 의 또 다른 성분입니다 . [ 158].
wogonin의 항암 효능은 HCT116 결장암 세포주에서 HKII, PDK1 및 LDHA 발현 감소, 젖산 생성 억제 및 포도당 흡수 감소를 동반했습니다.
더욱이, 단백질 분석은 wogonin이 PI3K/Akt 신호 전달 경로를 억제함으로써 HIF-1α 발현을 감소시킬 수 있음을 보여주었다. 또한,
wogonin은 HIF-1α 발현의 하향 조절, 해당 작용 관련 단백질의 억제 및 생체 내 PI3K/Akt 신호 전달의 억제를 통해 대사 조절 활성을 입증했습니다[ 159 ].
해당 성분과 관련된 HIF-1에 대한 조절 효과를 발휘하는 플라보노이드의 개요는 표 3 에 나와 있습니다.
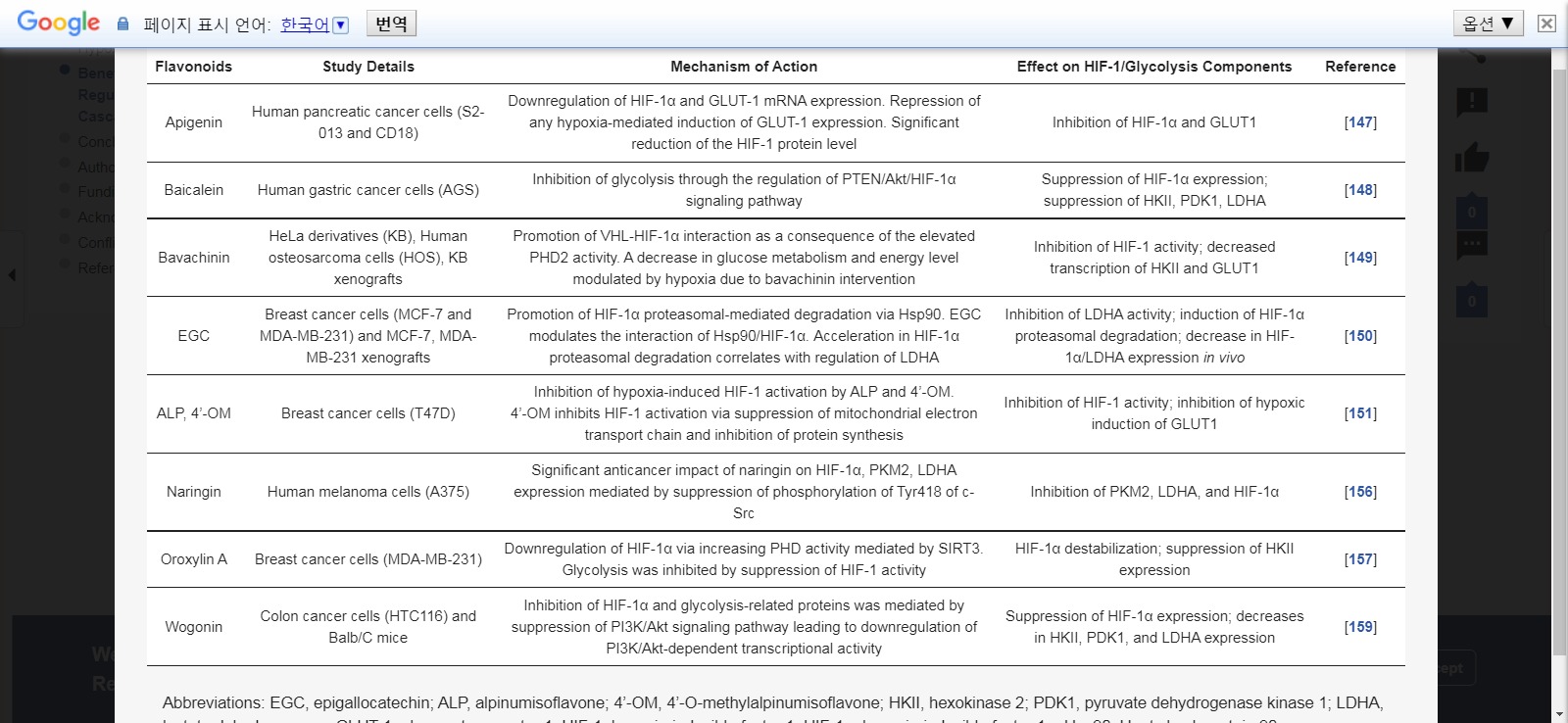
포도당 수송체와 포도당 대사 효소를 통해 매개되는 플라보노이드의 항암 효과
HK, PK, LDHA, PFK 및 PDK를 포함한 포도당 수송체(GLUT) 및 포도당 대사 효소는 HRE의 존재로 인해 HIF-1에 의해 조절됩니다.
HIF-1은 이러한 효소의 발현 개시에 필수적인 역할을 합니다.
따라서 저산소증-해당작용-암 캐스케이드와 관련된 신호전달 경로의 조절에서 플라보노이드의 역할을 정의하는 것이 적절합니다
아래에서 논의되는 바와 같이, 포도당 대사 및 포도당 수송체의 효소를 조절하는 플라보노이드의 능력은 HIF-1을 조절하는 항암제로서의 플라보노이드의 중요성을 강조합니다.
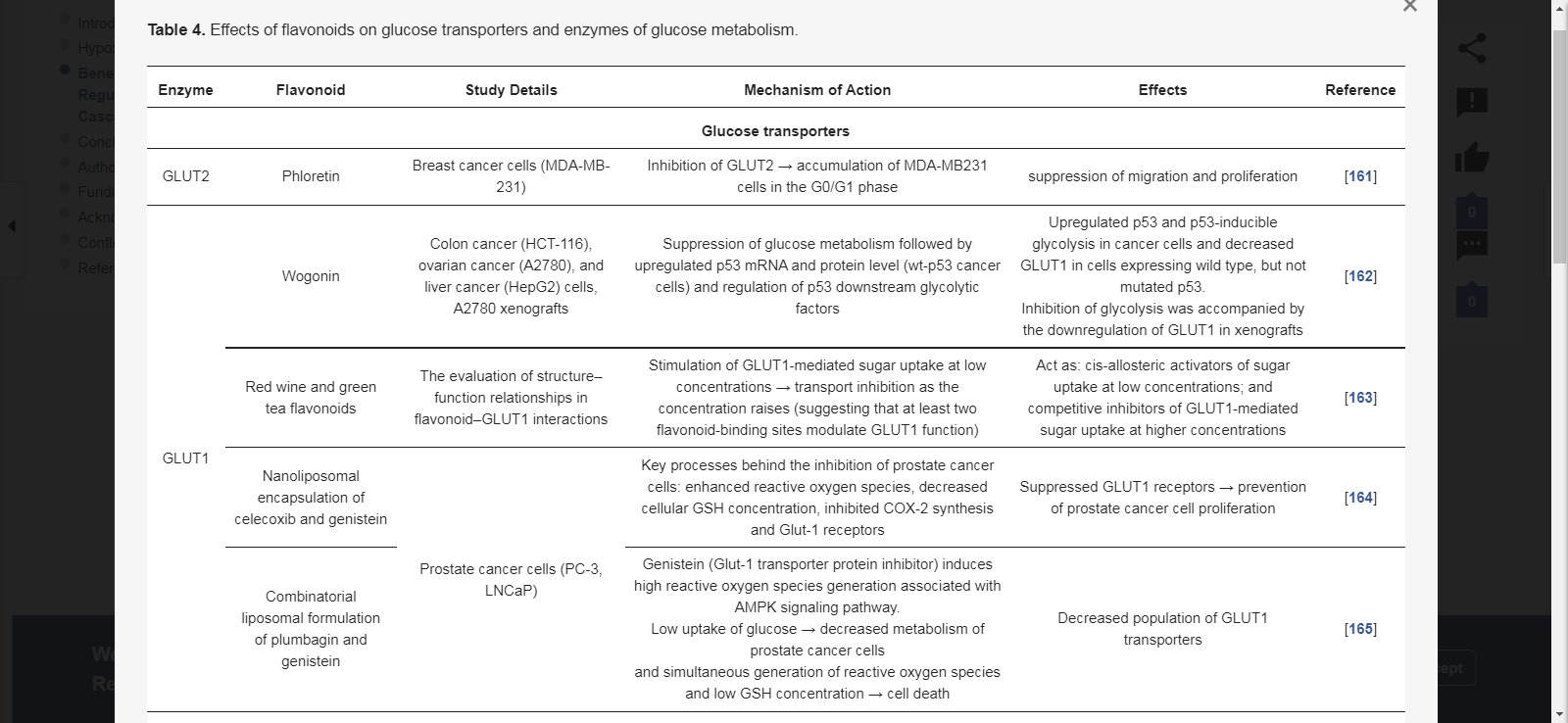
포도당 수송체(GLUT)
사과 잎에서 분리된 디하이드로칼콘 플로레틴은 2형 포도당 수송체(GLUT2)의 신호를 억제하여 MDA-MB-231 유방암 세포의 이동과 증식을 억제했습니다[ 161 ].
Wogonin은 결장암(HCT-116), 난소암(A2780), 간암(HepG2) 세포에서 p53 및 p53-유도성 해당과정을 상향조절하는 것으로 밝혀졌으며 돌연변이는 없지만 야생형을 발현하는 암세포에서는 포도당 수송체 1(GLUT1)을 하향조절하는 것으로 나타났습니다. p53.
Wogonin은 또한 GLUT1의 하향 조절을 동반한 A2780 이종이식편에서 해당과정을 억제했습니다[ 162].
적포도주와 녹차 플라보노이드는 낮은 농도에서 설탕 흡수의 시스-알로스테릭 활성제로 작용하고 높은 농도에서 GLUT1 매개 설탕 흡수의 경쟁적 억제제로 작용하여 가능한 항암 효과를 설명합니다.
셀레콕시브와 제니스테인의 나노리포솜 캡슐화는 GLUT1 수용체를 억제했습니다.
이러한 효과는 전립선암 세포(PC-3, LNCaP) 증식을 감소시켰습니다[ 164 ].
유사하게, 플럼바긴과 제니스테인의 조합 리포솜 제형은 동일한 유형의 전립선암 세포에서 GLUT1 수송체의 개체수를 감소시켰습니다[ 165 ].
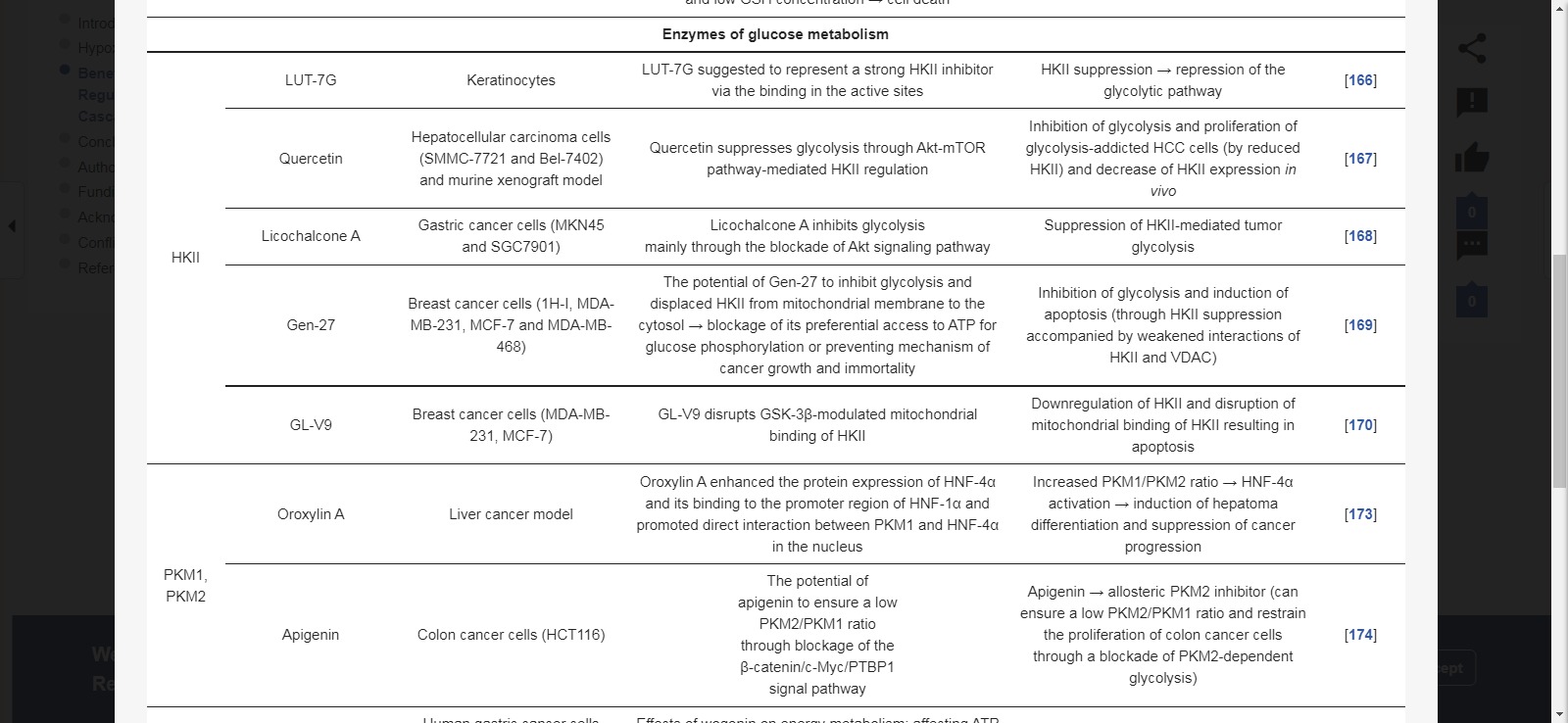
헥소키나제 II
GLUT 외에도 플라보노이드는 HK를 포함한 다양한 효소 시스템에도 영향을 미칩니다.
HKII 억제제인 루테올린-7- O -β-D-글루코시드(LUT-7G)는 HKII를 억제하여 각질세포의 해당 경로를 억제합니다[ 166 ].
케르세틴은 HKII를 하향 조절함으로써 해당 작용 의존성 간세포 암종(SMMC-7721 및 Bel-7402) 세포의 해당 작용 및 증식을 억제했습니다. 또한 생체 내에서 HKII 발현을 감소시키고 간세포 암종 이종이식편의 성장을 억제했습니다[ 167 ].
감초에서 추출한 찰콘 A는 위암(MKN45 및 SGC7901) 세포에서 Akt를 하향 조절하여 HKII 매개 종양 해당작용을 억제했습니다. [ 168].
또한 Tao et al. 합성 플라보노이드 Gen-27은 HKII를 억제하여 결과적으로 HKII와 전압 사이의 상호 작용을 약화시킴으로써 유방암(1H-I, MDA-MB-231, MCF-7 및 MDA-MB-468) 세포의 해당 작용을 억제하고 세포자멸사를 유도한다는 것을 입증했습니다. -의존 음이온 채널(VDAC) [ 169 ].
유사하게, 새로 확인된 플라보노이드 GL-V9는 HKII를 하향 조절하고 미토콘드리아 VDAC에서 분리하여 유방암(MDA-MB-231, MCF-7) 세포의 미토콘드리아 매개 세포자멸사를 유도합니다[ 170 ].
피루브산 키나제
해당과정에서 가장 중요한 조절점 효소로 여겨지는 PKM2(pyruvate kinase isoenzyme M2)를 표적으로 하는 것은 중요한 항암 전략이다[ 171 ].
PKM2는 다양한 암 유형에서 과발현되고[ 171 ], 그 발현은 HIF-1α[ 172 ]에 의해 조절됩니다 .
Wei et al. 간암에서 pyruvate kinase isoenzyme M1(PKM1)의 낮은 발현과 PKM2의 높은 발현을 입증했습니다.
따라서 PKM1/PKM2 비율의 증가와 간세포 핵인자 4 알파(HNF-4α)의 활성화를 통해 간암 분화를 유도하고 oroxylin A를 사용하여 암 진행을 억제하는 것은 간암에서 치료적으로 관련이 있을 수 있습니다[ 173].
또한 아피제닌은 낮은 PKM2/PKM1 비율을 보장하고 PKM2 의존적 해당과정의 차단을 통해 결장암(HCT116) 세포의 증식을 억제하는 능력으로 인해 PKM2의 알로스테릭 억제제로 제안되었다[ 174 ].
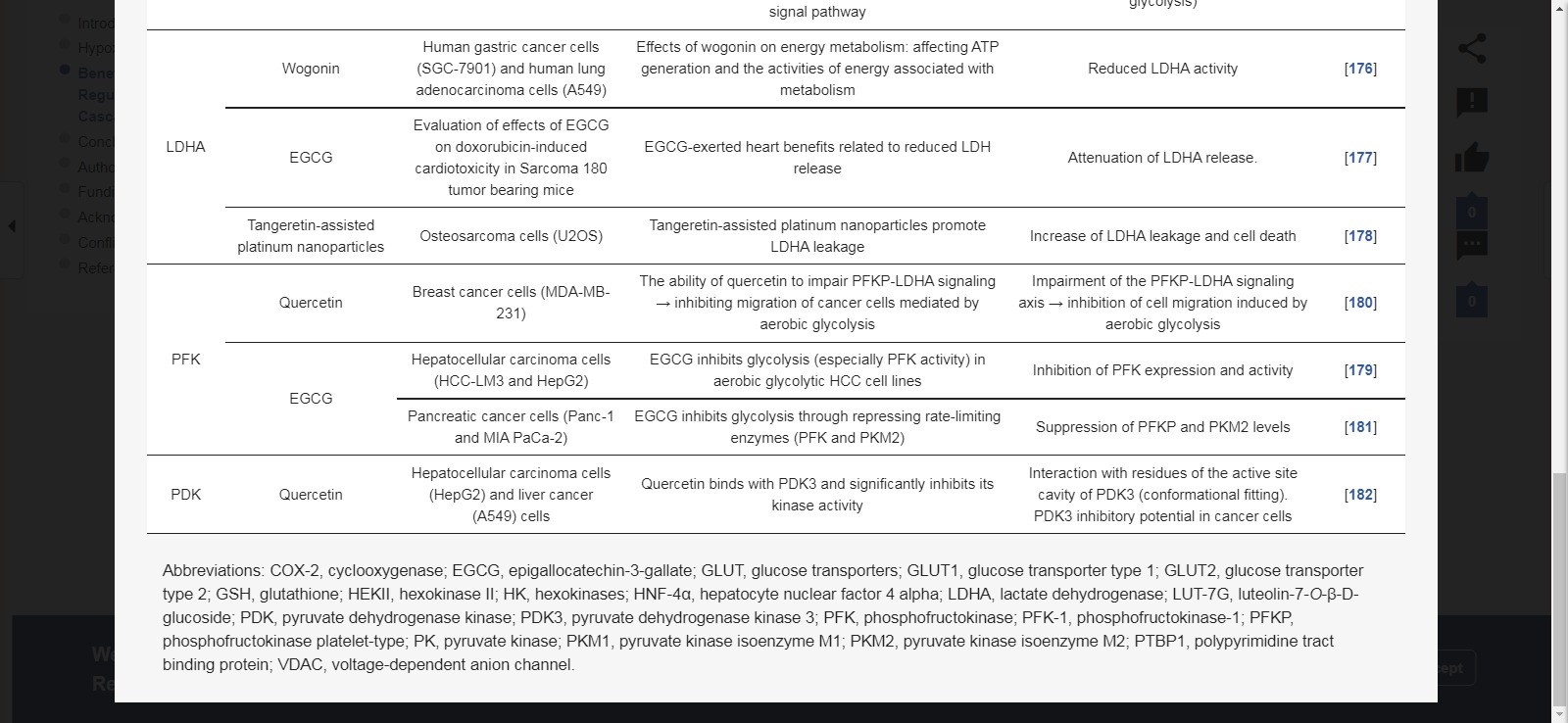
젖산 탈수소효소
여러 암에서 lactate dehydrogenase(LDHA)의 증가된 발현은 피루브산이 젖산으로 전환되는 해당과정의 촉진과 관련이 있습니다[ 175 ].
플라보노이드는 다양한 암 모델에서 LDHA를 조절합니다.
Wogonin 치료는 인간 위암(SGC-7901) 및 인간 폐 선암(A549) 세포에서 LDHA 활성을 억제했습니다[ 176 ].
EGCG는 Sarcoma 180 종양 보유 마우스에서 LDHA 방출을 약화시켰다[ 177 ]. 더욱이,
탄게레틴 보조 백금 나노입자와 독소루비신의 상승적 평가는 골육종(U2OS) 세포에서 LDHA 누출을 증가시키는 나노입자의 능력을 밝혀냈습니다[ 178 ].
포스포프룩토키나제-1
phosphofructokinase-1(PFK-1)의 동형은 해당작용의 심박조율기로 간주됩니다.
따라서 추가 에너지 방출을 통해 발암을 지원하기 위해 다양한 암 유형에서 높게 발현됩니다PFKP(Phosphofructokinase platelet-type) 단백질 발현은 결절 확장, 에스트로겐 수용체 및 프로게스테론 수용체 음성, 유방암 환자의 전반적인 생존 감소와 긍정적인 관련이 있었습니다.
그럼에도 불구하고 케르세틴은 PFKP-LDHA 신호축을 손상시켜 호기성 해당작용에 의해 유도된 유방암(MDA-MB-231) 세포의 이동을 억제하였다[ 180 ].
또한 EGCG는 간세포 암종(HCC-LM3 및 HepG2) 세포에서 PFK의 발현과 활성을 억제했습니다[ 179]. 유사하게, EGCG는 젬시타빈의 효과를 강화하고 췌장암(Panc-1, MIA PaCa-2) 세포에서 PFK 및 PK 수준을 더욱 억제했습니다[ 181 ].
피루브산 탈수소효소 키나제
대사성 암 전환에서 피루브산 탈수소효소 키나제 3(PDK3)의 잠재적 중요성은 암 치료 표적으로서의 역할에 대한 아이디어를 뒷받침합니다.
PDK3의 과발현은 암 진행과 상관관계가 있습니다.
그러나 퀘르세틴은 PDK3의 활성 부위 공동의 중요한 잔기와 상호 작용하여 구조적 적합성을 발휘합니다. 또한 케르세틴은 간세포암(HepG2)과 폐암(A549) 세포에서 PDK3를 억제했습니다[ 182 ].
실제로, 플라보노이드는 광범위한 생물학적 효과를 발휘합니다.
논의된 전임상 연구 결과( 표 4 ) 에 기초하여 , 우리는 종양 세포에서 HIF-1 조절 포도당 수송체 및 포도당 대사 효소를 조절함으로써 플라보노이드의 필수 항암 능력을 강조할 수 있습니다. 그림 4 는 HIF-1의 조절과 해당 작용의 중요한 구성 요소를 통해 Warburg 표현형의 억제자로 사용되는 플라보노이드의 개요를 보여줍니다.
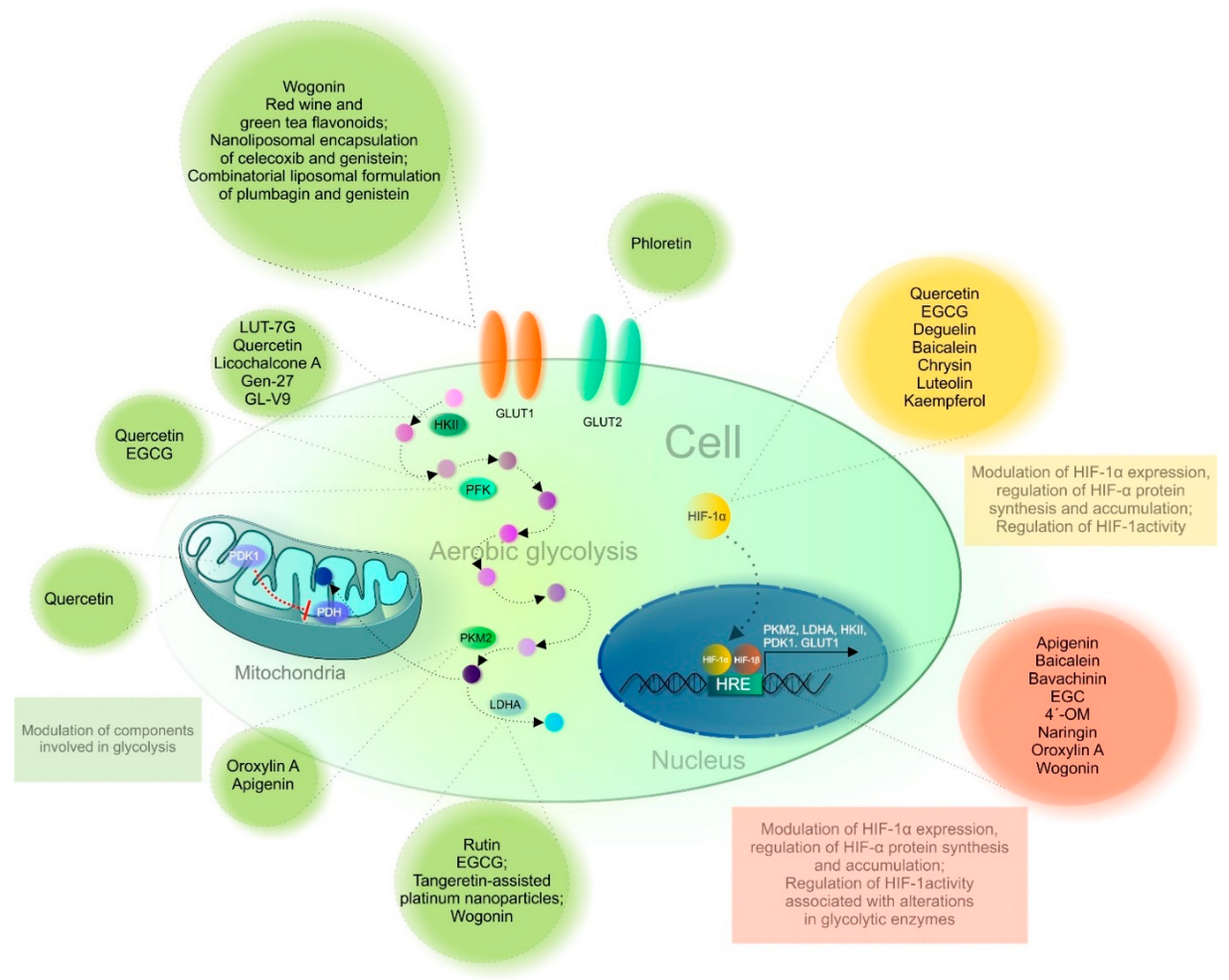
그림 4. HIF-1 및 해당 작용의 중요한 구성 요소를 표적으로 하는 플라보노이드.
약어: EGCG, 에피갈로카테킨-3-갈레이트; EGC, 에피갈로카테킨; 4'-OM, 4'-O 메틸알피누미소플라본; LUT-7G, 루테올린-7- O -β-D-글루코시드; HK 2 , 헥소키나제 2 ; PFK , 포스포프룩토키나제; PKM 2, 피루베이트 키나제 근육 동형 2 ; LDHA , 젖산 탈수소효소 A ; PDH, 피루베이트 탈수소효소; PDK1, 피루베이트 탈수소효소 키나제 1; HRE, 저산소 반응 요소; HIF-1α/1β, 저산소증 유발 인자 1α/1β; GLUT1/2, 포도당 수송체 1/2.
결론
HIF-1은 암세포 대사를 재프로그래밍하는 데 중요한 역할을 하는 선수 중 하나입니다.
그 효과에는 포도당 수송체, 해당 효소 및 피루브산 탈수소효소 키나제 1을 암호화하는 유전자의 발현 조절; 이 메커니즘에 의해 HIF-1은 Warburg 효과를 직접 유발할 수 있습니다.
HIF-1α 및 저산소증 관련 이펙터 분자를 표적으로 하는 것은 포도당 대사 과정을 약화시키거나 VEGF 유도 혈관신생 및 생존 촉진 신호 전달 경로를 억제함으로써 암 세포 생존을 손상시킬 수 있습니다.
전임상 연구는 플라보노이드가 종양 저산소증으로 유발된 해당 과정을 억제하고 결과적으로 세포 대사를 억제하고/하거나 방사선 및 화학 요법에 대한 암세포의 감수성을 증가시킬 수 있음을 보여주었습니다.
또한, 포도당 대사 및 세포 에너지 생산에 대한 플라보노이드의 효과는 암세포에서 세포자멸사 유도, 전이 억제 및 세포 생존율 감소에 대한 광범위한 의미에 기여합니다.
암 세포에서 변경된 유전자 발현과 대사 사이의 새로운 상호 작용은 플라보노이드에 설명된 많은 종양 억제 효과가 암세포 대사의 조절 완화를 방지한다는 것을 시사하며 과학 데이터베이스에서 증가하는 증거가 이 가설을 확인시켜줍니다.
현재 암 환자에서 HIF-1과 플라보노이드의 상관 관계에 초점을 맞춘 임상 연구는 없지만 전임상 데이터는 플라보노이드가 암 관리에 유용할 수 있음을 나타냅니다.
그러나 자연적으로 발생하는 페놀의 생체이용률 및 안전성과 관련된 몇 가지 합병증으로 인해 임상 영역에서의 적용이 제한됩니다.
대부분의 플라보노이드는 안전하지만 궁극적인 부작용은 과량 섭취로 인해 용혈성 빈혈이나 가벼운 위장 증상을 유발합니다.
더욱이, 장, 결장, 간에서 플라보노이드의 과도한 대사와 장내 미생물총의 참여 또한 생체 이용률과 적용 가능성을 제한합니다.
플라보노이드 생체이용률과 안전성에 대한 보다 심층적인 조사만이 플라보노이드의 생물학적 활성을 개선하고 부작용을 제거할 수 있습니다.
위에서 언급한 합병증에도 불구하고, 암 세포 대사의 조절자로 추정되는 플라보노이드는 화학 예방 및 치료 환경 모두에서 임상적으로 실행 가능한 화학 보조제를 나타낼 수 있습니다. 그러나 더 포괄적이고 통제된 조사가 필요합니다
'전사인자' 카테고리의 다른 글
| HIF-1 α 경로: 암 치료를 위한 역할, 조절 및 개입 (0) | 2021.10.20 |
|---|---|
| 암 치료용 HIF-1 억제제 개발 (0) | 2021.10.20 |
| 분자 신호 전달에 대한 폴리페놀 및 기타 파이토케미칼의 역할 (0) | 2021.10.20 |
| 암에서 NRF2의 이중 역할 (0) | 2021.10.15 |
| 암 치료를 위한 Nrf2의 약리학적 조절에 대한 논란 (0) | 2021.10.15 |