TARGETING HIF-1 FOR CANCER THERAPY
HIF-1α의 경우 합성은 O2-독립적 기전을 통해 조절되는 반면(도 1), 분해는 주로 O2-의존적 기전을 통해 조절되며(도 2), 아래에서 설명합니다.
Summary
.저산소증 유발성
인자 1(HIF-1)은 두 개의 단백질로 구성된 이종이량체 단백질입니다. HIF-1α 및 HIF-1β.HIF-1은 혈관신생, 포도당 대사, 세포 증식/생존 및 침습/전이에 관여하는 단백질을 암호화하는 많은 유전자의 전사를 활성화합니다.
.HIF-1α
단백질 합성은 포스파티딜이노시톨 3-키나아제(PI3K) 및 ERK 미토겐 활성화 단백질 키나아제(MAPK) 경로의 활성화에 의해 조절됩니다. 이러한 경로는 수용체 티로신 키나제, 비수용체 티로신 키나제 또는 G-단백질 결합 수용체를 통한 신호 전달에 의해 활성화될 수 있습니다.
.HIF-1α
단백질 분해는 E3 유비퀴틴-단백질 리가아제에 의한 유비퀴틸화를 위한 단백질을 표적으로 하는 O2 의존성 프롤릴 하이드록실화에 의해 조절됩니다. 이 리가아제에는 하이드록실화된 HIF-1α에 특이적으로 결합하는 von Hippel.Lindau 종양 억제 단백질(VHL)이 포함되어 있습니다. Ubiquitylated HIF-1α는 프로테아좀에 의해 빠르게 분해됩니다.
.HIF-1α
종양 유전자의 기능 획득 돌연변이(예: ERBB2) 및 종양 억제 유전자의 기능 상실 돌연변이(예: VHL 및 PTEN). HIF-1α 과발현은 치료 실패 및 사망률 증가와 관련이 있습니다.
.In
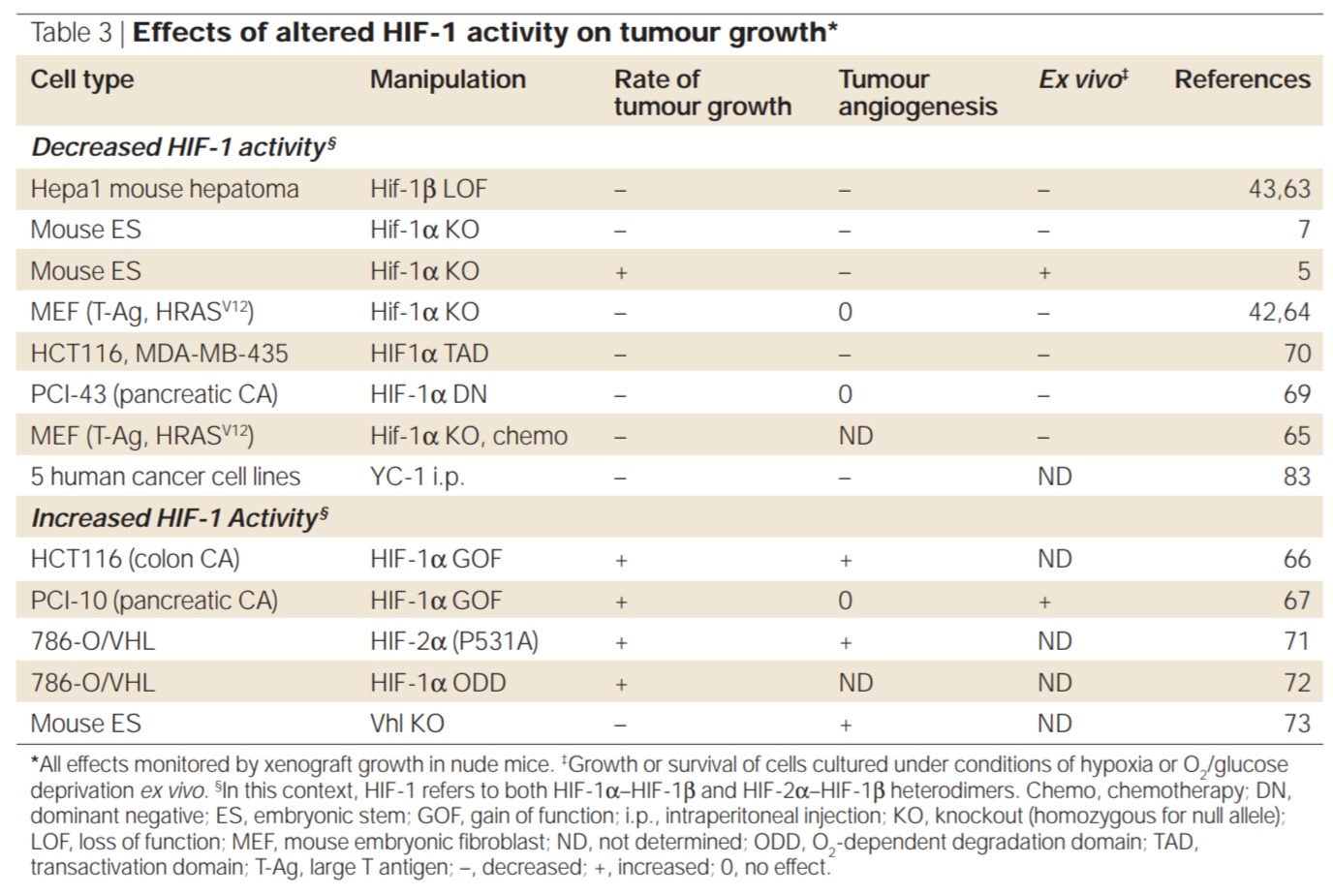
이종이식 분석, 유전적 또는 약리학적 수단에 의한 HIF-1 활성의 조작은 혈관신생, 포도당 대사 및/또는 세포 생존에 대한 영향으로 인해 종양 성장에 현저한 영향을 미쳤습니다.
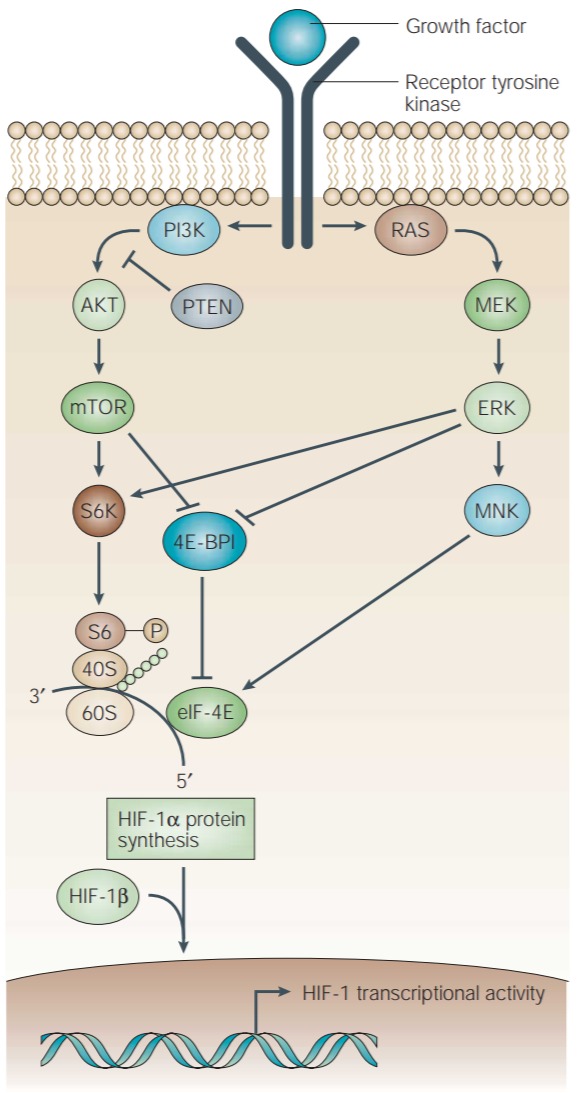
Figure 1 | Regulation of HIF-1α protein synthesis.
Growth-factor binding to a cognate receptor tyrosine kinase activates the phosphatidylinositol 3-kinase (PI3K) and mitogen-activated protein kinase (MAPK) pathways. PI3K activates the downstream serine/threonine kinases AKT (also known as protein kinase B (PKB)) and mammalian target of rapamycin (mTOR). In the MAPK pathway, the extracellularsignal-regulated kinase (ERK) is activated by the upstream MAP/ERK kinase (MEK). ERK, in turn, activates MNK. ERK and mTOR phosphorylate p70 S6 kinase (S6K) — which, in turn, phosphorylates the ribosomal S6 protein — and the eukaryotic translation initiation factor 4E (eIF-4E) binding protein (4E-BP1). Binding of 4E-BP1 to eIF-4E inactivates the latter, inhibiting cap-dependent mRNA translation. Phosphorylation of 4E-BP1 prevents its binding to eIF-4E. MNK phosphorylates eIF-4E and stimulates its activity directly. The effect of growth-factor signalling is an increase in the rate at which a subset of mRNAs within the cell (including HIF-1α mRNA) are translated into protein.
(동족 수용체 티로신 키나아제에 대한 성장 인자 결합은 포스파티딜이노시톨 3-키나아제(PI3K) 및 미토겐 활성화 단백질 키나아제(MAPK) 경로를 활성화합니다.
PI3K는 다운스트림 세린/트레오닌 키나제 AKT(단백질 키나제 B(PKB)라고도 함) 및 라파마이신의 포유동물 표적(mTOR)을 활성화합니다.
MAPK 경로에서 세포외 신호 조절 키나제(ERK)는 업스트림 MAP/ERK 키나제(MEK)에 의해 활성화됩니다. ERK는 차례로 MNK를 활성화합니다.
ERK 및 mTOR는 p70 S6 키나제(S6K)를 인산화하여 리보솜 S6 단백질을 인산화하고 진핵생물 번역 개시 인자 4E(eIF-4E) 결합 단백질(4E-BP1)을 인산화합니다.
eIF-4E에 대한 4E-BP1의 결합은 후자를 비활성화하여 cap-dependent mRNA 번역을 억제합니다.
4E-BP1의 인산화는 eIF-4E에 대한 결합을 방지합니다.
MNK는 eIF-4E를 인산화하고 그 활성을 직접 자극합니다.
성장 인자 신호 전달의 효과는 세포 내 mRNA의 하위 집합(HIF-1α mRNA 포함)이 단백질로 번역되는 속도의 증가입니다.)
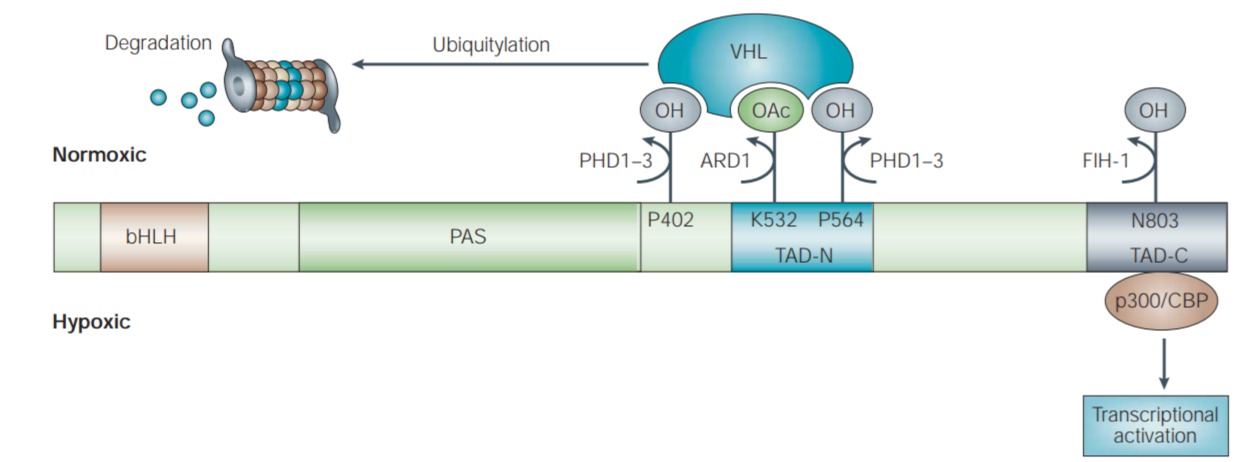
Figure 2 | O2-dependent regulation of HIF-1 activity.
O2 regulates the rate at which HIF-1α protein is degraded. In normoxic conditions, O2- dependent hydroxylation of proline (P) residues 402 and 564 in HIF-1α by the enzymes PHD (prolyl hydroxylase-domain protein) 1–3 is required for the binding of the von Hippel–Lindau (VHL) tumour-suppressor protein, which is the recognition component of an E3 ubiquitin-protein ligase. VHL binding is also promoted by acetylation of lysine (K) residue 532 by the ARD1 acetyltransferase. Ubiquitylation of HIF-1α targets the protein for degradation by the 26S proteasome. O2 also regulates the interaction of HIF-1α with transcriptional co-activators. O2-dependent hydroxylation of asparagine (N) residue 803 in HIF-1α by the enzyme FIH-1 (factor inhibiting HIF-1) blocks the binding of p300 and CBP to HIF-1α and therefore inhibits HIF-1-mediated gene transcription. Under hypoxic conditions, the rate of asparagine and proline hydroxylation decreases. VHL cannot bind to HIF-1α that is not prolyl-hydroxylated, resulting in a decreased rate of HIF-1α degradation. By contrast, p300 and CBP can bind to HIF-1α that is not asparaginyl-hydroxylated, allowing transcriptional activation of HIF-1 target genes. bHLH, basic helix–loop–helix; PAS, Per-Arnt-Sim; TAD-C, carboxy-terminal transactivation domain; TAD-N, amino-terminal transactivation domain.
(O2는 HIF-1α 단백질이 분해되는 속도를 조절합니다.
정상산소 조건에서, *영문확인*.
VHL 결합은 또한 ARD1 아세틸트랜스퍼라제에 의한 라이신(K) 잔기 532의 아세틸화에 의해 촉진됩니다. HIF-1α의 편재화는 26S 프로테아좀에 의한 분해를 위한 단백질을 표적으로 합니다.
O2는 또한 전사 보조 활성화제와 HIF-1α의 상호작용을 조절합니다.
효소 FIH-1(HIF-1을 억제하는 인자)에 의한 HIF-1α의 아스파라긴(N) 잔기 803의 O2 의존성 하이드록실화는 p300과 CBP가 HIF-1α에 결합하는 것을 차단하고 따라서 HIF-1 매개 유전자 전사를 억제합니다.
저산소 상태에서 아스파라긴과 프롤린의 수산화 속도는 감소합니다.
VHL은 프롤릴-하이드록실화되지 않은 HIF-1α에 결합할 수 없으므로 HIF-1α 분해 속도가 감소합니다.
대조적으로, p300과 CBP는 아스파라기닐-히드록실화되지 않은 HIF-1α에 결합하여 HIF-1 표적 유전자의 전사 활성화를 허용합니다.
bHLH, 기본 나선-루프-나선; PAS, Per-Arnt-Sim; TAD-C, 카르복시-말단 전사활성화 도메인; TAD-N, 아미노 말단 전사활성화 도메인.)

Figure 3 | Genes that are transcriptionally activated by HIF-1.
Genes that are involved in many processes are transcriptionally activated by HIF-1

Figure 4 | Mechanisms and consequences of HIF-1 activity in cancer cells.
Immunohistochemical analysis of HIF-1α levels in two separate oropharyngeal cancers. The biopsy section on the left shows HIF-1α protein (brown staining) in viable cancer cells surrounding areas of necrosis (indicated by asterisks). The cancer cells that express the highest levels of HIF-1α are at the greatest distance from a blood vessel (indicated by arrows) and are therefore the most hypoxic. In the biopsy section on the right, there are no areas of necrosis and HIF-1α is detected in cancer cells throughout the field, including cells that are immediately adjacent to a blood vessel (arrows), indicating that increased HIF-1α levels are being driven by an O2-independent mechanism, such as through genetic alteration. These two mechanisms are not mutually exclusive — genetic alterations can amplify the response to hypoxia. In either case, increased HIF-1 activity leads to upregulation of genes that are involved in many aspects of cancer progression, including metabolic adaptation, apoptosis resistance, angiogenesis and metastasis.
(두 개의 개별 구강인두암에서 HIF-1α 수준의 면역조직화학 분석. 왼쪽의 생검 섹션은 괴사 영역(별표로 표시) 주변의 생존 가능한 암세포에서 HIF-1α 단백질(갈색 염색)을 보여줍니다. 가장 높은 수준의 HIF-1α를 발현하는 암세포는 혈관에서 가장 멀리 떨어져 있으므로(화살표로 표시), 따라서 가장 저산소 상태입니다. 우측의 생검 부분에서 괴사 부위가 없고 혈관에 바로 인접한 세포(화살표)를 포함하여 필드 전체의 암세포에서 HIF-1α가 검출되어 HIF-1α 수치가 증가하고 있음을 나타냅니다. 유전자 변형과 같은 O2-독립적 메커니즘에 의해 구동됩니다. 이 두 메커니즘은 상호 배타적이지 않습니다. 유전적 변화는 저산소증에 대한 반응을 증폭시킬 수 있습니다. 두 경우 모두, 증가된 HIF-1 활성은 대사 적응, 세포자멸사 저항성, 혈관신생 및 전이를 포함하여 암 진행의 많은 측면에 관여하는 유전자의 상향조절을 유도합니다.)

Figure 5 | HIF-1 target genes that encode invasion factors.
Invasion of the basement membrane is the defining characteristic of epithelial cancers. a | Epithelial cells are normally constrained by cell–cell contacts and by the basement membrane. b | Cancer cells produce proteases, including the urokinase-type plasminogen-activator receptor (uPAR) and matrix metalloproteinase-2 (MMP2), which digest the basement membrane/extracellular matrix (ECM). c | Degraded ECM is replaced by fibronectin and other ECM proteins that are recognized by integrins that are expressed on cancer cells. d | An epithelial-to-mesenchymal transformation occurs in which intermediate-filament production is switched from keratin subtypes, which are characteristic of fixed epithelial cells, to keratins and vimentin, which promote the fluid structure that is required for motility and which is also stimulated by expression of secreted factors such as autocrine motility factor (AMF) and transforming growth factor-α (TGF-α), and surface receptors such as the c-MET tyrosine kinase. HIF-1 target genes that regulate invasion are listed.
(기저막의 침윤은 상피암의 특징적인 특징입니다.
a| 상피 세포는 일반적으로 세포-세포 접촉과 기저막에 의해 제한됩니다.
b| 암세포는 기저막/세포외 기질(ECM)을 소화하는 유로키나제형 플라스미노겐 활성화 수용체(uPAR) 및 기질 메탈로프로테이나제-2(MMP2)를 포함한 프로테아제를 생성합니다.
c | 분해된 ECM은 암세포에서 발현되는 인테그린에 의해 인식되는 피브로넥틴 및 기타 ECM 단백질로 대체됩니다.
d | 상피에서 중간엽으로의 변형은 중간 필라멘트 생산이 고정 상피 세포의 특징인 케라틴 아형에서 운동성에 필요하고 발현에 의해 자극되는 유체 구조를 촉진하는 케라틴 및 비멘틴으로 전환되는 것입니다.
자가분비 운동 인자(AMF) 및 변형 성장 인자-α(TGF-α)와 같은 분비 인자 및 c-MET 티로신 키나제와 같은 표면 수용체. 침입을 조절하는 HIF-1 표적 유전자가 나열됩니다.
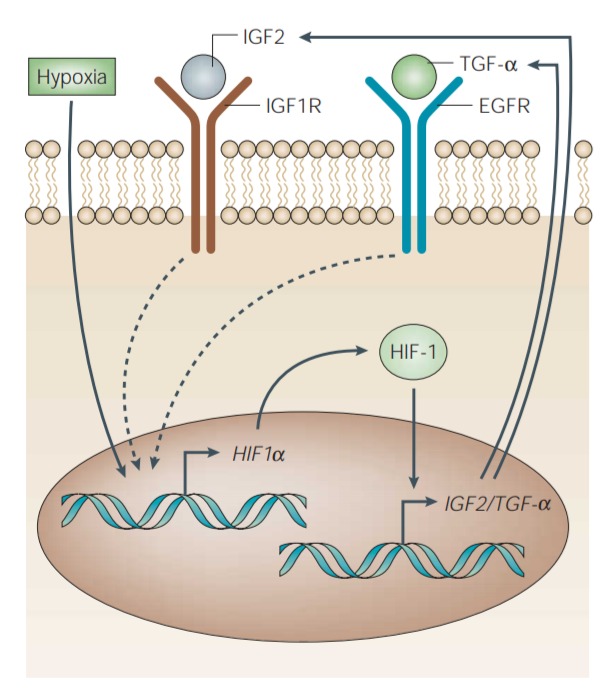
Figure 6 | Involvement of HIF-1 in autocrine growth-factor stimulation of cancer cells.
Binding of growth factors such as insulin-like growth factor-2 (IGF2) and transforming growth factor-α (TGF-α) to their cognate receptors — the IGF1 receptor (IGF1R) and the epidermal growth-factor receptor (EGFR), respectively — stimulates the expression of HIF-1α. This leads to increased HIF-1 transcriptional activity of target genes, which include those that encode IGF2 and TGF-α. Alternatively, hypoxia can activate HIF-1, via increased expression of HIF-1α, and initiate autocrine signalling.
(인슐린 유사 성장 인자-2(IGF2) 및 변형 성장 인자-α(TGF-α)와 같은 성장 인자가 동족 수용체--the IGF1 receptor (IGF1R) and the epidermal growth-factor receptor (EGFR), respectively--에 결합하면 HIF-1α의 발현이 자극됩니다.
이는 IGF2 및 TGF-α를 코딩하는 유전자를 포함하는 표적 유전자의 HIF-1 전사 활성을 증가시킨다.
또는 저산소증은 HIF-1α의 발현 증가를 통해 HIF-1을 활성화하고 자가분비 신호를 시작할 수 있습니다.)

*Increased signalling could be due to genetic alteration in a component of the pathway or an upstream activator.
For example,
AKT gain-of-function mutation or PTEN loss-of-function mutation induces PI3K–AKT–mTOR signalling; EGFR amplification or TGF-α overexpression induces EGFR (and PI3K–AKT–mTOR and MEK–ERK) signalling.

***************************************************************************************************************************
'전사인자' 카테고리의 다른 글
| Nrf2: 양날의 검 (0) | 2021.10.20 |
|---|---|
| HIF-1a를 표적으로 하는 최근 약제 -2012년 (0) | 2021.10.20 |
| HIF-1 및 HIF-2 및 이들의 신규 억제제 (0) | 2021.10.20 |
| HIF경로 표적화 (0) | 2021.10.20 |
| HIF-1 α 경로: 암 치료를 위한 역할, 조절 및 개입 (0) | 2021.10.20 |