https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6559821/
The Transcriptional Factors HIF-1 and HIF-2 and Their Novel Inhibitors in Cancer Therapy
2019
소개:
저산소증은 고형 종양의 본질적인 특징 중 하나이며 방사선 및 화학 요법에 대한 내성, 전이 및 불량한 환자 예후를 포함하여 항상 공격적인 표현형과 관련이 있습니다.
저산소증은 전사 인자 계열의 활성화를 통해 이러한 불리한 효과를 나타냅니다.
저산소증 유도 인자(HIF)는 여러 pro-oncogenic 유전자의 전사를 상향 조절함으로써 종양 세포가 저산소 상태 및 영양 결핍 조건에 적응하는 데 중추적인 역할을 합니다.
여러 진행성 인간 암은 최종 공통 경로로 HIF 활성화를 공유합니다.
전문가의 의견:
현재의 화학요법 요법에 HIF-1/2 억제제를 포함하는 것은 보고된 수많은 전임상 연구에서 유리한 것으로 입증되었습니다.
병용 요법은 이상적으로는 특정 암과 관련된 돌연변이 유형에 따라 개인화되어야 하며 시너지 분자 메커니즘에 의해 HIF-1/2 활성을 억제하는 두 가지 약물을 포함하는 것이 더 나을 수 있습니다.
소개:
저산소증과 괴사는 고형 종양의 두 가지 특징입니다.
종양 세포는 산소 공급 부족(만성 저산소증) 또는 일시적인 혈류 변동(급성 저산소증)의 결과로 저산소증이 발생합니다.
확산 장애, 종양 미세 혈관의 이상 및 미세 순환 장애는 모두 종양 미세 환경의 산소 공급 부족 또는 폐지로 이어집니
다.
결국, 종양 세포는 산소 부족으로 인해 괴사됩니다.
저산소증은 방사선 요법과 화학 요법의 결과에 부정적인 영향을 미치고 종양 전이를 강화합니다.
이것은 1953년과 같이 1950년대 초반의 과학적 증거에 의해 잘 뒷받침됩니다.
Gray와 동료들은 산소가 잘 공급된 배지에서 방사선에 대한 종양 세포의 치료 반응이 무산소 조건 3 에서 종양 세포를 조사할 때보다 더 낫다는 것을 보여주었습니다 .
그러나 이러한 결과는 방사선 치료의 성공에 있어 산소의 중요한 역할을 근거로 설명할 수 있다.
산소는 방사선 요법으로 인해 형성된 DNA의 자유 전자와 상호 작용합니다.
이러한 무산소 라디칼 상호작용은 방사선 손상을 영구적으로 만들고, 이는 낮은 수준의 산소를 갖는 저산소 세포의 방사선 저항을 설명합니다4 .
내화학성에 대한 저산소증의 영향은 여러 요인에 기인할 수 있습니다.
첫째, 저산소 세포의 낮은 약물 농도는 기능하는 혈관 에서 떨어진 영역에 축적됩니다.
둘째, 대부분의 항암제는 증식하는 세포를 표적으로 합니다. 그러나 저산소 세포는 호기성 세포에 비해 영양 결핍과 손상된 세포 증식을 경험하므로 저산소 세포에 미치는 영향이 적습니다.
저산소증의 불리한 영향은 방사선 요법 및 화학 요법의 효과에 대한 부정적인 영향을 넘어 확장됩니다.
저산소증 미세 환경은 게놈 불안정성, 유전자 변형, 돌연변이 유발 및 불량한 예후와 관련이 있기 때문입니다. 6. 예를 들어, 저산소증은 종양 억제 유전자인 p53과 세포자멸사 억제 단백질인 Bcl-2 모두에서 돌연변이를 발현하는 세포를 발암적으로 형질전환된 세포에서 선택될 수 있습니다 (7).
그렇게 함으로써 저산소증은 고형 종양 악성종양과 전이에 기여합니다.
저산소증은 국부적으로 또는 전신적으로 많은 생리학적으로 관련된 유전자에서 급성(단기) 및 장기 반응을 유발하고 호기성 에너지 대사에서 혐기성 에너지 대사로의 전환을 매개합니다.
저산소증은 혈관 구조 및 색조architecture and tone를 포함한 다양한 세포 기능에 관여하는 40개 이상의 유전자의 전사를 유도합니다: 혈관 내피 성장 인자(VEGF), 적혈구 생성(에리트로포이에틴, EPO), 철 대사(트랜스페린), 주로 포도당을 포함하는 에너지 대사 수송 단백질(GLUT-1, GLUT-3), 인슐린 유사 성장 인자-2(IGF-2) 및 pH 조절(탄산 탈수효소-9, CA IX) 8 , 9.
이러한 다양한 활성화 메커니즘의 전반적인 목표는 산소 전달을 증가시키고 산소 소비를 감소시키거나 산소를 필요로 하지 않는 대체 대사 경로를 활성화하는 것입니다 10 , 11 .
그러나 이러한 산소 조절 유전자는 저산소증 유발 인자-1-3(HIF-1-3)에 특이적으로 결합하는 저산소증 반응성 요소(HRE)로 알려진 특정 단백질 서열을 가지고 있습니다.
HIF는 저산소 환경 및 종양 진행 및 전이에 대한 적응 반응의 수단으로서 저산소 세포에서 발현이 증가하는 종양 저산소증의 고유 마커입니다.
4. HIF-1/2α 조절 경로:
4.1. HIF-1/2α를 규제하는 표준 메커니즘:
4.1.1: 수산화: Hydroxylation
HIF-1/2α의 전사 활성과 안정성은 α 소단위의 산소 의존성 하이드록실화에 의해 엄격하게 조절되며, 정상산소는 HIF-1/2α 전사체의 빠른 분해를 유도합니다. 반대로 저산소증은 pVHL의 비활성화를 통해 HIF-1/2α를 안정화시켜 HIF-α 유비퀴틴화와 프로테아좀 분해를 감소시킵니다.그림 2) 47 , 48 .
전자 수송을 통한 미토콘드리아 Complex III 52. 그러나 NADPH 산화효소 시스템, 특히 NADPH 산화효소의 Nox 계열과 같이 HIF-1/2α를 안정화시킬 수 있는 다른 ROS 생성 메커니즘이 보고되었습니다. NADPH 1은 (도 NOX1라고도 함) HIF-1α 상향 조절하는기구로 ROS 생성을 매개 다제 53 . 반면, NOX1 및 NADPH 산화효소 4(NOX4라고도 함)는 ROS 생성을 통해 신장 암종에서 HIF-2α 발현을 유지하는 데 도움이 되므로 신장 발암에 기여합니다 54 .

HIF-1/2를 조절하는 표준 메커니즘의 개략도.
정상 산소 조건(왼쪽 패널)에서
PHD 및 FIH는 프롤린 잔기 및 아스파라긴 잔기에서 HIF-1/2α를 수산화하고 수산화된 HIF-1/2α의 형성을 유발합니다. 한편, pVHL은 VHL, Elongin B, Elongin C, CUL2 및 RBX1을 포함하는 복합체의 조립을 매개하며, 이는 유비퀴틴이 결합된 E2 성분을 결합하여 HIF-1/2α 단백질의 유비퀴틴화를 달성합니다. P53은 E2 및 E3 유비퀴틴 리가제-pVHL 복합체에 의해 매개되는 HIF-1α의 프로테아좀 분해를 돕기 위해 E3 유비퀴틴-단백질 리가제, Mdm2를 모집할 수 있습니다. 게다가, HIF-1/2, FIH의 C-TAD에 있는 아스파라긴 잔기의 하이드록실화는 HIF-1α와 CBP/p300과 같은 보조 활성화제 사이의 필수 상호작용을 차단합니다.
그러나 저산소 조건(오른쪽 패널)에서는 pVHL, PHD 및 FIH 활성은 미토콘드리아 및 NADPH 산화효소(NOX)와 같은 기타에서 제한된 산소 및 ROS 생성 메커니즘에 의해 억제되어 프로테아솜 분해로부터 HIF-1/2α가 탈출하게 됩니다.
따라서, HIF 전사 복합체는 표적 유전자의 DNA 상의 HRE 모티프에 결합하여 표적 유전자 전사를 활성화시킨다.
4.2. HIF-1/2를 규제하는 비표준 메커니즘:
산소 의존성 pVHL 경로가 HIF-1/2α 단백질 안정성에 대한 주요 조절 메커니즘을 제공하지만, 저산소증 및 정상산소 상태 모두에서 HIF-1/2α 단백질 안정성, 합성 및 전사 활성을 미세 조정하기 위한 추가 메커니즘이 존재합니다.
그러나 HIF-1α의 산소 비의존적 제어에 대한 생물학에 대한 이해가 동형 HIF-2α보다 명확해지고 있기 때문에 HIF-2α의 산소 비의존적 제어에 대해 더 자세히 조사할 필요가 있습니다.
4.2.1: 아세틸화 및 탈아세틸화:Acetylation and deacetylation
많은 번역 후 아세틸화 및 탈아세틸화 현상이 HIF-1/2α 단백질 안정성과 전사 활성을 조절하는 역할을 하는 것으로 보고되었습니다. 그러나 상충되는 데이터는 이러한 규제 메커니즘의 기초와 HIF-1/2α 규제에서의 역할에 대해 의문을 제기합니다. HIF-1α 단백질의 여러 부위는 라이신 아세틸화에 의해 변형되어 다른 다운스트림 효과를 유발할 수 있습니다.
4.2.2: PI3K/AKT 및 MAPK/ERK 경로:
비-저산소 조건에서 HIF-1α의 과발현은 돌연변이 또는 리간드 결합에 의한 단백질 티로신 키나제(PTK)의 활성화를 통해 세포 유형별 방식으로 HIF-1α 단백질 합성을 증가시킬 수 있는 성장 인자 자극에 의해 달성될 수 있습니다 . 이 활성화는 포스파티딜이노시톨 3-키나제(PI3K)/단백질 키나제 B(AKT) 경로 또는 미토겐 활성화 단백질 키나제(MAPK/ERK) 경로를 통한 신호 전달로 이어집니다.그림 3).
두 경로는 종양 유전자를 활성화하고 종양 억제 유전자를 비활성화하는 체세포 돌연변이가 있는 세포의 종양 미세 환경 유리한 선택에 의해 영향을 받습니다.
이러한 돌연변이는 제어되지 않은 방식으로 세포 주기를 통해 세포를 구동하고 세포자멸사를 방지합니다.
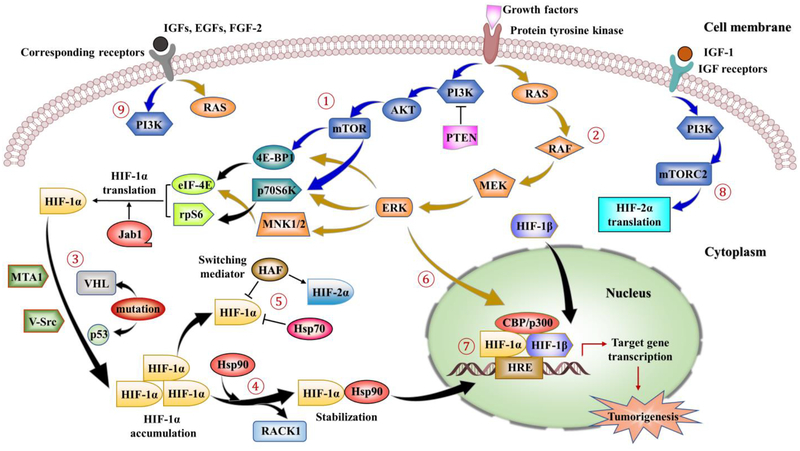
HIF-1/2를 조절하는 비정규 경로와 관련된 주요 신호.
①-②: HIF-1α 조절은 단백질 티로신 키나아제(PTK)의 활성화를 통한 성장 인자 자극에 의해 시작될 수 있습니다. 이 자극은 PI3K-AKT-mTOR 경로(파란색 화살표로 표시) 및 MAPK/ERK 경로(진한 노란색 화살표로 표시)를 통해 다운스트림 신호 활성화를 유도합니다. mTOR 및 ERK 신호전달은 3개의 다운스트림 이펙터인 4E-BP1, p70S6K 및 MNK1/2의 인산화 및 활성화를 추가로 매개하고 eIF-4E 및 rpS6의 활성화가 뒤따릅니다. 마지막으로, 이러한 인산화 작용은 HIF-1α mRNA의 단백질로의 향상된 번역을 초래합니다. 또한, Jab1은 HIF-1α의 전사 활성을 촉진할 수 있는 반면, PI3K의 음성 조절자인 PTEN은 HIF-1α 발현을 하향조절할 수 있습니다.
③: VHL의 돌연변이, PTEN과 p53은 HIF-1α의 발현을 증가시킬 뿐만 아니라 MTA1 및 V-Src와 같은 종양 유전자의 활성화를 유발합니다.
④: Hsp90은 RACK1이 프로테아좀 분해 경로를 통해 HIF-1α를 불안정화하기 때문에 HIF-1α PAS 도메인에 결합하기 위해 RACK1과 경쟁합니다. HIF-1α는 단백질 접힘을 돕고, 프로테아좀에 의한 HIF-1α의 분해를 방지하고, 핵 전위에 기여하는 Hsp90의 도움으로 세포질에 추가로 축적됩니다.
⑤: HIF-1α는 HIF-1α의 분해를 유도하여 HIF-2α의 transactivation을 증가시키면서 HAF에 의해서도 조절된다. Hsp90과 비교하여 Hsp70은 연장된 저산소증에서 HIF-1α 분해를 중재할 수 있지만 HIF-2α는 중재할 수 없습니다.
⑥: ERK는 co-activator CBP/p300을 인산화시키고 HIF-1α/p300 복합체 형성을 증가시킨다.
⑦: 핵에서, HIF 복합체는 표적 유전자의 DNA에 있는 HREs 모티프에 결합하고 전사를 활성화하여 세포 증식, 세포 생존, 혈관 신생 및 종양 형성에 관여하는 유전자의 상향 조절을 유발합니다.
⑧: IGF-1 활성화는 PI3K-mTORC2 시스템을 통해 HIF-2α의 전사를 유도할 수 있습니다.
⑨: 상응하는 수용체에 대한 IGF, EGF 및 FGF-2의 자극은 PI3K/AKT 및 MAPK 경로 모두의 활성화를 통해 HIF-1α 발현 및 단백질 합성을 유도한다.
4.2.3: HIF-1/2α 및 기타 인산화 사건:HIF-1/2α and other phosphorylation events
HIF-1α 단백질 합성을 조절하는 것 외에도 MAPK/ERK 경로는 HIF-1α 전사 활성화와도 관련이 있습니다.
여기서 ERK는 공동 활성화제인 CBP/p300을 인산화하고 HIF-1α/p300 복합체 형성 81을 증가시키는 것으로 보고됩니다 .
더욱이, ERK2는 2개의 별개의 세린 잔기(S641 및 S643)에서 HIF-1α의 C-말단 도메인을 직접 인산화시키는 것으로 보고되었으며, 그렇게 함으로써 염색체 유지 1(CRM1은 Exportin 1로도 알려져 있음)에 의해 HIF-1α 핵 배제를 차단합니다. XPO1) 및 HIF-1α 82 의 핵 축적 및 활성을 향상시킵니다 .
4.2.4: Hsp90, HAF 및 Hsp70:
Hsp90은 비 pVHL 매개 유비퀴틴화 및 프로테아좀 분해에 대한 HIF-α 소단위 안정화에 관여하며 핵에서 HIF-1α 축적을 돕습니다.
흥미롭게도, 저산소증에 대한 급성 노출은 HIF-1α 축적을 증가시키는 반면, 저산소증은 HIF-1α 축적의 저하 및 감소를 유발할 수 있지만 장기간 노출 시 세포 배양 시스템에서 HIF-2α 단백질 수준은 그렇지 않습니다.
Mei Koh와 동료들은 HIF-1α의 선택적 산소 비의존적 분해와 HIF-2α 전이 활성화의 촉진이 저산소증 관련 인자(HAF, SART1이라고도 함)에 의해 제어된다는 것을 보여주었습니다. HAF는 장기간의 저산소증에 따른 프로테아좀 분해를 위해 특별히 HIF-1α를 표적으로 하는 E3 유비퀴틴 리가제입니다.
그러나 열 충격 단백질 70(Hsp70)은 장기간 저산소증 매개 HIF-1α 분해에 역할을 하는 것으로 보고되었지만 HIF-2α는 그렇지 않은 것으로 보고되었습니다. Hsp70은 유비퀴틴 리가제, Hsp70-상호작용 단백질(CHIP)의 카르복실 말단을 모집하여 HIF-1α의 유비퀴틴화 및 프로테아좀 분해를 선택적으로 촉진하지만 HIF-2α 99 는 촉진하지 않습니다.
결과적으로, 문헌은 Hsp70 및 Hsp90이 각각 HIF-1α의 분해 및 안정화에 관여할 수 있는 HIF-1α를 조절하는 데 있어서 Hsp70 및 Hsp90의 반대 역할을 제안합니다.
5. HIF-1/2 전사 공동 활성화제:
다양한 저산소증 반응 유전자의 저산소증 유도성 전사는 HIF-1/2 결합에만 의존하지 않습니다.
그러나 최적의 유전자 전사를 위해서는 HIF-1/2가 인접하거나 때로는 멀리 떨어져 있는 전사 인자 및 공동 활성화 단백질과 상호 작용하여 다중 단백질 복합체 100 , 101 을 형성해야 합니다 .
이러한 다중 상호작용 전사인자 결합 부위는 각각의 산소 조절 유전자와 각 세포 유형에서 서로 다르며, 이는 어느 정도의 조직 선택성을 전달하고 저산소증에 의한 유도 수준과 관련하여 해당 유전자의 고유한 조절에 기여합니다 100.
몇몇 공동 활성제는 HIF-1/2와 전사 공동 활성제 CBP 또는 p300의 상호 작용을 안정화함으로써 표적 유전자 발현을 활성화하는 HIF-1/2 능력을 향상시키는 것으로 이전에 보고되었습니다.
6. 암에서 HIF-1/2 표적화:
고형 종양이 고유한 저산소 환경을 생성한다는 사실과 저산소가 종양의 공격적, 전이성 및 내성 형태를 매개한다는 사실을 종합하면, 암에 대한 표적 치료법을 설계하고 개발하기 위해 저산소 종양 미세 환경을 이용하는 것이 합리적입니다.
유전자 요법, 재조합 혐기성 박테리아, 저산소증 활성화 전구약물의 사용을 포함한 여러 접근 방식이 추구되었습니다 112 , 113.
또 다른 중요한 경로는 저산소 상태에서 전사 인자 HIF-1/2의 선택적 유도를 이용하는 것입니다.
이상적으로는 선택성이 달성될 수 있고 정상 세포는 영향을 받지 않습니다.
그러나 HIF-1/2 조절 경로는 매우 복잡하며 상호 연결된 신호 캐스케이드 및 중첩 메커니즘을 포함합니다.
이 컨볼루션은 두 가지 사실에서 나타납니다.
1) HIF-1/2의 선택적 억제제를 설계하는 것은 매우 어려운 작업이므로 억제 메커니즘을 기반으로 개발 및 분류된 HIF-1/2 표적 화합물의 수가 증가하고 있지 않습니다. 그들의 특정 표적으로 HIF-1/2 경로를 억제하기 위하여.
2) 일련의 상호 연관된 사건에 의존하는 HIF-1/2의 전사 활성화의 조절 메커니즘을 고려하면, 생리적 자극 및 유전적 변경을 통한 HIF-1/2α 서브유닛의 정상 상태 수준 상승, HIF-1/2α 핵 전위, β 서브유닛과의 이종이량체화, HREs-DNA 결합, 공동 활성제 모집 및 형성 활성 전사 복합체, 이러한 HIF-1/2 조절 이벤트의 각 단계를 조절하고 개입하기 위해 많은 노력이 이루어졌습니다.
합성된 많은 HIF-1/2 억제제는 직접적인 메커니즘을 통해 HIF-1α 또는 HIF-2α 또는 둘 모두에 작용하는 반면, 많은 다른 화합물 및 승인된 약물은 HIF-1/2 신호 전달과 다른 세포 경로 간의 연결로 인해 HIF-1/2 활성을 간접적으로 억제하는 것으로 나타났습니다.
(예를 들어 업스트림 경로: PI3K/AKT/mTOR 경로 또는 다운스트림 세포 경로: 항-VEGF-치료)
Table 1.
Newly reported HIF inhibitors
InhibitorMechanism of Inhibition
| Benzopyranyl triazole (1) | Increased HIF-1α hydroxylation |
| BIX01294 (2) | Increased HIF-1α hydroxylation/HIF-1α protein degradation |
| Cardenolides (3) | Decreased HIF-1 transcriptional activity |
| CRLX-101 (4) | Decreased HIF-1α protein accumulation |
| EZN-2208 (5) | Decreased HIF-1α protein expression and transcriptional activity |
| Glyceollins (6) | Decreased HIF-1α translation/stability |
| IDF-1174 (7) | Increased HIF-1α degradation |
| LBH589 (8) | Increased HIF-1α degradation |
| MPT0G157 (9) | Increased HIF-1α degradation |
| Vorinostat (10) | Decreased HIF-1/2α translation/nuclear localization/stability |
| NNC 55–0396 (11) | Decreased HIF-1α protein expression/translation/Increased HIF-1α hydroxylation |
| Kresoxim-methyl analogues (12) | Decreased HIF-1α stability |
| PT2385 (13) and PT2399 (14) | Decreased HIF-2 heterodimerization |
Glyceollins글리세올린 (글리세올린 I, II, III, 6 의 혼합물 )은 미생물 침입, 자외선 및 화학적 스트레스 요인에 대한 보호 메커니즘으로서 유도제의 자극 작용을 통해 대두에서 새로 합성되는 피토알렉신 그룹입니다 135 , 136 . 글리셀린은 항에스트로겐 활성 137 , 혈관 평활근의 항 수축 활성 138 , 향상된 인슐린 감수성 139 및 항 멜라닌 합성 활성 140을 포함한 다양한 생물학적 기능을 나타냅니다 . 가장 중요한 Glyceollins은 종양의 성장을 조절하고 HIF-1α의 조절을 통해 암 세포에서 VEGF의 발현을 억제하는 141 ,142 . 그들은 두 가지 수단으로 HIF-1 억제 작용을 수행합니다. 1) 저산소 조건에서 PI3K/AKT/mTOR 경로를 억제하여 HIF-1α 번역을 차단합니다. 2) Hsp90 결합 활성을 방해하여 HIF-1α 안정성을 감소시킨다.
Cardenolides카데놀라이드 ( 3 )는 전통적으로 암을 포함한 여러 질병의 치료에 사용되는 동남아시아 고유의 약용 식물인 Calotropis gigantea 의 라텍스와 열매에서 분리되었습니다 . Cardenolides는 25-26개의 탄소 원자와 C-17에 5 또는 6원 락톤 고리를 가진 스테로이드입니다. 이 중 Calactin은 21.8 nM 의 IC 50 값으로 HIF-1 전사 활성을 억제 하고 45.2 nM 122 의 IC 50 값 으로 인간 유방암 세포주 MCF-7에 대해 세포독성 효능을 나타낸다 .
결론:
종양 내 저산소증 외에도 다양한 메커니즘 세트가 HIF-1/2 신호 전달 및 조절에 기여하는 것으로 보고되었습니다.
여기에는 ROS, 사이토카인 및 성장 인자와 같은 저분자량 신호 분자, 종양 억제 인자 기능 상실 및 종양유전자 기능 획득이 포함됩니다. .
선택적 HIF-1/2 α 억제제는 임상적으로 승인되지 않았습니다.
또한 여러 승인된 약물이 HIF-1/2 신호 전달과 다른 세포 경로 간의 확장된 연결성을 반영하는 HIF-1/2 α 경로에 간접적으로 영향을 미치는 것으로 보고되었습니다.
따라서 암에서 이러한 경로를 표적으로 하면 HIF 활성이 2차(간접) 억제됩니다.
향후 방향은 선택적 HIF-1/2 α 억제제를 개발하고 HIF-1/2 억제제를 추가하면 부가적 또는 상승적 효과를 갖는 약물 조합을 다루는 방향으로 향할 것입니다.
8. 전문가 의견:
HIF-1α의 안정성과 분해는 저산소증에 대한 단기 또는 장기간 노출에 따라 차등적으로 영향을 받으며 HIF-1/2와 자가분비 성장 인자 및 기타 세포 스트레스 반응 매개체와 같은 영향 유전자 사이의 교차 대화는 복잡합니다.
유방암, 뇌암, 자궁경부암, 결장직장암, 급성림프양암, 골수성백혈병, 흑색종, 위암, 간암, 폐암, 난소암, 췌장암과 같은 많은 유형의 암은 HIF-1/2 활성화. HIF-1/2 활성화는 혈관 형성, 면역 회피, 대사 재프로그래밍, 성장 인자 신호 전달, 침습, 종양 진행 및 전이를 매개하는 단백질을 암호화하는 유전자의 활성화를 통해 암 환자의 사망률에 기여합니다.
이 연구 분야의 궁극적인 목표는 선택적 HIF-1/2 억제제를 개발하는 것입니다.
현재 치료에 HIF-1/2 억제제를 추가하는 것은 급성 및 만성 골수성 백혈병, 교모세포종, 결장암 및 간암을 포함한 광범위한 전임상 연구에서 유리한 것으로 입증되었습니다. 종합하면, 암 치료 요법에 HIF-1/2 억제제를 추가하는 것이 필요하다고 주장하는 것이 합리적입니다.
이상적으로는 2종 이상의 화학요법제를 사용하는 병용 요법이 부가적 또는 상승적 효과를 발휘해야 하며 바람직하게는 장기간 효능을 위해 서로 다른 분자 메커니즘에 의해 HIF-1/2 활성을 억제하는 다중 약물을 포함할 수 있습니다.
따라서 다른 분자 메커니즘에 의해 HIF-2 활성을 억제하는 여러 약물의 동시 투여가 필요할 수 있습니다.
그러나 현재 사용 가능한 pan-HIF-1/2 억제제(예: 에키노마이신 및 YC-1) 중 일부는 용량 제한 부작용이 있기 때문에 HIF-1/2 억제제를 선택할 때 약물-약물 상호작용, 부작용 및 독성을 고려해야 합니다. .
전반적으로 HIF 구조, 분자 메커니즘 및 다른 신호 전달 경로와의 상호 작용에 대한 이해가 높아짐에 따라 보다 특이적이고 선택적인 HIF-1/2 억제제를 개발하는 것은 여전히 매우 어려운 일이지만 우리는 확실히 점점 더 많은 빛을 보고 있습니다.
기사 하이라이트:
- 고형 종양은 종양 미세 환경에서 산소 공급의 결핍 또는 폐지로 인해 저산소증이 발생합니다. 저산소증은 방사선 요법과 화학 요법에 부정적인 영향을 미치며 종양 전이, 게놈 불안정성 및 불량한 예후를 강화합니다.
- 저산소증은 HIF-α 및 HIF-β의 두 단백질로 구성된 이종이량체 단백질인 전사 인자 HIF를 통해 유전자를 보유하는 저산소증 반응성 요소에서 장단기 반응을 유도합니다. HIF-α 안정성은 HIF 활성 조절의 주요 결정 요인입니다. HIF-α에는 HIF-1α, HIF-2α 및 HIF-3α의 세 가지 밀접하게 관련된 동족체가 있습니다.
- 정상산소 상태에서 HIF-α는 O 2 의존성 프롤릴 하이드록실화에 의해 조절되며 , 이는 von Hippel-Lindau를 포함하는 E3 유비퀴틴-단백질 리가아제에 의한 유비퀴틸화를 촉진합니다. 그 후, 유비퀴틴화된 HIF-α는 프로테아좀 분해에 대해 신호를 받습니다. HIF-1/2α는 종양 내 저산소증, 반응성 산소 종과 같은 저분자량 신호 분자, 종양 유전자의 기능 획득 돌연변이 및 종양 억제 유전자의 기능 상실 돌연변이의 결과로 인간 암에서 과발현됩니다. HIF-1/2 조절 경로는 매우 복잡하며 상호 연결된 신호 캐스케이드 및 중첩 메커니즘을 포함합니다.
- HIF-1/2의 전사 활성화 조절 메커니즘은 HIF-α 서브유닛의 정상 상태 수준 상승, 핵 내부의 HIF-α 국소화, β 서브유닛과의 이종이량체화, 저산소증 반응 요소 - DNA 결합, HIFα의 C-TAD 및 N-TAD에 의해 매개되는 전사 활성 증가, 공동 활성제 모집.
- HIF-1/2α 과발현은 원발성 인간 암 및 그 전이, 방사선 요법 및 화학요법 내성, 환자 사망률과 관련이 있습니다. 전임상 및 임상 연구에서 HIF-1/2 활성의 억제는 혈관신생 및 종양 성장에 현저한 영향을 미쳤습니다. 따라서 선택적 HIF-1/2 억제제를 개발하는 데 노력이 집중되고 있습니다.
'전사인자' 카테고리의 다른 글
| HIF-1a를 표적으로 하는 최근 약제 -2012년 (0) | 2021.10.20 |
|---|---|
| HIF-1 표적 (0) | 2021.10.20 |
| HIF경로 표적화 (0) | 2021.10.20 |
| HIF-1 α 경로: 암 치료를 위한 역할, 조절 및 개입 (0) | 2021.10.20 |
| 암 치료용 HIF-1 억제제 개발 (0) | 2021.10.20 |