Targeting the hypoxia-inducible factor (HIF) pathway in cancer | Expert Reviews in Molecular Medicine | Cambridge Core
Targeting the hypoxia-inducible factor (HIF) pathway in cancer - Volume 11
www.cambridge.org
Targeting the hypoxia-inducible factor (HIF) pathway in cancer
2009
세포에서 저산소증 감지의 중심 구성요소는 저산소증 유도 인자(HIF) 전사 복합체입니다.
HIF 활성은 많은 인간 암, 특히 고도로 저산소 상태인 암에서 규제가 완화됩니다.
저산소성 종양 세포는 일반적으로 방사선 요법 및 대부분의 기존 화학요법제에 내성이 있어 매우 공격적이고 전이성이 있습니다.
HIF의 조절 소단위인 HIF-α의 과발현은 증가된 혈관 밀도, 종양 등급의 중증도, 치료 실패 및 기존 요법의 불량한 예후 결과와 관련이 있습니다.
저산소증은 모든 고형 종양의 공통적인 특징이며(참고 1 ) 비정상적인 종양 미세혈관 구조로 인한 제한된 혈액 공급으로 인해 증식하는 종양 세포에 산소가 부족한 상태입니다( 그림 1 ).
저산소증 세포는 산화적 DNA 손상, DNA 가닥 파손 및 유전적 이상을 포함하여 스트레스로 인한 손상의 위험이 있으며, 이는 성장을 억제하고 궁극적으로 세포 사멸을 초래할 수 있습니다.
그러나 암세포는 생존을 개선하고 저산소 상태에 적응할 수 있도록 하는 다양한 유전적 변화를 보여줍니다.
그 결과 저산소성 종양 세포가 계속 증식하고 더 침습적이고 전이성인 표현형과 관련이 있으며 일반적으로 방사선 요법 및 화학 요법과 같은 기존 치료법에 내성이 있습니다(참고문헌 2 ,3 , 4 , 5 , 6 ).
따라서 암 세포의 저산소증 신호 전달과 관련된 기본 분자 메커니즘과 이러한 과정이 다른 암 유형에서 어떻게 탈조절되는지에 대한 더 명확한 이해를 얻으면 저산소성 종양 세포를 더 잘 표적화하고 고형 종양에 대한 더 효과적인 치료법을 얻을 수 있습니다.
세포에서 저산소증 신호의 중심 구성요소는 세포 산소의 변화를 감지하고 반응하는 데 결정적으로 관여하는 저산소증 유도 인자(HIF)입니다(참고 7 ).
HIF 경로
HIF는 세포 산소 수준의 변화에 반응하여 활성화되는 전사 복합체이며 많은 유전자의 발현을 매개합니다.
HIF 표적 유전자는 산소 수송, 철 대사, 해당과정, 포도당 수송, 세포 생존 및 증식, 혈관신생, 침습 및 전이를 비롯한 종양 생물학의 다양한 측면의 조절에 관여하는 단백질을 암호화합니다.
HIF 활성은 많은 인간 암에서 탈조절되며, 이는 가장 일반적으로 HIF 복합체의 조절 서브유닛인 HIF-α의 과발현으로 인한 것입니다.
HIF-α의 과발현은 일반적으로 혈관 밀도 증가, 종양 등급의 중증도, 치료 실패 및 불량한 예후 결과와 관련이 있습니다(참고 10 , 11).
HIF 활성을 차단하거나 종양에서 HIF-1α 발현을 표적으로 하는 것은 이종이식 모델에서 종양 성장을 상당히 늦추고(참고 12 ) 저산소 세포를 기존 요법에 의한 사멸에 더 취약하게 만드는 것으로 나타났습니다
HIF와 암
저산소증 외에도 산소 감지 메커니즘과 관련된 여러 유전자의 기능 상실 돌연변이는 HIF-α(HIF-1α 및 HIF-2α)의 과발현 및 HIF 경로의 활성화에 기여하는 것으로 나타났습니다.
종양 세포( 도 3 ). 예를 들어, VHL의 기능 상실 돌연변이 는 HIF-α 유비퀴틴화 및 분해 부족으로 인해 투명 세포 신장 암종, 혈관 모세포종 및 기타 VHL 관련 종양 에서 HIF-1α 및 HIF-2α 발현을 증가시키는 것으로 나타났습니다. 참조 44).
숙시네이트 탈수소효소(SDH) 및 푸마르산 수화효소(FH)의 돌연변이는 프롤릴 수산화효소 활성을 억제하여 HIF-1α의 비정상적인 안정화와 여러 암, 즉 부신경절종, 갈색세포종, 평활근종 및 신세포암(참고문헌 48 , 49 ).
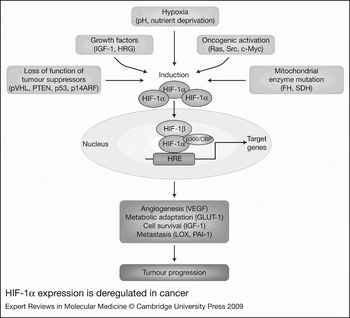
그림 3. HIF-1α 발현은 암에서 탈조절됩니다.
암에서 저산소증 유발 인자 1α(HIF-1α)의 과발현과 HIF 경로의 활성화는
산소 수준(저산소증),
pH 및 영양소(결핍)의 변화,
성장 인자의 증가와 같은 미세 환경 변화의 조합에 의해 유발됩니다. ,
종양 억제인자 기능의 상실,
발암성 활성화 또는 미토콘드리아 기능의 탈조절로 이어지는 유전적 이상.
암세포에서 증가된 HIF-α 단백질은 핵으로 이동하고, HIF-1β에 결합하고, 보조 활성화제(예: p300/CBP)를 모집하고, 혈관신생(예: VEGF), 대사 적응(예: GLUT-1), 세포 생존(예: IGF-1) 및 전이(예: LOX, PAI-1) 에 관련된 여러 유전자의 전사를 활성화합니다. - 따라서 종양 진행을 유도합니다
약어: FH, 푸마레이트 히드라타제;
GLUT-1, 포도당 수송체 1;
HRG, 헤레굴린; IGF-1, 인슐린 유사 성장 인자 1; LOX, 리실 산화효소; p300/CBP, p300/CREB-결합 단백질; p14ARF, 대체 판독 프레임(ARF) 제품CDKN2A (사이클린 의존성 키나제 억제제 2A) 유전자좌; PAI-1, 플라스미노겐 활성화제 억제제 1; PTEN, 포스파타제 및 텐신 동족체; pVHL, 폰 히펠-린다우 종양 억제 단백질; SDH, 숙시네이트 탈수소효소; VEGF, 혈관 내피 성장 인자.
Abbreviations: FH, fumarate hydratase; GLUT-1, glucose transporter 1; HRG, heregulin; IGF-1, insulin-like growth factor 1; LOX, lysyl oxidase; p300/CBP, p300/CREB-binding protein; p14ARF, alternate reading frame (ARF) product of CDKN2A (cyclin-dependent kinase inhibitor 2A) locus; PAI-1, plasminogen activator inhibitor 1; PTEN, phosphatase and tensin homologue; pVHL, von Hippel–Lindau tumour suppressor protein; SDH, succinate dehydrogenase; VEGF, vascular endothelial growth factor.
주요 신호 전달 경로의 조절 장애는 또한 암에서 HIF-1α의 과발현 및 HIF-1의 활성화에 기여합니다.
Ras-MAPK 경로, Src 또는 PI3K-AKT(PKB)-mTOR(라파마이신의 포유동물 표적) 경로가 구성적으로 활성화된 종양 세포는 HIF-1α 단백질 발현 증가를 나타낸다.
PTEN(AKT의 구성적 활성화로 이어짐) 및 p53과 같은 종양 억제 단백질의 기능 상실은 또한 HIF-1 활성을 증가시킬 수 있습니다
HIF-1α(핵)가 췌장(참고 56 ), 두경부(참고 57 , 58 ), 인두(참고 59 ), 유방을 포함한 많은 종양 유형에서 높게 발현되는 것으로 나타났습니다 . (참고 60 , 61 ), 신장 (참고 62 ), 난소 (참고 63 ), 요로 상피 (참고 64 ), 방광, 뇌, 결장 직장 및 전립선 (참고 문헌 .65 ).
여러 독립적인 연구에서 HIF-1α 과발현과 환자 사망률 사이에 강한 상관관계가 있음이 밝혀졌습니다.
높은 HIF-1α 발현은 또한 췌장암(Ref. 56 ), 두경부 편평세포암(Ref. 58 ), 투명세포 신세포암(Ref. 62 ) 및 유방암 (Ref. 62 ) 에서 낮은 생존율과 관련이 있습니다 . 60 , 61 ).
이는 종종 상당한 수준의 종양 저산소증을 나타내는 HIF-1α의 과발현이 종양 세포가 생존할 수 있도록 하는 세포 적응 반응을 매개하는 데 관여하기 때문일 수 있습니다.
종양 저산소증 및 HIF-1α 과발현은 종양 세포 행동의 공격성 증가, 혈관신생 및 전이와 상관관계가 있는 것으로 보고되었으며 전이성 질환 환자의 결과를 예측하는 마커로 사용할 수 있습니다.
놀랍게도 HIF-1α 과발현을 나타내는 모든 종양이 환자 생존율 감소와 관련이 있는 것으로 밝혀진 것은 아닙니다(참고 66 ).
예를 들어, 구강 바닥의 초기 편평 세포 암종에서 HIF-1α 과발현은 개선된 생존율과 관련이 있습니다(참고 66 ).
이러한 차이는 HIF-1α가 초기 발암에 이중 역할을 하여 기능할 수 있다는 사실에서 발생할 수 있습니다.
HIF-1α는 적응 반응을 매개할 때 종양 혈관신생과 세포 생존을 촉진하는 반면, HIF-1α는 세포 스트레스에 반응하여 종양 세포 사멸을 매개하는(아폽토시스 유전자 유도 또는 p53에 대한 crosstalk 누화) 통해 세포사멸 기구와 협력합니다 .
실제로, 종양 진행에서 HIF의 기능은 세포 유형 및 세포 상황 및 발암 단계에 따라 달라질 수 있으며, 암에서 HIF 경로를 표적으로 하는 것이 가장 좋은 시기와 어떤 특정 암 유형이 HIF 억제제에 민감한지 판명되어야한다.
암에서 HIF 경로를 표적으로 하는 전략
HIF-1α 단백질 가용성(안정성 및 합성)과 HIF-1 활성을 조절하는 것으로 알려진 다른 주요 경로 및 메커니즘의 치료적 이용은 잠재적으로 암의 HIF 경로를 표적화하는 데 사용될 수 있습니다( 그림 4).).
HIF 전사 복합체 자체가 어려운 치료 표적이지만, HIF 경로의 차단 및 HIF-α 발현의 억제는 혈관신생 및 종양 진행을 유도하는 중추적 역할 때문에 치료학적으로 매력적입니다.
많은 암에서 HIF-1α의 과발현과 HIF 활성의 조절 해제는 정상 조직에 비해 종양 세포에 대해 어느 정도 선택성을 제공하고(참고 68 ), 특히 기존 요법과 함께 사용할 때 HIF-1α를 차단하면 종양 성장에 상당한 영향을 미칩니다( 69 참조 ).

Figure 4. Strategies to target the HIF-1 pathway in cancer.
(a–c) Several strategies to specifically target hypoxia-inducible factor 1α (HIF-1α) protein levels and HIF-1 activity in cancer cells have been developed (shown in red), including:
(a) inhibition of protein–protein interactions (e.g. HIF-1 dimerisation or coactivator recruitment);
(b) inhibition of HRE transcriptional activity (e.g. using small-molecules identified in HRE cell-based reporter screens); and
(c) activation of HIF-1α protein degradation (e.g. using PHD activators).
(d–f) In addition, therapeutic targets currently in development that are known regulators of the HIF-1 pathway provide an alternative means for blocking HIF-1α protein availability (stability and synthesis) and HIF-1 activity in tumour cells (shown in green), including:
(d) inhibition of signalling pathways upstream of HIF (PI3K–AKT–mTOR/HDM2 and Ras–MAPK);
(e) inhibition of chaperone proteins (e.g. HSP90); and
(f) activation of the tumour suppressor p53. Direct downstream targets are indicated by solid lines, and downstream effectors are indicated by dashed lines.
Abbreviations: AKT, AKT/protein kinase B; HDM2, human homologue of MDM2 (E3 ubiquitin ligase; p53-binding protein); HRE, hypoxia-response element; HSP90, heat shock protein 90; MAPK, mitogen-activated protein kinase (also known as extracellular-signal-regulated kinase, ERK); MEK, MAPK kinase; mTOR, mammalian target of rapamycin; p300/CBP, p300/CREB-binding protein; PHD, prolyl hydroxylase domain protein; PI3K, phosphoinositide 3-kinase; pVHL, von Hippel–Lindau tumour suppressor protein; RTK, receptor tyrosine kinase; SIAH1a/2, seven in absentia homologue 1a/2; Ub, ubiquitination.
HIF-1α를 직접 표적화
이것은 전사 복합체의 일부로 기능하기 때문에 HIF-1α를 직접 표적화하는 것은 어렵습니다.
HIF-1α 발현과 전사 활성을 감소시키기 위해 특정 안티센스 접근법antisense approaches이 사용되었으며(참고 70 ), HIF-1α의 우성 음성 형태dominant negative form of HIF-1α 도 사용되었습니다(참고 71 ). 또 다른 접근법은 HIF-1α 단백질-단백질 상호작용을 차단하여 HIF-1 전사 활성을 억제하는 것입니다(Ref. 72 ). 예를 들어, HIF-1α와 보조 활성화제 p300/CBP 사이의 결합, 또한, PAS 도메인을 표적으로 하여 HIF-1α-HIF-1β 이량체화를 차단하는 롤리테트라사이클린(반합성 피롤리드노메틸테트라사이클린)과 같은 소분자는 HIF-1 compleex의 형성을 억제함으로써 종양 세포에서 HIF-1 매개 활성을 차단하는 전략을 제공합니다.
Targeting HIF-1α expression and/or HIF-1 activity indirectly
Prolyl hydroxylases
The p53 tumour suppressor protein
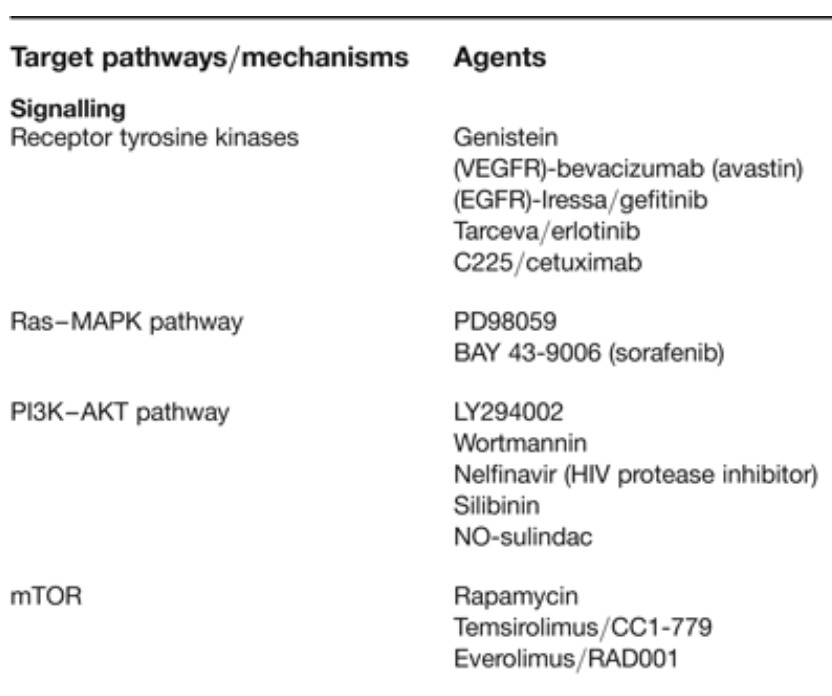
Table 2. Anticancer agents that decrease HIF-1α and target the HIF-1 pathway




HIF를 대상으로 하는 기타 메커니즘
HIF 경로를 표적으로 하기 위해 개발 중인 전략적 노력 외에도 HIF 기능의 알려진 조절자를 표적으로 하는 많은 인정된 항암제가 HIF-1α 단백질 수준 및/또는 HIF-1 활성을 차단하는 것으로 나타났습니다( 표 2 ).
예를 들어, 히스톤 데아세틸라제(HDAC) 억제제 트리코스타틴 A 및 FK228은 HIF-1α 유도 및 HIF-1 활성을 억제합니다(참고 문헌 107 , 108 , 109 , 110 , 111 ). HSP90 길항제인 Geldanamycin 및 17-AAG도 HIF-1α 발현 수준을 억제하는 데 효과적입니다(참고 112 , 113 , 114 , 115 , 116),
최근 연구에서는 디곡신이 HIF-1α 합성 및 종양 성장의 강력한 억제제임을 확인했습니다(참고 117 ).
최근에 등장한 다른 다루기 쉬운 HIF 레귤레이터에는 c-Myc, c-Met 및 Ras및 Wnt의 구성 요소가 있습니다.
억제할 HIF-α 소단위는?
암에서 HIF-α를 표적으로 하는 새로운 약제를 개발할 때 다른 세포 유형에서 특정 HIF-α(HIF-1α 또는 HIF-2α) 동형체에 의해 매개되는 특정 효과를 고려해야 합니다(참고 39 ).
단일 HIF-α 소단위를 표적으로 삼는 것은 서로 다른 소단위가 서로 다른 세포 상황에서 뚜렷한 역할을 할 수 있음이 입증되었기 때문에 반드시 원하는 효과를 제공하지 않을 수 있습니다(참조 39 , 41 , 127 , 128 ).
예를 들어, siRNA 기술을 사용하여 HIF-1α는 유방암과 내피 세포에서 일차 저산소증 유발 전사 인자인 것으로 보고되었습니다(Ref. 129),
반면에 신장 암종 세포에서는 HIF-2α가 저산소 유전자의 유도를 주로 담당하는 것으로 나타났습니다(참고 39 ).
이러한 발견은 HIF-1α가 MCF-7 유방암 세포에서 저산소증 조절 표적 유전자의 전사를 주로 조절하는 반면 HIF-2α는 포도당 수송체 1(GLUT-1 ) pVHL 기능을 상실한 신암 세포의 종양 진행(참고 39 , 43 , 130 ). 흥미롭게도, pVHL 결손 신암 세포에서 HIF-1α는 종양 억제 역할을 하는 것으로 밝혀졌습니다.
이들 세포주의 종양 촉진 HIF-α 소단위는 HIF-2α이기 때문에(참고문헌 43 , 118, 130 ), 이 소단위를 표적으로 하는 치료가 더 유익할 수 있습니다(참조 39 ).
HIF-1α 및 HIF-2α 또는 서브유닛 중 하나를 선택적으로 표적화하는 것이 생체내에서 더 나은 치료 효과를 제공하는지 여부를 평가하는 것이 중요합니다.
최근 연구에 따르면 pVHL 결손 신장 암종 세포는 검출 가능한 HIF-1α 및 HIF-2α 또는 HIF-2α만 있는 종양으로 더 세분화될 수 있음이 밝혀졌습니다(참고 119 ).
따라서, HIF-1α 및 HIF-2α가 검출 가능한 종양은 AKT-mTOR 및 MAPK 경로 및 γH2AX(인산화 히스톤 H2AX) 축적의 향상된 활성화를 나타내는
반면, HIF-2α 발현만 있는 종양은 증가된 c-Myc 활성을 나타냅니다. 이들 종양과 관련된 확인된 발암성 경로는 이들 상이한 종양 하위유형에 대해 사용될 조합 표적 요법의 전략적 선택을 가능하게 할 수 있다.
결론
저산소성 종양은 일반적으로 방사선 요법 및 기존 화학 요법에 의한 사멸에 내성이 있어 매우 공격적이고 전이성이 있습니다.
세포의 산소 항상성과 저산소 스트레스에 대한 반응은 주로 HIF 경로에 의해 매개됩니다.
그러나 HIF 경로의 조절장애는 많은 인간 암에서 발생하며 일반적으로 기존 치료법을 사용하는 불량한 예후 결과와 상관관계가 있습니다.
따라서 HIF 경로를 표적으로 하는 것은 저산소성 및 고도의 혈관신생 종양을 치료하는 매력적인 전략을 제공합니다.
HIF 억제제와 기존 치료법 또는 새로운 표적 치료법의 조합은 임상적으로 유용한 것으로 입증될 수 있습니다.
그러나 적절한 바이오마커 종점의 식별과 함께 종양의 저산소증을 정확하게 측정하기 위한 적절한 영상 전략의 개발은 새로운 치료 조합의 클리닉으로의 번역을 가속화할 뿐만 아니라 다양한 암 유형에 특정 치료법을 맞춤화하는 데 도움이 되는 예후 정보를 제공할 것입니다.
HIF 억제제는 전임상 및 임상 개발 중이며 고형 종양 치료를 위한 새롭고 매력적인 접근 방식을 제공합니다.
'전사인자' 카테고리의 다른 글
| HIF-1 표적 (0) | 2021.10.20 |
|---|---|
| HIF-1 및 HIF-2 및 이들의 신규 억제제 (0) | 2021.10.20 |
| HIF-1 α 경로: 암 치료를 위한 역할, 조절 및 개입 (0) | 2021.10.20 |
| 암 치료용 HIF-1 억제제 개발 (0) | 2021.10.20 |
| HIF-1을 표적으로 하는 플라보노이드: 암 대사에 미치는 영향 (0) | 2021.10.20 |
