2021
Phytochemicals as a Complement to Cancer Chemotherapy: Pharmacological Modulation of the Autophagy-Apoptosis Pathway
https://www.frontiersin.org/articles/10.3389/fphar.2021.639628/full
Phytochemicals as a Complement to Cancer Chemotherapy: Pharmacological Modulation of the Autophagy-Apoptosis Pathway
Bioactive plant derived compounds are important for a wide range of therapeutic applications, and some display promising anticancer properties. Further evidence suggests that phytochemicals modulate autophagy and apoptosis, the two crucial cellular pathway
www.frontiersin.org
화학 요법 내성은 다중 약물 내성, 세포 사멸 메커니즘의 변경(자가포식 및 세포 사멸), 약물 대사의 변화, 후성 유전 및 약물 표적, 향상된 DNA 복구 및 유전자 증폭, 종양 세포 이질성, 약물 유출 및 약물 노출에 대한 세포 반응으로서 대사, 종양 미세 환경 스트레스 유발 유전 또는 후성 유전적 변화등으로 인해 발생합니다.이러한 메커니즘 중 두 가지 자기 파괴적 과정인 자가포식('자가 먹기')과 세포자멸사('자가 살해')의 변경은 화학 요법 내성의 중요한 원인입니다.
https://cdrjournal.com/article/view/3039

세포외 ATP 유도 내성을 포함하여 이 리뷰에서 설명된 암의 약물 내성과 관련된 세포, 단백질 인자 및 메커니즘.
ABC: ATP 결합 카세트; RTK: 수용체 티로신 키나제; EGFR: 표피 성장 인자 수용체; TAM: 종양 관련 대식세포
진화적으로 보존되고 조절되는 세포 재활용 메커니즘인 자가포식은 대사 및 치료 스트레스의 핵심 역할로 부상했습니다. 실제로, 이 메커니즘은 불필요한 단백질과 손상되거나 노화된 세포 소기관의 이화 분해를 통해 대사 항상성을 유지하거나 복원하려고 시도합니다.
암 치료에서 자가포식의 역할은 역설적입니다. 이는 항암제의 세포독성 효과를 중화하거나 매개하는 생존 또는 사망을 촉진하는 메커니즘으로 작용할 수 있습니다.
자가포식은 주로 세포 내 활성산소종(ROS)을 조절하고 유전적 불안정성을 유지함으로써 종양 억제인자로 기능합니다.
또한 잘못된 자가포식은 암 줄기 세포의 악성 형질전환과 관련이 있습니다.
이러한 조건에서 자가포식 자극은 초기 종양 형성 및 발달을 중단시키는 중요한 접근 방식일 수 있습니다.그러나 자가포식은 이동 및 상피에서 중간엽으로의 전환 동안 현재 종양의 성장과 생존을 촉진할 수 있습니다.
또한, 이 과정은 암 줄기 세포가 면역 감시를 피하고 암 세포가 아노이키스에 내성을 갖도록 도울 수 있습니다.
이와 관련하여 autophagy의 억제는 화학 요법으로 인한 세포 독성을 증가시킵니다. 따라서 상황에 따라 작동하는 양날의 검인 autophagy는 종양 형성의 초기 단계를 차단하는 동시에 후기 단계에서 종양 침습 및 전이의 동인이 됩니다.
이러한 서로 다른 작용 모드 사이의 전환을 조절하는 분자 메커니즘은 잘 알려져 있지 않습니다.
그럼에도 불구하고 세포자살과 자가포식 사이의 상호작용은 암 치료를 개선하는 데 활용할 수 있습니다.
암세포는 하향조절된 프로-아폽토시스 신호, 상향조절된 항-아폽토시스 신호, 잘못된 아폽토시스 개시 및 실행과 같은 잠재적인 아폽토시스 기전의 일부를 탈출함으로써 화학요법에 내성을 갖게 됩니다.
그러나, apoptosis와 autophagy 사이의 기능적 관계는 복잡하고 최근에 분자 수준에서 해독되었습니다.
따라서 autophagic 및 apoptotic 경로의 핵심 요소를 조절하는 것은 화학 요법 효율성을 향상시키는 새로운 치료 전략이 될 수 있습니다.
이 리뷰에서 우리는 암의 자가포식과 세포자멸사의 분자 메커니즘을 요약합니다. 암 치료에서 식물 화학 물질의 중추적인 역할을 감안할 때, 우리는 암 화학 요법 결과를 향상시키기 위해 autophagy 및 세포 사멸 관련 신호 전달 경로를 조절할 수 있는 다양한 식물 화학 물질에 대해 논의하고자 했습니다.

그림 1 . autophagic 경로의 분자 메커니즘.
Autophagy는 pre-autophagosomal 구조의 형성에 의해 시작됩니다.
PI3K-AMPK와 포유류의 라파마이신 표적(mTOR)은 자가포식소체 전 구조의 형성에 기여합니다.
ULK1, Vps34 및 Beclin-1 복합체는 식세포 형성을 활성화하는 데 도움이 됩니다.
phagophore nucleation이 연장된 후 autophagosome에 대한 후속 결합이 발생합니다.
성숙한 autophagosome과 lysosome 사이의 결합은 autolysosome 형성을 초래합니다.
마지막으로, autolysosome은 산 가수분해효소를 통해 제거되어 영양소를 생성하고 대사산물을 재활용합니다.

그림 2. 암에서 세포 사멸 경로의 메커니즘.
세포 사멸을 시작하기 위해 두 가지 중심 경로,
즉 내인성 경로와 외인성 경로가 이 메커니즘에 관여합니다.
세포 사멸의 외부 경로는 TNF-α/TNFR1 및 FasL/FasR 모델에 의해 잘 정의됩니다.
여기서, 사멸 수용체는 어댑터 단백질에 의해 유도되고; 어댑터 단백질은 FADD(Fas 관련 사멸 도메인) 및 TRADD(TNF 수용체 관련 사멸 도메인)로 구성됩니다.
외부 경로를 통해 발생하는 신호 전달은 DR(사멸 수용체)이 특정 사멸 리간드(DL)에 부착되도록 하여 사멸 유도 신호 캐스케이드(DISC)를 형성합니다.
대부분의 세포 사멸 세포에서 단백질은 관례적으로 caspase-9, SMAC/DIABLO, Bcl-2, Bcl-w, Aven, Nox 및 MYC를 포함하는 고유 단계에 관여합니다.
미토콘드리아 기능 장애는 내막 미토콘드리아 전위의 상실,
과산화물 이온의 적절한 형성,
미토콘드리아 생물 형성 장애,
막내(intra-membrane) 단백질의 방출 및
기질 칼슘(matrix calcium) 글루타티온 파열(Burst)로 이어지며,
이는 내인성을 유발하여 종양 세포에서 세포자멸사의 고유 단계를 촉발함으로써 암 치료 전략의 중요한 잠재력을 나타냅니다.
caspase-8/-9 또는 caspase-activated dnase(CAD), Poly(ADP-ribose polymerase(PARP)) 및 기타 caspase-3, -6, -7, 및 caspase-10은 카스파제의 상향 조절기 또는 집행자 카스파제로 대표됩니다.
Caspase-3는 모든 initiator caspase에 의해 활성화될 수 있기 때문에 모든 이펙터 caspase 중에서 가장 중요하고 효과적입니다.

표 1. 다양한 시험관내 및 생체내 암 모델에서 자가포식 및 세포자멸사를 활성화하는 식물화학물질.
자가포식 신호에 관여하는 천연물질
아피게닌은 여러 키나제 경로를 조절하고 G2/M 단계에서 세포 주기를 억제하는 플라보노이드 유도체입니다. 연구에 따르면 아피게닌은 HepG2 세포에서 시간 및 용량 의존적 방식으로 세포 성장을 억제하고 자가포식을 유도할 수 있습니다( Zhong et al., 2010 ). Autophagy는 또한 HepG2 세포에서 PI3K/Akt/mTOR 경로의 억제를 통해 매개되는 것으로 밝혀졌습니다 ( Yang et al., 2018 ).
유기 황 화합물인 알리신은 PI3K/mTOR 신호 전달 경로를 억제하여 자가포식 세포 사멸을 활성화하는 항종양제로 작용합니다( Sak, 2012 ). Allicin은 또한 p53 및 Bcl-2의 발현을 억제하고 Beclin-1 신호 전달 및 AMPK/TSC2 신호 전달 경로를 상향 조절합니다( Chu et al., 2012).
검은콩에 존재하는 안토시아닌(ACN)은 자가포식을 유도합니다. 그러나 그들의 기본 메커니즘은 아직 결정되지 않았습니다( Choe et al., 2012 ).
Aspalathin은 Dox로 인한 심장 독성을 억제하고 P53 발현을 감소시키는 데 중요한 역할을 하는 폴리페놀계 디히드로칼콘 C-글루코시드입니다. Aspalatin은 autophagy 관련 유전자를 유발하고 AMPK 및 Fox 경로를 유도하여 p62를 감소시켰습니다( Johnson et al., 2017 ).
베르베린은 AMPK/mTOR/ULK1 경로를 억제하여 자가포식 유도를 위한 항암 활성을 발휘하는 이소퀴놀린 알칼로이드입니다( Wang et al., 2016a). Celastol은 인간 전립선암에 효과적인 또 다른 트리테르페노이드입니다.
Celastol은 자가포식을 유도하고 miR-101의 발현을 하향 조절하는 AR 신호 전달 경로를 차단합니다( Guo et al., 2015 ).
코디세핀은 암세포에서 ROS를 생성하고 p53 및 LC3I/II 발현을 향상시켜 자가포식을 조절합니다( Chaicharoenaudomrung et al., 2018 ). 코디세핀은 microRNA-21 발현과 Akt 인산화를 감소시키고 PTEN 포스파타제 수준을 증가시켜 Caki-1 세포주의 이동에서 신암을 억제합니다( Yang et al., 2017 ). 또한 코디세핀은 SKOV-3 및 OVCAR-3을 포함한 난소암 세포주에서 Bax 활성화를 통해 자가포식 을 유도합니다 ( Jang et al., 2019).
커큐민은 암세포에서 ROS와 DNA 손상을 증가시키는 것으로 나타났습니다. 또한 커큐민은 ERK1/2 및 p38 MAPK의 인산화를 증가시키고 Akt와 P54 JNK를 억제했으며( Masuelli et al., 2017 ), 결국 NSLCA549 세포에서 자가포식을 유도했습니다( Liu et al., 2018 ).
퀴놀론 알칼로이드인 에보디아민은 Beclin-1 및 Bax 발현을 상향 조절하고 Bcl-2를 하향 조절하여 자가포식 활성화를 매개합니다( Rasul et al., 2012 ).
피세틴은 전립선암 세포에서 Akt 억제 및 AMPK 활성화 및 자가포식 프로그램된 세포 사멸을 통해 mTOR 신호 전달 경로 를 억제하는 것으로 보고된 자연 발생 플라보노이드입니다 ( Suh et al., 2010).
유사하게, 제니스테인은 암세포에서 화학예방 및 화학치료 효과를 나타냈습니다. 난소암 세포를 제니스테인으로 치료하면 Akt 인산화의 감소와 자가포식 유도가 유도되어 암세포의 포도당 흡수 감소에 기여합니다( Gossner et al., 2007 ).
진세노사이드 F2는 항증식 활성을 보여 유방암 줄기세포에서 자가포식 과정을 시작했습니다. 동시에 진세노사이드 F2는 Atg-7 수준을 높이고 산성 혈관 소기관의 형성을 유도하며 GFP 태그가 붙은 LC3-II를 자가포식소체로 모집했습니다( Mai et al., 2012 ).
Phellinus igniarius 에서 분리된 페놀 화합물인 Hispolon(L.) Quél.은 자궁경부암 세포주에서 세포자멸사 및 항종양 효과를 나타내었고 특히 자가포식을 유도했습니다. 히스폴론 치료는 리소좀 프로테아제 카텝신 S(CTSS)를 하향 조절하여 전이를 억제했습니다( Chen et al., 2012 ). 또한, 히스폴론은 ERK 경로를 기계적으로 차단하고 LC3 전환 및 산성 소포 소기관 형성을 향상시키는 것으로 밝혀졌습니다( Hsin et al., 2017 ).
3'-hydroxydaidzein(3'-ODI)은 자가포식을 유도하는 또 다른 식물화학적 유도체입니다. 실제로 흑색종 세포에서 α-MSH 매개 멜라닌 생성을 유의하게 감소시키는 것으로 밝혀졌습니다( Kim et al., 2013 ).
Antira toxicaria Lesch. 에서 추출한 천연물 Toxicarioside O 는 자가포식 유도를 통해 항암 력을 나타냈습니다 .Akt/mTOR 경로의 후속 감소를 통해 ( Huang et al., 2017 ).
천연 폴리엔인 팔카린디올(FAD)( Minto and Blacklock, 2008 )은 ER 스트레스( Jin et al., 2012 ) 에 대한 반응으로 자가포식을 촉진 하는 반면,
α-망고스틴은 인간 교모세포종 세포에서 AMPK 활성화를 통해 자가포식 세포 사멸 을 매개 합니다( Chao et al. , 2011 ).
바이오플라보노이드인 케르세틴은 항암 및 항염 작용을 합니다. 과민성 원발성 삼출 림프종(PEL)에서 케르세틴은 사이토카인의 방출을 감소시키고 PI3K/Akt/mTOR 및 STAT3 경로 유도 자가포식을 억제하여 궁극적으로 PEL 세포 사멸을 초래했습니다( Granato et al., 2017).
유방암 증기 세포에서 rottlerin(Rott)은 자가포식 동안 LC3, Beclin-1 및 Atg12 응집의 발현을 향상시켰습니다.
실리비닌(실리빈)은 신세포암(RCC)에 대한 항전이 효과를 나타낼 수 있는 화학보호 플라보노이드입니다. 실리비닌은 mTOR 조절을 억제할 뿐만 아니라 AMPK 경로를 활성화하는 LC3-II의 발현을 증가시켰습니다( Li et al., 2015 ).
설포라판(SFN)은 이소티오시아네이트라고 하는 식물화학물질 그룹입니다( Uddin et al., 2020 ). 여러 연구에 따르면 SFN 유도 세포 사멸의 자가포식은 세포독성 효과를 나타내지 않으면서 ROS를 방출하여 저항성이 높은 췌장암 세포를 제거합니다( Naumann et al., 2011 ; Uddin et al., 2020).
Gintonin은 일차 피질 성상세포에서 Akt/mTOR/p70S6K 매개 경로를 통해 자가포식 플럭스 를 자극하는 것으로 밝혀졌습니다 ( Rahman et al., 2020b ).
5환 트리테르페노이드인 Ursolic acid(UA)는 G1 위상 정지 를 통해 항증식 효과 를 보였고 beclin-1 및 Akt/mTOR 경로를 통해 자가포식 조절을 유도했습니다( Shin et al., 2012 ).
Tripterygium에는 Tripchlorolide가 존재합니다. 트립클로로라이드 처리는 PI3K/Akt/mTOR 신호전달 경로의 발현을 약화시키는 것으로 밝혀졌습니다( Chen et al., 2017a ).
Tetrandrine은 한약재인 Stephania tetrandra 에서 분리된 비스벤질이소퀴놀린 알칼로이드입니다.S. 무어. Tetrandrine은 인간 간세포 암종의 억제에 중요한 역할을 하고 Wnt/β-catenin 경로를 억제하며 MTA1 발현을 감소시켜 결국 자가포식을 유발합니다( Zhang et al., 2018 ).
N-desmethyldauricine은 Ulk-1/PERK/AMPK mTOR의 억제에 의해 매개되는 새로운 자가포식 유도제이며 칼슘 축적을 일으켜 자가포식 세포사를 유발합니다( Law et al., 2017 ).
Quinacrine은 p53 및 p21 조절을 강화하고 토포이소머라제 활성을 억제하여 유방암 세포에서 항암 특성을 나타냈습니다( Mohapatra et al., 2012).
탄게리틴의 항증식 활성은 자가포식을 조절하고 MDA-MB-468 및 MCF-7 세포에서 CYP1 효소 및 CYP1A1/CYP1B1 단백질을 유도함으로써 항암 활성을 개시합니다( Surichan et al., 2018 ).
여러 연구에 따르면 licochalcone A 치료는 LC3-II 신호 전달 경로를 활성화하고 PI3K/Akt/mTOR 경로를 억제하여 MCF-7 세포에서 자가포식을 촉진하는 것으로 나타났습니다( Xue et al., 2018 ).
또한, 오피오포고닌 B는 PI3K/Akt/mTOR 신호 전달 경로를 억제하여 자가포식을 유도하는 것으로 밝혀졌습니다( Chen et al., 2013a).
일반적으로 녹색 껍질에서 추출되는 유글라닌(juglanin)에서도 항암 활성이 나타났습니다. Juglanin 매개 치료는 인간 유방암에서 ROS/JNK 신호 전달 경로를 조절하여 G2/M 단계 정지를 약화시키고 자가포식을 유도했습니다( Sun et al., 2017a ).
Cucurbitacin B(Cuc B)는 일반적으로 항염증제로 사용되는 또 다른 천연 사환식 트리테르펜 화합물입니다( Chen et al., 2005 ). Cuc B 처리는 γH 2 AX 단백질 발현을 증가 시키고 ATM/ATR의 인산화를 통해 DNA 손상을 촉진하며 동시에 MCF-7 세포에서 자가포식을 유도하는 ROS의 수준을 증가시킵니다( Ren et al., 2015 ).
세포자멸사 신호전달에 관여하는 천연물질
Angelicin을 함유한 Angelica polymorpha Maxim은 SH-SY5Y 인간 신경모세포종 세포에서 Bcl-xL, Bcl-2, Mcl-1을 포함한 항세포사멸 단백질의 발현을 감소시켜 세포의 세포독성을 증가시키고 세포사멸을 유도한다( Rahman et al., 2012b , Rahman et al., 2012b ).
FAD 유발 세포 사멸은 카스파제 의존적 조절에 의해 유발되는 것으로 알려져 있기 때문에, FAD는 암세포를 죽이도록 설계된 여러 승인된 암 약물에 상승 효과가 있는 것으로 제안됩니다( Lu et al., 2017 ).
Alisol B는 CaMKK-AMPK-mTOR 신호 전달 경로, 칼슘 동원 및 강화된 ER 스트레스를 조절하여 자가포식을 유도하여 세포 사멸을 유도합니다( Law et al., 2010).
루테올린은 다양한 식물에서 발견되는 플라보노이드로 G0/G1기 세포주기 정지를 통해 간세포암 세포주에서 주도적인 역할을 하는 것으로 알려져 있습니다. 연구에 따르면 루테올린 치료는 caspase-8 발현을 증가시키고 mRNA 수준에서 Bcl-2를 감소시키며 LC3B-I에서 LC3B-II로의 전환을 개선하고 SMMC-7721 세포의 생존력을 감소시켜 세포자멸사를 유도하는 것으로 나타났습니다( Cao et al. ., 2017 ).
인간 암종 BEL-7402 세포주에서 오리도닌 매개 세포자멸사는 세포 성장을 억제할 수 있는 감소된 Bcl-2 발현 및 Bax 상향 조절뿐만 아니라 카스파제-3의 활성화에 의해 유도되는 것으로 밝혀졌습니다( Zhang et al., 2006).
유방 CSC에서 Rott로 장기간 치료하면 Akt와 mTOR의 인산화를 억제하고 AMPK의 인산화를 상향 조절하여 결국 세포 사멸을 상향 조절합니다( Kumar et al., 2013 ).
비타민 E 이성질체인 γ-토코트리에놀( Ling et al., 2012)는 Ang-1/Tie-2를 표적으로 하고 AMPK 신호 전달의 활성화를 통해 항암 효과를 발휘하여 인간 전립선암 세포주에서 세포 사멸을 유도하는 것으로 알려져 있습니다( Tang et al., 2019 ).
Triptolide는 췌장암 세포에서 세포자멸사를 유도하여 Akt/mTOR/p70S6K의 비활성화와 ERK1/2 경로의 상향조절을 유발했습니다( Mujumdar et al., 2010 ).
Kaempferol은 ROS 및 p53 신호를 생성하고 p38 인산화 및 caspase 활성화를 조절하여 대장암 세포의 세포자멸사를 유도하는 플라보노이드 화합물입니다( Choi et al., 2018 ).
미리세틴은 다양한 과일과 채소에서 발견되는 천연 플라보노이드입니다. 이전 보고서에서는 미리세틴이 세포 사멸을 촉진하여 종양 세포 성장을 약화시켰다고 제안했습니다.Cao et al., 2018 ). 미리세틴은 P1M1을 억제하고 P1M1과 CXCR4 사이의 상호작용을 하향 조절함으로써 전립선암 세포에 대해 세포자멸사 및 세포독성 효과를 발휘합니다( Ye et al., 2018 ).
Galangin은 Bax 및 Cyt-c의 발현을 증가시키고 Bcl-2 발현을 감소시켜 신장암 세포에서 세포자멸사를 유도했습니다( Zhu et al., 2018 ).
인간 유방암 세포주에서 isorhamnetin은 S기에서 세포 주기 정지를 유도하여 종양 성장을 억제 하고 ROS 의존적 세포자멸사 경로 를 통해 강력한 세포독성 효과 를 나타냈습니다 ( Wu et al., 2018 ). H522 세포에서 Hesperet은 caspase-3/9, p53 및 Bax 발현을 하향 조절하고 Fas, FADD 및 caspase-8 발현을 상향 조절하여 세포 사멸을 유도했습니다.Elango et al., 2018 ).
Cyanidin-3-glucoside(C3G)는 과일에서 발견되는 ACN입니다. C3G는 항염증 특성을 발휘하고 miR - 124 발현을 유도 합니다. 동시에 miR- 124 조절은 STAT3를 하향 조절하고 인간 유방암에서 C3G에 의해 유도된 혈관신생을 억제합니다( Ma and Ning, 2019 ).
벤질 이소티오시아네이트(BITC)는 십자화과 야채에 존재합니다. BITC를 마우스에 투여하면 PI3K/Akt/FOXO1/PDK1/mTOR/FOXO3a의 인산화가 감소하여 췌장암 세포 성장을 억제하고 세포자멸사를 유도했습니다( Boreddy et al., 2011).
여러 연구에서 글루코시놀레이트 유래 페네틸 이소티오시아네이트(PEITC)가 유망한 항종양제라고 보고했습니다. 실제로, PEITC 처리된 마우스는 HER2, EGFR 및 STAT3의 감소된 발현을 나타내고 카스파제 3 및 PARP의 절단을 통해 향상된 세포자멸사를 나타내는 것으로 밝혀졌습니다( Gupta 및 Srivastava, 2012 ).
NCTD는 c-Met 및 mTOR를 억제하고 항암 특성을 나타냅니다( Sun et al., 2017b ).
Autophagic-Apoptotic 신호 전달의 식물 화학 물질
β-Elemene은 Curcuma WenYuJin과 같은 다른 약용 식물에서 수집된 천연 화합물입니다( Edris, 2009 ). β-엘레멘은 LC3-I를 LC3-II로 전환하여 자가포식을 활성화하고 세포 자멸사 를 통해 인간 유방암 세포의 시험관 내 성장을 현저히 감소시키는 자가용해소체를 형성함으로써 세포 보호 활성을 발휘합니다 ( Guan et al., 2014 ).
캡사이신은 PI3K/Akt/mTOR 경로를 하향 조절하여 항종양 효능을 발휘하는 또 다른 자연 발생 식물화학물질입니다. 캡사이신은 자가포식 마커인 LC3-II 및 Atg5의 발현을 증가시켜 자가포식 과정을 유발하고 p62 및 Fap-1의 분해를 향상시키면서 caspase-3 활성을 증가시킵니다( Lin et al., 2017a ).
NS뽕나무 L. 뿌리 추출물 함유 oxyresveratrol 은 인간 신경 아세포종 세포에서 FOXO - 카스파 제 -3 통로를 통해 ROS를 축적 autophagic 및 아폽토시스 세포 사멸을 유도하는 것으로 밝혀졌다 ( 권 등, 2015. , 라만 등의 문헌 (2017). ).
Gingerol은 항산화, 항염 및 항종양 특성을 가지고 있으며( Shukla and Singh, 2007 ; Baliga et al., 2011 ), 카스파제 의존 경로를 활성화하고 동시에 자가포식을 유도하는 PARP를 절단함으로써 결장암 세포 증식을 억제합니다( Radhakrishnan et al., 2014).
honokiol(Hono)과 magnolol(Mag)의 동시 치료는 신경교종 세포 U87MG 및 LN229 인간에서 세포 주기 진행을 정지시키고 p-PI3K, p-Akt 및 Ki67 발현을 감소시키는 cyclin A, D1 및 cyclin-dependent kinase의 발현을 감소시켰습니다. Hono 및 Mag 매개 치료는 모두 세포 증식을 억제하여 상승적인 항종양 효과를 나타냅니다. 따라서 이들은 인간 GMB 세포에서 자가포식 및 세포자멸사를 유도합니다( Cheng et al., 2016 ). 6-
Shogaol은 Akt/mTOR 매개 신호 전달 경로를 방해합니다. Akt의 차단은 세포 사멸에 유익합니다. 6-Shogaol은 Akt 과발현 억제를 통해 자가포식을 유도하고 비소세포폐암에 대한 항암 활성을 나타낸다( Hung et al., 2009).
블랙 커민의 주요 성분인 티모퀴논(TQ)은 여러 암세포주에서 강력한 세포독성 효과를 나타냅니다. SASVO3 세포에서 TQ는 Bax 발현의 향상으로 인한 세포 사멸을 매개하고 세포자멸사 및 자가포식 후 자가포식 액포 및 LC3-II 단백질 발현을 증가시키는 것으로 밝혀졌습니다( Chu et al., 2014 ).
이전에 발표된 연구에서 우리는 갭 접합 억제제인 18α-Glycyrrhetinic acid(18-GA)가 세포자멸사와 자가포식을 유도한다는 것을 밝혔습니다. 18-GA 유도 자가포식은 p62 분해를 통해 Atg5, Atg7 및 LC3II 축적을 유도하는 것으로 나타났습니다( Rahman et al., 2016b). 18-GA는 또한 Bcl-2/Beclin-1 상호작용과 Beclin-1 절단을 불안정하게 하는 것으로 밝혀져 궁극적으로 SH-SY5Y 세포에서 미토콘드리아 매개 세포자멸사의 발생을 강조합니다( 그림 4 ). 18-GA는 또한 여러 MAPK를 활성화하고 세포 주기를 정지시켜 세포자멸사를 활성화시키는 것으로 알려져 있습니다. 따라서 18-GA는 신경모세포종의 세포자멸사-자가포식 경로에 대한 치료 표적으로 사용될 수 있습니다.
델피니딘은 강력한 항산화 특성을 가진 안토시아니딘 단량체입니다. HER-2 양성 유방암 세포에서 델피니딘은 mTOR를 억제하고 AMPK 신호 전달 경로를 활성화하여 세포자살과 자가포식을 향상시킵니다( Chen et al., 2018 ).
새로운 증거는 에피카테킨-3-O-갈레이트(EGCG)가 다양한 암 라인에서 자가포식 및 세포자멸사를 촉진한다는 것을 보여주었습니다( Siddiqui et al., 2011 ; Grube et al., 2018 ; Stadlbauer et al., 2018 ).
이전에 OxyR은 NB에서 세포자멸사와 자가포식을 동시에 활성화하는 것으로 밝혀졌습니다. OxyR은 또한 PI3K/Akt/mTOR 신호전달을 감소시키고 자가포식 수준을 증가시켜 세포독성을 향상시킵니다( 그림 5 )( Rahman et al., 2017). OxyR-유도된 세포 사멸은 SH-SY5Y 세포에서 PI3K/Akt/mTOR 및 p38 MAPK 활성 수준의 변경으로 인해 세포자살 유도와 무관하게 발생하는 것으로 밝혀졌습니다.
Saikosaponin-d는 CaMKKβ-AMPK-mTOR 경로를 활성화하여 세포 내 칼슘 축적과 자가포식을 유도하는 것으로 보고되었습니다. 그럼에도 불구하고, 사이코사포닌-d에 의한 ER 스트레스와 UPR 활성화는 세포자멸사 및 자가포식 세포사를 유발하는 것으로 입증되었습니다( Wong et al., 2013 ).
Isoliquiritigenin(ISL)은 난소암 세포주(OVCAR5)와 ES-2 모델의 생존을 방해합니다. ISL은 또한 G2/M 단계에서 세포 주기 정지, 절단된 카스파제-3, LC3B-II 및 Beclin-1 발현 증가 를 통해 OVCAR5에서 자가포식을 유도했습니다 ( Chen et al., 2017b ).
garcinia yunnanensis Hu 에서 분리된 Guttiferone K(GUTK) ( Xu et al., 2008)는 Akt 인산화를 감소시키고 mTOR 경로를 억제하는 것으로 밝혀졌습니다. GUTK는 또한 ROS를 강화하고 EBSS에서 JNK의 인산화를 유발하여 영양소 결핍 조건에서 자가포식 및 세포자멸사를 유도했습니다
ROS 신호 전달을 통해 자가포식-아폽토시스를 조절하는 천연물질
O 2 •− , H 2 O 2 및 • OH 와 같은 ROS 는 생물학적 시스템에 의해 대사 부산물로 생성됩니다. 이러한 세대는 유익한 건강 결과뿐 아니라 해로운 결과를 유발할 수 있습니다.
최적 수준의 ROS는 세포 신호 전달, 단백질 활성화, 면역 기능 및 전사 인자, 세포 사멸 및 분화 조절과 같은 다양한 생물학적 과정에 필요합니다.
그러나 ROS의 과잉 생산은 다양한 단백질, 지질 및 핵산에 해로운 영향을 미칠 수 있습니다
따라서 ROS 수준의 불균형은 암과 같은 여러 질병의 원인이 될 수 있습니다.
세포의 ROS 수준도 암 진행에 중요합니다.
ROS 매개 DNA 손상은 발암의 시작과 진행에 중요한 역할을 할 수 있습니다.
가역적 DNA 손상은 내부 복구 시스템이 ROS의 부작용을 정상화하도록 할 수 있습니다. 그러나 돌이킬 수 없는 손상으로 인해 수리 시스템이 제대로 작동하지 않을 수 있습니다. 결과적으로 세포는 세포 사멸을 겪으며 이는 암 치료에 상당한 영향을 미칩니다.
항산화 천연물질은 산화 스트레스 유발 화합물의 농도, 노출 시간 및 능력에 따라 ROS 신호전달은 표적 암세포에서 자가포식 활성화제 또는 세포자멸사 개시제로 작용할 수 있습니다.
EGCG는 녹차에 가장 풍부한 폴리페놀입니다. EGCG는 ROS를 촉진하여 인간 중피종 세포 사멸에서 세포자멸사 및 자가포식을 유도하는 것으로 밝혀졌습니다( Satoh et al., 2013 ).
에피카테킨은 자가포식 및 소포체(ER) 스트레스 유발 인간의 다양한 질병의 세포사멸을 조절하는 것으로 나타났습니다
적포도주와 포도에서 발견되는 갈산(3,4,5-trihydroxy-benzoic acid)은 자동 산화로 작용하여 H 2 O 2 및 O 2 - 를 생성 하여 전립선암 세포에서 내재적 미토콘드리아 매개 세포자멸사를 유도합니다.
갈산은 ROS 수준 을 높이고 GSH를 고갈 시켜 폐암 세포 성장 을 방지합니다 .갈산은 추가로 JNK 경로의 ROS 매개 활성화를 통해 세포자멸사를 촉진합니다
카테킨 유래 퀴논의 산화는 또한 ROS 조절을 통한 자가포식 세포사뿐 아니라 세포자멸사를 통해 여러 인간 암세포에서 항종양 활성을 초래하는 것으로 관찰되었습니다 .
따라서 산화 스트레스 신호의 활성화가 예상치 못한 부작용과 항상 관련이 있는 것은 아닙니다.
고용량의 EGCG는 산화촉진 효과를 발휘하여 궁극적으로 자가포식 활성화와 항종양 활성을 증가시킵니다.
EGCG는 PI3K/Akt 신호전달의 억제( Liu et al., 2016 ), 미토콘드리아 막 전위의 감소( Li et al., 2009 ) 및 Bcl을 포함한 항-세포사멸 단백질의 발현을 포함한 다양한 메커니즘을 통해 암세포에서 세포자멸사를 유도합니다
퀘르세틴은 암에서 ROS 자극 된 세포 사멸 및 자식 작용을 촉진하는 것으로 확인되었다 ( 최 등, 2008. , 비스무트 등의 문헌 (2016). )
암세포에서 커큐민 은 ROS 매개 DR5 상향 조절( Jung et al., 2005 )을 통해 TRAIL 유도 세포자멸사 를 강화 하고 ROS-ERK1/2-p38 MAPK 신호 전달 경로를 통해 자가포식을 활성화합니다( Lee et al., 2011 ).
레스베라트롤은 또한 유익한 효과를 갖는 것으로 입증되었습니다( Moni et al., 2018 ) ROS 의존성 카스파제 활성화( Shankar et al., 2007 ) 및 Bax/caspase-3( Whitlock and 백, 2012 ) 를 통해 세포 사멸 을 촉진하고 세포 사멸 을 유도합니다. 암세포의 미토콘드리아 기능 장애와 관련이 있습니다( Lin et al., 2012 ).
그림 6 과 같이, phytochemicals는 autophagy-apoptosis 경로로 인해 암세포 제어의 중요한 조절자입니다.
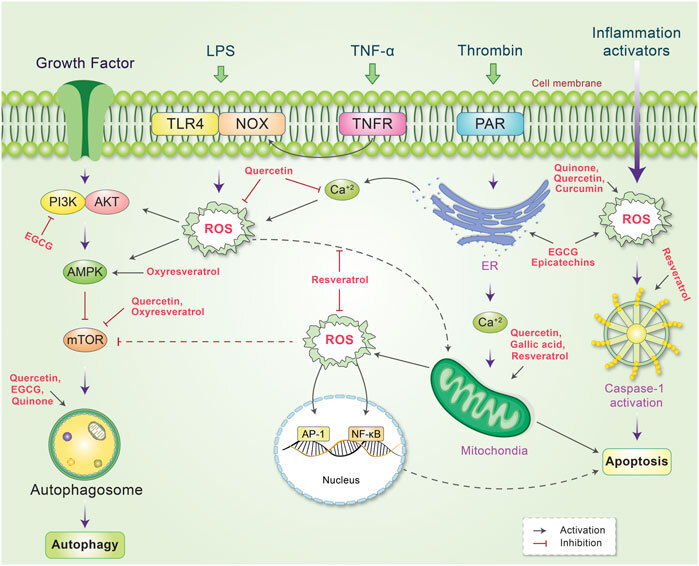
그림 6.
여러 신호 경로의 제어로 이어지는 식물 화학 물질 및 활성 산소 종(ROS)의 작용 메커니즘의 도식적 표현.
ROS는 여러 내부 및 외부 자극에 의해 생성됩니다.
외부적으로, ROS는 성장 인자, LPS, TNF-α, 트롬빈 및 염증을 통해 활성화됩니다.
다양한 천연물질이 그들의 작용을 억제하거나 자극함으로써 세포의 ROS 수준을 제거하거나 감소시키는 것으로 밝혀졌습니다.
내부적으로 천연물질은 자가포식을 활성화하고 ROS 생성을 감소시키는 PI3K 또는 mTOR를 억제합니다.
일부 천연물질은 미토크론드리아 ROS 생성을 활성화하는 반면 다른 천연물질은 ROS를 청소하고 DNA 손상을 방지합니다.
ER 및 염증 활성화제에 의해 매개되는 ROS 생성은 또한 자가포식-세포자멸사 경로를 조절하는 식물화학물질에 의해 감소됩니다.
암 예방을 위한 자가포식-아폽토시스 조절에서 천연물질의 치료 표적
폴리페놀 화합물과 알칼로이드는 다른 모든 암 치료제 중에서 특히 우세합니다( Newman and Cragg, 2016 ).
폴리페놀은 항산화 특성으로 인해 세포자멸사, 자가포식 및 세포증식억제 활성에서 더 큰 역할을 하여 예방적 암 치료법으로 작용합니다( Focaccetti et al., 2019).
폴리 페놀은 쉽게 카스파, 표피 성장 인자 (EGF), Bcl-2 단백질 패밀리 단백질, 미토 겐 활성화 단백질 키나아제 (MAPK), 마이크로 RNA (포함 세포막 트리거 다수의 신호 경로에 결합 할 수있는 결과 miR NAS), 핵 인자 (NF) - κB, 포스파티딜이노시톨-3-키나제 PI3K/Akt/mTOR 및 표피 성장 인자 수용체(EGFR)( Sun et al., 2019 ). MicroRNA( miR NAs)는 또한 유전자 발현을 조절하는 것으로 입증되었으며 암을 제어하기 위한 새로운 치료 접근법으로 표적이 됩니다.
레스베라트롤(resveratrol), 실리비닌(silibinin), 커큐민(curcumin), 제니스테인(genistein) 및 EGCG와 같은 식물화학물질은 세포자멸사 유도제, 자가포식 조절제 및 세포 주기 억제제로 사용될 수 있습니다( Lancon et al., 2012 ; Estrela et al., 2017 ;Jahanafrooz et al., 2018 ).
miRNA는 발암성 유전자 발현의 조절을 통해 암세포 분화, 침입, 증식, 자가포식 및 세포자멸사 를 조절하는 데 중요한 것으로 예측되었습니다 ( Karius et al., 2012 ).
또한, MAPK 및 PI3K/Akt/mTOR 신호 전달 경로는 자가포식-아폽토시스 경로에서 여러 식물화학물질을 조절함으로써 수많은 암 세포주에서 NF-κB를 활성화하는 것으로 나타났습니다( Chao et al., 2017 ).
Matrix metalloproteinase(MMP)-2 및 MMP-9는 autophagy-apoptosis 경로를 조절하고 다양한 폴리페놀의 작용을 통해 암을 조절합니다( Bali et al., 2016 ).
다양한 암에 대한 임상 시험 조사에서 가장 중요한 천연물질은
설포라판, 레스베라트롤, 리코펜, 에피갈로카테킨, 커큐민 및 베르베린을 포함합니다. 이러한 식물화학물질은 자가포식-세포자멸사 경로를 표적으로 삼는 것을 목표로 합니다( Choudhari et al., 2020 ).
항암제 개발에서 파이토케미컬을 사용한 자가포식-아폽토시스 상호작용에 대한 표적의 한계
증가하는 증거는 파이토케미컬이 자가포식 및 세포자멸사와 같은 다양한 신호 전달 경로를 조절하여 항암 효과를 나타낼 수 있음을 시사합니다( 그림 3 ). 이 두 가지 중요한 세포 경로는 주로 암세포의 운명을 결정하는 역할을 합니다( Su et al., 2013 ).
그러나 이러한 발견은 주로 in vitro 및 전임상 in vivo를 기반으로 합니다 .반드시 임상 결과를 보장하지 않을 수 있습니다.
많은 천연물질이 작용 면에서 특이적이지 않고 다중 표적 효과를 발휘하지만, 항암 효과가 자가포식에 의존하는지 아니면 단순히 종양 미세 환경에서 세포의 생존을 지원하는 불리한 조건을 완화하기 위한 반응인지는 불확실합니다( Patra et al., 2020년).
자가포식은 양날의 검으로 간주되기 때문에 이 경로를 표적으로 삼는 것은 전례 없는 결과를 초래할 수 있습니다.
결론 및 미래 전망
많은 암 유형이 신호 전달 경로, 특히 세포 사멸의 결함으로 인해 화학 요법에 내성을 갖게 됩니다.
자가포식(autophagy) 및 세포자멸사(apoptosis)를 포함한 여러 신호 경로를 조절하는 식물화학물질의 새로운 항암 잠재력을 시사하는 증거가 증가하고 있습니다.
천연물질의 항암 효과는 암세포에 선택적이고 특이적이며 자가포식과 세포자멸사를 조절하는 것으로 관찰되었습니다.
생체 외 및 생체 내 에서 항암 잠재력 을 발휘한 가장 주목할만한 천연물질은 자가포식-아폽토시스 경로(즉, 설포라판, 레스베라트롤, 리코펜, 에피갈로카테킨, 커큐민 및 베르베린)를 조절함으로써 현재 다양한 암 유형에 대한 임상 시험이 조사되고 있습니다.
자가포식은 암 환자에서 상황에 따른 역할을 하기 때문에 이 중요한 세포 경로를 표적으로 하는 것이 항상 유익한 것은 아닙니다.
천연물질의 임상 적용은 생체 이용률이 낮아 제한적이므로 나노 기술 기반 약물 전달을 사용하여 개선할 수 있습니다.
결국, 자가포식-아폽토시스 경로를 기반으로 하는 표적 암 치료를 위한 정밀 나노의약 또는 나노기술의 번역 개선을 가속화하는 것 외에도 항암 효과를 개선할 수 있다는 희망으로 다가오는 과제와 가능한 전망이 입증되었습니다.
'Ferroptosis' 카테고리의 다른 글
| 암세포에서 선택적으로 세포자멸사를 유발하는 미토콘드리아 취약성의 이용 (0) | 2021.11.20 |
|---|---|
| 표적으로서의 VDAC1: 세포자멸사에서의 역할에 초점 (0) | 2021.11.19 |
| ER 스트레스 매개 세포자멸사를 유도하는 항암 천연물 (0) | 2021.11.10 |
| 세포 사멸(Apoptosis)의 경로를 표적으로 하는 천연물 (0) | 2021.11.10 |
| 암 치료에서 세포자멸사를 표적으로 하는 식물 유래 천연물 (0) | 2021.11.10 |