2021
Targeting Reactive Oxygen Species Capacity of Tumor Cells with Repurposed Drug as an Anticancer Therapy
https://www.hindawi.com/journals/omcl/2021/8532940/
Targeting Reactive Oxygen Species Capacity of Tumor Cells with Repurposed Drug as an Anticancer Therapy
Accumulating evidence shows that elevated levels of reactive oxygen species (ROS) are associated with cancer initiation, growth, and response to therapies. As concentrations increase, ROS influence cancer development in a paradoxical way, either triggering
www.hindawi.com
ROS의 종류와 출처
호기성 생물에서 세포 대사의 불가피한 산물인 활성산소종(Reactive Oxygen Species, ROS)은 반응성을 갖는 산소를 함유한 화학종으로 광범위하게 정의되며, 비라디칼과 자유라디칼로 나눌 수 있다
ROS는 효소 반응과 분자 산소로부터의 미토콘드리아 전자 수송 사슬(ETC)에 의해 지속적으로 생성됩니다미토콘드리아 ETC의 복합체 I, II, III는 세포 내 ROS 생산의 많은 양을 차지합니다
효소 촉매 반응에는 NADPH oxidase (NOX), xanthine oxidase, uncoupled endothelial nitric oxide synthase (eNOS), arachidonic acid 및 대사 효소(예: cytochrome P450 enzymes, lipoxygenase, and cyclooxygenase)가 포함됩니다.
실제로 NOX는 주로 ROS를 생성하도록 발달하였습니다[
호기성 호흡 및 세포 대사 과정에서 과산화물(O 2 - )은 ETC에서 1 e -가 O 2 로의 전달에 의해 세포 내에서 생성되거나 NOX에 의해 세포 외에서 생성됩니다.
미토콘드리아에서 O 2 -는 철-황(Fe-S) 클러스터를 손상시켜 철(Fe 2+)가 세포외 기질로 들어가 제2철(Fe 3+ )을 제1철(Fe 2+ )로 환원시켜 단백질 기능을 비활성화시킵니다
O 2 - 는 완충제에서 과산화수소(H 2 O 2 )로 변이되거나 슈퍼옥사이드 디스뮤타제(SOD1 및 SOD2)에 의해 촉매됩니다
더욱이, H 2 O 2 는 또한 소포체(ER) 내강을 포함하여 세포 내 국소화에 존재하는 다양한 다른 산화효소에 의해 생성됩니다
한편, O 2 -는 산화질소(NO)와의 반응을 통해 퍼 옥시 아질산염(ONOO - ) 및 하이드록실 라디칼(OH ∙ )로 전환됩니다
OH ∙ 은 철 매개 H 2 O 2 환원 과 ONOO −의 분해에 의해 생성 됩니다.
또한 H 2 O 2 는 병원체 방어를 위해 호중구의 식세포 액포에서 myeloperoxidase를 통해 차아염소산 및 차아브롬산(HOCl 및 HOBr)으로 전환될 수 있습니다(그림 3).).
한편, 생물학적으로 관련된 ROS는 대기 오염 물질, 스트레스, 자외선, 독성 물질, 종양 화학 요법 및 방사선 요법을 포함하는 외인성 환경에서도 파생됩니다
그러나 이러한 노출은 매우 다양합니다. 세포와 조직에서 ROS를 직접 측정하는 것은 어렵습니다.
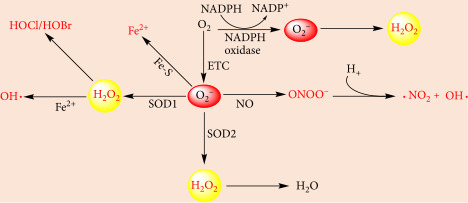
세포 효소 및 전자 수송 사슬에 의한 ROS 생산에 대한 일반적인 도식.
세포내 ROS의 주요 공급원은 미토콘드리아 ETC 및 NADPH 산화효소를 포함합니다.
SOD1 및 SOD2는 O 2 - 를 H 2 O 2 로 변환할 수 있습니다 .
그런 다음 H2O2는 H2O로 변환될 수 있습니다.
한편, H2O2는 Fe2+와 myeloperoxidase에 의해 각각 OH∙, HOCl, HOBr로 전환될 수 있다.
NO는 O2-를 ONOO- 및 OH∙로 전환하는 역할을 합니다.
ROS의 영향 및 손상 결과
라디칼 및 비라디칼 산소종 중 H2O2는 생물학적 활성의 산화환원 조절에 있어 핵심적인 산화환원 신호전달제로 인식되고 있으며, 총 37개의 H2O2생성 효소가 발견되었습니다.
H 2 O 2 는 정상적으로 호흡하는 진핵 세포에서 처음에는 낮은 항상성 수준이며 단백질 산화를 담당하는 주요 ROS입니다
일반적으로 H2O2의 생성은 세포내 대사 신호나 다양한 스트레스 요인에 의해 지속적으로 자극되며, H2O2의 농도는 낮은 나노몰 범위에서 유지되는데, 이는 산화를 통한 산화환원 신호의 신호전달에 중요하며 "oxidative eustress"라고 불린다.
확산 가능한 H2O2는 표적 단백질에서 황(thiolate groups)의 산화를 통해 세포 증식, 분화 및 혈관신생을 포함한 다양한 과정의 조정에 기여하고 스트레스 반응 생존 경로를 추가로 활성화합니다.
한편, H 2 O 2 는 (NF- κ B) 경로 를 유도하는 신호 전달 분자로 작용 합니다.
낮은 수준의 H2O2와 대조적으로, 초생리학적 농도의 H2O2는 "산화적 스트레스"를 유발하며, 이는 단백질, DNA 및 지질에 돌이킬 수 없는 과도한 손상 효과를 유발하고 궁극적으로 세포 사멸을 유발할 수 있습니다.세포 수준에서 ROS에 의한 단백질의 산화는 DNA와 지질의 산화보다 더 일반적입니다
단백질이 ROS에 노출되면 아미노산 측쇄가 변형되어 결과적으로 단백질 구조가 변경됩니다
높은 ROS 수준에 지속적으로 노출되면 single strand break, point mutations, miscoding, and abnormal amplification (단일 가닥 절단, 점 돌연변이, 잘못된 코딩 및 비정상적인 증폭)을 통해 DNA가 손상될 수 있다는 것도 마찬가지로 잘 알려져 있습니다..
DNA는 히스톤과 염색질로 복합체를 형성합니다.
ROS는 DNA의 부가물 라디칼 (adduct radicals of DNA)의 산화 및 환원에 추가로 영향을 미칠 수 있습니다
게다가, 독성 농도의 ROS는 또한 미토콘드리아 DNA 돌연변이를 유도합니다
지질은 세포에서 에너지 저장, 신호 전달, 수송 및 세포막 구성의 기능을 가지며 많은 유형의 지질이 ROS에 의해 쉽게 산화됩니다
ROS와 지질 분자의 반응은 일반적으로 매우 빠른 지질 과산화 자유 라디칼 캐스케이드를 활성화할 수 있습니다
과도한 ROS는 생물막에서 지질 과산화를 일으켜 유동성 손실, 비정상적인 막 전위, 세포 내용물의 파열 및 누출을 초래할 수 있습니다
따라서 정확한 역할을 결정하고 안전한 세포 ROS 기울기를 유지하고 산화 환원 신호 전달 경로를 조절하는 것은 어렵고 중요합니다.

ROS 균형 및 전사 인자 및 세포 사멸 조절에서의 역할.
ROS는 NADPH 산화효소, 리폭시게나제, 시클로옥시게나제, 스트레스, 독성물질 및 자외선에 의해 생성될 수 있습니다.
반면에, ROS는 GSH, PRX, TrxR, GPx, 카탈라아제 및 SOD의 활성화를 통해 제거될 수 있습니다.
극도로 높은 수준의 ROS는 DNA, 단백질 및 지질에 위험하며 결국 세포 사멸을 유발합니다.
세포는 먼저 NRF2를 활성화하여 ROS의 증가에 적응한 다음 NRF2 지시 방어에 의해 상쇄되지 않는 과도한 수준의 ROS가 있을 때 항산화 전사 인자의 다른 구성원을 촉발합니다.
암 치료를 위한 ROS의 역설과 ROS에 기반한 모순 전략
일반적으로 ROS는 낮은 농도(보통 서브마이크로몰 농도)에서 정상 세포와 암세포의 증식과 분화를 유도하는 미토겐으로 작용합니다.
중간 농도에서 ROS는 종양 시작 및 진행, 악성 전환 및 화학 요법에 대한 내성과 관련이 있습니다.
더 높은 농도의 ROS는 세포 생체 분자를 손상시키고 유전자 돌연변이를 일으켜 정상 세포의 암화를 촉진하거나 암세포의 세포 사멸, 괴사, 자가포식, 페로프토시스 및 파이롭토시스를 유도합니다(그림 5 ).
따라서 ROS의 역할은 복잡하고 ROS는 암 진행에서 다양한 생화학적 실체로 작동합니다.
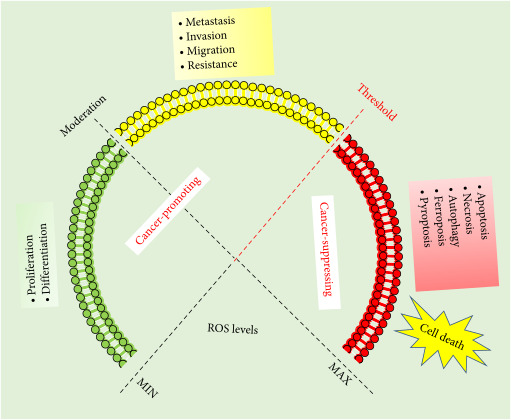
암에서 ROS의 암 촉진 활성 및 암 억제 활성.
낮은 ROS(녹색)는 정상적인 세포 증식 및 분화를 유지하기 위한 기본 요구 사항입니다.
중등도 ROS(노란색)는 증가된 세포 전이, 침습 및 이동, 저항에 대한 신호입니다.
ROS 수준이 역치(적색)를 초과하면 ROS는 세포 사멸, 괴사, 자가포식, 페로토시스 및 파이롭토시스의 활성화를 통해 암세포 사멸을 유도할 수 있습니다.
암 발병에 대한 ROS의 영향은 모순되기 때문에 세포 내 ROS 수준을 낮추거나 높이는 것이 암을 예방하거나 치료하는 잠재적인 전략이 될 것입니다
즉, ROS 생성 경로를 억제하여 세포 내 ROS 함량을 줄이고 항산화제의 외인성 보충제를 사용하는 것이 효과적인 전략이며 종양 발생의 초기 단계를 효과적으로 예방할 수 있습니다.
암세포는 정상 세포보다 증가된 세포 내 ROS에 더 민감합니다.
따라서 암세포를 선택적으로 죽이는 또 다른 전략이 될 수 있는 세포 ROS 수준을 향상시켜 암세포를 우선적으로 죽일 수 있습니다.
또한, 약물 내성 종양 세포에서 항산화 효소의 발현 수준과 산화 스트레스 환경은 일반적으로 더 높습니다.
ROS 조절 약물은 약물 내성 종양 세포의 개입에 더 나은 치료 효과를 가질 수 있습니다
암에서 ROS 제거제로서의 용도 변경 약물
| 비타민 C | 항산화제 | (1) 화학 요법을 받고 있는 유방암 환자에서 비타민 C와 E의 효과( nct04463459 ) (2) 국소 진행성 직장암에서 고용량 비타민 C와 mFOLFOX6을 동시에 사용한 수술 전 IMRT (3) 비타민 C와 정맥 주사(IV) 시스플라틴 부적격 방광암 환자를 위한 화학요법 (4) 유방암에 대한 선행 화학요법에서 정맥내 아스코르빈산 보충( nct03175341 ) (5) 비타민 C 및 G-FLIP의 Ph 2 시험(저용량의 젬시타빈, 5FU, 류코 췌장암에 대한 이리노테칸 및 옥살리플라틴)( nct01905150 ) (6) 기타 임상 시험은 Clinicaltrials.gov에서 확인할 수 있습니다. |
| 비타민 E | 항산화제 | (1) 전립선암 위험이 있거나 전립선암이 있는 환자의 암 예방을 위한 비타민 E 보충제 (2) 대장암 수술을 받는 환자의 비타민 E 보충제 ( nct00905918 ) (3) 예방을 위한 셀레늄 및 비타민 E 초기 방광암 환자의 암 진행 및 재발 (4) 전립선암 예방에 있어서 S0000 셀레늄 및 비타민 E ( nct00006392 ) (5) 유방암에 대한 토코트리에놀의 파일럿 임상 시험 ( nct01157026 ) (6) 기타 임상 임상시험은 Clinicaltrials.gov에서 확인할 수 있습니다. |
| 티게사이클린 | 항균 | (1) 비뇨 생식기암 의 맞춤형 치료는 미생물 군집 에 달려 있습니다( nct03962920 ) (2) 급성 골수성 백혈병을 치료하기 위한 티게 사이클린의 정맥내 주입을 평가하는 안전성 연구( nct01332786 ) (3) 만성 골수성 백혈병을 치료하기 위한 티게 사이클린의 시험관 내 연구( |
| 독시사이클린 | 항균 | (1) 국소 유방암 또는 자궁암 환자를 치료하기 위한 메트포르민 염산염 및 독시사이클린 (2) 피부 T 세포 림프종 치료를 위한 독시사이클린 ( nct02341209 ) (3) 전이성 유방 환자에서 독시사이클린과 골 표적 요법의 병용 암 ( nct01847976 ) (4) 독시사이클린의 림프관 (램) ( nct00989742 ) (5) 독시사이클린, 테모 졸로 마이드 및 ipilimumab의 흑색 종 ( nct01590082 ) 재발 된 NHL에 독시사이클린 (6) 위상 II 연구 ( nct02086591 ) |
| 클라리트로 마이신 |
항균 | (1) clarithromycin은 폐암 환자의 악액질에 대한 잠재적 치료법입니까? (2) NSCLC에서 표준 치료와 비교하여 규칙적인 low-dose treosulfan, pioglitazone, and clarithromycin을 사용한 시험 nct02852083 ) (3) 다발성 골수종 발병 위험이 높은 환자를 치료하는 화학 예방 요법 (4)와 Clarithromycin에 다발성 골수종 유도 요법 ( nct02573935 ) (5) 첫 번째 재발성 다발성 골수종 치료에서 clarithromycin, lenalidomide 및 dexamethasone의 임상 시험 ( nct04063189 ) (6) 기타 임상 시험은 Clinicaltrials.gov 에서 확인할 수 있습니다. |
| 니클로사미드 | 구충제 | (1) 절제 가능한 대장암 환자를 대상으로 한 니클로사미드 연구 ( nct02687009 ) (2) 치료 후 진행되는 대장암 전이 환자에서 니클로사미드 정제의 안전성과 유효성을 조사하기 위한 약물 시험 ( nct02519582 ) (3) 엔잘루타미드와 니클로사미드 재발성 또는 전이성 거세 저항성 전립선암 환자 치료에 사용 ( nct03123978 ) (4) 거세 저항성, 전이성 전립선 암 환자 치료에 니클로사미드 및 엔잘루타미드 (5) 아비라테론 아세테이트, 니클로사미드 및 프레드니손 호르몬 환자 치료에 사용 - 저항성 전립선암 ( nct02807805 ) |
| 하이드록시 클로로퀸 |
말라리아 방지제 |
(1) 생화학적 재발성 전립선암이 있는 이트라코나졸과 히드록시 클로로퀸의 1/2상 연구 (2) 이전에 치료를 받은 전이성 췌장암 환자 의 히드록시 클로로퀸 ( nct01273805 ) (3) 히드 록시클로로퀸이 전립선 종양 억제인자 파 -4 전이성 올리고머 에서 증가 암 (4) 호르몬 요법을 진행 중인 전이성 에스트로겐 수용체 양성 유방암에서 히드록시 클로로퀸 ( nct02414776 ) (5) 히드록시클로로퀸 과 폐암 치료를 위한 제피티닙 에서 다른 임상 시험 이용 가능 |
| 심바스타틴 | 항고지혈증 | (1) 전이성 유방암에 대한 Simvastatin + 이중 항 -HER2 요법 ( nct03324425 ) (2) 진행성 위암 환자에서 xp(카페시타빈/cddp) 심바스타틴의 시험 ( nct0109908 ) (3) 새로운 유방암에 대한 고위험( nct00334542 ) (4) 방광암에서 메트포르민 및 심바스타틴 사용( nct02360618 ) (5) 표준 화학요법에 실패한 위장관암 환자에서 고용량 심바스타틴에 대한 I상 연구 ( 6) 기타 임상 시험은 Clinicaltrials.gov에서 확인할 수 있습니다. |
| 디곡신 | 항심부전 | (1) 고급 절제 불가능한 머리와 목 암 환자에서 디곡신에 의한 시스플라틴 (cisplatin) 기반 화학 요법 (의 증강 nct02906800 ) 2) 재발 성 전립선 암 ( nct01162135 ) (3) 카페시 타빈 전이성 유방암 (대한 디곡신과 nct01887288 ) (4) 단계 고형 종양에서 IB 메트포르민, 디곡신 및 심바스타틴( nct03889795 ) (5) 고전적 또는 풍토성 카포시 육종에서 digoxin per os에 대한 II상 다기관 연구 (6) 기타 임상 시험은 Clinicaltrials.gov에서 이용 가능합니다. |
| 플루페나진 | 항정신병약 | (1) 불응성 진행성 다발성 골수종 환자 치료에서의 플루페나진 ( nct00335647 ) (2) 재발성 또는 재발성 및 불응성 다발성 골수종에서의 플루페나진 연구 |
***********************************************
'암치료' 카테고리의 다른 글
| 암세포의 리소좀 기능 조절 장애에 대한 새로운 접근 방식 (0) | 2021.11.28 |
|---|---|
| 종양 미세 환경 및 약물 용도 변경의 업데이트 (0) | 2021.11.21 |
| 미토콘드리아를 표적으로 하는 약물 (0) | 2021.11.19 |
| ⚡Depmep (체계적인 생존력 프로파일링을 통해 비종양 약물의 항암 잠재력 발견) (0) | 2021.11.12 |
| ⚡혈관신생 억제 천연물 (0) | 2021.11.12 |