2021
Dysregulating Lysosome Functions in Cancer Cells by Specific | IJN
Presenting recent updates about the lysosome ultrastructure, its cross-talk with other organelles, and the novel strategies of targeting this organelle
www.dovepress.com
Novel Approaches of Dysregulating Lysosome Functions in Cancer Cells by Specific Drugs and Its Nanoformulations:
A Smart Approach of Modern Therapeutics
카스파제 의존적 세포자멸사 경로를 우회하는 암세포의 현명한 전략은 리소좀 표적화를 포함한 새로운 항암 접근법의 발견으로 이어졌습니다.
최근 발견에 따르면 리소좀은 세포 폐기물의 재활용 그 이상을 수행하는 것으로 나타났습니다.
이러한 세포 소기관은 대사적으로 매우 활동적이고 세포 대사 상태를 감지하기 위해 여러 신호 경로를 매개하기 때문입니다.
이 소기관은 또한 면역계 기능을 매개하는 데 중요한 역할을 합니다.
따라서 다른 약물을 사용한 직접적 또는 간접적인 리소좀 표적화는 암을 비롯한 다양한 질병에서 새로운 치료 접근 방식으로 간주될 수 있습니다.
약물 나노제형을 사용한 암세포 리소좀의 특정 표적화는 매우 최근에 이루어졌으며 정상 조직에 대한 독성 문제와 같은 문제에 직면해 있으며, 이는 향후 연구에서 해결될 수 있습니다.
이전에는 리소좀이 주로 다른 거대 분자의 분해 및 재활용에 관여하는 정적, 효소 로딩, 막으로 둘러싸인 세포 소기관으로 생각되었습니다.
리소좀에 대한 이러한 제한된 견해는 최근 몇 가지 발견으로 극적으로 뒤집혔습니다.
리소좀은 다양한 생체 물질의 분해 외에도 수많은 세포 활동에 참여하는 동적 소기관입니다.
리소좀의 다양한 활동에는 대사 신호 전달, 유전자 조절, 원형질막 복구, 세포 이동 및 접착에서의 역할이 포함됩니다.
리소좀은 또한 환경 자극 및 면역 반응의 조절, 특히 선천 및 적응 면역 반응 모두에서 대식세포에 대한 기여에 기여합니다.
이러한 세포 소기관은 염증 신호의 처리 및 분비에 기여하고 주요 조직 적합성 복합체(MHC) 분자와 결합하는 펩티드를 생성하는 대식세포에 의해 삼켜진 병원체의 최종 상태입니다.
수많은 선천적 및 적응적 기전이 면역계에 의해 배치되어 악성 형질전환을 예방하고 병원체를 퇴치합니다(면역 감시).
명백한 종양은 면역 인식(면역 회피)을 회피할 수 있는 능력을 갖는 악성 세포 클론을 나타냅니다.
PD(L)1 및 CTLA-4와 같은 T 세포 억제 체크포인트 단백질을 표적으로 하는 중요한 치료제는 다양한 암에 효과적이며, 이는 종양 부담 감소 및 환자의 장기 생존 증가로 이어집니다. 이러한 면역 요법의 상당한 효과는 종양 미세 환경 내의 T 세포, 골수 세포 및 기타 세포 유형에 대한 효과를 통해 항종양 면역을 조절하는 추가 조치를 활성화했습니다.
전형적인 포유동물 세포는 다양한 세포 활동에서의 역할에 따라 50~1,000개의 리소좀을 가질 수 있습니다.
리소좀의 수, 활동 및 내부 구성은 환경 신호에 따라 지속적으로 변합니다.
리소좀은 정보와 내용을 지속적으로 교환하여 다른 세포 소기관 및 세포 구조와 유의하게 통신합니다.
세포 내 리소좀의 위치는 동적으로 조절되므로 이러한 활동의 조절 장애로 인해 다른 질병이 발생할 수 있습니다.
리소좀 기능 장애는 거의(1:5,000 사례) 희귀 리소좀 축적 질환(LSD)을 유발할 수 있습니다. 이러한 LSD에는 암 외에 일반적인 대사 및 신경퇴행성 질환이 포함됩니다.
리소좀은 엔도사이토시스(endocytosis) 또는 자가포식(autophagy)을 통해 분해 또는 재활용될 예정인 물질을 받습니다.
암세포에서는 일상적인 신호 전달 경로가 조절되지 않아 리소좀 구조와 기능의 변화를 초래합니다.
따라서 이러한 활동은 내인성(산화 스트레스, p53 활성화) 및 외인성(양이온성 양친매성 약물) 유발 요인에 의해 암세포가 리소좀 막 투과화(LMP)에 더 취약하게 만듭니다.
암세포는 카스파제 의존적 세포자멸사 경로에 의해 lysosome membrane permeabilization(LMP, 리소좀 막 투과성) 촉진 리소좀 세포 사멸(LCD)을 우회하는 현명한 전략을 실행합니다.
이 전략은 세포자멸사 및 약물 내성 암세포의 새로운 표적으로 여겨집니다.
사용되는 일부 중요한 약물에는 항히스타민제, 항말라리아제 및 항암제가 포함됩니다.
또한 플루페나진, 티오리다진 또는 토레미펜과 같이 LMP를 스크리닝하는 데 사용되는 약물은 리소좀 축적을 달성하여 LMP로 이어지는 것으로 알려져 있기 때문에 임상 시험 중입니다.
진핵 세포 소기관으로서의 리소좀
리소좀은 세포 대사와 협력하여 효소 분해 기능을 관리하는 소기관입니다.
이 소기관은 세포질 주위를 이동할 수 있고, 모양과 크기를 변경할 수 있으며, 그리고/또는 분열과 융합을 겪을 수 있습니다.
리소좀의 내강은 pH 4.5-5.0 사이의 산성이며 멤브레인에서 양성자 펌프의 작용에 의해 유지됩니다.
단백질, 탄수화물, 핵산 및 지질을 소화할 수 있는 다양한 유형의 효소가 리소좀에 존재합니다. 그 중에는 다양한 효소 계열을 나타내는 카텝신 프로테아제가 있습니다.
리소좀은 수많은 내장 단백질과 관내 소포를 포함하는 외부 제한 막을 형성하는 지질 이중층을 포함합니다( 그림 1 ).
다른 세포막과 마찬가지로 리소좀 막 구성은 적절하게 조절됩니다. 그러나 다른 세포막과 달리 비스(모노아실글리세롤)포스페이트(BMP)가 풍부할 뿐만 아니라 리소좀막에서 스핑고리피드와 글리세로인지질의 비율이 더 풍부합니다.

| 그림 1리소좀의 일반적인 구조 및 특성. 다른 기능을 가진 말초 및 통합 막 단백질을 가진 리소좀 지질 이중층. |
리소좀은 신호 전달 또는 막 접촉 부위에 의해 다른 세포 소기관과 기능적 및 물리적 상호 작용에 지속적으로 관여합니다.
(TFEB) 및 (MITF)와 같은 마스터 조절자는 리소좀 생합성을 제어합니다.
이들 단백질은 세포질로부터의 신호를 감지하고 핵으로 전위되어 리소좀 생물발생 네트워크 유전자 전사의 유도를 시작한다.
세포질에서(mTORC1)의 포유류 표적은 MITF와 TFEB를 인산화하고 14-3-3 단백질에 결합하여 거기에 유지됩니다.
스트레스가 많은 상태에서는 mTOR 경로가 억제되어 리소좀 생합성이 활성화됩니다.
다른 소기관과의 리소좀 신호 및 상호작용
이전에는 리소좀이 상대적으로 고립되어 있는 것으로 생각되었지만 최근에는 이러한 소기관이 세포 내의 다른 모든 소기관과 완전히 연결되어 있음이 목격되었습니다( 그림 2 ).
리소좀은 이 소기관이 특정 세포의 영양 상태를 감지할 수 있기 때문에 다양한 생체 분자 분해 및 재활용 이벤트에 대한 정보를 얻을 수 있는 독특한 위치를 가지고 있습니다.
이 영양소 조절 메커니즘 과정의 핵심 요소는 세포 생합성 경로의 주요 조절자로 알려진 mTORC1에 의해 수행됩니다.
이 복합체는 성장 인자와 영양소를 감지하여 세포 성장과 동화 작용을 지원하는 리소좀과 동적으로 연결됩니다.
이 복합체는 또한 Unc-51-like kinase 1(ULK1)의 인산화를 매개하여 자가포식과 같은 이화작용 경로를 억제합니다.
mTORC1은 또한 자가포식 시 리소좀 재형성을 조절할 수 있으며 장기간 기아 상태에서 성숙한 리소좀 조직을 복원하는 데 도움이 됩니다.
리소좀 표면에서 mTORC1의 동원은 (RAG)-GTPase에 의해 매개되는 활성화를 시작합니다.
RAG GTPase는 또한 결절성 경화증 복합체(TSC) 및 폴리쿨린 상호작용 단백질 1(FNIP) 복합체 및 TFEB와 같은 일부 영양소 반응성 요소의 모집을 조절합니다.
TFEB는 리소좀 생합성 및 자가포식을 위한 마스터 조절자입니다( 그림 2 ).
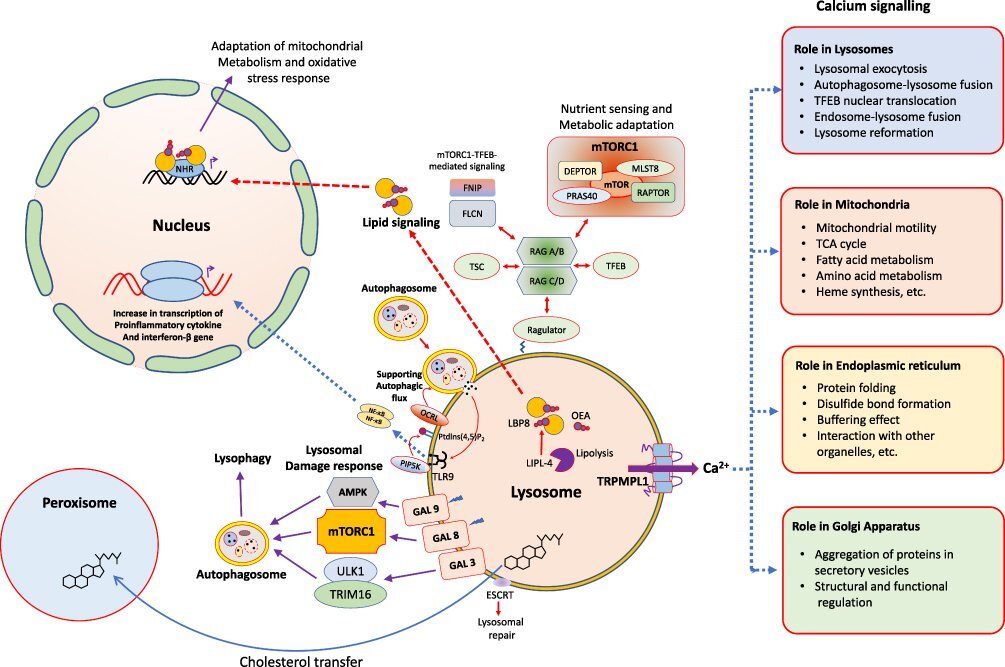
| 그림 2 세포 내 신호 전달 코어로서의 리소좀. 신호 경로에 의해 제어되고 리소좀 표면에서 시작되는 다양한 유형의 세포 과정. |
리소좀은 다른 세포 소기관 및 원형질막, 엔도좀 및 자가포식소체와 같은 구조와의 융합을 포함하는 Ca 2+ 방출을 통해 중요한 기능 중 일부를 조절합니다 ( 그림 2 ).
리소좀 막 에는 세 가지 주요 종류의 Ca 2+ 채널이 있습니다.
Ca 2+ 매개 상호작용은 막 손상의 복구, 세포내막 이동 및 자가포식을 초래합니다.
Ca 2+ 항상성은 다른 세포 소기관의 적절한 기능과 리소좀 내강 내 산성화에도 중요하며, 이는 리소좀 가수분해효소의 활성에 중요한 요구 사항입니다( 그림 2 ).
리소좀 Ca 2+ 채널은 pH, 스트레스, 영양소 수준뿐만 아니라 인지질, 스핑고신, ATP 및 NADP 수준과 같은 다양한 자극에 반응할 수 있습니다.
리소좀은 심각한 감염 또는 리소좀트로픽 약물의 사용과 같은 여러 상황에서 파열 또는 막 투과성으로 인해 손상됩니다. 이 손상은 카텝신 누출로 이어져 프로그램된 세포 사멸의 진행을 촉진합니다.
리소좀은 원형질막, 자가포식소체, 후기 엔도좀, 거대피노좀 및 포식소체(이형 융합) 외에 다른 리소좀(동형 융합)과 융합할 수 있습니다.
이러한 융합은 리소좀에서 Ca 2+ 방출에 의해 촉진됩니다 .
유사하게, 각 소기관은 특정 trans-SNARE 복합체와 몇 가지 정확한 조절자를 통해 리소좀과 융합할 수 있습니다( 그림 2).
일부 최근 연구에 따르면 리소좀과 자가포식소체 융합은 종양 억제 단백질인 UVRAG(자외선 저항 관련 유전자) 인산화를 촉진하는 mTORC1에 의해 부정적으로 조절됩니다.
리소좀과 암 진행
암세포는 정상 세포에 비해 상대적으로 약하고 더 큰 리소좀을 가지고 있습니다.
많은 유형의 암이 스핑고지질 대사를 변경하여 스핑고신 키나아제를 과발현하고 산성 스핑고미엘리나아제를 하향 조절합니다.
이 모든 상황은 리소좀 막 기능과 구조에 영향을 미칩니다.
암세포는 증가된 리소좀 생합성을 보여 리소좀 확대를 초래합니다.
이 확장된 리소좀은 상당한 양의 화학요법 약물을 삼키고 최종 목적지에 도달하기 위해 차단합니다.
또한, 리소좀은 암 세포에서 이러한 약물의 세포외 배출을 위한 메커니즘을 마련합니다.
이러한 모든 수단은 암세포가 약물 내성을 갖도록 하여 암 치료의 약물 표적으로서 리소좀을 새로운 전략으로 강조합니다. .
또한, 암세포의 특징인 포스파티딜 이노시톨-3 키나아제(PI3K)의 향상된 활성은 종양 세포 리소좀에 안정성을 부여합니다. 크기, 성숙 및 리소좀 활성과 같은 여러 세포 과정은 PI3K에 의해 조절됩니다.
PI3K 억제는 TNF-촉진 세포 사멸 캐스케이드를 카스파제 의존적 방식에서 카텝신 의존적 방식으로 이동시킨다.
리소좀은 암 생물학에서 중요한 역할을 합니다.
이 세포 소기관은 종양이 진행되는 동안 에너지원에 대한 요구 사항을 강화하도록 명령하기 때문입니다.
유방암, 폐암, 췌장암, 전립선암 등과 관련된 여러 암은 주로 리소좀에 의한 자가포식 분해와 영양소 소거 경로처럼 작용하는 재활용 활동에 의존하는 것으로 밝혀졌습니다.
리소좀-자가포식 경로는 (MiT-TFE) 유전자의 과발현과 관련이 있기 때문에 흑색종, 신세포 암종, 췌장 선암종 등과 같은 증식 및 암세포 성장을 지원합니다.
이러한 암 유형에서 MiT-TFE에 의한 mTORC1 유도는 mTORC1 촉진 및 자가포식 조정 영양소 소거 생합성 경로의 관련 과활성화를 허용합니다.
따라서 비정상적인 이화작용 및 생합성 활성화는 함께 종양 세포 내에서 에너지를 요구하는 암 대사를 지원합니다.
종양 세포의 산성 배지는 세포 주변으로 리소좀 재분배를 일으키고 ,
이 활성은 mTORC1 및 mTORC2 신호를 강화하여 조직 증식을 향상시킵니다.
이 변화는 또한 침습 및 전이 단계를 강화하는 리소좀 가수분해효소, 기질 금속단백분해효소 및 인테그린의 세포외 배출을 유도합니다.
암세포는 세포외 기질(ECM)을 소화하는 데 도움이 되는 놀라운 단백질 분해 활성을 가지고 있습니다.
암 침범은 카텝신 B 및 기타 시스테인 카텝신의 발현 증가와 관련이 있습니다.
암세포에서 방출되는 카텝신은 라미닌, 엘라스틴, 피브로넥틴과 같은 ECM 성분을 분해하여 침습, 혈관 신생 및 전이를 용이하게 합니다.
암세포는 세포자멸사 촉진 경로 변조 및 리소좀 촉진 세포 사멸 경로의 변형에 의존하는 화학요법 내성을 효과적으로 성공적으로 발달시킵니다.
암세포는 LMP를 억제하는 세포질 및 리소좀 프로테아제 억제제를 과발현합니다.
또한, 세포질 열 충격 단백질 70(Hsp70)은 암세포 내의 리소좀 내강으로 전위됩니다. 이 전위는 산성 스핑고미엘리나제 활성을 보증함으로써 리소좀 막을 안정화하는 데 도움이 됩니다.
이 절차는 또한 리소좀 프로테아제의 세포질 누출로부터 종양 세포를 보호하는 데 도움이 됩니다.
Hsp70의 모든 고갈은 리소좀 촉진 세포 사멸 프로그램으로 이어집니다.
또한, 카텝신 억제제에 의해 암세포의 생존력이 향상되어 리소좀 활성이 증가합니다.
이러한 발견은 P13K 및 리소좀 Hsp70 축적 또는 카텝신 활성을 표적으로 할 수 있는 약물 나노제형이 암세포를 리소좀 매개 세포 사멸에 민감하게 만드는 새로운 치료제로 작용할 수 있음을 보여줍니다
암세포의 리소좀 표적화
증식과 새로운 환경에 대한 적응을 위해 암세포는 증가된 리소좀 기능에 적응합니다.
리소좀 파괴는 차례로 산화 스트레스를 더욱 강화하여 지질 과산화, 미토콘드리아 기능 장애 및 자가포식을 촉진합니다. 이러한 모든 변경은 카텝신 방출로 이어지며, 이는 다른 거대분자의 분해를 촉진합니다. 또한 이러한 변화는 autosis, apoptosis 또는 ferroptosis를 통해 암세포 사멸을 유발할 수 있습니다.
.리소좀은 mTORC1에 의해 추진되는 이화작용(대음화작용 및 자가포식) 및 동화작용 경로 모두에서 역할을 수행합니다. 이러한 모든 경로는 암 치료의 잠재적 표적입니다.
Autophagy는 분해를 위해 세포 물질을 리소좀으로 전달하고 암 진행에서 여러 기능을 수행합니다.
autophagy는 항종양 효과와 protumor 효과를 모두 가질 수 있기 때문에 치료 전략으로 암세포 autophagy를 표적으로 하는 최근의 노력이 우선시되고 있다.
Autophagy는 종양 성장을 촉진하고 암 치료 중 화학 내성을 촉진하는 능력이 있습니다.
Macropinocytosis (거대음세포증)은 세포외 단백질을 리소좀으로 전달하여 특히 RAS 유발 암에서 암 성장을 촉진할 수 있습니다..
mTOR 기능의 억제는 전임상 시험 환자에서 항암 요법으로 널리 인식됩니다.
퀴나크린(quinacrine), 클로로퀸(chloroquine), 하이드록시클로로퀸(hydroxychloroquine)과 같은 일부 항말라리아제는 자가포식 캐스케이드(autophagy cascade)를 억제함으로써 리소좀 기능을 억제하는 것으로 밝혀졌습니다.
이러한 약물은 항암제로 사용되지만 mTORC1 조절에는 영향을 미치지 않습니다.
또한 PPT1의 억제는 리소좀 v-ATPase 활성의 적절한 국소화에도 영향을 미치며, 이는 pH 구배에 의해 리소좀을 산성으로 유지하는 역할을 합니다.
리소좀과 아폽토시스
아폽토시스는 리소좀과 미토콘드리아의 협력과 카스파제의 활성화를 모두 포함하는 프로그램된 세포 사멸입니다.
모든 유형의 암을 비수술적으로 치료하는 새로운 전략은 세포자멸사를 표적으로 하는 것입니다.
여러 항암제는 내인성 및 외인성 경로의 서로 다른 단계를 표적으로 합니다.
두 가지 일반적인 전략에는 항-세포사멸 분자의 억제와 세포사멸 촉진 분자의 자극이 포함됩니다.
세포자멸사 유도 능력을 가진 중요한 식물 유래 화합물에는 알로에-에모딘, 블랙 코호시 커큐민, 에피갈로카테킨-3-갈레이트(EGCG), 제니스테인, 그라비올라, 주글론 및 케르세틴이 있습니다.
(aloe-emodin, black cohosh curcumin, epigallocatechin-3-gallate (EGCG), genistein, graviola, juglone, and quercetin)
미토콘드리아 기능 장애와 리소좀 파괴 사이에는 연관성이 있다는 것이 강력히 권장됩니다.
막 전위의 손실은 지질 과산화를 통해 리소좀 막을 불안정화하고 파열을 촉진하는 강화된 ROS 생성을 촉진하며, 이는 카스파제 8 및 9의 활성화와 관련됩니다.
전반적으로, 이러한 발견은 리소좀이 세포 사멸 경로를 시작하거나 실행하는 데 놀라운 역할을 가지고 있음을 보여줍니다.
리소좀과 자가포식
리소좀과 자가포식소체의 융합은 세포내 및 세포외 물질의 분해가 일어나는 자가용해소체의 형성을 초래합니다.
Autophagy는 암세포가 스트레스에 적응하는 데 중요한 역할을 합니다.
이는 암세포를 사멸이나 진행 유도로부터 보호하기 때문입니다.
정상적인 조건에서 세포의 항상성은 생합성 및 세포 내 이입 경로를 통해 발생하는 생합성에 의해 리소좀을 통해 유지됩니다.
그러나 스트레스가 많은 조건에서는 리소좀 수가 감소합니다.
리소좀은 손상된 세포소기관을 재활용하거나 제거하기 위한 거대분자 분해에 중요한 역할을 하기 때문입니다.
리소좀의 복원은 자가포식 리소좀 재형성(ALR)을 통해 발생합니다.
자가포식은 또한 손상된 리소좀을 자가포식소체로 삼켜 나중에 활성 리소좀과 결합하여 세포에서 제거하도록 함으로써 리소좀 주기를 조절합니다.
이 과정을 통해 아미노산과 기타 영양소가 세포로 재활용됩니다.
그러나 이 과정이 적절하게 조절되지 않으면 세포내 구조가 파괴되어 세포가 붕괴되고 자가화될 수 있으며 이는 전적으로 리소좀에 의존한다.
암 세포에서 자가포식의 변경은 종양 관리의 유망한 전략으로 입증될 수 있습니다. 일부 약물은 개시부터 분해 단계에 이르기까지 다양한 유형의 자가포식 과정을 표적으로 하는 것으로 알려져 있습니다.
autophagy의 억제는 항암제의 치료 효과를 촉진하고 apoptosis로 이어진다.
표 2 는 다양한 메커니즘에 의해 자가포식을 조절할 수 있는 몇 가지 일반적인 항암 천연 화합물 또는 합성 약물을 나열합니다.

| 표 2 암 예방 및 치료로 사용되는 자가포식 조절제 역할을 하는 다양한 화합물의 예와 사용되는 다양한 암의 예 |
리소좀과 페롭토시스
암세포에서 대사율이 증가하고 철 함유 단백질의 회전율이 높아져 리소좀에 철이 축적되고 ROS 유도 LMP에 예민하게 됩니다.
암 세포는 세포 사멸을 유도할 수 있는 리소좀에서 더 많은 카텝신 방출과 함께 더 높은 ROS 생산 속도를 가지고 있습니다.
이 리소좀 촉진 세포 사멸은 일반적인 세포 사멸에 저항하는 암세포를 치료할 수 있는 새로운 옵션을 제공합니다.
그러나 암세포는 리소좀 대사를 재구성하여 리소좀이 후원하는 세포 사멸을 세심하게 회피합니다.
암세포는 정상적인 비암성 세포에 비해 추가적인 철 요구량을 보입니다.
따라서 철에 대한 이러한 추가 요구 사항은 이러한 세포를 ferroptosis로 알려진 철 촉매 괴사에 취약하게 만들 수 있습니다.
Ferroptotic 세포 사멸은 철 의존성 ROS의 축적으로 인한 독특한 유형입니다.
ferroptosis는 철 수치 조절을 담당하는 페리틴, 트랜스페린, 시스테인 항포터 수용체와 같은 단백질에 의해 조절됩니다.
리소좀은 철의 주요 저장 위치 중 하나이며, H 2 O 2 존재 시, 자유 Fe는 Fenton 반응을 일으켜 반응성 철을 생성하여 ROS를 증가시킵니다.
활성 철과 ROS의 증가를 통한 ferroptosis를 조절하는 리소좀의 실제 역할은 아직 완전히 이해되지 않았으며 추가 조사가 필요합니다.
표 3 다양한 유형의 기전과 함께 철 대사 촉진 ferroptosis를 유도하거나 억제할 수 있는 몇 가지 중요한 약물을 나열합니다.

| 표 3 다양한 유형의 기전으로 철 대사를 매개하는 Ferroptosis를 조절하는 다양한 약물 및 기타 화합물의 예 |
리소소모트로픽 에이전트
리소좀트로픽 제제는 리소좀 내부에 축적되는 약염기 양이온성 또는 친유성 양친매성 약물로 구성됩니다.
리소좀 막은 이러한 화합물의 확산을 허용하고 리소좀 내부의 양성자화로 인해 갇히게 됩니다.
이들의 과도한 축적은 리소좀 막 손상을 일으키고 최종적으로 LMP를 유발합니다.
리소소모트로픽 제제에는 ML-9와 같은 키나제 억제제, 금속 나노입자(NP), 및 노르트립틸린, 시라메신, 데시프라민, 클로미프라민, 이미프라민 등을 포함하는 일부 약학적으로 중요한 약물이 포함됩니다.
또한, loratadine 및 terfenadine과 같은 항알레르기 약물은 유방암 및 폐암 세포 사멸을 유도하는 것으로 보고되었습니다.
또한, 스틸베노이드 항산화제, 프테로스틸벤 및 항정신병제, 티오리다진, 클로르프로마진 및 아리피프라졸을 사용한 치료는 백혈병 및 유방암에서 우수한 효능을 갖는 것으로 밝혀졌습니다.
클로로퀸을 제외한 이들 약물의 대부분은 FDA 승인을 받았으며 임상 시험에서 적절하게 조사되었습니다.
'암치료' 카테고리의 다른 글
| 암에 대한 약물 용도 변경에 대한 Paracelsus 역설 (0) | 2021.11.28 |
|---|---|
| 암 치료 개선을 위한 약물의 용도 변경: 현황 및 향후 방향 (0) | 2021.11.28 |
| 종양 미세 환경 및 약물 용도 변경의 업데이트 (0) | 2021.11.21 |
| 항암 용도변경약물에 의한 ROS 표적화 (0) | 2021.11.21 |
| 미토콘드리아를 표적으로 하는 약물 (0) | 2021.11.19 |