2020
The updated landscape of tumor microenvironment and drug repurposing
https://www.nature.com/articles/s41392-020-00280-x
The updated landscape of tumor microenvironment and drug repurposing - Signal Transduction and Targeted Therapy
www.nature.com
TME는 비악성 세포, 혈관, 림프 기관 또는 림프절, 신경, 세포 간 구성 요소 및 종양 병변의 중심, 가장자리 또는 부근에 위치한 대사 산물로 구성됩니다(그림 1 ).
고전 이론은 악성 세포의 발암성 돌연변이가 암의 시작을 유발한다고 제안합니다.
그 후, 주변의 형질전환되지 않은 세포가 모집되고 적응되며 사이토카인, 케모카인 및 소포를 포함한 다양한 세포간 커뮤니케이터의 방출이 수반됩니다.
결과는 TME 형성 및 암세포와의 긴밀한 상호 작용입니다.
일부 연구에서는 비정상적인 미세 환경에서 만성 염증 또는 상처 치유 과정이 발암성 신호 전달을 활성화하고 종양 형성을 촉진하는 것으로 나타났습니다

종양 미세 환경(TME)의 업데이트된 개요도.
TME는 암세포, 기질 세포, 혈관, 신경 섬유, 세포외 기질 및 관련 무세포 성분으로 구성됩니다.
TME는 암세포의 고향이며 암과 전체 유기체를 연결하는 다리 역할을 합니다.
TME는 저산소 틈새, 면역 미세 환경, 대사 미세 환경, 산성 틈새, 신경 분포 틈새 및 기계적 미세 환경의 6가지 특수 미세 환경으로 분류할 수 있습니다.
TME는 암 특징의 발달을 지원하고, 내적 또는 외적 스트레스, 자극 및 치료에 반응하고, 궁극적으로 유기체에서 이러한 세포의 생존 및 이동을 돕기 위해 암 세포에 의해 형성되고 훈련됩니다.
전체 TME와 비교할 때 전문화된 미세 환경이 암 치료에 더 나은 표적인 것 같습니다.
저산소증과 면역 억제는 암의 두 가지 특성입니다.
이러한 특수화된 미세환경은 십자형으로 배열되어 있어 각 미세환경의 기능과 상호간의 혼선을 인식할 필요가 있음을 시사한다(Fig. 1 ). 병용 요법의 잠재 능력도 무시할 수 없습니다.
TME의 특징
저산소 환경: 일정하고 이질적인 TME
정상산소-저산소증 전환에 대한 응답으로, 세포는 저산소 상태에 적응하기 위해 저산소증 유발 인자(HIF) 및 HIF 신호의 상승에 크게 의존합니다.
저산소증은 암 세포와 그 미세 환경에 존재할 수 있으며, 이후 암 진행, 줄기, 휴면, 산화 환원 적응, 세포 간 통신 및 치료 내성을 포함한 다양한 측면에서 암 생물학을 재프로그래밍합니다
저산소증은 혈관 내피 세포를 활성화하고 혈관 내피 성장 인자(VEGF) 전사를 상향 조절하며 과도한 혈관 신생을 자극하여 TME 및 치료 효능에 영향을 미칩니다.
저산소 틈새는 또한 TP53, PTEN 및 MYC와 같은 종양 유전자 및 종양 억제 인자의 체세포 변이 및 변경의 돌연변이 부하 증가와 관련이 있습니다.
면역 미세 환경: 건강한 조직, 원발성 병변 및 전이가 뚜렷함
차가운 암을 뜨거운 암으로 바꾸는 것이 오늘날 암 면역 요법의 목표입니다. 전자는 세포독성 T 세포의 억제를 포함하는 치료 경험이 없는 암을 말하며, 후자는 암 관련 T 세포의 생성 및 활성화를 필요로 합니다.
억제 면역 미세 환경은 암이 면역 파괴를 피하는 데 도움이 됩니다. 암의 핵심이나 가장자리 또는 인접한 림프 기관 또는 림프절(3차 림프 구조라고도 함)에 위치한 TME의 면역 세포 침윤은 암의 예후와 밀접한 관련이 있습니다
원발성 병변과 전이 병소 사이의 면역 미세 환경의 차이는 전이, 특히 뇌 전이가 있는 진행된 환자의 치료 실패에 대한 설명을 제공했습니다.
대사 미세환경: 젖산, 활성산소종(ROS) 및 지질에 초점
대사 재프로그래밍(대사 또는 영양 공급의 변화)은 암의 특징 중 하나입니다.
암은 종종 포도당, 지질, 글루타민 및 아미노산의 대사 증가, 젖산 축적 및 ROS 중독을 나타냅니다.
젖산 대사는 악성 및 기질 세포에 관여합니다.
정상 세포는 산화적 인산화를 통해 에너지를 얻는 경향이 있으며 정상 산소 상태에서는 해당 작용이 억제됩니다.
암세포는 산화적 인산화 대신에 정상산소 상태에서도 향상된 해당과정과 증가된 젖산 대사를 선호합니다.
젖산은 아래와 같은 방법으로 통해 TME의 악성 및 면역 세포에 의해 생성됩니다.
(1) 젖산 탈수소효소의 참여로 포도당에서 피루브산으로, 젖산으로 전환 및
(2) 글루타민에서 글루타메이트, α-케토글루타레이트로 시작하여 트리카르복실산 회로에 연결하고 젖산 탈수소효소-A(LDH-A)의 참여로 피루베이트를 전환하는 일련의 과정.
젖산은 신진대사의 부산물로 간주되어 왔지만 새로운 증거는 이것이 TME에서 암세포와 기질 세포를 재프로그래밍할 수 있는 대사산물일 수 있음을 보여줍니다.
그것은 pro-tumor 및 pro-inflammatory (M2-like) 표현형으로 대식세포 분극을 촉진합니다.
Foxp3의 발현은 Myc와 해당과정을 억제하여 높은 젖산 미세환경에서 Treg의 생존을 촉진함으로써 암세포에 대한 면역억제 미세환경을 제공합니다.
젖산은 혈관신생과 저산소 세포의 생존을 촉진하고 산성 미세환경을 유도합니다.
글루타민과 포도당은 젖산 대사의 두 가지 중요한 기질이며 포도당이 부족할 때 글루타민이 우세합니다.
글루타민은 암세포와 림프구와 같은 기질 세포를 위한 에너지, 탄소 및 질소를 생성합니다.
암세포는 단백질을 흡수하여 RAS-activated macropinocytosis을 통해 암세포에 연료를 공급하는 글루타민으로 분해될 수 있습니다.
TME에서 ROS 대사
ROS 수준의 상승은 암에서 관찰되었으며 종양 형성, 종양 면역 및 TME 재프로그래밍과 밀접한 관련이 있습니다.
저산소 상태에서 미토콘드리아 ROS는 HIF 안정화에 필요하며,이는 자가포식을 추가로 유도하고 종양형성을 향상시킬 수 있습니다.
TME의 종양 세포와 기질 세포는 ROS를 생성할 수 있는 반면, 국소적 TME의 상승된 ROS는 그 대가로 암세포의 성장에 영향을 줄 수 있습니다.
흥미롭게도 암세포가 진화함에 따라 ROS 축적에 내성이 생기고 ROS 중독이라는 현상인 ROS와 균형을 이룹니다.
미세 환경의 ROS는 MDSC, TAM, CAF 및 T 세포의 조절에도 영향을 줄 수 있습니다
TME에서 ROS 대사를 정상화하면 면역 요법이 항종양 활성의 효과를 증가시키는 데 도움이 될 수 있습니다.
지질 대사 및 전이성 틈새 형성
콜레스테롤, 지방산, 트리글리세리드 등의 지질은 암세포의 세포막 생성, 단백질 번역 후 변형, 암세포의 에너지를 위한 물질입니다. 75
TME의 지질 대사는 암 성장, 재발 및 종양과의 연관 식이를 조절합니다.
높은 콜레스테롤 수치는 TME에서 볼 수 있으며 CD8+ T 세포 고갈 과 양의 상관관계가 있습니다.
지방산은 지방세포가 지방분해되는 동안 방출되고 암세포가 성장을 촉진하기 위해 흡수합니다.
TME의 지질 대사는 암 전이 예방의 잠재적 표적이 될 수 있습니다.
산성 환경: 저산소증과 젖산 대사의 결과
조절되지 않거나 역전된 pH는 암의 일반적으로 인식되는 특징이 되었습니다.
상승된 세포내 pH(pH i )는 암세포 생존, 증식, 이동, 침입 및 해당과정을 촉진하고 세포자멸사를 억제합니다.
암세포 는 비악성 세포에 비해 pH i (7.4 대 ~7.2)가 더 높지만 세포외 pH(pH e )(6.7–7.1 대 ~7.4) 는 더 낮은 경향이 있습니다 .
그것은 산성 환경을 만들어 종양과 그 미세 환경의 산증으로 나타납니다.
산성 환경은 젖산 대사 또는 CO2 hydration에 의해 생성되기 때문에 저산소 환경 및 대사 미세 환경, 특히 젖산 대사 미세 환경과 분리될 수 없습니다
저산소증은 증가된 젖산 생산, 저산소 틈새에서의 양성자 축적, TME 산성화를 통한 종양 세포 적응을 유발합니다.
젖산은 MCT(monocarboxylate transporter) 4에 의해 수출되고 MCT1과 H+ 의 공동 수송에 의해 암세포로 수입됩니다 .
이 과정에서 종양 산증은 종양 침습과 전이를 촉진하고 산성 환경은 암 발달을 위한 지지적인 미세 환경을 제공하는 젖산 대사에 시너지 효과를 줍니다.
처음으로 젖산 기반 대사 공생이 인정되었습니다.
종양유전자 활성화(예: Ras 및 Myc) 및 종양 억제인자(예: p53)의 비활성화도 산성 환경 생성을 유도합니다.
산증은 면역 세포에 조절 효과가 있습니다. M2(대안적으로 활성화된) 표현형으로 대식세포 분극을 유도하고, 호중구 또는 DC를 활성화하고, TIL의 세포독성 활성을 억제합니다.
세포외 소포(EV) 및 엑소좀 트래피킹도 이러한 상황에서 폐기물과 과잉 산을 이동시키기 위해 증가됩니다.
TME의 신경분포 환경
신경계가 고형암(예: 전립선암, 뇌암) 및 혈액암의 발병 및 전이에 관여한다는 연구 결과가 증가하고 있습니다.
Innervated niche: TME의 신경 조절에 초점을 맞춘 새로운 특수 미세 환경
신경 주위에 암이 침범하거나 신경을 관통하거나 암 전이 경로를 나타내는 PNI(Perineural Invasion) 현상은 암 예후가 좋지 않은 것과 상관관계가 있습니다.
TME의 기계적 미세 환경
기계적 미세 환경은 새로 조사된 또 다른 특수 미세 환경입니다. 32 , 34 , 36
그것의 형성은 주로 세포내 성분(비멘틴, 액틴, 신경섬유), 세포외 성분(콜라겐 및 피브린), 세포간 신호(인테그린) 및 기질 세포(섬유아세포)에 의존합니다.
cancer-associated fibroblasts(CAF)는 MMP2, MMP3 및 MMP9를 포함한 기질 금속단백분해효소(MMP)를 분비하거나 yes-associated protein을 활성화하여 extracellular matrix (ECM) 분해 및 리모델링, 상피-중간엽 전이 및 암-줄기세포 줄기를 촉진합니다.
기계적 미세 환경은 종양 유전자 또는 종양 억제 인자, 세포 형태, 암 발암 및 치료 반응에 영향을 미칩니다.
또한, ECM의 기계적 강성은 교모세포종 세포 진행을 가속화하는 것으로 보고됩니다.
HIF1은 lysyl oxidase 생성을 촉진하여 인테그린 신호 전달을 강화하고 종양-기질 강성을 증가시킵니다.
Park et al.은 기계적 미세 환경이 tripartite motif-containing protein 21 and phosphofructo-1-kinase Isozyme C 축을 통해 해당 작용을 조절한다는 것을 확인했습니다.
그들은 또한 암세포의 강성이 빠른 신진 대사의 유지를 촉진하여 이질적인 특수 TME를 더욱 명확히한다는 것을 보여주었습니다.
저산소 환경에서 TME 재프로그래밍
저산소 환경은 거의 전체 종양과 외부 미세 환경을 차지합니다. 그
것은 암세포에 영향을 미치고, 다른 특수 미세 환경을 재프로그래밍하고, 저산소증 유발 캐스케이드를 시작합니다.
특히, 면역, 젖산 및 ROS 대사 미세 환경 및 산성 환경은 잘 알려진 가장 큰 영향을 받는 TME입니다.
저산소증에 의해 유발된 VEGF 발현은 면역 미세환경 재형성의 전형적인 산물이다
충분한 산소의 암세포는 포도당보다 젖산을 이용하는 것을 선호한다고 밝혔습니다.
여기서 MCT1이 종양에서 젖산 교환을 매개합니다.
저산소 세포는 포도당을 소비하고 젖산염을 생성하는데, 이는 농도 구배에 따라 확산될 수 있는 반면, 충분한 산소의 암세포는 MCT1을 통해 젖산염을 흡수합니다.
MCT1 억제 후, 호기성 암세포는 젖산보다 포도당을 사용하도록 변경됩니다.
포도당 구배가 산소 공급 구배를 따르기 때문에 충분한 산소의 암세포는 포도당 기아와 괴사를 유발하는 저산소 세포보다 포도당을 더 많이 흡수합니다.
저산소 환경은 또한 CAF에 의해 매개되는 기계적 미세 환경과 양방향 통신을 합니다.
한편으로, 그들은 ECM 재형성과 저산소 미세 환경의 형성에 관여합니다.
한편, HIF-1은 저산소증에 대한 반응으로 PLOD2, P4HA1 및 P4HA2의 활성화를 유발합니다.
CAF는 길어지고 방추형이 되며, I형 콜라겐의 증가된 양을 분비하고, 기질 접착 및 중간엽 형태를 촉진하고, 증가된 강성과 콜라겐 섬유 정렬을 갖는 ECM을 생성하며, 이 모두는 유방암 세포의 침습 및 이동을 지원합니다.
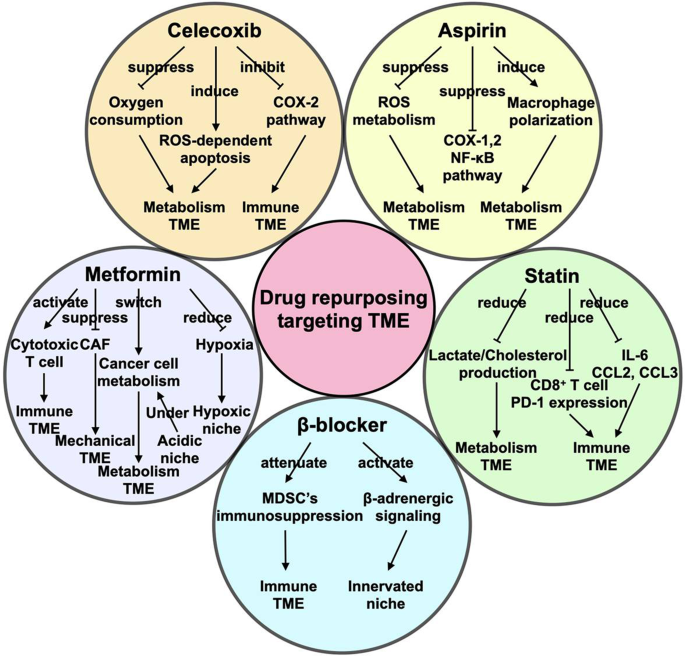
TME를 표적으로 하는 오래된 약물의 새 생명.
TME는 암 치료의 표적으로 간주됩니다.
아스피린, 셀레콕시브, β-아드레날린성 길항제, 메트포르민, 스타틴은 TME를 표적으로 하여 병용 요법에서 잠재적으로 사용 가능한 항종양 능력을 가진 5가지 기존 약물입니다.
'암치료' 카테고리의 다른 글
| 암 치료 개선을 위한 약물의 용도 변경: 현황 및 향후 방향 (0) | 2021.11.28 |
|---|---|
| 암세포의 리소좀 기능 조절 장애에 대한 새로운 접근 방식 (0) | 2021.11.28 |
| 항암 용도변경약물에 의한 ROS 표적화 (0) | 2021.11.21 |
| 미토콘드리아를 표적으로 하는 약물 (0) | 2021.11.19 |
| ⚡Depmep (체계적인 생존력 프로파일링을 통해 비종양 약물의 항암 잠재력 발견) (0) | 2021.11.12 |