2020
https://onlinelibrary.wiley.com/doi/full/10.1002/mco2.27
********************************************************************
(a) 새로운 FA 합성 차단,
FASN-올리스타트
ACLY-EGCG
ACSS-Ranolazine
히드록시시트레이트(HCA)
(b) FA 흡수 차단,
멜라토닌
(c) FA 이용 차단
ranolazine(협심증 치료)
*콜레스테롤
Betulin
Statins-피타바스타틴(리바로)
Bitter-melon extract
----------------
ALACOX-2 억제제(세레브렉스)
**최적의 치료를 위해서는 지질의 새로운 합성과 지질 흡수의 동시 억제가 필요할 수 있습니다.
지질 제한 식이 요법 또는 항혈관신생 요법
********************************************************************************
Lipid metabolism in cancer progression and therapeutic strategies
조절되지 않은 지질 대사는 암에서 중요한 대사 변화를 나타냅니다.
지방산, 콜레스테롤 및 인지질은 세포막의 생합성을 위한 에너지 생산자, 신호 분자 및 소스 물질로 작용하는 가장 널리 퍼진 세 가지 지질입니다.
강화된 합성, 저장 및 지질 흡수는 암 진행에 기여합니다.
암에서 지질 대사의 변경은 발암성 신호 전달 경로의 활성화 및 종양 미세 환경과의 혼선과 관련이 있습니다.
결과적인 활성은 종양 내의 가혹한 조건에서 종양 세포의 생존 및 증식을 촉진합니다.
지질대사는 또한 종양 미세 환경 내 비암세포, 특히 면역 관련 세포의 기능에 영향을 줌으로써 tumor immunogenicity= 종양 면역생성에 중요한 역할을 한다.
<약어>
- CAF-Cancer associated fibroblast
- CTL-cytotoxic T lymphocyte
- FA-Fatty acid
- FABPs-fatty acid-binding proteins
- FAS-Fatty acid synthesis
- LDLR-low-density lipoprotein receptor
- MDSC-myeloid-derived suppressor cells
- NK cell-natural killer cell
- PGE2-prostaglandin E2
- Th 17-T helper cell 17
종양 세포는 가혹한 미세 환경에서 적응하고 생존할 수 있는 대사 가소성의 이점을 가지고 있습니다.
1920년대에 Otto Warburg가 암 대사 분야에서 선구적인 연구를 수행한 결과 암세포는 현재 "Warburg 효과"라고 하는 과정을 통해 호기성 조건에서도 포도당을 젖산으로 전환하는 대사 선호도가 있음을 발견했습니다.
대사체학을 통해 새로운 증거는 조절되지 않은 지질 대사를 포함하여 암 진행에서 대사 재프로그래밍에 대한 중요한 역할을 제안했습니다.
지질은 지방산(FA), 글리세리드(중성 글리세리드 및 포스포글리세리드), 비글리세리드 지질(스테로이드 및 스핑고지질) 및 지단백질을 포함하는 복잡한 생체 분자 그룹으로 표시됩니다.
(fatty acids (FAs),
glycerides (neutral glycerides and phosphoglycerides),
nonglyceride lipids (steroids and sphingolipid), and
lipoproteins)
지질은 세포 구조의 유지, 에너지 공급 및 신호 전달의 다양한 측면에 필요합니다.
양친매성 지질은 세포 항상성을 위한 원형질막을 형성합니다.
지질 대사의 변화는 세포 기능에 중요한 막 구성과 투과성을 변경할 수 있습니다.
지질 대사는 또한 일련의 생물학적 중간체를 생성하며, 이들 중 다수는 세포 성장, 증식, 분화, 세포자멸사, 운동성, 염증, 생존 및 막 항상성을 제어하는 다양한 신호 경로 세트를 조절하는 데 도움이 되는 신호 분자로 작용할 수 있습니다.
지질 대사는 지질 흡수, 새로운 합성, 수송 및 분해를 포함하는 분자 과정의 복잡한 세트를 나타 냅니다 .
지질 대사의 조절 장애는 막 구성, 유전자 발현, 신호 전달 경로 활성 및 다운스트림 세포 기능을 변경할 수 있으므로 다양한 질병 과정의 시작 및 진행에 직접적인 영향을 미칠 수 있습니다.
지방 생성 효소의 상향 조절은 결장직장암, 전립선암, 난소암, 위장관암 및 폐암을 포함한 다양한 암에서 설명되었습니다.
증가된 지질 생합성은 세포 복제에 필요한 세포막 생성을 위한 증가된 "건축 재료"를 제공하고, FA의 베타 산화를 통한 에너지 공급, 마지막으로 발암 경로를 매개하는 "지질 2차 전령" 분자의 증가를 통해 부분적으로 종양 세포 증식에 기여하는 것으로 생각됩니다.
지질의 대사 재프로그래밍은 또한 소포체(ER) 스트레스 및 ferroptosis, 와 같은 암 진행에 중요한 다른 과정에 영향을 줄 수 있는 반면 지질 생합성의 억제는 암세포 생존 및 종양 성장을 제한하는 데 도움이 될 수 있습니다.
FA, 인지질 및 콜레스테롤은 종양에서 조절 장애를 일으키는 세 가지 주요 지질 부류를 나타냅니다.
탄소 길이와 포화 수준이 다양한 탄화수소 사슬과 말단 카르복실을 포함하는 FA는 지질 합성을 위한 초기 건축 자재를 나타냅니다.
최근 보고서는 FAs 합성, 흡수 및 지방산 산화(FAO)가 암 발병 및 진행에 중요한 역할을 한다고 강조했습니다.
FAO의 주요 산물이자 지질 생합성의 전구체인 아세틸-코엔자임 A(CoA)는 아세틸화에 필요한 분자 기질을 제공함으로써 후성 유전적 조절에 중심적인 역할을 합니다
인지질과 콜레스테롤은 세포막의 주요 성분입니다.
이러한 지질은 악성 암 표현형을 유지하는 데 필수적인 역할을 합니다.
예를 들어 다제 내성을 촉진하고 원격 전이를 유도 하여 환자의 결과가 좋지 않습니다.
최근에는 phosphoinositides, lipoprotein, and triglyceride (TG)와 같은 여러 다른 지질의 역할도 이러한 환경에서 역할이 밝혀졌습니다.
최근 연구에서는 지질 대사 중간체가 암 진단 및 예후를 위한 대사 바이오마커 역할을 할 수 있다고 제안했습니다.
암에서 지질 대사를 조절하는 데 필수적인 일부 유전자가 암 치료의 치료 표적으로 제안되었습니다.
이들 유전자 중 일부를 표적으로 하는 약물은 현재 콜레스테롤 대사에서 속도 제한 효소인3-hydroxy-3-methylglutaryl-CoA(HMG-CoA)를 표적으로 하는 스타틴을 포함하여 전임상 조사를 진행 중입니다.
종양 성장을 촉진하고 유지하는 데 있어 종양 미세 환경(TME)의 일반적인 중요성은 잘 알려져 있습니다.
일련의 연구에서 암 진행에서 지질 대사가 TME에 미치는 영향을 설명했습니다.
ME의 기질 세포, 특히 면역 세포는 TME에서 생존할 수 있도록 지질 대사 재프로그래밍을 겪습니다.
또한, TME에 존재하는 지질 대사산물은 종양 면역원성을 조절하는 데 중요한 역할을 합니다.
다음 섹션에서 우리는 암 진행에서 FA, 콜레스테롤 및 인지질에 초점을 맞추어 지질 대사 재프로그래밍에 대한 최근 증거에 대해 논의할 것입니다.
우리는 암에서 지질 대사 재프로그래밍의 기본이 되는 다양한 조절 메커니즘과 암세포와 TME 사이의 지질 대사 매개 상호관계를 요약할 것입니다.
마지막으로 현재 전임상 및 임상 개발 중인 지질 대사 표적화 전략의 최근 발전에 대해 논의할 것입니다.
2 암에서 지질 대사 조절 장애
암세포는 공격적인 증식이 특징입니다.
이것은 세포가 O 2 및 일반적인 영양소 공급이 부족한 미세 환경에서 영양소를 획득하기 위한 전략을 개발할 것을 요구합니다.
포도당, 글루타민 및 일부 아미노산에 대한 수요 증가 외에도 암세포는 지질 대사 재프로그래밍을 거쳐 빠른 증식에 필요한 에너지 저장 및 막 생성을 획득할 수 있습니다.
암세포가 악성 표현형을 지원하기 위해 지질 대사 재프로그래밍을 활용하는 방법에 대한 보다 포괄적인 이해는 암 치료를 위한 새로운 치료 표적을 식별하는 데 도움이 될 수 있습니다(그림 1 ).

암의 지질 대사.
글루타민과 포도당 유래 아세틸-CoA는 콜레스테롤과 지방산의 새로운 합성에 사용 됩니다.
또한 외인성 흡수는 암세포의 지방산 풀에 기여합니다.
지방산은 β-산화를 거쳐 ATP와 아세틸-CoA를 생성할 수 있습니다.
FA 유래 아실-CoA 및 포도당 유래 glyverol 3-phosphate가 인지질의 새로운 합성을 위한 주요 재료 공급원 역할을 합니다.
ACC, acetyl-CoA carboxylase; ACLY, ATP-citrate lyase; ACS, acyl-CoA synthetase;
CACT, carnitine acyl-transferase; CD36, fatty acid translocase/scavenging receptor;
FABPs, fatty acid-binding proteins; FASN, fatty acid synthase; FPP, farnesylpyrophosphate;
HMGCR, 3-hydroxy-3-methylglutaryl-CoA reductase; HSL, hormone-sensitive lipase;
LDLR, low-density lipoprotein receptor; MUFA, monounsaturated fatty acid;
SCD, stearoyl-CoA desaturase (D9); TAG, triacylglycerol.
2.1 암에서 재프로그래밍된 FA 대사
FA는 TG, 인지질, 스핑고지질 및 스테롤을 포함한 다양한 지질 분자의 합성에 중요한 역할을 합니다.
정상 포유동물 세포는 주로 외인성 흡수에 의해 FA를 얻는 반면, 암세포에서 FA의 주요 공급원은 주로 미세 환경보다는 드 노보 합성에서 유래합니다.
지방산 합성효소(FASN)로 암호화된 유전자는 여러 인간 암에서 고도로 발현되어 de novo FA 합성 경로의 비정상적인 활성화에 중요한 역할을합니다.
FASN은 이후 결장직장암에서 혈관신생을 촉진하는 것으로 보고되었습니다.
췌장암에서 FASN의 증가는 질병 진행 및 생존율 저하, ER 스트레스 증가를 통한 젬시타빈 내성과 관련이 있었습니다.
FA는 포화 및 불포화 분자로 하위 그룹화될 수 있습니다.
포화지방산 대 불포화지방산의 비율은 지방독성으로부터 세포를 보호하는 데 중요합니다.
Stearoyl-CoA desaturase(SCD)는 stearoyl-(18:0) or palmitoyl-CoA (16:0)로부터 단일불포화 FA인 oleic acid (18:1) or palmitoleic acid (16:1) 형성의 속도 제한 단계를 촉매하는 ER에서 발견되는 통합 막 단백질입니다.
여러 연구에서 SCD가 종양에서 유의하게 증가하고 포화된 FA의 축적이 지방독성 및 ER 스트레스로 이어지기 때문에 FA의 SCD 매개 불포화화는 세포 생존을 위한 중요한 단계를 나타낼 수 있다고 보고했습니다. .
SCD를 표적으로 하는 억제제는 위암의 이종이식 모델에서 종양 세포의 세포자멸사를 유도하고 종양 형성을 억제하는 것으로 나타났습니다.
우리는 HCC 진행과 관련된 28개의 변경된 대사 산물과 169개의 차별적으로 발현된 유전자를 확인할 수 있었습니다.
추가 분석은 SCD 대사 경로 시그니처가 HCC의 진행과 유의하게 상관관계가 있음을 보여주었습니다.
기능적 연구는 이후에 SCD의 발현에 대한 간섭이 HCC의 이동 및 침입을 감소시킬 수 있음을 보여주었다.
드 노보 의 중심 역할암에서 FA 합성 활성화는 잘 알려져 있습니다.
그러나 TME로부터의 FA 흡수의 잠재적 기여는 덜 평가됩니다.
최근 보고서에 따르면 종양은 종양 환경에서 FA를 흡수하기도 하는데, 이는 FA 흡수가 종양 진행에 대한 새로운 합성 만큼 중요할 수 있음을 시사합니다 .
FA 트랜스로카제(FAT/CD36), FA 수송 단백질(FATP/SLC27A), 저밀도 지단백질 수용체(LDLR) 및 FA 결합 단백질(FABP)과 같은 특정 분자 수송체가 FA 흡수에 필요합니다.
인간 구강암 전이 개시 세포는 CD36 매개 FA 흡수를 통해 구강암의 전이를 촉진하는 데 도움이 되는 표면 단백질 CD36을 발현하는 것으로 나타났습니다.
핵 liver-X-receptor(LXR) 작용제를 사용한 LDLR 표적화는 GBM 환자에 대한 치료적 가치를 보여주었습니다.
Li et al의 연구는 막관통 당단백질 CD147이 다양한 종양에서 고도로 발현되고 판코니빈혈 대사의 중요한 조절자임을 보여주었습니다.
요약하면, FA는 종양 성장과 관련된 다양한 생물학적 과정에 관여합니다.
FA는 세포막의 구조 분자인 인지질에 필요합니다.
진행 중 증가하는 수요를 충족시키기 위해 종양 세포는 다량의 FA를 흡수하거나 합성합니다.
특정 유형의 종양(예: 전립선암)은 FA의 β-산화를 주요 에너지원으로 사용합니다.
FA는 또한 inositol phosphate, lysophosphatidic acid (LPA), and the prostaglandins을 포함한 지질 기반 신호 분자의 생성에 중요합니다.
최근 연구에 따르면 FA 대사 경로와 관련된 주요 유전자의 발현이 증가한다는 보고가 있습니다.
특정 억제제에 의한 이러한 대사 효소의 억제는 종양 성장을 억제할 수 있습니다.
2.2 암에서 재프로그래밍된 인지질 대사
인산을 함유한 지질을 인지질이라고 합니다.
인지질은 세포막의 필수 구성 요소이며 세포막의 구조와 정상적인 기능을 유지하고 신호 전달 및 세포 주기를 조절하는 데 중요합니다.
아실-CoA를 공여자로 사용하여 인지질은 케네디 경로라고 하는 새로운 경로에 의해 형성됩니다.
그런 다음 Lands' 주기로 알려진 리모델링 경로를 통해 탈아실화 및 재아실화의 후속 주기에 의해 수정됩니다.
인지질 함량은 종양 성장, 이동 및 전이와 같은 다양한 발암 과정을 조절하는 것으로 나타났습니다.
Phosphoglycerides and sphingolipids은 두 가지 주요 인지질 구조입니다.
또한 혈소판 활성화 인자(PAF), 아라키돈산(AA), 디아실글리세롤(DG) 및 크레아틴 삼인산(IP3)과 같은 인지질 대사 산물도 세포의 생물학적 기능에 중요합니다.
platelet activating factor (PAF), arachidonic acid (AA), diacylglycerol (DG), and creatine triphosphate (IP3)
2.2.1 Phosphoglyceride 대사와 암
glyceropholipid이라고도 하는 Phosphoglyceride은 가장 풍부한 인지질이며 막 이중층의 주요 구성성분입니다.
포스포글리세리드는 phosphatidylcholine(PC), phosphatidylserine (PS), phosphatidylethanolamine (PE), phosphatidylglycerol (PG), phosphatidylinositol (PI), and cardiolipin으로 더 나눌 수 있습니다. 13 더 노보포스포글리세리드의 합성은 CDP-콜린 경로(또는 케네디 경로)를 통해 이루어지며, 여기서 choline kinase, phosphocholine cytidylyltransferase (CCT), and 1,2-diacylglycerol cholinephosphotransferase의 세 가지 효소가 생합성에 기여합니다.
암에서 발생하는 phosphoglyceride 대사의 변화는 phosphoglyceride 대사와 관련된 속도 제한 효소의 조절 장애에 기인할 수 있으며 종양 성장에 중요합니다.
예를 들어, 유리 FA를 생성할 수 있는 포스포리파제 A1/A2(PLA1/2)의 활성, 인지질의 글리세롤 부분의 sn-1 및 sn-2 위치를 변형하여 2-아실 리소인지질 또는 1-아실 리소인지질, 암세포에서 현저히 증가합니다.
또한 Lipins 및 LPCAT를 포함하여 인지질 대사와 관련된 여러 다른 효소도 종양 진행에 중요한 역할을 하는 것으로 보고되었습니다.
포스포글리세리드 및 그 유도체는 일부 악성 암 표현형의 유지에 중요하며 불량한 암 예후와 관련이 있습니다.
PC는 진핵 세포에서 가장 우세한 인지질이며 진단 마커 역할을 할 수 있는 인간 결장직장암에 풍부합니다.
PC 합성에서 중요한 효소인 phosphocholine CCT의 발현은 암에서도 예후적 가치가 있습니다.
PI는 다른 인지질과 비교할 때 다소 덜 중요한 막 구성 요소입니다. 그러나 PI 및 PI 4-인산(PI4P), PI 4,5-이인산(PI-4,5-P2) 및 이노시톨 1,4,5-삼인산(IP3)과 같은 밀접하게 관련된 PI phosphate(PIP) , 호르몬 및 성장 인자 신호 전달에 중요하며 암의 비정상적인 신호 전달 과정과 관련이 있습니다.
PC 및 PI는 phospholipid-specific phospholipase C(PLC)에 의해 각각의 인지질로부터 생성되는 2차 전령 diacylglycerol(DG)의 중요한 공급원입니다.
PLC는 종양 진행에 필수적이며 잠재적인 암 치료 표적으로 확인되었습니다.
인지질 가수분해물인 lysophosphatidic acid (LPA)는 특정 수용체에 결합하여 다양한 생물학적 과정을 조절할 수 있는 생리활성 리소인지질입니다.
임상 데이터를 분석한 결과 암에서 LPA 수준이 증가했으며, 이는 LPA가 암의 진단 또는 예후 바이오마커 역할을 할 수 있음을 시사합니다.
새로운 연구에 따르면 LPA는 증식 신호 활성화, 무제한 세포 성장 및 세포자멸사에 대한 내성, 혈관신생 및 림프관신생, 상피에서 중간엽으로의 전이(EMT) 매개 종양 침습 및 전이, 게놈 불안정성, 종양 촉진 염증, 대사 재프로그래밍 및 항암 면역 회피에 관여합니다..
AA는 발암과 관련된 중요한 인지질 대사 산물입니다.
AA는 PLC 및 PKC의 활성화를 통해 종양 세포 성장을 촉진할 수 있으며, 이는 차례로 세포 내 Ca 및 cAMP 농도를 조절하고 산소 소비 및 CO 2 생산을 증가시킵니다..
또한 AA는 사이클로옥시게나제(COX), 리폭시게나제(LOX) 및 시토크롬P450(CYP)의 세 가지 효소 경로를 통해 생성되는 PGG2, 류코트리엔(LT) 및 에이코사노이드와 같은 생물학적 활성 대사 산물의 생성을 통해 종양 진행에 기여합니다.
AA-유래 PGE2는 또한 4개의 별개의 E-프로스타노이드 수용체(EP1-4)와의 상호작용을 통해 종양 진행에서 중요한 역할을 합니다.
또한 PGE2는 종양 면역 억제를 통해 종양 발달을 촉진할 수도 있습니다.
중요한 LOX isoform인 5-LOX는 유방암, 췌장암, 폐암, 전립선암, 간암 및 대장암과 같은 다양한 암의 진행에 관여합니다.
5-LOX 활성의 분자 산물인 LTB4는 종양 세포 표현형의 조절을 통해 발암에 영향을 미칠 수 있을 뿐만 아니라 암 진행에 유리하도록 미세 환경을 재형성함으로써 발암에 영향을 미칠 수 있습니다.
2.2.2 Sphingolipid 대사와 암
스핑고지질은 세포막의 기능과 완전성을 유지하는 데 중요한 역할을 하는 세포막의 구조적 구성요소입니다.
스핑고지질은 구조적 분자로 작용하는 것 외에도 세포 증식, 세포자멸사, 노화 및 형질전환과 같은 다양한 세포 과정의 조절에 중요한 역할을 하는 세포내 및 세포외 매개체로 기능하는 생체 활성 지질의 큰 패밀리로 대표됩니다.
ceramides and sphingosine-1-phosphate (S1P)와 같은 스핑고지질은 암 성장, 진행 및 화학요법에서 중요한 조절제로서 관련되어 있습니다.
세라마이드와 S1P는 특정 자극에 대한 반응으로 세포 운명을 결정하기 위해 반대되는 기능적 역할을 할 수 있습니다.
세라마이드는 세포 주기 정지 및 세포 사멸과 같은 세포 스트레스 반응을 매개하는 데 관여하는 반면, S1P는 세포 생존, 증식 및 이동을 자극하는 것으로 나타났습니다.
명백히 반대되는 생물학적 작용을 갖는 이러한 스핑고지질은 세포 내에서 상호 전환될 수 있으며, 이는 이들 사이의 균형이 세포 운명에 결정적일 수 있음을 시사합니다.
생리활성 스핑고지질은 일련의 효소와 대사산물에 의해 조절됩니다.
스핑고지질 분자의 수준은 대사효소에 의해 조절되며, 그 발현이나 활성의 변화는 암 유도, 세포 생존 및 사멸에 영향을 미친다.
스핑고지질 대사의 첫 번째 속도 제한 효소로서 Serine palmitoyltransferase(SPT)의 효소 활성은 많은 암의 종양 형성에 영향을 미칩니다.
미리오신을 통한 SPT 억제는 흑색종 세포의 증식을 방지하고 G(2)/M 단계에서 세포 주기 정지를 유도할 수 있습니다.
세라마이드는 복잡한 스핑고지질 생성에서 스핑고지질 대사 경로의 핵심 중간체입니다.
개별 유형의 스트레스 자극에 대한 반응으로 세라마이드의 합성 및/또는 축적은 노화, 자가포식 및 ER 스트레스의 유도를 통해 세포자멸사 프로그램의 증강 인자로 작용할 수 있습니다.
그러나 많은 종양에서 관련 효소의 활성이 증가하고 세라마이드 대사가 강화되었습니다.
스핑고지질의 생성을 증가시켜 생존 기능을 향상시킵니다.
S1P는 스핑고리피드 계열의 또 하나의 중요한 생리활성 지질입니다.
그것은 세라미다제에 의한 세라마이드 변형의 촉매 생성물인 스핑고신의 sphingosine kinase(SKs) 매개 인산화를 통해 생성됩니다.
세라마이드와 S1P 수준 사이의 균형이 세포 생존과 세포자멸사를 결정하는 데 중요한 역할을 한다고 제안되었습니다. .
또한, 세포 내 S1P는 후생적으로 유전자 발현을 조절할 수 있습니다.
S1P 농도는 실험적 암 모델과 암 환자 모두에서 정상 조직과 비교하여 암 간질액에서 증가된 것으로 나타났습니다.
S1P는 암세포 성장, 세포 변형, EMT, 종양 촉진 염증 강화 및 혈관 신생 촉진과 같은 암세포의 중요한 특성을 촉진함으로써 종양 진행을 촉진하는 것으로 볼 수 있습니다.
항-S1P 단일클론 항체를 사용한 실험적 치료는 쥐의 이종이식편에서 종양 진행을 감소시키는 것으로 나타났으며, 이는 지질 S1P가 암 치료의 표적이 될 수도 있음을 시사합니다.
2.3 암에서 재프로그래밍된 콜레스테롤 대사
최근 암에서 콜레스테롤 대사 재프로그래밍은 비타민 D, 프로게스테론 및 에스트로겐을 포함한 필수 호르몬을 제공하는 것과 같은 세포 항상성을 유지하는 데 중요한 역할에 부분적으로 기반하여 주목을 받았습니다.
뿐만 아니라 암세포에서 중요한 세포막 구조인 지질 뗏목을 형성하는 역할도 있습니다.
많은 종양 관련 단백질은 사멸 수용체, 단백질 키나제 및 칼슘 채널과 같은 지질 뗏목에 위치하여 지질 뗏목을 발암성 신호 전달 경로의 중요한 플랫폼으로 만듭니다.
세포막의 콜레스테롤 결핍은 암 진행을 억제하는 것으로 나타났습니다.
mevalonic acid, farnesyl pyrophosphate(FPP), geranylgeranyl pyrophosphate와 같은 콜레스테롤의 새로운 변형에 의해 생성되는 수많은 대사산물 은 부분적으로 Hedgehog, PI3K/Akt/mTORC1 및 Wnt/β-catenin 경로와 같은 발암성 신호 전달 경로에서 중요한 역할을 하기 때문에 암세포 성장에 중요합니다.
데노보콜레스테롤 합성은 주로 메발로네이트 경로에 의존하고 아세틸-CoA를 사용합니다.
암세포에서 포도당, 글루타민 및 아세테이트 소비가 증가하면 아세틸-CoA 의 생산이 증가 하여 메발로네이트 경로를 통해 생성되어 HMG-CoA를 형성할 수 있습니다.
3-hydroxy-3-methylglutaryl-CoA reductase(HMGCR)에 따라 HMG-CoA는 환원되어 메발로네이트를 형성하고 후속 변형을 거쳐 종양 성장에 필수적인 스테롤 및 이소프레노이드를 형성할 수 있습니다.
콜레스테롤은 일반적으로 acyl-CoA cholesterol acyl transferase(ACAT)에 의한 에스테르화 후 지질 방울의 형태로 세포질에 저장됩니다.
세포의 콜레스테롤 수치는 새로운 합성과 외인성 흡수를 통해 엄격하게 조절 됩니다 .
지질 대사와 항상성은 두 종류의 전사 인자인 SREBP와 LXR을 통해 전사적으로 조절됩니다.
SREBP1은 주로 FA 합성 관련 유전자를 조절하는 반면, SREBP2는 특정 SRE에 대한 서로 다른 친화력을 기반으로 콜레스테롤 생합성에 관여하는 유전자를 조절합니다.
핵에서 SREBP 활성은 hepatocyte nuclear factor 4(HNF4) 및 LXR과 같은 다른 전사 인자와의 상호 작용에 의해 영향을 받습니다.
LXR 전사 인자는 콜레스테롤 항상성 조절에 중요합니다.
세포 내 콜레스테롤 함량이 증가하면 LXR이 활성화되어 ATP 결합 카세트 서브패밀리 A 멤버 1(ABCA1) 및 ATP 결합 카세트 서브패밀리 G 멤버 1(ABCG1)과 같은 콜레스테롤 유출과 관련된 유전자의 전사를 유도하여 콜레스테롤 유출을 유도합니다.
LXR은 또한 SREBP에 결합하여 전사 활성을 감소시켜 콜레스테롤의 새로운 합성을 감소 시킬 수 있습니다.
암세포는 종종 SREBP의 증가된 활성을 나타내며, 이는 메발로네이트 경로의 속도 제한 효소인 HMGCR을 포함하여 메발로네이트 경로에 관여하는 효소의 발현을 증가시킵니다
종양에서 증가된 SREBP의 활성은 스테롤 풍부와 무관한 메커니즘인 발암성 신호전달 활성화와 관련이 있습니다.
콜레스테롤의 새로운 합성의 조절 장애 외에도 CD36, VLDLR, LDLR, 스캐빈저 수용체 클래스 B 멤버 1( SCARB -1), ABCG1 및 ABCA1과 같은 인자에 의해 매개되는 변경된 콜레스테롤 유입이 콜레스테롤에 기여합니다.
또한 LXR에 의해 크게 전사적으로 조절되는 과정을 통해 암세포의 콜레스테롤 항상성에 기여합니다.
콜레스테롤 대사 재프로그래밍을 받는 암세포는 강화된 약물 내성, 증가된 증식, 면역 탈출, 전이 및 "줄기" 특성의 존재를 포함하는 강화된 악성 표현형을 보여 줍니다.
콜레스테롤 대사 재프로그래밍은 종양 성장과 강하게 연관되어 있습니다.
콜레스테롤 생성을 억제하는 것은 유동성과 전반적인 지질 뗏목 형성에 영향을 미치므로 잠재적으로 세포막의 정상적인 기능을 수정합니다.
CD36은 지질을 세포로 수송하고 CD36을 억제하여 암세포의 성장과 전이에 중요한 역할을 하는 중요한 지질 수송체로서 전이 활성을 상당히 감소시킬 수 있습니다.
또한 FPP 및 GGPP(gernaylgerany parophosphate)와 같이 암세포 성장에 중요한 메발로네이트 경로의 중간체 생성을 억제하는 것도 암세포의 세포자멸사를 촉진할 수 있습니다.
세포 사멸 및 세포 주기 진행의 세포 내 콜레스테롤 매개 조절은 부분적으로 전암성 및 세포 사멸 경로의 조절에 관여하는 단백질과 관련된 콜레스테롤이 풍부한 지질 뗏목에 기인할 수 있습니다.
따라서 콜레스테롤 대사가 암세포의 생존과 진행에 중요한 역할을 함을 알 수 있습니다.
3 지질 대사 재프로그래밍의 분자 메커니즘
3.1 지질 대사 재프로그래밍에 기여하는 전사 인자
앞서 자세히 설명했듯이 LXR과 SREBP는 지질 대사 조절, 지질 흡수, 수송, 유출 및 지질의 새로운 합성에 기여하는 전사 인자 입니다.
최근 보고서는 종양 세포에서 보이는 지질 대사의 조절 장애에서 추가적인 전사 인자에 대한 조절 역할을 제안했습니다.
배아 발달 및 세포 재프로그래밍 동안 활성화되는 전사 인자인 NANOG,또한 줄기와 관련이 있으며 지질 대사의 재프로그래밍에 관여합니다.
아실-CoA 탈수소효소와 같은 FAO 관련 유전자의 전사 활성화를 통해 유도되는 Nanog로 자극된 FAO와 SCD1의 상향 조절을 통한 강화된 지질 불포화도는 간암 세포에서 강화된 자가 재생 및 약물 내성에 기여하는 것으로 나타났습니다.
RUNX1은 세포 증식 및 분화를 포함한 다양한 세포 활동을 조정하는 전사 인자 계열에 속합니다.
최근 연구에 따르면 RUNX1은 지질 대사에 관여하는 두 가지 중요한 효소인 SCD1 및 sterol O-acyltransferase 1의 직접적인 전사 조절을 통해 FA 생산에 영향을 주어 막 조직을 조절할 수 있습니다.
이것은 암세포의 빠른 증식에 필요한 신호 전달을 더욱 촉진할 수 있습니다.
MYC는 세포 성장, 세포 변형 및 종양 형성에 기여하는 중요한 원암 발생 전사 인자입니다.
지질 대사에서 MYC의 역할은 잘 알려져 있습니다.
MYC는 아세틸-CoA의 미토콘드리아 합성을 증가시키고 FA 팔미테이트의 새로운 합성 을 유도하는 것으로 나타났습니다.
최근 연구에서는 MYC가 FASN과 SCD를 활성화하여 FA의 새로운 합성에 기여할 수 있다고 제안했습니다.
또한, MYC는 FAO 조절에도 역할을 합니다.
MYC 억제는 미토콘드리아 호흡 복합체의 억제와 신경모세포종 세포의 β-산화를 통해 FAO 수준을 감소시켜 성장 억제와 세포 사멸을 초래합니다.
간모세포종 세포에서도 동일한 효과가 관찰되었습니다.
FAO 억제는 MYC가 높게 발현된 삼중 음성 유방암(TNBC)에서 에너지 대사를 감소시키고 종양 형성을 억제할 수 있으며, 이는 MYC가 FAO 억제 요법의 혜택을 받을 수 있는 환자를 결정하기 위한 바이오마커 역할을 할 수 있음을 시사합니다.
저산소증 유도 인자(HIF)는 종양에서 저산소 스트레스의 중요한 매개체이며 증식, 분화, 이동 및 화학방사선 요법 내성과 같은 세포 활동의 다양한 측면과 관련이 있습니다.
HIF 계열의 구성원인 HIF-2α는 대장암, 췌장암 및 난소암의 증식, 혈관신생 및 줄기세포 특성에 중요한 역할을 합니다.
Qiu et al은 HIF-2α가 지질 저장을 조절하여 투명 세포 신세포 암종(ccRCC)에서 ER 항상성에 영향을 줄 수 있다고 보고했습니다.
종양 세포에서 HIF-2α의 증가된 발현은 LD 코트 단백질 유전자 PLIN2의 발현을 증가시킬 수 있습니다.
이 단백질은 간에서 지질 합성 및 저장을 증가시킬 수 있으며 일반적으로 세포 지질 축적의 마커로 사용됩니다.
PLIN2의 HIF-2α 매개 발현은 ER 항상성에 필요한 지질 저장을 유도하고 종양 성장과 ER 스트레스에 대한 약리학적 내성에 기여할 수 있습니다.
3.2 지질 대사 재프로그래밍에 기여하는 신호 전달 경로
암세포는 일반적으로 발암성 신호 전달 경로의 과활성화를 나타냅니다. 실제로, 주요 경로의 비정상적인 신호는 다양한 암 유형에서 지질 대사 재프로그래밍과 연관되어 있습니다(그림 2 ).

지질 대사 재프로그래밍의 신호 전달 경로.
(A) PI3K/Akt 신호전달 경로는 암세포에서 지질 대사를 조절합니다.
PI3K/Akt는 FOXO1의 발현을 증가시켜 SREBP 전사를 시작할 수 있습니다.
PI3K/Akt 신호전달의 하류 표적인 mTORC는 LPIN의 활성화를 억제할 수 있으며, 또한 SREBP를 격리하고 핵으로의 전위를 억제합니다.
또한 Akt는 GSK3의 활성을 억제하여 SREBP의 분해를 억제할 수 있습니다.
(B) Hippo 신호 전달 경로는 암세포에서 지질 대사를 조절합니다.
Noncannonical Hippo 경로는 ER에서 Golgi로의 전위를 방지함으로써 SREBP의 성숙을 억제함으로써 지질 대사를 조절합니다.
LATS1/2는 또한 YAP/TAZ 분해를 촉진하며, 또한 FAO 관련 유전자의 발현을 시작하여 암세포에서 FA 산화를 촉진합니다.
게다가, YAP는 또한 핵에서 SREBP와 상호작용하여 전사 활성을 향상시키고 HMGCR 및 지방산 합성효소와 같은 다운스트림 표적의 발현을 증가시킬 수 있습니다.
(C) p38 MAPK는 PGC-1α의 직접적인 인산화를 통한 지질 대사 조절에 참여하여 PPARγ 표적 유전자에 대한 보조 활성화제의 모집을 촉진하고 염색질 리모델링을 촉진하여 PPARγ 의존성 유전자 전사를 촉진합니다.
약어:
ACLY, ATP-citrate lyase; ACOX1, acyl-CoA oxidase 1; CPT, carnitine palmitoyltransferase;
EGFR, epidermal growth factor receptor; ER, endoplasmic reticulum; EP300, E1A binding protein p300; FAS, fatty acid synthesis; FASN, fatty acid synthase; FOXO1, forkhead box O1;
GSK3, glycogen synthase kinase 3; HMGCR, 3-hydroxy-3-methylglutaryl-CoA reductase;
HSL, hormone-sensitive lipase; LATS1/2, large tumor suppressor kinase 1/2;
LDLR, low-density lipoprotein receptor; M- SREBP, mature SREBP;
MST1/2, macrophage stimulating 1/2; mTOR, mammalian target of rapamycin;
p38 MAPK, p38 Mitogen-activated protein kinase;
PPARγ, peroxisome proliferator activated receptor gamma;
PGC-1α, PPARG coactivator 1 alpha; Pre-SREBP, premature SREBP;
SREBP, sterol regulatory element binding protein; TEAD, TEA domain transcription factor;
YAP/TAZ, Yes1-associated transcriptional regulator/Tafazzin.
3.2.1 NF-κB 신호 전달 경로
염증 반응의 조절에 관여하는 주요 전사 인자인 NF-κB는 많은 암에서 과활성화되는 것으로 밝혀진 중요한 생존 신호 전달 경로이기도 합니다.
NF-κB 신호전달은 지질 대사 재프로그래밍에도 영향을 미칠 수 있습니다.
NF-κB의 억제는 세포에서 지질 축적을 감소시킬 수 있으며, 이는 지질 대사에서 NF-κB의 필수적인 역할을 시사합니다
SCD1 효소는 포화 FA를 ∆9-단일불포화 FA로 전환하는 역할을 합니다.
Li et al은 SCD1 매개 지질 불포화가 NF-κB 신호 전달을 통해 매개되는 난소암 줄기세포 특성을 유지하는 데 필수적인 역할을 한다고 보고했습니다.
NF-κB는 SCD1의 프로모터에 직접 결합하여 전사를 시작하여 암 줄기세포 현상에 기여하는 양성 피드백 루프를 효과적으로 형성할 수 있습니다.
3.2.2 PI3K/Akt 신호 전달 경로
PI3K/Akt 경로는 종종 암세포에서 과활성화되어 세포 성장과 증식이 향상됩니다
여러 연구에서 PI3K/Akt 경로가 암세포의 지질 대사 재프로그래밍에도 영향을 미칠 수 있음을 발견했습니다.
Akt 신호는 SREBP1 분해를 방지하여 지질 드 노보 합성을 촉진하는 것으로 보고되었습니다.
또한, PI3K/Akt/mTORC는 또한 핵 내 SREBP1 축적의 자극을 통해 지질 합성을 강화하고 세포 성장을 촉진할 수 있습니다.
EGFR은 수용체 티로신 키나제 계열에 속하는 종양 유전자입니다.
EGFR 활성화는 PI3K/Akt 신호전달 경로의 활성화를 통해 세포 증식을 촉진할 수 있습니다.
EGFRvIII 양성 GBM은 SREBP1의 PI3K/Akt 신호 전달 경로 의존적 과활성화에 반응하여 증가된 지방 생성을 나타내며, 이는 차례로 종양 성장과 연결됩니다
PI3K 경로 활성은 또한 세포 생존, 증식, 분화 및 전이에 상당한 영향을 미치는 단백질 및 지질 포스파타제 활성을 모두 갖는 이중 포스파타제인 PTEN에 의해 유도된 PIP3의 세포내 수준 감소에 의해 영향을 받을 수 있습니다.
최근에 지질 대사 재프로그래밍에서 PTEN/PI3K/Akt 신호 전달 경로에 대한 조절 역할이 확인되었으며 전사 및 전사 후 이벤트를 통해 SREBP 발현을 조절하는 것으로 나타났습니다.
forkhead box O1(FOXO1) 전사 인자를 포함한 PI3K/Akt 신호 전달 경로의 여러 다운스트림 표적은 SREBP 발현을 조절하여 지질 대사를 전사적으로 조절할 수 있습니다.
PI3K/Akt는 또한 ER에서 골지로 SREBP2의 수송에 관여하여 SREBP2 성숙 및 활성화에 기여합니다.
3.2.3 Hippo 신호 전달 경로
Hippo 신호 전달 경로는 세포 증식 및 분화의 중요한 조절자입니다.
Hippo 경로 신호 전달 기능 장애는 Yes1 관련 전사 조절자(YAP) 및 Tafazzin(TAZ)의 구성적 활성화로 이어져 궁극적으로 암세포의 증식에 기여하는 주요 다운스트림 표적 유전자의 조절을 초래합니다.
그림에 도시된 바와 같이, YAP/TAZ는 핵 내에서 성숙한 SREBP와 상호작용하여 전사 활성이 향상되고 HMGCR 및 지방산 합성효소(FAS)와 같은 다운스트림 표적의 발현이 증가하는 것으로 보고되었습니다.
하마 신호 전달 경로의 활성화는 당뇨병 마우스에서 간 지방증을 감소시키는 것으로 밝혀졌습니다.
YAP는 또한 FAO 조절에 참여하는 것으로 보이며, 따라서 tumor-draining lymph nodes(LN)을 통해 전이되는 암세포가 LN 미세 환경 내에서 생존하도록 돕는 것으로 보입니다.
흥미롭게도, 이 과정은 CYP7A1 매개 콜레스테롤의 담즙산 전환에 의해 유도되는 것으로 나타났으며, 이는 이전에 YAP를 활성화하는 신호로 작용하는 것으로 보고되었습니다.
표준 히포 경로 신호 외에도 비표준 히포 경로 신호는 지질 대사 재프로그래밍에 기여할 수 있습니다.
3.2.4 MAPK 신호 전달 경로
MAPK 신호 전달 경로는 세포 내 및 세포 간 통신에 중요하며 증식, 분화 및 생존과 같은 기본 세포 기능의 조절에 참여합니다.
증거는 p38α 억제가 SREBP1의 비활성화를 통해 콜레스테롤 항상성을 손상시켜 간 및 전립선 암에서 제한된 암세포 증식을 유도한다는 관찰에 따라 MAPK 신호 전달 경로가 지질 대사 제어에도 관여한다는 것을 시사합니다.
MAPK 억제는 SREBP1/SREBP2의 핵 축적을 감소시키고 다운스트림 표적 유전자의 발현을 감소시켜 전립선암의 전이 진행을 억제했습니다.
여러 연구에 따르면 지질 대사에서 MAPK의 조절 역할은 퍼옥시좀 증식자 활성화 수용체 감마(PPARγ) 활성의 조절을 통해 작용합니다.
간암에서 MAPK/PPARγ 축은 CD147 매개 FA 대사 재프로그래밍에 기여하고 암세포 증식 및 전이에 역할을 하는 것으로 나타났습니다.
3.2.5 Wnt/β-카테닌 신호전달 경로
Wnt/β-카테닌 신호전달은 암 진행 동안 세포 운명과 줄기 특성을 조절하는 중요한 경로입니다.
최근 연구에 따르면 Wnt/β-카테닌 경로는 또한 FA 수송 및 미토콘드리아 β-산화를 위한 증식자 활성화 수용체 알파(PPARα)에 대해 위에서 설명한 바와 같이 지질 대사에 반대 효과를 발휘할 수 있음이 밝혀졌습니다.
Senni et al은 β-카테닌이 PPARα를 부정적으로 조절함으로써 세포가 성장을 지원하기 위해 사용하는 에너지원의 종류를 결정하는 데 중추적인 역할을 한다고 보고했습니다.
유방암에서 β-카테닌의 녹다운은 FA의 새로운 합성에 관여하는 단백질인 아세틸-CoA 카르복실라제(ACC)와 FASN의 발현을 증가시켰습니다.
ACC 및 FASN의 증가된 발현 외에도 β-카테닌은 종양 세포에서 증가된 새로운 지질 합성 으로 상쇄될 수 없는 미토콘드리아 기능 장애와 관련이 있습니다. .
Wnt/β-카테닌 경로 신호전달은 복잡하고 상황에 따라 크게 좌우됩니다.
지질 대사에서 Wnt/β-카테닌의 조절 역할은 추가 연구가 필요합니다.
세포 분화에서 Wnt/β-카테닌 신호전달의 중심 역할을 고려할 때, β-카테닌 매개 지질 대사 재프로그램이 발달 및 세포 분화에 필수적인지 여부를 결정하는 것도 흥미로울 것입니다.
3.2.6 AMPK 신호 전달 경로
세포 대사의 중심 조절자로서 단백질 키나아제 AMPK는 세포 내 ATP 생산이 떨어질 때 활성화되는 세포 내 아데노신 뉴클레오티드 수준에 대해 고도로 보존된 센서입니다
세포 에너지 수준이 감소함에 따라 이 효소의 후속 활성화는 FA 산화를 자극하여 아세틸-CoA 카르복실라제(ACC1 및 ACC2) 및 HMGCR과 같은 지질 대사에 관여하는 다운스트림 표적 효소의 활성화를 통해 ATP를 증가할 수 있습니다.
다양한 진핵생물에서 FA 및 스테롤 합성을 위한 속도 제한 효소로 작용합니다.
성상세포 종양에서 AMPK는 새로운 지방 합성 감소와 세포외 지질 internalization 증가 를 통해 에너지 소비를 줄임으로써 지질 대사 재프로그래밍에 기여하는 것으로 나타났습니다.
SREBP1은 지질 대사의 중요한 전사 조절자입니다.
AMPK는 활성화를 억제하여 지방 생성을 감소시키는 SREBP1 단백질 내의 절단 부위 근처에서 보존된 세린을 인산화할 수 있습니다.
지질 대사 조절에 중요한 역할을 하는 NAD+ 의존성 히스톤 단백질 탈아세틸화 효소인 Sirtuin1(SIRT1)은 AMPK와 함께 지질 대사를 조절하는 것으로 보고되었습니다.
AMPK는 조직 상황에 따라 다르게 작용하는 것으로 보이는 지질 대사의 중요한 조절자입니다.
3.2.7 Notch 신호 경로
Notch 신호 전달 경로는 세포 운명 결정, 증식, 분화 및 세포 간 통신과 같은 다양한 주요 세포 과정을 조절합니다.
최근 연구에서는 종양 시작과 관련된 지질 대사를 조절하는 Notch의 역할을 확인했습니다.
Notch 매개 지질 대사 재프로그래밍은 지방육종의 시작에 중심적인 역할을 합니다.
Notch 경로의 활성화를 나타내는 지방 세포는 결국 지방육종으로 발전하는 관련 지질 대사 기능 장애와 함께 역분화를 겪습니다.
Notch 신호 전달의 억제는 감소된 지질 흡수 및 FA 산화로 이어질 수 있습니다.
지방 세포에서 지질 항상성의 중요한 조절자 역할을 하는 PPARγ 리간드의 생산에서 Notch에 의한 억제를 포함하는 잠재적인 메커니즘이 제안되었습니다.
PPARγ의 합성 보충제는 지방 세포의 Notch 활성화 유도 변형을 부분적으로 역전시키는 것으로 나타났습니다. 147내피 세포에서 Notch 신호 전달 경로는 혈관벽을 통한 FA 수송과 연결된 효소인 내피 리파제의 발현을 조절하는 것으로 보고되었습니다. 148 암에서 Notch 신호전달의 일반적인 역할은 거의 탐구되지 않았으며, 다른 분자 메커니즘이 암에서 Notch 주도 지질 대사 재프로그래밍에 기여할 수 있는지 여부를 결정하기 위해서는 추가 연구가 필요합니다.
3.2.8 STAT3 신호 전달 경로
STAT3는 증식, 분화, 염증 및 줄기세포를 비롯한 다양한 세포 과정의 조절에 참여하는 STAT 전사 인자 계열에 속합니다.
최근 보고서에 따르면 STAT3 매개 지질 대사도 암 진행에 필수적인 역할을 합니다.
STAT3는 긴 다중불포화 FA로 막을 풍부하게 하여 ferroptosis에 기여하는 효소인 acyl-CoA synthetase long-chain family member 4(ACSL4)의 발현 억제를 통해 세포 ferroptosis를 억제하는 것으로 밝혀졌습니다.
STAT3는 안드로겐 수용체(AR)와 협력하여 세포 주기 관련 키나제(CCRK)의 발현을 유도하여 간암의 종양 형성을 향상시킬 수 있음이 추가로 나타났습니다.
CCRK는 GSK3β/mTORC1 신호 전달을 통해 핵에서 성숙한 형태의 SREBP1 수준을 증가시켜 지질 드 노보 합성 및 흡수를 증가시키는 것으로 나타났습니다.
난소암에서 STAT3는 FA 흡수를 촉진하여 암세포 성장을 촉진하는 FABP4의 활성화를 유도하는 것으로 밝혀졌습니다.
유방암에서 JAK/STAT3는 FAO에 필요한 핵심 효소의 전사 활성화를 초래하는 카르니틴 팔미토일트랜스퍼라제 1B(CPT1B)의 프로모터에 직접 결합하여 암 줄기 세포에서 FAO를 촉진하는 것으로 밝혀졌습니다.
STAT3 억제 후 감소된 수준의 FAO가 관찰된 반면, CPT1B의 필요성을 우회할 수 있는 중쇄 FA(미리스트산) 보충은 JAK/STAT3 억제에 의해 유도된 종양 회전 타원체 형성 및 약물 내성의 억제를 역전시켰습니다.
이러한 발견은 STAT3 매개 지질 대사 재프로그래밍이 줄기 특성과 약물 내성을 유지하는 데 필수적임을 시사합니다.
3.3 암에서 비암호화=Noncoding RNA 매개 지질 대사 재프로그래밍
주로 긴 비암호화 RNA(lncRNA) 및 마이크로RNA(miRNA)인 비암호화 RNA(ncRNA)는 다양한 유형의 암에서 지질 대사의 중요한 조절자로 정의되었습니다.
4 지질 대사 및 종양 미세 환경
TME는 면역 세포, 섬유아세포, 내피 세포, 지방세포 및 세포외 기질로 구성됩니다.
TME의 정상 세포와 암세포 사이의 지속적인 상호작용은 종양 성장 및 진행의 중요한 구성 요소를 나타냅니다.
지질은 이 상호작용에 크게 기여하는 것으로 보입니다.
TME를 포함하는 기질 세포는 스트레스가 많은 환경에 적응하는 데 도움이 되는 지질 대사 재프로그래밍을 겪을 수도 있습니다.
따라서 TME 내에서 발견되는 지질 조절은 매우 역동적으로 보입니다.
여기에는 종양과 기질 세포, 말초 순환에서 지질 흡수 조절이 포함됩니다.
TME 내의 지질은 암세포의 증식을 강력하게 조절하고 암 관련 기질 세포, 특히 면역 세포의 기능을 형성하는 데 도움이 될 수 있습니다.
4.1 암세포에서 미세환경 매개 지질 대사 재프로그래밍
현재까지의 연구는 TME가 암세포에서 발생하는 지질 대사 재프로그래밍을 유도하는 데 도움이 되며 따라서 암세포가 TME에 적응하는 데 필수적인 역할을 하는 것으로 볼 수 있음을 시사합니다.
고형 종양 내의 무산소 및 산성 미세 환경은 종양 공격성 및 치료 저항성과 관련이 있습니다.
저산소증 및 산증에 노출된 암세포에서 지단백질의 증가된 흡수 및 축적이 관찰되며, 이 지질 농축 표현형은 시험관 내에서 spheroids를 형성하는 능력 (줄기 특성의 척도) 및 전이를 겪을 수 있는 능력의 증가와 관련이 있습니다.
산성 pH에 적응한 암세포는 미토콘드리아에서 트리카르복실산(TCA) 주기에 연료를 공급하고 강화된 미토콘드리아 단백질 아세틸화를 유도하는 FAO 유래 아세틸-CoA의 생성 증가를 보여줍니다.
미토콘드리아 단백질의 강화된 아세틸화는 피루브산/말레이트-유도 복합체 I의 활성을 억제하고 ROS 생성을 감소시켜 결국 산성 pH에 적응된 세포의 증식에 기여합니다.
Kondo 등은 산 자극이 SREBP2의 활성 증가를 통해 암세포에서 콜레스테롤 생합성을 향상시킬 수 있고 따라서 산성 TME 내에서의 생존을 촉진할 수 있다고 보고했습니다.
TME의 비암성 기질 세포는 사이토카인, 성장 인자, Wnt 리간드 및 MMP와 같은 인자의 측분비 분비를 통해 종양 성장 및 전이를 촉진할 수 있으며, 이는 암세포에서 지질 대사 재프로그래밍을 촉발하는 데 도움이 됩니다.
또한, 기질 세포는 종양 진행을 촉진하는 데 도움이 될 수 있는 암세포와 가용성 대사 산물을 공유합니다.
일련의 연구에서 지방세포 유래 FA가 암 세포 틈새에서 필수적인 역할을 한다는 것이 입증되었습니다.
지방 세포와 암세포 사이의 지질 매개 누화는 암 진행과 관련된 줄기 특성을 육성하고 원격 전이를 유지하는 데 도움을 주는 것을 포함하여 암 진행에 기여합니다.
지방 세포는 암세포의 지질 방울 축적을 증가시켜 암세포 성장을 촉진할 수 있습니다.
지방세포는 페리리핀 및 호르몬 민감성 리파제(HSL)와 같은 지방분해 관련 유전자의 증가된 발현 및 활성에 대한 반응으로 유리 FA의 생산 및 방출을 향상시킵니다.
이러한 연구는 TME가 암세포의 지질 대사 재프로그래밍에 필수적인 역할을 하고 종양 진행을 촉진하는 데 도움이 된다는 것을 강력하게 시사했습니다(그림 3).

암에서 미세 환경 매개 지질 대사 재프로그래밍.
TME의 산성 pH는 암세포에서 콜레스테롤과 FA 합성을 향상시키는 데 기여합니다.
지방세포는 AMPK를 활성화하여 종양 세포에서 FAO를 촉진할 수 있습니다.
또한 지방 세포에 의한 지방 분해가 강화되어 암세포가 흡수할 수 있는 지질 방울이 생성됩니다.
CAF는 또한 지질 방울로 암세포에 연료를 공급하는 데 도움이 되는 향상된 지방분해를 보여줍니다.
TME 및 TH-17 분비 IL-17의 렙틴은 STAT3 신호전달의 활성화를 통해 FA 흡수 및 FAO를 촉진할 수 있습니다.
상피 세포는 암세포에서 PUFA 및 글리세로인지질의 수준을 증가시킬 수 있습니다
약어:
AMPK, adenosine 5‘-monophosphate (AMP)-activated protein kinase; ACC, acetyl-CoA carboxylase;
CAF, cancer-associated fibroblast; FATP1, fatty acid transport protein 1;
STAT3, signal transducer and activator of transcription 3.
4.2 암 관련 기질 세포의 지질 대사
종양 조직에서 세포 집단의 ~50%를 구성하는 종양 기질 세포는 또한 지질 대사 재프로그래밍을 겪을 수 있습니다.
CAF는 암의 성장과 진행을 촉진하는 중요한 기질 세포입니다.
이 세포는 예를 들어 PGE 생산을 통해 지질 대사를 조절하는 데 도움이 될 수 있습니다.
신경모세포종에서 CAF는 증가된 PGE를 발현하는 것으로 밝혀졌으며, 이는 차례로 종양 성장, 면역 억제 및 혈관 신생 증가와 관련이 있습니다.
EMT 관련 인자인 Snail은 TGF-β 자극에 대한 반응으로 CAF에 의한 강화된 PGE 분비를 부분적으로 설명할 수 있습니다..
Tumor infiltrating lymphocytes(TIL)는 악성 종양 세포를 인식하고 죽일 수 있으며 종양 성장에 대한 중요한 내인성 check를 나타냅니다.
이 중요한 효과기 세포는 종종 피로로 인해 종양 세포를 죽이는 능력을 잃습니다.
이 현상은 잘 알려져 있지 않습니다.
TIL에서 지질 대사 재프로그래밍은 TME에 의해 촉발될 수 있으며 지질 및 그 유도체는 TIL 기능에 영향을 미칠 수 있습니다.
영양 경쟁적 TME에서 TIL은 기능적 활성을 유지하기 위해 대사를 다시 배프로그래밍해야 합니다.
지질 대사 패턴은 T 세포의 기능적 성숙과 활성화 동안 변화합니다.
T 세포는 Th1, Th2, Th17, Treg, 세포독성 T 림프구(CTL) 및 다양한 기억 세포와 같은 다양한 effector 세포 계통으로 표시됩니다.
정상에서 T 이펙터 세포의 생성은 FA 산화 감소, 해당 작용 강화 및 FA 합성을 동반합니다..
Treg 세포와 CD8+ T 기억 세포는 생성을 위해 FAO에 의존합니다.
mTOR와 AMPK는 T 세포의 대사 경로를 형성하는 데 도움이 됩니다.
TIL에서 FA 합성은 PI3K/AKT/mTORC1/SREBP 축을 통해 유도되는 반면 AMPK는 랩터의 인산화를 통해 mTORC1을 억제할 수 있으며 이를 통해 TSC1-TSC2 복합체의 생성과 FAO의 증가를 촉진합니다.
TME에서 Treg 세포는 FABP5를 통해 세포 내 FA를 수송하여 FAO에 연료를 공급합니다.
FABP5를 차단하여 FA 대사를 억제하면 미토콘드리아 완전성을 손상시키고 Treg 세포의 확장 및 증식을 억제할 수 있습니다.
시험관 내 에서 개발된 Treg 세포와 달리 , 종양층 유래 Treg는 세포 내 지질을 축적하고 증식을 촉진하는 mTOR/SREBP 신호 전달을 통해 FA 합성을 매개합니다.
일반적으로 CTL 및 기타 이펙터 T 세포는 뚜렷한 mTOR 신호 전달을 나타내고 강력한 해당 작용 및 지질 합성을 특징으로 합니다.
TME에서 T 이펙터 세포는 FAS 활성을 유지하고 FAS는 기능을 유지하는 데 중요한 역할을 합니다.
랩터 결핍 또는 SREBP 억제에 의한 FA 합성의 감소는 시험관 내 CD8+ T 세포 성장 및 증식을 감소시킬 것 입니다.
지질 합성의 핵심 효소인 ACC1의 결핍은 단세포 유전자에 감염된 마우스에서 CD8+ T 세포의 antigen-specific 확장 및 축적을 감소시킬 것입니다.
그러나 TME를 특징짓는 대사적으로 경쟁적인 환경 내에서 effector T 세포에 의한 해당 작용은 포도당 부족으로 인해 억제되어 피로를 유발할 수 있습니다.
이러한 세포는 lipid/PPAR 신호 전달에 대한 반응하여 기능을 유지하는 수단으로 FAO로 재부팅될 수 있습니다.
PPAR 신호전달은 FAO를 재활성화하여 CD8+ T 세포 항종양 기능을 유지하는 데 중요한 역할을 합니다.
유리 FA는 PPAR 신호를 활성화하고 차례로 CPT1의 상향 조절을 유도하고 마지막으로 CD8+ T 세포의 FAO를 증가시킵니다.
최근 연구에서는 포도당 결핍 및 산소 결핍 CD8+ T 세포에서 PPARα 신호전달의 활성화가 강화되어 FA 흡수 및 FAO가 증가했다고 설명했습니다.
따라서, PPARα 작용제의 적용을 통해 CD8+ T 세포에서 FAO를 촉진하면 항종양 효과를 강화하고 항 PD1 요법을 촉진할 수 있습니다.
PPARα 작용제에 대한 보다 광범위한 연구는 T 세포 재활성화 수단으로 사용할 가능성을 결정하는 데 도움이 될 것입니다.
지질 대사 재프로그래밍은 PD1 유도 T 세포 고갈과도 관련이 있습니다.
PD1 신호를 받는 T 세포는 포도당과 아미노산의 이상 대사와 에너지 생성에 사용되는 증가된 FAO를 특징으로 하는 대사 재프로그래밍을 겪습니다.
고갈의 정도와 이들 세포의 소생 능력은 FAO에 의한 에너지 생성의 유일한 원천인 지질의 공급에 달려 있습니다.
TIL의 일반적인 대사는 콜레스테롤의 영향을 받을 수 있습니다.
이전 연구에서는 T 세포 수용체(TCR) 활성화가 콜레스테롤 생합성 경로의 활성화를 촉진하고 SREBP2 경로를 통해 유도되는 T 세포의 콜레스테롤 수치를 증가시키는 것으로 나타났습니다.
ACTA1을 억제하여 콜레스테롤 에스테르화를 방지하면 CD8+ T 세포에서 콜레스테롤의 생합성을 촉진하고 골수종에 대한 항종양 Effector 기능을 향상시킬 수 있습니다.
MDSC, 종양 관련 대식세포(TAM) 및 수지상 세포(DC)를 포함한 골수 세포는 TME의 중요한 구성 요소입니다.
이들 세포는 항종양 T 세포 면역을 억제하는 역할을 하며 종양 면역 요법을 약화시킬 수 있습니다.
DC는 TIL 의존성 항종양 면역을 시작하고 유지합니다.
세포 지질의 농축은 TIL의 활성화를 돕는 DC의 손상된 능력과 관련이 있습니다.
종양 환경의 DC는 환경으로부터 지질을 흡수하고 FA 합성을 증가시켜 세포 지질을 증가시킵니다.
FASN의 활성화에 의한 증가된 FA 합성의 결과 또는 SRA를 상향 조절함으로써 증가된 FA의 흡수는 암에서 항종양 T 세포를 지원하는 DC의 능력의 억제로 이어질 것입니다.
DCs 지질 항상성의 중단은 TME 지질 대사산물에 의해 유발될 수 있습니다.
지질 과산화 생성물은 난소암 관련 DC에서 ER 스트레스를 유발할 수 있습니다.
ER 스트레스 관련 단백질 XBP1은 TG 생합성 관련 표적 유전자의 발현을 상향조절할 수 있으며, 이어서 DC의 세포질 지질 함량을 증가시킬 수 있습니다.
지질 과산화 생성물 외에도 TME의 옥시스테롤은 DC에서 LXR-α를 활성화할 수 있습니다.
이는 DC 표면에서 CCR7의 발현을 감소시켜 성숙한 DC가 LN으로 이동하는 능력을 감소시켜 항종양 면역을 감소시킬 수 있습니다.
TAM은 또한 활성화 및 성숙 동안 지질 대사 재프로그래밍을 겪을 수 있습니다.
TAM의 분류에는 항종양 M1 유사 TAM 및 종양 M2 유사 TAM이 포함됩니다.
일반적으로 LPS 및 IFN-γ 활성화된 M1 유사 TAM은 IDH의 전사 억제에 의한 시트레이트 축적을 통해 FA 합성을 증가시키는 반면, IL-4/IL-13 활성화된 M2 유사 TAM은 STAT6/PGC1β에 의해 구동되는 FAO를 증가시킵니다.
TME는 대사 산물과 세포 성분의 존재를 통해 TAM 대사와 기능을 형성합니다.
세포 내 지질의 축적은 M1 유사 TAM에 중요합니다.
이전 연구에서는 세포내 FA가 M1 유사 TAM의 세포독성 활성을 향상시키는 것으로 나타났습니다.
그러나 세포 외 지질과 지질 대사 산물은 TAM의 성질을 바꿀 수 있습니다.
또 다른 연구는 FAO에 연료를 공급하기 위해 CD36을 통해 세포외 지질을 세포질로 TAM 수송하는 것으로 나타났습니다.
CD36을 유전적으로 제거함으로써 FAO를 억제하면 종양 촉진 TAM 활동을 억제하는 것으로 나타났습니다.
TAM은 TME에 반응하여 콜레스테롤 대사를 변경할 수 있습니다.
난소암 세포는 ABC 수송체의 발현을 통해 TAM의 막-콜레스테롤 유출을 자극할 수 있습니다.
SREBP를 통한 FAS의 활성화는 최근에 M2 유사 TAM에서 기술되었으며, Treg 세포의 도움으로 세포-세포 상호작용이 일부 대사 재프로그래밍에서 중요할 수 있음을 시사합니다.
종합하면 TME는 TAM 대사 재프로그래밍에 복잡한 영향을 미칩니다.
TME에서 MDSC는 FA 흡수를 증가시키고 FAO를 ATP 생산의 주요 공급원으로 사용합니다.
FAO 장애는 MDSC의 억제 활동을 차단할 수 있습니다.
MDSC는 종양 유래 G-CSF 및 GM-CSF에 의한 자극과 STAT3 및 STAT5를 통한 후속 신호 전달을 통해 매개되는 지질 수송 수용체의 상향 조절을 통해 지질 흡수를 증가시킵니다.
FA 트랜스로카제 CD36의 유전적 고갈에 의한 지질 흡수의 억제 또는 STAT3 또는 STAT5 신호의 억제는 MDSC에서 손상된 면역억제 기능을 초래하고 종양 성장을 지연시킵니다.
TME의 지질 대사 산물은 또한 MDSC 축적을 조절하고 면역 억제 활성을 향상시킬 수 있습니다.
PGE2는 MDSC의 분화를 유도하고 EP2 수용체를 통해 MDSC 면역 억제를 강화하는 것으로 보고되었습니다.
옥시스테롤은 CXCR2 수용체를 통해 호중구를 모집할 수 있습니다.
4.3 지질 유도체는 종양 immunogenicity을 조절할 수 있습니다
면역 탈출은 암의 특징입니다.
증가하는 증거는 종양 세포 및 TME의 지질 대사 rewiring이 종양 면역원성에 중요한 조절 효과를 발휘함을 시사했습니다(그림 4 ).
lipid mediators=지질 매개체라고 하는 Lipid-derived signal molecules=지질 유래 신호 분자도 TME를 염증 또는 면역 억제 상태로 만드는 데 중요한 역할을 합니다.
암 조직에 존재하는 S1P의 농도는 IL-6의 S1P/S1PR1/STAT3 매개 생산을 유도함으로써 대장염 관련 암에서 암 진행과 만성 염증 사이의 연결에 기여합니다.
또한, S1P-S1PR1 축은 단핵구를 유인하고 대식세포에서 M2 표현형 분극을 유도함으로써 종양 면역 반응의 조절자 역할도 합니다.
PGE2는 잘 규명된 지질 매개체입니다. 효소 COX-2에 의해 AA에서 생성되는 불포화 FA입니다.
PGE2는 자연 살해(NK) 세포 세포 독성 및 NK 세포 분화의 억제를 통해 면역 공격을 피하도록 돕는 갑상선암 세포에 의해 분비됩니다.
위암에서 종양 유래 PGE2는 또한 NK 세포의 증식을 억제하고 세포 사멸을 증가시켜 종양 진행을 촉진합니다.
또한, PGE2는 TAM과 MDSC에서 PD-L1 발현에 기여하여 종양 숙주의 면역 억제를 촉진합니다.
PGE2는 또한 CD8+ CTL에서 EP2/4 수용체를 통해 PD-1 발현을 상향 조절하여 폐암에 대한 면역 내성을 향상시키는 것으로 보고되었습니다.
저산소 상태에서 PGE2는 EP2를 통해 활성화된 M2 TAM에서 VEGF-C/D 분비의 잠재적인 유도자가 될 수 있으며, 이는 림프 내피 세포 발아를 유도합니다
종양 immunogenicity에 대한 PGE2의 기여는 조직 상황에 따라 어느 정도 달라질 수 있습니다.
콜레스테롤 대사는 또한 항종양 면역 조절에 중요한 역할을 합니다.
Yang et al은 콜레스테롤 에스테르화 효소 ACAT1을 약리학적으로 억제하는 것이 CD8+ T 세포의 증식 및 효과기 세포독성을 증가시키는 데 기여한다고 보고했습니다.
ACAT1 억제는 CD8+ T 세포의 원형질막에서 콜레스테롤을 증가시키고 T 세포 수용체 클러스터링 및 신호전달을 향상시키는 것으로 생각됩니다.
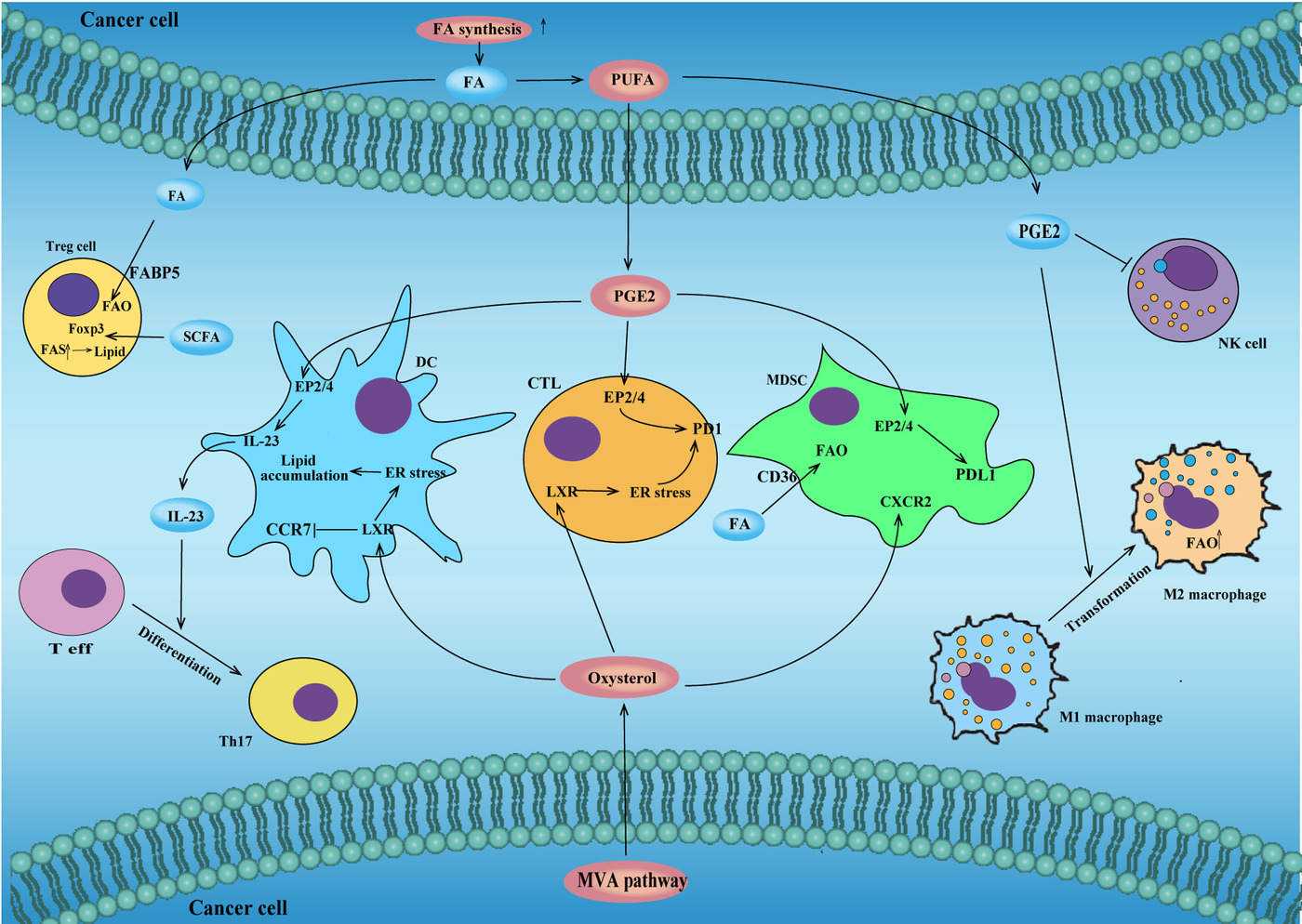
지질 대사 재프로그래밍은 종양 immunogenicity에 영향을 미칩니다.
암세포에서 증가된 FA 합성은 TME에서 지질 저장에 기여하여 Treg 세포에서 FAO를 연료로 사용합니다.
SCFA는 또한 Foxp3 발현을 유도하여 Treg 세포의 발달을 촉진할 수 있습니다.
암세포에서 분비되는 PGE2는 NK세포의 세포독성과 NK세포 분화를 억제할 수 있다.
PGE2는 또한 CTL에서 PD1의 발현을 증가시키고 MDSC에서 PD-L1의 발현을 증가시킬 수 있습니다.
PGE2는 NK 세포 기능을 억제하고 대식세포의 M2 대식세포로의 분극화를 촉진할 수 있습니다.
유선 종양 세포에 의해 분비되는 PGE2는 또한 DC의 EP2 및 EP4 수용체를 활성화하여 Th17 세포 생존 및 확장에 중요한 사이토카인인 IL-23의 생성을 자극할 수 있습니다.
암세포의 옥시스테롤은 면역 체크 포인트 발현 유도와 T 세포 고갈을 통해 T 세포 항종양 면역을 억제할 수 있습니다.
옥시스테롤은 LXR을 활성화하여 DC 표면에서 CCR7의 발현을 감소시켜 이차 림프관으로의 이동을 방지하고 잠재적인 항원 제시를 감소시킬 수 있습니다.
옥시스테롤은 CXCR2와 상호작용하여 MDSC를 TME로 모집할 수 있습니다.
약어:
CCR7, C-C motif chemokine receptor 7; CXCR2, C-X-C motif chemokine receptor 2; DC, dendritic cells;
EP2/4, prostaglandin E receptor 2/4; ER, endoplasmic reticulum; FA, fatty acid; FABP5, fatty acid binding protein 5;
FAO, fatty acid oxidation; FAS, fatty acid synthesis; Foxp3, forkhead box P3; LXR, liver X receptor;
MDSC, myeloid-derived suppressor cells; NK cell, natural killer cell; PD1, programmed cell death 1;
PDL1,programmed cell death 1 ligand 1; PGE2, prostaglandin E2; PUFA, polyunsaturated fatty acid;
Th17, T helper cell 17.
최근에, 일반적인 종양 immunogenicity을 재조절하는데 있어서 암 지질 대사의 조절 역할이 관찰되었다.
흑색종 세포에서 지질 산화 대사 상태의 상승된 수준은 세포독성 T 세포에 항원을 제시하는 주요 조직적합성 복합체(MHC) 클래스 I 분자의 발현 증가를 통해 T 세포 매개 사멸에 대한 흑색종 세포의 감수성을 증가시키는 것으로 나타났습니다.
항원 제시에 대한 효과 외에도 암의 지질 대사 산물은 TME 내에서 면역 세포를 직접 재프로그래밍할 수 있습니다.
예를 들어, 암세포는 면역 세포 기능을 조절하는 콜레스테롤 대사 산물을 분비할 수 있습니다.
면역 세포에 대한 콜레스테롤의 영향은 복잡하며, 내인성 또는 외인성 콜레스테롤이 TIL에 서로 다른 영향을 미치는 것으로 나타났습니다.
내인성 콜레스테롤 생합성의 SREBP 매개 상향 조절은 CD8+ T 세포 증식 및 효과기 기능에 필수적이지만, TME에 축적된 콜레스테롤 또는 산화 생성물은 T 세포 항종양 면역을 억제할 수 있습니다.
TME의 콜레스테롤 축적은 면역 관문 분자 발현을 증가시키고 ER 스트레스 센서-XBP1로 인한 PD1 및 2B4의 상향 조절 증가를 통해 T 세포 고갈을 촉진할 수 있습니다.
옥시스테롤(콜레스테롤 산화 생성물)의 핵 수용체인 LXR은 T 세포 기능을 부정적으로 조절할 수 있으므로 TME의 옥시스테롤은 LXR의 활성화를 유도하여 T 세포에 의한 항종양 면역을 억제할 수 있습니다.
옥시스테롤은 LXR sumoylation를 유도하여 CD8+ T 세포 분극에 필수적인 IL-9 발현을 억제하여 더 나은 항종양 효과기 기능을 가진 이러한 효과기 세포의 IL-9 분비 버전으로 분극화할 수 있습니다.
따라서 지질 대사는 MHC 매개 항원 제시의 조절, 면역 억제 세포의 활성화 및 세포 독성 효과기 T 세포의 기능 장애를 통해 종양 면역 탈출에 참여함을 알 수 있습니다.
암에서 지질 대사 재프로그래밍을 목표로 하는 5가지 치료 전략
지질 대사 재배선은 종양 생존 및 증식에 필수적이며 암에서 지질 대사 재프로그래밍을 표적으로 하는 치료적 개입은 종양 성장을 제어하는 효과적인 수단을 나타낼 수 있습니다.
5.1 FA 대사 표적화
종양 세포 생존 및 성장에서 FA의 필수적인 역할에 기초하여 FA의 가용성을 제한하는 것은 치료 전략을 나타낼 수 있습니다
예를 들어, 암세포에서 LD로 저장된 TG의 분해는 FA의 중요한 세포 내 공급원을 나타냅니다.
암에서 FA를 표적으로 하는 요법은
(a) 새로운 FA 합성 차단,
(b) FA 흡수 차단,
(c) FA 이용 차단의
세 가지 일반적인 전략으로 나눌 수 있습니다.
FA 대사를 표적으로 하는 항암제는 표 1 에 자세히 설명되어 있습니다.
| 분지 | C75 | 유방암, GBM, RCC, 중피종, 신경교종, 폐암 및 흑색종 | 이종이식 | 221, 278, 279 |
| 세룰레닌 | 난소암과 유방암 | 이종이식 | 280 | |
| FASN | 올리스타트 | 전립선암, 흑색종, 신경교종 자궁내막암, 흑색종 및 OTSCC | 이종이식 | 281-286 |
| 트리클로산 | 전립선암과 유방암 | 이종이식 | 287 | |
| 아멘토플라본 | 유방암 | 이종이식 | 288 | |
| ACLY | EGCG | 폐암, 유방암 | 이종이식 | 279, 289 |
| TVB-3166 | 난소 암 | 이종이식 | 290 | |
| SB-204990 | 폐암 | 이종이식 | 227, 291 | |
| LY294002 | 폐암 | 이종이식 | 292 | |
| ACC | TOFA | HNSCC, 난소암, 결장암 및 RCC | 이종이식 | 293-296 |
| 메트포르민 | 폐암, 전립선암, 난소암 | 이종이식 | 297, 298 | |
| AICAR | AMPK Activator 간세포암종, 전립선암, 자궁경부암 | 이종이식 | 299 | |
| ACC | ND-654 | 간세포암종 | 이종이식 | 223 |
| ACC | ND-646 | 비소세포폐암 | 이종이식 | 300 |
| SCD | BZ36 | 전립선암 | 이종이식 | 240 |
| A939572 | 신장암 | 이종이식 | 24, 301, 302 | |
| CAY-10566 | HCC, 유방암, HNSCC 및 난소암 | 이종이식 | 303-305, 118 | |
| CVT-11127 | 간세포암종 | 이종이식 | 306 | |
| MF-438 | 폐암 | 이종이식 | 307, 308 | |
| T-3764518 | CRC 및 중피종 | 이종이식 | 308, 309 | |
| CPT1 | Etomoxir | 전립선암, 유방암 및 교모세포종 | 이종이식 | 237, 238, 310, 110 |
| Ranolazine | 협심증 치료제 전립선암 | 이종이식 | 311 | |
| Perhexiline | 유방암, 전립선암 및 림프구성 백혈병 | 이종이식 | 237, 312, 313 | |
| ACSS | Triacscin C | 폐암, 대장암, 뇌암 | 이종이식 | 314 |
- 약어: ACC, acetyl-CoA carboxylase; ACLY, ATP citrate lyase; ACSS, acetyl-CoA synthetase;
- EGCG , (-)-Epigallocatechin 3-gallate; FASN, fatty-acid synthase; GBM, glioblastoma multiform;
- HCC, hepatocellular carcinoma; HNSCC, head and neck squamous cell carcinoma;
- NSCLC, nonsmall-cell lung cancer; OTSCC, oral tongue squamous cell carcinom;
- RCC, renal cell cancer; CRC, colorectal cancer; SCD, stearoyl-CoA desaturases;
- CPT1, carnitine palmitoyltransferase 1
5.1.1 de novo FA 합성 차단
암세포는 일반적으로 FA의 새로운 합성 증가를 나타 냅니다.
FASN, ACLY 및 ACC와 같은 FA 합성을 위한 속도 제한 효소는 암세포에서 유의하게 상향 조절되며 이러한 효소의 억제는 암세포의 증식과 성장을 감소시킬 수 있습니다.
전임상 연구에서 FA 대사 경로를 표적으로 하는 화합물의 항종양 효과가 확인되었습니다.
cephalosporin cyanobacterium의 천연 대사산물인 Cerulenin은 FASN 억제제입니다.
그것은 세포에서 FA의 합성을 차단하고 다양한 암 세포주에 세포 독성 효과가 있습니다.
FASN 억제제인 C75는 세룰레닌보다 화학적 성질이 더 안정적이며 유방암, 전립선암, 중피종, 난소암 등 다양한 인간 암 세포주에 대해 강력한 억제 효과를 보인다.
FA 대사 재프로그래밍은 항혈관신생 치료에 대한 암 적응에 기여하고 FASN 억제제의 사용은 수니티닙 치료 중단 후 종양 재성장 및 전이를 억제할 수 있습니다.
Furutal 등은 FASN 억제제와 cyclophosphamide의 조합이 종양 저산소증으로 인한 약물 내성을 부분적으로 극복했다고보고하여 FASN 억제가 화학 요법의 효율성을 향상시킬 수 있음을 시사했습니다.
Jiang et al은 종양 세포 고유의 FASN이 T 세포 침윤의 부재 및 DC 기능 장애를 유발할 수 있으며 난소암의 면역 억제 미세 환경과 관련이 있다고 보고했습니다.
따라서 면역 요법과 함께 FASN을 표적으로 하는 것은 임상적 이점을 나타낼 수 있습니다.
ACC는 암 세포에서 상향 조절되는 FA 생합성에서 중요한 효소입니다.
ACC를 억제하면 항종양 효과가 있습니다.
시트르산을 아세틸-CoA로 전환하는 주요 세포질 효소인 ACLY는 GBM, 결장직장암, 유방암, 비소세포폐암 및 HCC에서 과발현됩니다.
ACLY 억제제 중 일부는 FA의 합성을 차단하는 것으로 입증되었으며 디플루오로시트르산 및 히드록시시트레이트와 같은 시트르산 유사체를 포함합니다.
일부 ACLY 억제제가 검증되었지만 현재까지 대부분의 연구는 전임상입니다.
FASN, ACC 및 ACLY는 암 세포에서 상향 조절되는 SREBP 전사 인자의 다운스트림 표적 유전자입니다.
따라서 SREBP는 치료 표적을 나타낼 수 있습니다.
이전 연구에서는 SREBP1 억제가 시험관 내 및 생체 내 에서 다양한 종양 세포의 증식 및 이동을 감소시킬 수 있다고 제안했습니다 . 비스테로이드성 디아릴티아졸 유도체인 파토스타틴은 ER에서 골지체로의 SCAP 수송을 차단함으로써 SREBP1의 활성화를 억제하는 것으로 나타났습니다
표적 전사 조절제 또는 FA 합성을 위한 속도 제한 효소를 통해 FA의 새로운 합성을 억제하는 것은 종양 성장 억제를 위한 표적을 나타낼 수 있습니다 .
5.1.2 FA 흡수 차단
점점 더 많은 보고서에서 종양이 환경에서 FA 흡수를 향상시키는 것으로 나타났으며, 이는 FA 흡수 경로를 차단하는 것이 암 치료에 효능을 나타낼 수 있음을 시사합니다.
FA 흡수를 매개하는 막관통 단백질인 CD36의 억제는 종양 성장을 억제하는 것으로 나타났습니다.
LDLR, FATP 및 FABP를 포함하여 암에서 FA의 증가된 흡수에 기여하는 다른 단백질도 종양에서 상향 조절됩니다.
멜라토닌은 FATP의 기능을 간접적으로 억제하여 종양 성장을 억제할 수 있습니다. .
연구에 따르면 TME는 암 세포에 대한 FA의 중요한 공급자 역할을 할 수 있으며 CAF 및 지방 세포와 같은 암 기질 세포의 지방 분해 증가와도 관련이 있습니다.
TME에서 강화된 FA에 기여하는 잠재적인 분자 메커니즘을 이해하면 새로운 항암 치료법을 개발할 수 있습니다.
5.1.3 FA 사용 차단
FA는 세포 내에서 다양한 기능을 수행하며, 논의한 바와 같이 그 중 하나가 FAO를 통해 에너지를 공급하는 것이다.
FAO 관련 효소의 과발현은 여러 유형의 악성 종양에서 발견되었으며 종양 진행에서 이들의 중요한 역할이 입증되었습니다.
CPT1은 FAO의 속도 제한 효소이며 암세포의 빠른 증식에 필요합니다.
etomoxir 및 ranolazine과 같은 CPT1 억제제는 전립선암에서 항종양 효능을 나타냅니다. .
또한 FAO 경로와 VEGF 경로를 표적으로 하는 병용 요법이 단독 요법에 비해 우수한 항암 효과를 나타내는 것으로 밝혀져 CPT1 억제제가 항혈관신생제(AAD) 내성을 극복하는 효과가 있음을 시사한다.
이러한 발견은 CPT1이 암 치료를 위한 치료 표적으로서의 가능성을 강력하게 시사합니다.
흥미롭게도 FAO는 MDSC 기능에 필수적이므로 CPT1 억제제 치료는 MDSC의 기능을 억제하여 항종양 효율을 더욱 높일 수 있습니다.
FAO 외에도 FA는 불포화를 거쳐 MUFA를 형성할 수 있으며 이 과정은 암세포 생존에도 중요합니다.
SCD1은 다양한 악성 종양에서 과발현되며 암세포가 포화 지질을 불포화 지질로 변환하여 포화 지질 독성으로 인한 세포 사멸로부터 세포를 보호하는 데 도움이 되는 중요한 효소입니다.
SCD1 억제제를 사용한 치료는 MUFA와 SFA 사이의 균형을 깨뜨리고 전립선 및 폐암의 이종이식 모델에서 종양 세포의 생존율을 감소시키는 것으로 밝혀졌습니다.
현재까지 CAY-10566 및 MF-438을 포함하여 종양 치료에서 SCD1을 표적으로 하는 여러 화합물은 주로 체중 감소 및 피부 및 눈에 대한 독성 부작용으로 인해 전임상 시험으로 제한되었습니다.
이러한 독성 부작용을 극복하는 것은 차세대 SCD1 억제제 개발의 핵심 포인트입니다.
5.2 콜레스테롤 대사 표적화
수많은 연구에서 암 생존에서 콜레스테롤 대사의 중요한 역할이 확인되었습니다.
조절되지 않고 암 진행에 기여하는 콜레스테롤 대사 중간체 및 콜레스테롤 대사 재프로그래밍 관련 유전자는 암 치료를 위한 유망한 치료 표적이 될 수 있습니다.
콜레스테롤 대사를 표적으로 하는 항암제는 표 2 에 자세히 설명되어 있습니다.
표 2. 콜레스테롤 대사를 표적으로 하는 항암제의 요약
TABLE 2. Summary of anticancer drugs targeting cholesterol metabolism
| SREBPs | Fatostatin | Prostate cancer | Xenografts | 231, 8 |
| 25-HC | Glioblastoma | Xenografts | 122 | |
| Betulin | Lung cancer | Xenografts | 315 | |
| HMGCR | Statins | CRC, prostate cancer, and multiple myeloma | A cohort study | 316-318 |
| Lipophilic statins | Melanoma | Xenografts | 319 | |
| ACAT1 | Avasimibe | Prostate cancer | Xenografts | 320 |
| Avasimin | Prostate cancer and CRC | Xenografts | 321 | |
| Bitter-melon extract | Breast cancer | Xenografts | 322 | |
| LXR | RGX-104 | Melanoma and lung cancer | Xenografts | 323 |
| LXR623 | RCC | Xenografts | 324 | |
| SR9243 | CRC and prostate and lung cancer | Xenografts | 325 | |
| OSC | R048-8071 | CRC and pancreatic adenocarcinoma | Xenografts | 326 |
| Squalene synthase | Zaragonic acids | Lymphoma and lung cancer | Xenografts | 327 |
| CYP27A1 | GW273297X | Breast cancer | Xenografts | 217 |
- Abbreviations:
- ACAT1, cholesterol acyltransferase 1; CYP27A1: cytochrome p450 27A1; HMGCR, HMG-CoA reductase;
- LXR, liver X receptor; OSC, oxidosqualene cyclase; SREBPs, sterol regulatory element-binding proteins;
- CRC, colorectal cancer; RCC renal cell carcanima
5.2.1 콜레스테롤 생합성 차단
콜레스테롤 생성을 줄이면 지질 뗏목 형성을 줄이고 에너지 저장을 차단하며 암 증식, 전이 및 생존과 관련된 유전자를 조절하는 데 중요한 핵 호르몬 생산을 줄일 수 있습니다.
메발로네이트 경로의 억제는 항암 전략을 나타낼 수 있습니다.
메발로네이트 경로의 속도 제한 효소인 HMGCR은 암 치료를 위한 치료 표적으로 연구되었습니다.
HMGCR 억제제인 스타틴은 콜레스테롤 합성을 억제하여 암 환자의 치료를 위한 임상 연구에서 콜레스테롤 대사 표적 약물로 일반적으로 사용되어 왔습니다.
대조적으로, 스타틴은 때때로 종양 촉진 효과를 나타낼 수 있으며, 다른 설정에서는 종양 부담에 대한 메발로네이트 경로 억제제의 억제 효과가 보고되었습니다.
앞서 언급한 증거에 따르면 암에 대한 스타틴의 영향(억제 또는 촉진)은 다양한 생물학적 활성을 가질 수 있는 암의 유형에 따라 다릅니다.
메발로네이트 경로 효소인 lanosterol synthase의 억제는 최근 콜레스테롤 합성을 억제하고 신경교종의 세포 사멸을 유도하는 것으로 보고되었습니다.
콜레스테롤 대사 관련 유전자는 암 진행에 중요한 것으로 보이며 따라서 암 치료를 위한 잠재적인 치료 표적을 나타냅니다.
5.2.2 콜레스테롤 유도체 생합성 차단: 콜레스테롤 에스테르 및 옥시스테롤
우리가 보았듯이 콜레스테롤 에스테르화는 암 진행에 중요한 역할을 합니다.
아바시미브는 ACAT-1을 표적으로 하는 저분자 억제제로 콜레스테롤 에스테르화를 억제하고 세포내 유리콜레스테롤 수치를 개선한다.
avasimibe에 의한 콜레스테롤 에스테르화 억제는 췌장암의 증식, 전이 및 침윤을 효과적으로 억제하는 것으로 밝혀졌습니다.
또한 상승된 유리 콜레스테롤은 SREBP1을 비활성화시켜 카베올린-1/MAPK 경로의 하향 조절과 종양 전이 및 침윤의 억제를 초래할 수 있습니다.
축적된 증거는 콜레스테롤 유도체 생합성을 차단하는 것이 암세포를 다른 항종양 요법에 민감하게 만든다는 것을 나타냅니다.
또한, ACAT1 억제제를 사용한 치료는 항-PD1 항체 요법의 항종양 효능을 향상시킬 수 있다.
ACAT1 억제제와 젬시타빈,파클리탁셀, 또는 독소루비신와 같은 화학요법제와의 조합 또한 췌관 선암종, 흑색종 및 유방암 모델에서 항종양 효과를 향상시키는 것으로 밝혀졌습니다.
5.2.3 콜레스테롤 유출 유도
LXR은 스테롤에 의해 활성화되는 핵 수용체로서 콜레스테롤의 흡수, 수송, 유출 및 분비와 관련된 일련의 표적 유전자의 기능을 조절하여 콜레스테롤의 대사 균형을 유지하는 데 중요한 역할을 합니다.
Pencheva et al은 LXR 작용제 GW3965에 의해 유도된 ApoE의 발현이 흑색종의 침입, 혈관신생 및 전이를 억제한다는 것을 발견했습니다.
전립선암에서 TO901317은 지질 뗏목 막의 콜레스테롤 함량과 AKT의 인산화를 감소시켜 신호 장애 및 전립선 암 세포 증식 억제를 유도합니다.
그러나 병행 연구에서는 간질 세포의 콜레스테롤 유출이 반대 효과를 유발할 수도 있다고 보고했습니다.
ABC 수송체의 유전적 결실은 TAM의 종양 촉진 기능을 역전시키는 것으로 밝혀졌다.
콜레스테롤 유출의 영향과 암세포와 기질 세포 간의 누화는 더 많은 조사가 필요합니다.
5.3 인지질 대사 표적화
phosphoglyceride와 sphingolipid로 구성된 인지질은 종양의 성장, 증식, 침습, 전이를 조절하는 중요한 역할을 하는 세포막의 구조적 분자이다.
이들 분자의 생합성에 관여하는 신호 전달 경로 및 관련 속도 제한 효소를 표적으로 하는 것은 종양 치료를 위한 전략을 나타낼 수 있습니다. 인지질 대사를 표적으로 하는 항암제는 표 3 에 자세히 설명되어 있습니다.
표 3. 인지질 대사를 표적으로 하는 항암제의 요약
| PLD | VU0359595 | 유방암 | 이종이식 | 328 |
| VU-0155069 | 유방암 | 이종이식 | 329 | |
| LPA | Ki16425 | 췌장암 | 이종이식 | 267 |
| S1P | FTY720 | 폐암 | 이종이식 | 269 |
| JTE013 | 방광암 | 이종이식 | 330 | |
| AB1 | 신경 모세포종 | 이종이식 | 274 | |
| 스핑고맙 | RCC | 2단계 | 275 | |
| SPHK | SK1-I | GBM | 이종이식 | 331 |
| PF543 | 대장암 | 이종이식 | 332 | |
| ABC294640 | 진행된 고형 종양 | Ib 및 II 단계 | 333, 272 | |
| 세라마이드 | LCL‑521 | 전립선암 | 이종이식 | 273 |
| LCL-385 | 전립선암 | 이종이식 | 334 |
- 약어:
- LPA, lysophosphatidic acid; PLD, phospholipase D; S1P, sphingosine-1-phosphate;
- SPHK, sphingosine kinase; RCC, renal cell carcinoma; GBM, glioblastoma multiforme
5.3.1 포스포글리세라이드 경로 차단
종양 생물학에서 LPA 및 LPA 수용체의 역할을 감안할 때 이러한 수용체의 효과적인 표적화는 종양 연구에서 중요한 목표가 되었습니다.
이 작업은 LPA 합성을 줄이고, LPA 대사 경로 활성화를 차단하고, LPA 수용체 활성을 억제하고, 관련 경로에서 신호 전달을 차단하는 접근 방식에 주로 초점을 맞추었습니다.
5.3.2 스핑고리피드 경로 차단
ceramide and sphingosine은 세포 주기 정지를 유도하고 세포 사멸을 촉진하는 반면, S1P는 세포 생존을 촉진하기 때문에 세라마이드/스핑고신과 S1P 사이의 균형 조절은 종양 치료의 새로운 전략으로 간주되었습니다.
6 결론 및 전망
대사체학의 발전은 암에서 발생하는 대사 재프로그래밍에 대한 이해를 극적으로 확장시켰으며, 이는 현재 종양의 중요한 특징으로 인식되고 있습니다.
종양은 악성 형질전환 및 종양 진행과 강하게 연결된 지질 대사 재프로그래밍을 겪습니다.
암세포에서 지질 대사 재프로그래밍과 발암성 신호 전달 사이에는 밀접한 관련이 있습니다.
발암성 신호 활성화는 차례로 암세포에서 지질 대사를 조절하는 지질 대사 관련 유전자의 발현을 촉진할 수 있습니다.
지질 대사 생성 중간체는 암에서 발암성 경로의 활성화를 더욱 향상시켜 암세포 증식, 침습 및 원격 전이에 협력적으로 기여할 수 있습니다.
발암성 신호 전달에 의해 조절되는 것 외에도 암세포에서 지질 대사 재프로그래밍은 TME에서 파생된 신호(예: 저산소증 또는 산성 pH)로 인해 발생할 수 있으며, 이는 암세포에서 지질 대사를 다시 연결할 수 있습니다.
암세포에서 이러한 지질 대사 재프로그래밍은 거친 종양 환경에서 생존을 촉진할 수 있습니다.
암에서 지질 대사 재프로그래밍에 중요한 유전자를 표적으로 하는 것은 암 치료를 위한 중요한 수단이 될 수 있습니다.
불행히도 지질 대사에 관여하는 효소 및/또는 신호 전달을 표적으로 하는 화합물은 현재 전임상 연구에 사용할 수 있는 화합물이 비교적 적습니다.
스타틴은 콜레스테롤의 속도 제한 효소를 표적으로 하는 지질 대사 장애에 널리 사용되는 약물입니다.
드 노보 합성-HMGCR. 전임상 연구에서 암 위험을 줄이는 데 스타틴의 긍정적인 역할이 확인되었으며 단일 요법과 병용 요법 모두에서 항암제로서의 스타틴의 가치를 추정하기 위해 여러 임상 시험이 수행되었습니다.
다양한 정도의 성공으로 스타틴 섭취의 잠재적인 사망 이점은 유방암, 폐암, 췌장암 및 결장직장암을 포함한 다양한 유형의 암에서 관찰되었습니다.
암 세포 외에도 암 관련 기질 세포는 TME에서 생존과 기능을 지원하기 위해 지질 대사를 겪습니다.
지질 대사는 TME 내의 비암 세포, 특히 면역 관련 세포의 기능을 조절하는 데 중요한 역할을 합니다.
T 세포의 기능적 활성은 SREBP 매개 고유 콜레스테롤 생합성의 상향 조절을 필요로 하며, 이는 암세포 생존에도 중요합니다.
T 세포 기능에 대한 SREBP1을 표적으로 하는 약물의 잠재적인 부작용을 평가하고 T 세포에 대한 적당한 부작용으로 치료 효율을 달성할 수 있는 약물의 합리적인 용량이 있는지 조사하기 위한 연구가 시급합니다.
면역 세포 기능에서 지질 대사의 중추적인 역할을 고려할 때, 무엇보다도 규제가 완화된 지질 대사가 암 진행을 어떻게 조절하는지에 대한 포괄적인 이해는 암 치료를 위한 새로운 전략을 고안하는 데 도움이 될 것입니다.
지질 대사에서 단일 분자 또는 경로를 표적으로 삼는 것이 더 효과적인 암 치료를 초래할 가능성이 없다는 것이 점점 더 분명해지고 있습니다.
최적의 치료를 위해서는 지질의 새로운 합성과 지질 흡수의 동시 억제가 필요할 수 있습니다.
종양 세포의 지질 기아 가능성은 지질을 TME로 수송하는 것을 감소시키는 지질 제한 식이 요법 또는 항혈관신생 요법에 의해 달성될 수 있습니다.
다른 항종양 요법과 함께 지질 대사를 표적으로 하는 약물의 조합은 종양 진행을 제어하는 보다 유망한 전략을 나타냅니다.
종양 진행을 방해하고 항종양 면역을 강화하는 치료 전략의 발견은 지질 기반 약물 개발에서 가장 유망한 접근법 중 하나입니다.
'암치료' 카테고리의 다른 글
| 지질 대사와 암 (0) | 2022.09.28 |
|---|---|
| 암의 지질 대사 환경과 새로운 치료적 관점 (0) | 2022.09.27 |
| AMPK (0) | 2022.09.15 |
| (링크) Full Metabolic Blockage(좋은습관님) (0) | 2022.08.11 |
| (링크)APOTOSIS 세포자멸사, 암 대사 치료의 종착역(좋은습관님) (0) | 2022.08.11 |