2020
https://www.frontiersin.org/articles/10.3389/fonc.2020.605154/full
The Lipid Metabolic Landscape of Cancers and New Therapeutic Perspectives
Lipid metabolism reprograming, as a hallmark of malignancy, has received renewed interest in recent years in such areas as energy sources, cell membrane components, and signaling molecules involved in the rapid tumor growth and the adaptation to the tumor
www.frontiersin.org
지방산 산화 및 콜레스테롤 축적을 통해 종양 성장 및 진행을 촉진합니다.
지질 대사 재프로그래밍은 암의 특징이며 종양 미세 환경과 암세포 표현형을 형성하는 데 중요한 역할을 하여 종양의 발생과 발달에 기여합니다.
종양 세포의 지질 대사는 에너지를 저장하고 증식에 필요한 기본 세포 구성요소를 합성하기 위해 호기성 해당작용에 의해 생성된 탄소 기반 전구체를 활용함으로써 세포 신호 전달 캐스케이드의 매개체 역할을 할 수 있습니다.
따라서 지질 대사 재프로그래밍은 종양 대사에서 필수적인 연결 고리입니다.
지질 대사의 변화는 세포 증식, 분화 및 운동성을 포함한 수많은 세포 과정에 영향을 미칠 수 있습니다.
또한 암세포는 영양소가 제한된 미세 환경에서 산소와 영양소를 놓고 경쟁하기 때문에 대사를 변경하고 지방산(FA)을 얻음으로써 악성 잠재력을 유지합니다.
암세포는 새로운 합성 및 FA의 외인성 흡수 증가, 상향 조절된 지방산 산화(FAO), 콜레스테롤 축적 및 유도된 암 관련 지방 조직을 포함한 여러 메커니즘을 통해 지질 대사를 재 연결 합니다.
동시에 암세포의 대사 재프로그래밍은 대사 경쟁, 대사산물 및 엑소좀과 같은 다양한 방식으로 면역 세포에 영향을 미칠 수 있습니다
축적된 증거는 신진대사를 표적으로 하는 병용 치료 또는 단기 기아가 면역 요법 또는 화학 요법 효능을 향상시킬 수 있음을 나타냅니다.
암에서 지질 대사에 대한 연구에 따르면 지질 대사 경로의 가장 광범위한 변화는 FA 대사, 콜레스테롤 대사, 아라키돈산 대사 및 퍼옥시좀 증식자 활성화 수용체(PPAR) 신호 전달입니다
FA 대사 조절 완화는 암 진행을 지원합니다
FA 대사 재프로그래밍은 종양의 빠른 증식과 침습성에 기여합니다.
암세포의 지질 대사 재프로그래밍에는 지질 흡수 증가, 새로운 지방산 합성(FAS) 및 FAO와 같은 여러 측면이 포함됩니다 ( 그림 1 ).
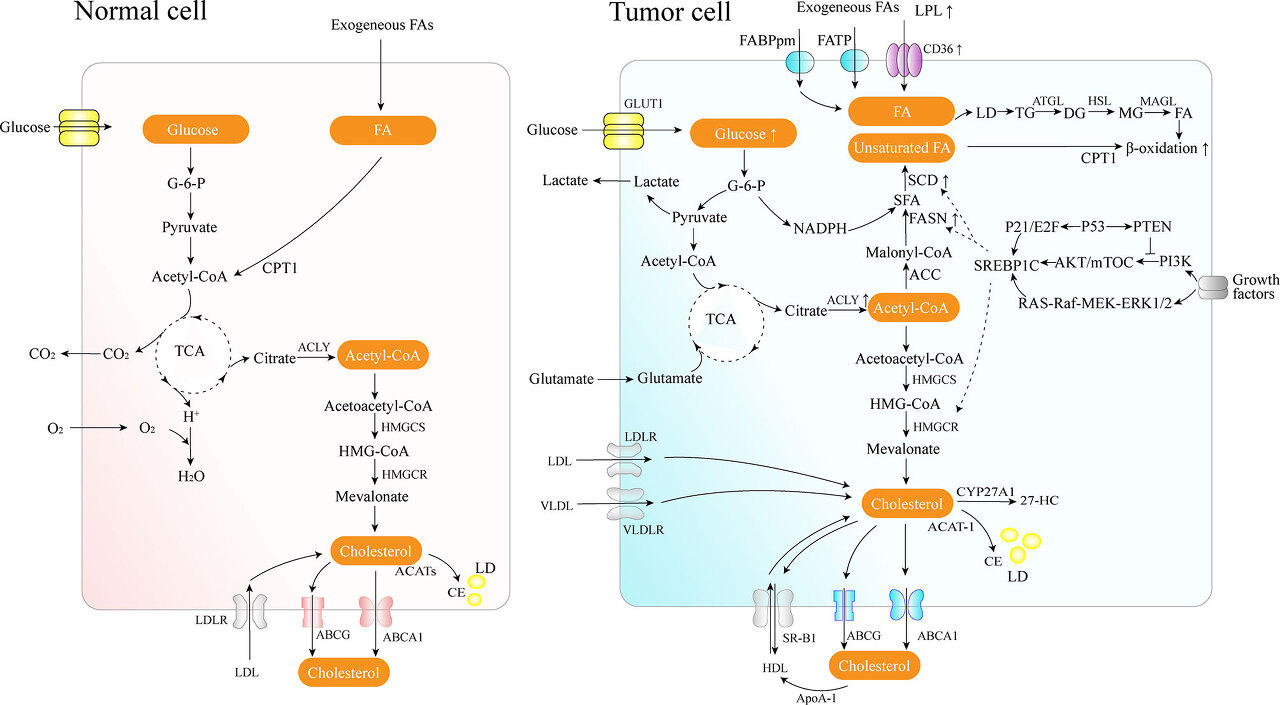
그림 1 정상 세포와 암세포의 지질 대사 개요.
암세포는 LPL, CD36, FATP 및 FABPpm을 통해 식이 유래 FA를 획득합니다.
포도당은 해당과정에 의해 아세틸-CoA로 전환되고 미토콘드리아에서 TCA 회로를 통해 시트르산으로 전환됩니다.
구연산염은 세포질로 운반되고 아실 사슬의 탄소원을 성장시키는 사용되는 구연산 분해효소에 의해 다시 아세틸-CoA로 전환됩니다.
해당과정에서 오탄당 인산 경로는 NADPH를 생성합니다.
암세포는 또한 효과적인 드노보(생합성) 로 발달합니다.
암세포는 또한 주요 지방생성 효소의 활성을 증가시키면서 효과적인 새로운 FAS 기계를 개발합니다..
세포의 잉여 지질(과량의 FA 및 콜레스테롤 포함)은 LD의 핵심에 중성의 불활성 생체 분자 형태로 존재합니다.
ATGL은 지방분해의 초기 단계를 촉매하여 TG를 DG로 전환합니다.
HSL은 주로 DG에서 MG로 가수분해를 담당하고 MAGL은 MG를 FFA와 글리세롤로 가수분해합니다.
CPT1은 외부 미토콘드리아 막 효소로서 미토콘드리아 막을 가로질러 FA를 전위시킨 다음 미토콘드리아에서 장쇄 FA의 분해가 발생합니다.
콜레스테롤 항상성은 새로운 합성(메발로네이트 경로), 식이 콜레스테롤 흡수, 말초 조직에서 과잉 콜레스테롤 제거 사이의 상호작용을 포함합니다.
27-HC는 CYP27A1 효소에 의한 콜레스테롤의 대사 기질입니다.
SREBP-1은 PI3K/Akt/mTOR 경로 및 Ras/Raf/MEK/ERK 신호 경로를 통해 활성화됩니다.
순환하는 FA로부터 증가된 지질 흡수 이점
종양 세포는 막 생합성 또는 신호 전달 과정을 위한 지방분해에 의한 에너지 공급으로 순환 유리 FA(FFA)를 사용할 수 있습니다.
지단백질 리파제(LPL), CD36(지방산 트랜스로카제, FAT라고도 함), 지방산 수송 단백질 계열(FATP) 및 원형질막 지방산 결합 단백질(FABPpm)은 혈류에서 식이 유래 FA를 획득하는 데 사용됩니다.
Lipoprotein lipase (LPL)은 세포외 지방분해에 의해 분비되고 모세혈관 내피세포의 관강 표면에 결합된 중요한 효소이며 잠재적으로 종양 세포 또는 종양 미세 환경의 비악성 세포에 의해 공급될 수 있습니다
종양 저산소증은 산소 의존성 스테아로일-CoA 불포화 효소(SCD)를 제한하여 포화 FA 전구체의 축적을 초래합니다.
저산소 상태에서 외인성 불포화 지질의 증가된 흡수는 FA 불포화에 대한 요구 사항을 우회하여 포화 FA 유도 독성을 완화하고 저산소 암세포에서 항상성을 유지하는 데 중요한 역할을 합니다.
상향 조절된 내인성 de Novo FAS 형성은 지질에 대한 수요 증가를 적응시킵니다.
성인 유기체의 새로운 FAS는 주로 지방 조직, 간 및 수유 중인 유방에서 발생하며 적절하게 균형 잡힌 식단을 섭취하는 사람들은 내인성 FAS를 거의 나타내지 않습니다.
그러나 몇몇 암세포는 새로운 내인성 FAS의 높은 비율을 보여줍니다.
또한 종양이 감소된 혈관 밀도 영역에서 자라면 순환계의 지질에 대한 접근도 감소합니다.
FA는 모든 생물학적 막 지질의 필수 구성 요소이며 에너지 대사에 중요한 기질입니다.
종양 세포의 성장과 분열은 탄소, 질소, 자유 에너지, 그리고 포도당과 글루타민의 환원 물질?을 요구하기 때문에 호기성 해당 작용은 FAS에 필요한 아세틸-CoA 및 니코틴아미드 아데닌 디뉴클레오티드 포스페이트(NADPH)의 강력한 생산을 지원할 수 있습니다
세포질에서 ACLY는 미토콘드리아에서 파생된 시트르산을 아세틸-CoA로 전환하며, 이는 FA와 콜레스테롤의 내인성 생합성을 위한 중요한 빌딩 블록입니다.
ACLY는 여러 유형의 암에서 높은 수준의 활동과 발현을 나타냅니다.
대조적으로 ACLY 녹다운은 p53의 활성화를 유발하여 암세포에서 DNA 손상 유발 세포자멸사를 촉진할 수 있습니다.
또한, FAS 경로에는 2개의 속도 제한 효소인 ACC 및 FASN이 있습니다.
콜레스테롤 생성 및 지방 생성의 마스터 조절자로서, 스테롤 조절 요소 결합 단백질(SREBP, SREBP1a, SREBP1c 및 SREBP2 포함)은 내인성 콜레스테롤, FA, TG 및 인지질 합성에 필요한 효소 캐스케이드를 전사적으로 활성화합니다( 표 1 ). .
저산소증은 생체 내 FASN 발현 수준에도 영향을 미칩니다 . 저산소증은 Akt의 유도를 통해 SREBP-1을 유의하게 상향 조절합니다
또한 SREBP-1은 포도당과 글루타민 대사 경로를 조절하는 것으로 알려져 있으며 SREBP-1은 해당 작용을 강화하여 종양 세포를 보호할 수도 있습니다.
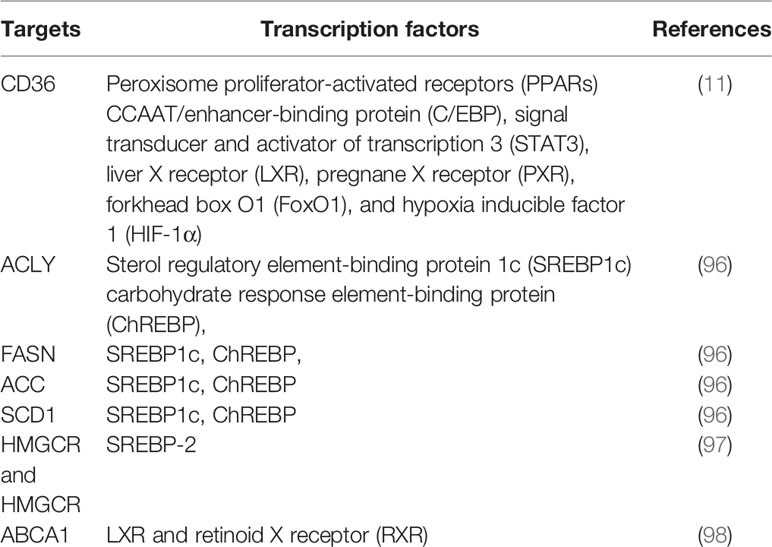
표 1 지질 대사에서 주요 효소를 조절하는 전사 인자 요약.
인간은 포화 및 단일 불포화 종에서 다중불포화 FA를 생성하는 데 필요한 효소가 부족합니다.
그러나 포화지방산(SFA)의 Δ9 위치에 이중결합을 도입하여 단일불포화지방산(MUFA)을 생산하는 SCD1은 다양한 암세포에서 발현이 증가하고 암세포 증식 촉진에 관여하며, 이동, 전이 및 종양 성장에 관여합니다..
집중적으로 증식하는 암세포는 주로 새로운 막을 형성하는 PL, 트리아실글리세롤 및 콜레스테릴 에스테르를 합성하는 데 사용되는 MUFA에 대한 더 높은 수요로 구별됩니다.
미토콘드리아 FAO 경로 증가
장쇄 FAs 분해는 미토콘드리아에서 발생하며 carnitine-acylcarnitine translocase(CAT)와 함께 외막에 위치한 카르니틴 팔미토일트랜스퍼라제(CPT) 1 및 내막에 위치한 CPT2를 포함한 여러 카르니틴 아실 전이효소에 의해 촉매됩니다.
외부 미토콘드리아 막 효소인 CPT1은 미토콘드리아 막을 가로질러 FA를 전위시킴으로써 β-산화의 속도 제한 단계를 촉매합니다.
그것의 활동은 FA 대사 및 에너지 소비의 조직별 필요에 따라 다릅니다.
또한, 종양 세포는 지방분해를 통해 FA를 획득하여 FA β-산화(FAO라고도 함)를 수행할 수 있으며, 이는 암 증식, 생존, 약물 내성 및 줄기세포를 더욱 촉진합니다.
FAO는 높은 수준의 ATP를 생성하고 암세포의 증식을 지원하는 데 활용될 수 있습니다.
그러나 FAO는 ATP 생성을 위한 주요 산화 기질이 아닙니다.
Guppy와 동료들은 약 10%의 포도당, 14%의 글루타민, 7%의 팔미테이트, 4%의 올레산 및 65 %의 확인되지 않은 출처가 MCF-7 유방암 세포주의 산화 성분에 기여한다고 보고했습니다.
더욱이, 전골수구성 백혈병은 PPAR 신호 전달과 FAO를 조절하여 조혈 줄기 세포 유지에 기여할 수 있습니다.
동시에 세포 재프로그래밍의 핵심 조절자인 NANOG는 미토콘드리아 산화적 인산화(OXPHOS)와 ROS 생성을 감소시키고 FAO를 촉진하여 CSC의 자가 재생 능력과 치료에 기여합니다.
저장된 FA를 해방하기 위한 Lipolysis and Lipophagy 의 유연한 조절
새로 합성된 FA가 중성 및 인지질 저장소에 빠르게 통합된다는 점을 고려하면 암세포는 대사 및 신호 전달 목적으로 저장된 FA를 유리시키기 위해 상보적인 지질분해 경로를 보유해야 합니다.
저산소 상태에서 세포로의 FA 전달은 상당한 양의 산소를 소비하는 FA 산화 속도를 초과하여 미토콘드리아 ROS 생성을 증가시키고 지방 독성으로 알려진 후속 세포 손상 및 세포 사멸을 초래합니다.
따라서 지방분해 억제를 통해 TG-LD에 과잉 FA의 저장과 결합된 FA 산화 스위치오프는 저산소 상태의 암세포에 대해 생각할 수 있는 전략을 구성할 것입니다.
세포의 잉여 지질(과량의 FA 및 콜레스테롤 포함) 은 저산소성 암세포의 특징인 지질 방울(LDs)의 핵에 중성의 불활성 생체 분자 형태로 존재하며 지방 분해 및 지방 포식이라고 불리는 선택적 자가 포식 메커니즘의 조합을 통해 방출됩니다.
동시에 산성 TME에 노출되면 자가분비 TGF-β2 신호전달이 암세포에서 촉진되어 FA의 흡수와 산화, LD의 형성을 더욱 촉진합니다
또한 장기간의 영양 결핍이나 지질 과부하는 암세포의 자가포식을 유발하는 경향이 있습니다.
HER2과발현은 과량의 FA를 TG로 전환 및 저장하는 것을 촉진하는 PPAR-γ를 상향 조절하여 세포가 내인성 팔미테이트 관련 지방독성으로 인한 세포 사멸을 방지할 수 있도록 합니다.
혈청 및 O 2 제한 조건에서 TG는 스트레스를 개선하기 위해 불포화 FA를 우선적으로 방출하여 과도한 FA 포화를 중화할 수 있습니다.
세포 대사는 종양 주변 기질 구성 요소(예: 지방 세포) 및 저산소증과의 직접적인 상호작용에 의해 조절됩니다.
반면, ATGL은 PPARα 신호 전달을 통해 산화 환원 항상성, 염증 및 자가포식과 같은 암 과정에 광범위한 영향을 미칠 수 있습니다.
스핑고지질 대사는 종양 증식 조절에 관여합니다
축적된 증거는 스핑고신, 세라마이드 및 스핑고신-1-포스페이트를 포함한 스핑고지질이 암세포 생물학의 다층적 측면을 포함한다는 것을 나타냅니다.
스핑고지질 항상성의 교란은 다양한 고형 종양 및 혈액 악성 종양에서 보고되었습니다.
가장 풍부한 세포 스핑고지질로서 세라마이드는 종양 억제 지질로서 세포자멸사 촉진 효과를 발휘할 수 있고 화학요법 및 표적 요법의 효능을 증가시킬 수 있습니다.
그러나 세라마이드의 대사를 촉진하는 여러 효소(예: 산성 세라미다제, 세라마이드 키나제 등)는 여러 종양에서 발현 수준이 향상된 것으로 밝혀졌습니다.
따라서 세라마이드 대사는 이러한 필수 효소를 표적으로 하여 치명적인 세라마이드 축적을 유도하고 암 치료 내성을 극복하는 일부 약물을 개발하는 데 활용되었습니다.
암에서 콜레스테롤 대사의 조절 상실
세포막의 필수 구성요소인 콜레스테롤은 유동성을 조절하여 막의 생물물리학적 특성을 변경하고 지질 뗏목의 필수 구성요소로서 신호 전달 경로 및 세포간 통신의 조절을 비롯한 다양한 생화학적 기능에 영향을 미칩니다.
콜레스테롤 항상성은 새로운 합성, 식이 콜레스테롤(저밀도 지단백 – LDL 또는 고밀도 지단백 – HDL) 섭취, 말초 조직에서 과도한 콜레스테롤 제거 사이의 상호 작용을 포함합니다 ( 그림 1). 암
에서 재프로그래밍된 콜레스테롤 대사는 신호 전달 플랫폼을 제공하고 두 번째 메신저 또는 지질 뗏목의 구성 요소로서 줄기 및 발암성 신호 전달(예: Hedgehog 경로, mTORC1)을 활성화하여 암 진행 및 침습에 기여할 수 있습니다.
콜레스테롤 항상성을 유지하기 위한 콜레스테롤 수송의 조절
투명 세포 신세포 암종(ccRCC) 및 PCa 골 전이와 같은 여러 종양 세포가 세포 콜레스테롤의 비정상적인 분포를 나타내는 것으로 나타났기 때문에 일부 필수 콜레스테롤 수송체는 암 관련 인자로 특성화되었습니다.
막관통 단백질로서 ATP-결합 카세트 수송체(ABCA1)는 내부 세포에서 순환계로 콜레스테롤 역수송을 담당합니다.
ABCA1을 안정화함으로써 아포지단백 AI(ApoA-I)는 추출된 콜레스테롤을 회수하고 HDL을 합성할 수 있습니다.
ABCA1은 현저하게 과발현되고, EMT를 촉진하고, 대장암(CRC)의 진행 단계에서 침습성을 증가시킵니다
상향 조절된 콜레스테롤 합성
콜레스테롤은 메발로네이트 경로 를 통해 합성 되고 속도 제한 효소인 3-hydroxy-3-methylglutarylcoenzyme A reductase(HMGCR)에 의해 조절되며, 이는 3-hydroxy-3-methylglutarylcoenzyme A (HMG-CoA)를 메발로네이트로 환원하는 것을 촉매합니다.
HMGCR의 조절은 SREBP2, SREBP 절단 활성화 단백질(SCAP) 및 인슐린 유도 유전자(Insigs)를 포함한 조절 단백질 네트워크의 영향을 받습니다.
PI3K/AKT 및 RAS/MAPK와 같은 발암성 성장 신호는 SREBP 매개 콜레스테롤 생합성을 활성화하여 콜레스테롤 항상성을 유지하도록 촉발됩니다.
SREBF2 유전자에서 전사된 SREBP2 는 메발로네이트와 콜레스테롤 합성에 관여하는 유전자를 활성화하는 주요 전사 인자입니다.
저산소증은 또한 HIF-1α 축적을 유도하여 전사를 자극하여 HMGCR 수준과 활성을 증가시킵니다.
P53은 전사적으로 ABCA1 을 상향 조절함으로써 SREBP-2의 활성화를 능동적으로 억제할 수 있습니다.
또한 콜레스테롤은 치료 저항성과도 관련이 있습니다.
콜레스테롤 대사 및 에스테르화 증가
oxysterol 27-hydroxycholesterol(27-HC)은 사이토크롬 P450 패밀리 27 서브패밀리 A 멤버 1(CYP27A1) 효소에 의한 콜레스테롤의 대사 기질로 알려져 있습니다.
높은 수준의 혈청 콜레스테롤은 높은 수준의 혈청 27-HC에 해당합니다.
선택적 내인성 에스트로겐 수용체(ER) 작용제 및 간-X-수용체(LXR) 작용제로서, 27-HC는 여러 EMT 유전자를 유도하고 MDM2 의존에 의한 방식으로 구성적 p53 신호전달을 방해함으로써 ER-양성 유방암 성장 및 전이에 기여할 수 있습니다.
암 치료를 위한 치료 표적
현재까지 해당작용 억제제와 같은 여러 대사 효소 억제제가 표적 암 치료제로 임상 시험에서 연구되었습니다( 표 2 및 그림 2 ).

표 2 지질 대사 경로의 치료적 관점.

그림 2 지질 대사 경로 내의 치료 표적 및 항암제. 지질 대사 표적 요법은 흰색 상자로 표시됩니다.
지질 흡수 차단
LPL과 FASN을 모두 억제하는 화합물인 Orlistat는 LPL이 제공되고 CD36을 발현하는 종양에 사용될 수 있습니다.
그러나 LPL 활성의 장기간의 전신 억제는 특히 식이 지방 섭취를 줄이지 않을 경우 고중성지방혈증 및 이에 따른 췌장염을 유발할 수 있습니다.
또한, 종양 세포는 LPL이 풍부한 조직에서 전이를 확립할 수 있으며, 이는 LPL을 인근 TME에 제공할 수 있습니다.
전이를 감소시키기 위해 oxLDL 및 관련 수용체(예: CD36 수용체)를 표적화하는 가능성은 다양한 정위 암 모델에서 입증되었습니다.
항-CD36 중화 항체의 사용은 부작용 없이 면역 결핍 또는 면역 적격 동위 마우스 모델의 인간 구강암에서 전이를 거의 완전히 억제합니다.
동시에 FASN 억제제와의 조합은 CD36 차단의 효능을 증가시킵니다.
그러나 CD36은 또한 FA의 심근 대사에서 중요한 역할을 하기 때문에 CD36의 장기간 억제로 인한 부작용과 oxLDL의 직접 표적화 효과에 대해서는 추가 조사가 필요합니다.
새로운 FA 생합성의 표적화
새로운 FA 생합성 경로 내에서 다른 효소(특히 ACC 및 FASN, SCD) 및 AKT/mTOR/SREBP-1 경로의 억제는 암세포 성장을 차단할 수 있습니다.
FASN은 확립된 치료 표적입니다. .
그러나 orlistat와 같은 1세대 FASN 억제제는 약리학적 특성(예: 선택성 결여, 낮은 대사 안정성, 낮은 세포 투과성 등)을 갖고 해로운 전신 부작용(예: 거식증)을 나타냅니다.
또한, 양성자 펌프 억제제(PPI)는 FASN의 thioesterase 활성의 효과적인 억제제이기도 하며, PPI인 오메프라졸은 삼중 음성 유방암(NCT02595372) 환자에 대한 임상 시험에 들어갔습니다.
중요한 효소의 유전자 발현을 조절하는 AKT/mTOR/SREBP-1 경로의 중요성은 표적으로 관심을 받았습니다.
mTOR 억제제인 에베롤리무스와 메트포르민의 조합은 시험관 내에서 부작용이 거의 없이 유방암 세포의 증식과 집락 형성을 상승적으로 억제하는 것으로 보입니다.
SREBP-1의 녹다운 및 억제는 HCC 세포의 포도당 흡수, 해당 활성 및 지질 대사를 방해하기 때문에 SREBP-1 억제제인 베툴린은 소라페닙(1차 항종양제)에 대한 HCC 세포의 감수성을 향상시키는 것으로 나타났습니다. .
AMPK는 SREBP-1 및 SREBP-2와의 상호작용을 통해 SREBP 활성화를 억제하고 인산화합니다.
AMPK를 활성화하는 두 가지 제제인 AICAR(5-amino-4-imidazolecarboxamide ribose)과 rosiglitazone은 PCa 세포에서 ACC의 활성과 FASN 및 ACC 농도를 감소시키고 이러한 매개변수에 대한 안드로겐의 자극 효과를 억제합니다.
더욱이, SCD1은 잠재적인 항암 치료 표적인 것으로 보입니다.
SCD1은 정상적인 피부와 눈꺼풀 기능에 필요한 TG, 콜레스테롤 에스테르 및 왁스 에스테르의 새로운 합성에 중요한 역할을 하기 때문에 마우스에서 SCD1의 표적 파괴는 눈꺼풀의 피지선 과 meibomian glands의 위축과 왁스 에스테르의 고갈을 유발합니다.
FAO 타겟팅
FA 이화작용 억제는 유망한 항암 전략일 수 있습니다.
지방분해 및 지방포식 표적화
MAGL 억제는 또한 cyclin D1 및 Bcl-2 발현을 감소시켜 자궁내막암 및 CRC에서 증식을 억제하고 종양 세포자살 또는/및 세포 주기 정지를 촉진합니다.
최근에 long-chain salicylketoxime derivatives and phenyl (piperazin-1-yl) methanone derivatives를 포함한 여러 가역적 MAGL 억제제가 만성 치료로 인한 원치 않는 부작용이 없는 것으로 보고되었습니다.
콜레스테롤 생합성 표적화
암세포는 성장과 생존을 위해 콜레스테롤이 필요하며 세포 내 콜레스테롤 생합성을 감소시키는 것이 잠재적인 치료 전략일 수 있습니다.
HMGCR의 억제제인 스타틴은 세포가 고콜레스테롤혈증을 제어하기 위해 20년 이상 성공적으로 이용된 MVA 경로를 상향 조절하고 복원하도록 하는 강력한 항상성 피드백 반응을 촉발 합니다 . .
콜레스테롤 억제와는 별도로 스타틴은 세포 증식 및 세포 내 신호 전달을 포함한 콜레스테롤 비의존적 과정을 억제합니다.
스타틴 효과는 콜레스테롤 합성을 억제할 뿐만 아니라 정상 세포에 독성을 줄 수 있는 다른 경로도 억제합니다.
이 비특이적 독성은 임상 시험에서 스타틴의 제한된 항암 결과에 대한 가능한 이유입니다.
근육 증상(예: 횡문근 융해증), 제2형 당뇨병, 신경계 및 신경인지 상태(예: 출혈성 뇌졸중), 간독성, 신장 독성 등과 같은 일부 심각한 부작용이 있습니다.
콜레스테롤 수송 표적화
LXR 작용제는 유출을 향상(ABCA1 증가)하고 동시에 콜레스테롤 재흡수를 감소(LDL 수용체 감소)함으로써 교모세포종 및 흑색종을 포함한 종양 세포의 콜레스테롤 수치를 중화하는 새로운 수단을 나타냅니다.
LXR 작용제가 세포자멸사 Bcl-2 계열 구성원인 Noxa, BH3 모방체(ABT263 및 ABT199)의 발현을 상향 조절하기 때문에, LXR 작용제는 세포자멸사를 향상시켜 세포 생존력을 상승적으로 감소시켜 고형 종양 세포 전반에 상승적인 항증식 효과를 나타냅니다.
콜레스테롤 에스테르화 표적화
마우스 모델에서 콜레스테롤 에스테르화 억제는 세포 내 유리 콜레스테롤 수치를 증가시켜 콜레스테롤 항상성을 교란시켰으며, 이는 ER 스트레스 상승과 관련되어 결국 세포자멸사를 유도하고 종양 성장 및 전이를 감소시켰습니다.
결론 및 전망
지질 대사는 암세포에서 생존과 증식의 필수 요소를 구성할 뿐만 아니라 TME에서 면역 세포와의 상호작용에도 영향을 미칩니다.
그러나 종양 세포뿐만 아니라 활성화된 T 세포와 같은 면역 세포도 대사 재프로그래밍에서 상당한 유사성을 보입니다.
FA 대사 효소와 합성 효소는 암과 정상적인 전신 대사 항상성에도 관여합니다.
예를 들어, FASN 발현은 단순히 악성 종양의 표지자가 아니라 세포 증식의 대사 표지자로 간주됩니다.
따라서 종양과 정상 조직 미세환경에서 지질 함량의 차이를 분석함으로써 보다 표적화된 지질 대사 조절 전략을 찾는 데 도움이 됩니다.
동시에 지질 대사의 재프로그래밍과 관련된 특정 메커니즘과 여러 종양 관련 신호 전달 경로에서의 이중 역할을 명확히 하는 것이 치료 표적을 식별하는 데 더 나을 수 있습니다.
FASN 억제제와 같은 일부 약물은 대사성 질환에 사용되어 왔으며, 항종양 치료 분야에서는 점진적으로 개발되고 있으며, 향후 대사성 질환과 암의 중복이 더 많이 발견될 수 있음은 잘 알려져 있습니다.
따라서 추가 조사는 최대 임상 이점을 얻기 위해 표적 지질 대사 또는 식이 중재 및 기타 요법을 관리하고 결합하는 방법을 신중하게 고려해야 합니다.
'암치료' 카테고리의 다른 글
| 암세포가 지질 대사를 리모델링하는 방법: 전사 인자를 표적으로 하는 전략 (0) | 2022.09.29 |
|---|---|
| 지질 대사와 암 (0) | 2022.09.28 |
| 암 진행 및 치료 전략에서의 지질 대사 (프로토콜) (0) | 2022.09.26 |
| AMPK (0) | 2022.09.15 |
| (링크) Full Metabolic Blockage(좋은습관님) (0) | 2022.08.11 |