2021
https://lipidworld.biomedcentral.com/articles/10.1186/s12944-021-01593-8
How cancer cells remodel lipid metabolism: strategies targeting transcription factors - Lipids in Health and Disease
Reprogramming of lipid metabolism has received increasing recognition as a hallmark of cancer cells because lipid dysregulation and the alteration of related enzyme profiles are closely correlated with oncogenic signals and malignant phenotypes, such as me
lipidworld.biomedcentral.com
How cancer cells remodel lipid metabolism: strategies targeting transcription factors
암은 단백질, 핵산 및 지질과 같은 많은 세포 빌딩 블록을 필요로 하는 세포 증식의 근본적인 장애입니다.
암세포는 이러한 빌딩 블록의 원천으로 대사 중간체를 축적하기 위해 신진대사를 변경합니다.
가장 잘 알려진 대사 변화는 포도당 흡수와 해당 작용의 악화를 수반하는 바르부르크 효과입니다.
정상적인 조건에서 포도당은 해당과정을 거쳐 피루브산을 생성합니다.
트리카르복실산 회로와 산화적 인산화는 아데노신 트리포스페이트의 형태로 에너지를 추출합니다.
그러나 산소가 없으면 포도당은 피루브산으로 대사되고 과량의 포도당은 젖산으로 전환됩니다.
암세포는 산소가 있는 상태에서도 Warburg 효과를 선호하는 경향이 있어 산화적 인산화 감소와 함께 포도당 흡수 및 소비가 증가합니다.
일반적으로 관찰되는 또 다른 대사 변화는 글루타민 대사입니다.
암세포에 의한 글루타민 소비는 뉴클레오티드, 아미노산 및 지질을 합성하기 위해 탄소와 아미노-질소를 제공합니다.
암의 세 번째 특징은 변경된 지질 대사입니다.
지질 대사의 변화는 암세포의 다른 변화보다 덜 주목을 받았지만 최근 연구에서는 지질 재프로그래밍과 암 진행 사이의 관계가 입증되었습니다.
지질은 콜레스테롤(CHO), 지방산(FA) 및 이들의 유도체(예: 모노-, 디-, 트리글리세리드[TG])를 포함하는 미세 생체 분자의 클래스입니다.
지질은 막 합성, 에너지 생산 및 세포 내 신호 전달 경로의 활성화와 같은 세포에서 다양한 생화학적 기능을 발휘합니다.
예를 들어, 글리세롤-지질은 에너지 합성에 사용되는 저장된 지질이며, 글리세로인지질은 세포막의 구조적 구성요소로 사용됩니다.
또한, 스핑고지질은 세포 성장, 분화, 세포 자멸사 와 같은 다양한 생물학적 과정을 조절하는 신호 분자 역할을 합니다.
고도로 증식하는 세포는 비정상적으로 높은 지질 공급을 필요로 하기 때문에 지질 구성 및 대사의 변화는 암 공격성(예: 유방암, 결장암, 간 및 전립선암)의 특징으로 간주됩니다.
저밀도 지단백질(LDL)과 같은 지단백질도 암 환자의 혈장에서 더 높습니다.
중요하게도, 암세포는 전사 인자 의존적 조절을 통해 새로운 합성에서 지질의 대부분을 얻는 반면, 대부분의 정상 세포는 순환하는 외인성 지질로부터 지질을 얻습니다..
전사 인자는 고도로 증식하는 세포 조건에 적응하는 데 필요한 유전자의 발현을 담당합니다.
또한 지질 대사에 관여하는 전사 인자에 의한 조절 시스템의 미세 조정은 암세포가 까다로운 미세 환경에 적응하는 데 도움이 됩니다.
예를 들어, 암에서 지방 생성 유전자 발현의 상향 조절은 스테롤 조절 요소 결합 단백질(SREBP)의 발현 증가 및 활성화로 인해 발생합니다.
탄수화물-반응 요소 결합 단백질(ChREBP)로 인한 과도한 탄수화물 섭취 및 고혈당증은 TG로 에너지 저장을 유도하고 종양 진행을 촉진합니다.
전사 인자는 약물을 투여할 수 없는 표적이지만 전사 인자(구조 포함) 및 DNA 결합 역학에 대한 고급 이해는 암 퇴치를 위한 전략을 제공할 수 있습니다.
암세포에서 지질의 역할
원형질막의 지질
지질 포화는 포화 지방산(SFA) 및 단일불포화 지방산(MUFA)의 증가 및 다중불포화 지방산(PUFA)의 감소와 함께 새로운 지방 생성을 향한 지질 흡수로 인해 발생합니다.
SFA는 PUFA에 비해 지질 과산화 경향이 적습니다.
또한 SFA는 막 유동성을 감소시켜 암세포의 사멸 수용체, 세포 사멸 자극 및 전이를 변화시킵니다..
전반적으로 이러한 변화는 암세포에 생존 혜택을 제공합니다.
신호 분자로서의 지질
단백질 조절제로서의 지질
지질은 동적 지질 번역 후 변형에 의해 단백질을 조절합니다.
이러한 변형 중에서 팔미토일화는 중요한 신호전달 종양단백질의 기능에 필수적이기 때문에 상당한 관심을 끌었다.
예를 들어 Wnt와 세포 내 샤페론 Wntless 사이의 상호 작용을 촉진하기 때문에 Wnt 분비에 팔미토일화가 필요합니다.
표피 성장 인자 수용체 팔미토일화는 PI3K/Akt 신호 전달을 촉진하여 폐암에서 세포 증식을 유도합니다 .
지질 관련 번역 후 변형의 또 다른 유형은 파르네실기가 표적 단백질에 공유적으로 부착되는 프레닐화입니다.
프레닐트랜스퍼라제를 표적으로 하는 약물은 전임상 시험에서 사용되었습니다.
그들은 여러 고형암에서 보호 효과를 나타냅니다.
프레닐트랜스퍼라제의 결핍은 Ras 패밀리와 원형질막 사이의 결합을 억제하고; 이것은 Ras로 인한 폐 종양 형성을 지연시킵니다.
암에서 지질의 역할은 그림 1 에 나와 있습니다.
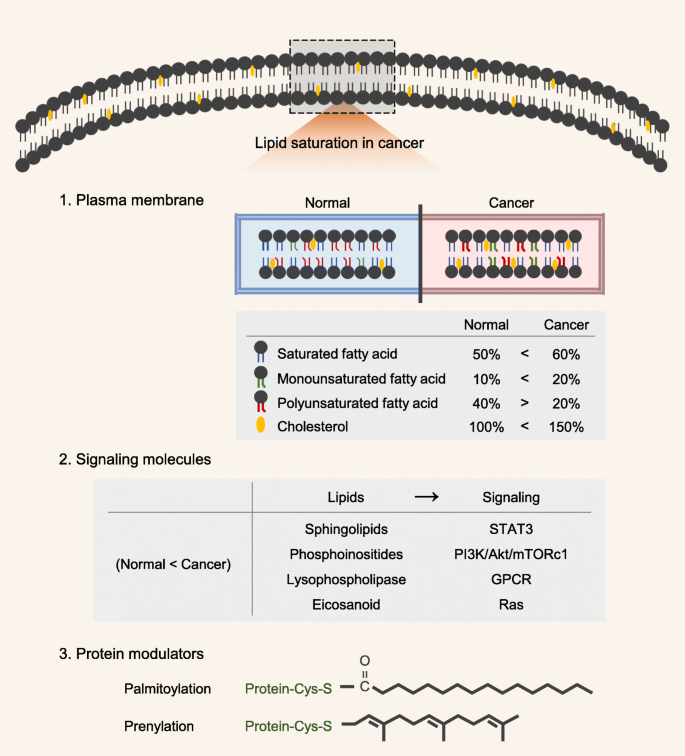
암에서 지질의 역할에 대한 도식적 스케치
암에서의 지질 재프로그래밍
지질 프로필의 변화와 암 발병
암에서 지방 생성 효소의 비정상적인 수치
암세포가 필요로 하는 지질의 90% 이상이 새로운 합성에서 유래된 것으로 보고되고 있습니다.
이러한 공개된 연구 결과와 일치하게, 암세포는 종종 FA와 CHO의 합성에 관여하는 새로운 지방 생성 효소의 상향 조절을 나타냅니다.
예를 들어, adenosine triphosphate citrate lyase와 acetyl-coenzyme A carboxylase는 대부분의 암에서 상향조절되고 활성화됩니다.
FASN의 상향 조절은 가장 공격적인 종양이 있는 환자에서 좋지 않은 결과와 관련이 있습니다.
전반적으로, 비정상적으로 높은 수준의 지질 및 지방생성 효소는 여러 암의 발달, 진행 및 불량한 예후와 유의하게 연관되어 있습니다.
암에서 지질 대사 재프로그래밍으로 이어지는 전사 인자
ChREBP
식이에서 얻은 포도당 및 기타 단순당은 대사되어 FA 합성을 위한 아세틸-CoA를 제공합니다.
이 과정에서 MLXIPL 유전자에 의해 암호화된 ChREBP는 과도한 포도당을 간에서 지방으로 전환시키는 전사 매개체 역할을 합니다
암세포는 피루브산 축적보다 피루브산이 아세틸-CoA로 전환되는 것을 선호합니다[ 57 ]. ChREBP 단백질이 ChREBP 단백질이 종양 악성종양과 양의 상관관계가 있음을 고려할 때, 이러한 결과는 ChREBP/MLXIPL의 발암성 역할이 포도당이 지방으로 전환되는 결과임을 보여줍니다.
FXR
최근의 연구에서는 FXR이 다양한 대사 효소를 조절함으로써 CHO/담즙산 항상성의 유지에 기여하는 내인성 담즙산 수용체라는 것이 밝혀졌습니다.
담즙산은 식이 지방 및 스테로이드의 흡수를 촉진하는 주요 인자를 구성하기 때문에 대사 질환에서 FXR의 기능은 잘 정립되어 있습니다
FXR 기능의 상실은 장내 지방 흡수를 촉진하고 상승적으로 간 발암을 증가시킵니다.
LXR
LXR은 핵 수용체(예: PPAR, FXR 및 RXR)와 관련이 있으며 NR1H3(LXRα) 및 NR1H2(LXRβ)의 서브패밀리로 분류 됩니다 [ 69 ] .
LXRα는 주로 간 조직[ 70 ]에서 발현되는 반면 LXRβ는 대부분의 조직[ 71 ]에서 발현됩니다.
LXR은 SREBP1c 및 ChREBP 단백질의 업스트림입니다.
해당 작용을 직접 조절하고 지방 생성을 증가시킵니다[ 72 ].
LXR 녹아웃 마우스는 SREBP1c, FASN 및 스테아로일-CoA 불포화 효소1(SCD1)을 포함한 주요 지방 생성 유전자의 수준 감소와 TG 생성 감소를 보여줍니다
LXR은 다양한 암에 항암 효과를 발휘하는 CHO 센서입니다.
LXR 작용제는 LDL 수용체를 분해하고 아데노신 삼인산 결합 카세트 서브패밀리 A 구성원 1(ABCA1) CHO 유출 수송체의 발현을 증가시켜 교모세포종의 외인성 CHO 흡수를 방지합니다.
교모세포종 세포는 성장을 위해 높은 수준의 CHO를 필요로 하기 때문에 LXR 작용제는 종양 세포 사멸을 촉진합니다
그러나 LXR 길항제는 Warburg 효과와 지방 생성을 모두 억제하여 결장, 폐 및 전립선 암 세포에서 세포 사멸을 유도합니다.
특히, 이러한 길항제는 비악성 세포에 독성 효과가 없습니다.
LXR 작용제와 길항제가 서로 다른 효과를 보인다는 점을 감안할 때 항암제로서의 LXR( NR1H3 , NR1H2 ) 전략 개발을 신중히 고려해야 한다.
PPAR
Peroxisome proliferator-activated receptors(PPARs)는 표적 유전자의 프로모터에 있는 peroxisome proliferator 반응 요소에 결합하여 유전자 발현을 조절하는 전사 인자입니다.
조직 분포와 리간드 특이성에 따라 PPAR은 -α, -β/δ 및 -γ의 세 가지 핵 수용체 하위 유형으로 나뉩니다.
PPARα는 주로 간, 신장, 심장 및 근육과 같이 FA 의 β-산화율이 높은 조직에서 발현됩니다.
PPARβ/δ는 대부분의 조직에서 편재적으로 발현되고,
PPARγ는 주로 지방 조직에서 발현된다.
PPARα는 영양소 결핍 시 주요 에너지 생성 인자이며 FA β-산화에 참여합니다.
또한 지단백질 리파제 유전자 발현을 증가시켜 혈장 TG를 감소시킵니다.
PPARβ/δ는 포도당 6-인산 탈수소효소 활성을 유도하고 근육에서 FA의 β-산화를 증가시키며 백색 지방 조직에서 FA의 방출을 억제합니다.
식이 유도 비만 마우스에서 PPARβ/δ의 활성화는 혈청 인슐린과 TG 농도를 정상화합니다.
그것은 또한 제2형 당뇨병 치료를 위한 새로운 표적으로 작용합니다.
PPARγ는 FA를 에스테르화 및 TG로 축적하도록 유도함으로써 에너지 저장을 촉진합니다.
PPARγ 작용제 rosiglitazone의 식이 보충은 비만 마우스에서 제2형 당뇨병을 억제하지만 rosiglitazone을 사용한 만성 치료는 간 지방증을 현저하게 악화시킵니다.
PPARα 작용제를 먹인 마우스는 체중이 감소하고 간암 발병률이 증가했습니다.
PPARδ는 ATP 결합 카세트 수송체 1( ABCA1 ) 유전자 를 조절하여 전립선암 세포의 이종이식 종양 성장을 유도합니다 .
PPARγ는 여러 암에서 종양 억제 및 발암 효과가 있습니다.
특히, 식이 FA는 PPAR에 직접 결합하고 PPAR을 활성화시키는 합성 작용제의 효과를 모방합니다.
이러한 방식으로 PPAR은 식이 지질에서 파생된 FA 신호를 감지하고 암 진행을 촉진하는 지질 조절제 역할을 합니다.
SREBP
지질 항상성은 SREBP 전사 인자에 의해 조절됩니다.
그들은 또한 CHO, FA 및 TG의 합성 및 흡수에 기여합니다.
세포는 CHO에 대한 수요 증가가 있을 때 CHO 합성을 활성화하기 위해 SREBP1a와 -2를 모두 생성합니다.
최근 연구에 따르면 SREBP는 암에서 지질 대사를 조절합니다.
전사 수준에서 SREBP의 억제는 난소암 환자에서 지방 생성 유전자의 발현과 지질 흡수를 약화시킵니다.
SREBP는 또한 암세포에 생존 이점을 제공합니다.
SREBP는 SFA와 불포화 장쇄 FA의 비율을 변경하여 활성 산소 종과 소포체 스트레스로부터 암세포를 보호합니다.
SFA는 PUFA보다 지방 독성이 적기 때문에 SREBP는 암세포가 가혹한 미세 환경에서 생존할 수 있도록 합니다
암에서 지질 관련 전사 인자의 역할은 그림 2 에 나와 있습니다..
그림 2
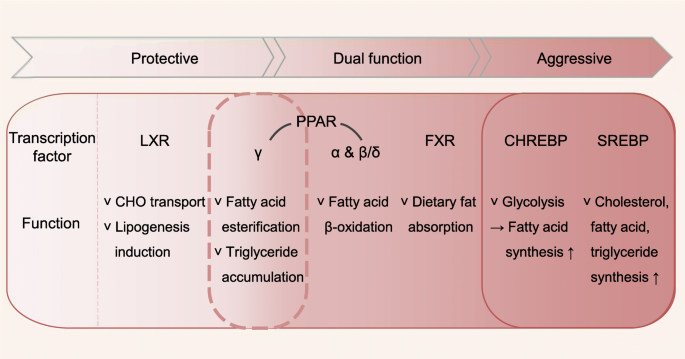
암세포에서 지질 관련 전사 인자의 역할 요약
지질 대사를 표적으로 하는 치료 전략
FXR을 표적으로 하는 약물
FXR을 표적으로 하는 약물의 효과는 암 조직의 유형에 따라 다르기 때문에 특정 장기에 대한 치료법을 설계해야 합니다.
LXR을 표적으로 하는 약물
LXR 억제제인 SR9243은 Warburg 효과와 지방 생성을 억제하고 암세포의 세포 사멸을 유도하지만 비악성 세포에는 독성이 없습니다.
Pommier et al. 해명된 LXR 활성화제 T0901317은 Akt 경로를 하향 조절하고 생체내 및 전립선암 세포에서 세포자멸사를 유도합니다
PPAR을 표적으로 하는 약물
PPARα 작용제인 fenofibrate는 흑색종과 섬유육종에서 종양 성장과 혈관신생을 억제합니다
PPARδ의 유전적 억제는 전립선암 세포의 종양 성장을 억제하지만, 일부 연구에서는 PPARβ/δ 작용제의 항암 활성이 보고되었습니다.
티아졸리딘디온(글리타존이라고도 함)은 새로 개발된 PPARγ의 합성 리간드입니다.
thiazolidinedione은 PPARγ에 직접 결합하여 형태 변화를 일으키고 전사 기구를 활성화합니다. .
대사 작용 외에도 thiazolidinedione은 악성 세포주(예: 결장암, 간암 및 췌장암)에서 cyclin-dependent kinase를 표적으로 하여 세포사를 유도합니다.
티아졸리딘디온은 평활근 세포로부터 내피 성장 인자의 방출을 감소시키고 교모세포종, 지방육종, 폐암 및 전립선암에서 혈관신생을 억제합니다.
중요하게는, 상피-중간엽 전이-유래 유방암 세포는 유사분열 후 지방세포로 분화될 수 있고 침습성 및 발암성 표현형을 잃을 수 있습니다.
티아졸리딘디온은 암세포의 지방세포로의 전이분화를 촉진하고 종양 침습 및 전이를 방지합니다.
PPARγ 길항제인 T0070907 및 GW9662는 방광암 세포에 보호 효과가 있습니다.
그러나 PPAR을 표적으로 하는 약물은 환자에게 유익한 효과에 대해 결정적이지 않았습니다.
임상 시험은 더 많은 연구가 필요합니다.
SREBP를 표적으로 하는 약물
실리비닌은 밀크씨슬 식물의 종자에서 분리되어 기계적으로 SREBP1 인산화를 증가시키고 핵 전위를 억제합니다.
유방암 세포에서 실리비닌은 에스트로겐 수용체-α를 억제하고 에스트로겐 수용체-β를 상향 조절하여 자가포식을 촉진합니다.
실리비닌은 인간 폐암 세포에서 유로키나제-플라스미노겐 활성화제 및 기질 메탈로프로테이나제-2의 생성을 감소시켜 세포 침입을 억제합니다[ 132 ].
실리비닌은 또한 두경부암과 전립선암에 강력한 효과를 나타냈습니다[ 133 , 134 , 135 ].
Betulin, fatostatin 및 nelfinavir는 SREBP의 처리를 억제하고 항종양 특성을 가지고 있습니다.
Li et al. 베툴린이 인터루킨-6 및 -1β와 같은 종양 촉진 사이토카인을 하향 조절함으로써 디에틸니트로사민으로 유도된 간세포암종의 진행을 극적으로 감소시킨다는 것을 발견했습니다[ 103 ].
Nelvinavir는 처음에 인간에 대한 HIV 치료에 대해 FDA의 승인을 받았으며 현재 골수종, 교모세포종, 췌장암 및 폐암에 대한 2상 임상 시험이 진행 중입니다.
시험관 내에서 nelfinavir는 지방육종 및 전립선암 세포에서 세포 증식을 억제합니다[ 139 , 140 ].
지질 대사를 표적으로 하는 약물
Orlistat은 1999년 FDA에서 비만 관리용으로 승인된 약물입니다.
Orlistat는 소포체 스트레스를 유도하고 결과적으로 유방암, 결장암 및 전립선암 세포에서 세포자멸사를 증가시킵니다.
아세틸-CoA 카르복실라제(ACC) 억제제의 사용에 대한 전임상 연구가 진행 중입니다.
SCD1 억제제 A939572는 소포체 스트레스를 유도하고 투명 세포 신세포 암종에서 세포 사멸을 향상시킵니다
SCD1을 차단하면 HCC에서 AMPK 신호 전달을 비활성화하여 세포 사멸을 유도합니다[ 154 ].
CHO 합성을 표적으로 하는 것은 또 다른 잠재적인 접근이 될 수 있습니다.
스타틴은 β-히드록시 β-메틸글루타릴-CoA 환원효소(HMGCR) 억제제이며 시험관 내 및 생체 내에서 유망한 결과를 보여주었습니다.
또 다른 CHO 합성 억제제인 심바스타틴은 또한 Akt 경로를 억제하고 전립선암 세포에서 세포자멸사를 유도합니다.164 ].
그러나 최근의 암에 대한 메타 분석에서는 스타틴이 암 치료에 미치는 유의한 영향이 없는 것으로 밝혀져 CHO를 표적으로 하는 약물의 임상 사용을 신중하게 고려해야 함을 나타냅니다[ 165 , 166 ].
지질 흡수를 표적으로 하는 문제는 CD36 및 FABP에 초점을 맞추고 있습니다.
지질 관련 약물의 목록은 표 2 에 요약되어 있습니다.
Target Drug Phase of development Cancer type Reference
| FXR | GW4064 | Preclinical | Eesophagus, liver and pancreatic cancer | [106,107,108,109] |
| Guggulsterone | Preclinical | Liver and pancreatic cancer | [106, 107] | |
| LXR | GW3965 | Preclinical | Glioblastoma | [74] |
| LXR-623 | Phase I | Glioblastoma | [110] | |
| SR9243 | Preclinical | Colon cancer | [77] | |
| T0901317 | Preclinical | Prostate cancer | [75] | |
| PPARα | Fenofibrate | Preclinical | Breast, oral and prostate cancer, Melanoma | [111,112,113,114] |
| Wy-14,643 | Preclinical | Breast, colon, lung and liver cancer | [89, 115] | |
| PPARβ/δ | SR13904 | Preclinical | Lung cancer | [117] |
| GW0742 | Preclinical | Melanoma | [118, 119] | |
| PPARγ | Thiazolidinedione | Phase III | Colon, pancreatic, liver and breast cancer, Liposarcoma | [121,122,123,124,125,126] |
| GW9662 | Clinical | Bladder cancer | [128] | |
| SREBPs | Sibilinin | Preclinical | Breast, head and neck, lung, and prostate cancer | [131,132,133,134,135] |
| Betulin | Preclinical | HCC | [103] | |
| Fatostatin | Preclinical | Glioblastoma, osteosarcoma, breast and prostate cancer | [104, 136, 137] | |
| Compound 24 | Preclinical | Glioblastoma | [105] | |
| S1P/S2P | Nelfinavir | Phase II | Glioblastoma, liposarcoma, myeloma, lung, pancreatic, and prostate cancer | [139, 140, 175] |
| FAS | TVB-2640 | Phase II | Lung, ovarian and breast cancer | [141] |
| C75 | Preclinical | Breast, colon, ovarian, and prostate cancer | [142, 144, 145, 176] | |
| Cerulenin | Preclinical | Colon and ovarian cancer | [143, 144] | |
| Orlistat | Approved for anti-obesity | Breast, colon and prostate cancer | [145, 146] | |
| ACC | Soraphen A | Preclinical | Prostate cancer | [147] |
| ND-646 | Preclinical | Lung cancer | [148] | |
| TOFA | Preclinical | Breast, colon, lung, and prostate cancer | [149,150,151] | |
| SCD | A939572 | Preclinical | Clear cell renal cell carcinoma, Lung cancer | [152, 153] |
| CAY10566 | Preclinical | Colon and ovarian cancer, glioblastoma, melanoma, HCC | [154,155,156,157] | |
| HMGCR | Statin | Approved | Many cancers | [158,159,160,161,162,163, 165, 166] |
| Simvastatin | Preclinical | Prostate cancer | [164] | |
| CD36 | ABT-510 | Phase I | Glioblastoma, melanoma and renal cell carcinoma | [167,168,169] |
| FABP5 | dmrFABP5 | Preclinical | Prostate cancer | [172] |
| SBFI-102 and SBFI-103 | Preclinical | Prostate cancer | [173] | |
| EI-05 | Preclinical | Breast cancer | [174] |
- FXR Farnesoid X receptor; SREBP Sterol regulatory element-binding protein;
- S1P site-1 protease; LXR Liver X receptor; ChREBP Carbohydrate-response element-binding protein;
- PPARs Peroxisome proliferator-activated receptor; FASN Fatty acid synthase;
- ACC Acetyl-coenzyme A carboxylase; SCD Stearoyl-CoA desaturase;
- HCC Hepatocellular carcinoma; HMGCR β-Hydroxy β-methylglutaryl-CoA reductase
식이 지질과 암
과도한 칼로리 섭취와 비만은 암 공격의 높은 위험과 관련이 있기 때문에 많은 연구에서 암 치료의 잠재적 표적으로 식이 조절에 초점을 맞추었습니다
최근 연구에서는 식이 지방의 효과가 개별 FA의 구성에 달려 있음을 확인했습니다.
SFA는 발암과 긍정적인 관련이 있는 반면, n-3 PUFA는 암에 대해서 보호 효과가 있을 가능성이 더 높습니다.
암 진행에 대한 MUFA 및 n-6 PUFA의 영향에 관한 데이터는 논란의 여지가 있습니다.
n-3 PUFA의 보호 효과는 수많은 암세포주에서 확인되었습니다.
도코사헥사엔산은 항암 활성에 관여하는 주요 n-3 PUFA입니다.
시험관 내 연구에 따르면 도코사헥사엔산은 Akt 및 Wnt 경로를 조절하여 암세포 증식과 방사선에 대한 내성을 억제합니다
동물 연구의 결과에 따르면 식이성 n-3 PUFA는 증식과 혈관신생을 감소시키면서 세포자멸사를 증가시키는 것으로 나타났습니다 .
암 발병 위험에 대한 MUFA 및 n-6 PUFA의 효과는 일치하지 않습니다.
식이 n-6 PUFA는 악성 조직에서 유의하게 더 높았고 전립선 발암과 관련이 있었습니다.
반면, 모든 유형의 암에 대한 2020년 메타 분석에서는 n-6 PUFA가 발암성과 관련이 없는 것으로 나타났습니다.
MUFA와 관련하여 Oleic acid(OA) 치료는 유방암 세포에서 PI3K/Akt 경로와 NF-κB 활성을 조절하여 이동을 증가시킵니다.
또한 높은 올리브 오일 식단은 마우스에서 HeLa 이종이식편의 세포 성장과 전이를 촉진합니다.
대조적으로, OA 치료는 HER-2 발현을 억제함으로써 유방암 세포의 세포 성장을 감소시킵니다.
OA는 혀 편평 세포 암종에서 Akt/mTOR 경로를 억제하여 세포 사멸과 자가 포식을 유도합니다.
Li et al. 세포 생존 및 이동에 대한 OA의 다양한 효과는 AMPK 의존성으로 인해 발생한다고 보고했습니다[ 200 ].
식이 지질, 특히 n-3 PUFA 보충제는 임상 결과를 개선합니다.
환자가 지질 구성의 정도를 조절하면 암 치료의 잠재적 후보가 될 수 있습니다.
암세포에서 지질과 면역계의 상호작용
암세포에서 지질 매개 면역 체계 조절
면역 설정의 조절은 효과적인 암 치료로 입증되었습니다. 암과 마찬가지로 면역 반응의 영향은 개별 지질 구성에 따라 다릅니다.
N-3 PUFA는 전염증성 사이토카인[ 205 ]에 대응하여 항산화 및 항염증 특성을 나타내는 반면, n-6 PUFA는 면역 세포에서 전염증 효과를 발휘합니다[ 206 ].
단백질 지질화(예: 미리스토일화, 프레닐화 및 팔미토일화)는 암 진행을 담당하는 면역 관련 분자의 반응을 다시 연결할 수 있습니다.
지질 및 체크포인트 억제제
PD-1, PDL-1 및 분화 클러스터 152와 같은 면역 체크포인트는 세포 사멸로부터 면역 체계를 보호하는 면역 세포의 분자입니다.
암세포는 면역 체계의 공격을 피하기 위해 면역 체크포인트를 사용합니다.
따라서 암의 면역 환경을 표적으로 하는 약물이 적용되고 있다.
이러한 약물을 체크포인트 억제제라고 합니다.
최근 연구에 따르면 지질 대사는 항암 면역 반응의 조절자가 될 수 있습니다.
예를 들어, 단쇄 FA는 체크포인트 억제제에 유익한 효과가 있습니다.
흑색종 환자의 대변 및 혈장 샘플은 단쇄 FA의 높은 수준이 PD-1 억제제(니볼루맙 및 펨브롤리주맙)에 대한 양성 반응과 관련이 있는 것으로 나타났습니다
매우 긴 사슬 FA 수준이 낮은 종양이 성공적인 면역 관문 억제를 회피하는 것으로 나타났습니다[ 208 ].
암 세포와 면역 세포 사이의 대사 누화는 중요한 결정 요인입니다.
논의
이 모든 정보를 통해 암세포는 성장과 생존을 지원하기 위해 전사 인자에 의존합니다.
전사인자의 높은 발현은 불량한 예후와 관련이 있으며, 종양유전자의 약 20%가 전사인자로 확인되었다.
지질 매개 조절 외에도 발암과 관련된 많은 전사 인자에는 NF-kB, STAT3 및 activator protein 1과 같은 염증 단백질이 포함됩니다.
또한, 종양 미세 환경 단백질(예: 저산소증 유발 인자)은 종양 세포가 저산소증 및 영양 결핍에서 생존하도록 도와 종양 발생에 기여합니다.
암에서 잘 확립된 다른 전사 인자는 상피-중간엽 전이 및 증식 마커입니다. β-카테닌/Wnt 신호전달은 이동을 자극하고 사이클린 D 및 c-Myc 전사 인자와 같은 다운스트림 표적을 활성화합니다.
Myc 계열은 cyclin-dependent kinases 및 E2Fs의 전사를 활성화하여 세포 증식을 유도합니다
PI3K/Akt, Wnt/Hedgehog 및 MAPK 경로를 포함한 많은 생존 신호는 E2F와 밀접하게 연관되어 있으며 종양에서 과활성화된 E2F는 나쁜 예후와 관련이 있습니다.
암 연구는 암 진행에서 지질 대사의 중요한 역할을 밝혀냈습니다.
그러나 기존 과제가 있습니다.
1) 지질 및 지질 관련 전사 인자의 수준이 암 유형에 따라 다릅니다.
2) 약물이 환자에게 유익한 효과에 대해 결정적이지 않았습니다.
약물은 신중하게 표적화되어야 하며 더 나은 암 관리를 위해 더 많은 연구가 수행되어야 합니다.
결론 및 향후 전망
지질 대사는 암의 진단, 예후 및 치료를 위한 새로운 바이오마커로서 높은 잠재력을 가지고 있습니다.
지질 대사 조절은 정상 세포에서도 중요한 유전자이기 때문에 지질 대사 및 지질의 무독성 효과를 표적으로 하는 물질을 찾는 것은 여전히 큰 도전이다.
'암치료' 카테고리의 다른 글
| 종양학에서의 지질 대사: 중요한 이유, 연구 방법 및 치료 방법 (0) | 2022.10.01 |
|---|---|
| 암의 지질 대사 변화: 예후 및 치료에 미치는 영향(허브 포함) (1) | 2022.09.30 |
| 지질 대사와 암 (0) | 2022.09.28 |
| 암의 지질 대사 환경과 새로운 치료적 관점 (0) | 2022.09.27 |
| 암 진행 및 치료 전략에서의 지질 대사 (프로토콜) (0) | 2022.09.26 |