2020
Alterations of Lipid Metabolism in Cancer: Implications in Prognosis and Treatment
https://www.frontiersin.org/articles/10.3389/fonc.2020.577420/full
Alterations of Lipid Metabolism in Cancer: Implications in Prognosis and Treatment
Cancer remains the second leading cause of mortality worldwide. In the course of this multistage and multifactorial disease, a set of alterations takes place, with genetic and environmental factors modulating tumorigenesis and disease progression. Metaboli
www.frontiersin.org
Warburg 효과 및 증가된 글루타민분해와 함께 지질 대사는 종양 발달 및 진행에 필수적인 것으로 나타났습니다.
물론, 여러 조사에서 전이 중에 발생하는 세 가지 기본 단계인 세포 이동, 침습 및 혈관신생에서 지질 대사 변경의 결과가 입증되었습니다.
또한 비만 및 관련 대사 변화는 암의 위험을 증가시키고 예후를 악화시키는 것으로 나타났습니다.
암의 특징 중 하나는 세포 대사의 비정상적인 조절입니다( 2 ).
종양 세포는 성장, 증식 및 생존을 지원하기 위해 높은 속도의 호기성 해당작용과 증가된 동화작용을 나타냅니다.
매우 다양한 종류의 생물학적 분자인 지질은 세포에서 세 가지 주요 기능을 수행합니다.
첫째, 지질 방울(LD)에서 주로 트리아실글리세롤 에스테르 및 스테릴 에스테르로 에너지 저장에 사용됩니다.
또한 지질은 세포막의 구조적 구성 요소이며 대사 신호 전달자 역할도 합니다.
스테롤 조절 요소 결합 단백질(SREBP)은 지질 합성을 조정하고 조절하는 전사 인자입니다.
그들은 상류 신호 네트워크와 세포 내 영양소 상태에 대한 반응으로 작용하여 콜레스테롤 및 지방산(FA) 합성 및 흡수에 관여하는 효소의 발현을 조절합니다.
세포 자율적 방식으로 대사 재프로그래밍을 매개하는 유전적 변형과 함께 암의 진행과 전파는 종양 미세 환경에서 영양분과 산소의 가용성에 달려 있습니다.
종양은 암 증식 및 전파를 지원하기 위해 섬유아세포, 지방세포, 면역 세포, 내피 세포 및 세포외 기질의 구성요소를 포함하는 주변 미세환경과 소통합니다.
또한, 주요 지질 대사 유전자는 종양 재발 및/또는 생존과 관련된 여러 유형의 암에서 예후 바이오마커로 제안되었습니다.
실제로, 종양 세포 이동, 침습 및 혈관신생에서 지질 대사 변경의 역할은 명확하게 입증되었습니다.
비만이 암에 미치는 영향
비만 동안 지방세포는 전통적으로 지방 조직과 관련이 없는 위치에 축적됩니다.
이소성 부위의 지방 축적은 전신 효과가 있는 중심 지방 조직과 종양 미세 환경을 지지하는 국소 축적 지방 조직으로 분류됩니다.
중심 지방 조직은 스테로이드 성 호르몬 수치의 변화, 인슐린 감수성 감소 및 저급 염증을 유발하며 주로 CRC. 및 유방암.과 관련이 있습니다..
또한, 지방 조직의 내장 저장소는 유방, 난소 또는 결장 종양과 같은 지방 조직에 가까이 위치한 종양의 경우와 같이 종양 세포 증식 및 전파에 기여하는 종양 미세 환경을 둘러싼 세포의 세포 구성 변경을 유발할 수 있습니다.
종양 미세 환경에서 종양 세포의 효과는 약물 내성과 관련이 있는 것으로 밝혀졌습니다
암 관련 지방 세포는 주변 종양 미세 환경을 지원하는 데 기여하는 FA 및 전염증 매개체의 방출로 인해 종양 진행 및 전파를 유지하는 대사 기능을 나타냅니다.
지방 조직의 과형성과 비대는 이용 가능한 산소 수준을 감소시키고, 이는 종양 전파에 기여할 수 있는 혈관신생을 촉진합니다.
아라키돈산(AA)은 프로스타글란딘, 트롬복산 및 류코트리엔과 같은 염증 유발성 지질 매개체의 주요 전구체로, 이는 암세포의 증식, 세포 생존 및 보급을 촉진합니다.
프로스타글란딘 E 2 와 같은 염증성 프로스타글란딘COX2(사이클로옥시게나제 2)에 의해 생성된 표피 성장 인자 수용체 세포 신호전달을 활성화하여 결장암에서 혈관신생 및 기질 메탈로프로테아제의 발현을 촉진합니다.
프로스타글란딘은 세포독성 CD8 + T 림프구의 활성화와 자연 살해 세포 및 수지상 세포가 종양에 침투하는 것을 감소시켜 항종양 면역 반응을 억제하는 것으로 나타났습니다.
이와 관련하여 COX2 억제제는 흑색종에서 면역 관문 억제제에 대한 반응을 증가시키는 것으로 입증되었습니다.
또한, 비만인 사람은 장내 미생물총이 변경되고 장 상피 장벽이 파괴되는 것으로 설명되었습니다.
장내 세균 불균형은 위암, CRC 및 식도암과 관련이 있습니다
따라서, 미생물총 표적화 요법의 설계는 이제 임상에서 실행 가능한 전략으로 간주됩니다.
비만과 종양 형성 과정 사이의 중요한 대사 연결 때문에( 그림 1),
개인의 영양 및 대사 상태의 효과적인 제어(포도당, 지질 수준, 혈압 및 만성 염증의 제어)는 암 진행을 예방 및/또는 개선하기 위한 구체적이고 기계적인 접근을 나타낼 수 있습니다.
이 시나리오에서 정밀 영양은 암 예후와 관련된 대사 변화 관리의 보완적 치료 도구로 등장했습니다.
중요한 것은 영양소와 생리활성 식이 화합물이 게놈, 신진대사, 미생물군유전체 등과 상호작용하는 방식에 대한 지식을 기반으로 하는 영양학적 개입입니다.

그림 1 . 암에서 지질 대사 변화의 관련성.
그림은
(i) 암에서 지질 대사 재프로그래밍을 지원하는 발암성 돌연변이와
(ii) 비만과 관련된 전신 지질 대사 변경(환경적으로 수정 가능한 위험 요소)의 중요한 역할입니다.
정밀 중재에는 환자의 영양 및 대사 상태를 고려한 생리 활성 화합물, 식이 유래 성분과 같은 영양 중재와 함께 확인된 지질 대사 분자 표적을 표적으로 하는 치료 임상 약물이 포함되어야 합니다.
T2DM, 제2형 진성 당뇨병; IR, 인슐린 저항성; TME, 종양 미세환경; CAA, 암 관련 지방세포; FAO, 지방산 산화; FA, 지방산.
암에서 발암 경로의 지질 대사 재프로그래밍
암세포는 암세포 증식 및 전파를 위한 에너지 및 대사 산물의 추가 요구 사항을 제공하기 위해 대사 변경을 나타냅니다( 2 ).
서로 다른 유형의 암 사이에는 엄청난 다양성이 존재하며 심지어 같은 종양 내에서도 존재합니다. 더욱이, 암세포는 종양 미세 환경에서 영양소와 산소 수준의 변화에 적응하는 지속적인 능력이 특징입니다( 6 ).
변경된 종양 대사는 세포의 자율적 유전적 변화뿐만 아니라 식단, 음식 행동, 운동 및 미생물군유전체를 포함한 추가 요인에 따라 달라집니다.
이러한 모든 요소가 함께 발달하는 종양의 생물학을 결정할 것입니다( 39 )( 그림 1 ).
암에서 관찰되는 가장 빈번한 대사 변화 중 하나는 산소 수준과 관계없이 해당 경로의 증가입니다(Warburg 효과)( 40 ).
암에서 호기성 해당작용은 트리카르복실산(TCA) 주기의 중간 단계의 보충 대사를 위한 글루타민 대사를 증가시키기 위해 결합됩니다( 41 ).
지질은 생물학적 막의 구조적 구성요소일 뿐만 아니라 β-FA 산화(β-FAO)를 통해 에너지를 제공하고 산화환원 항상성을 조절하며, 또한 증식, 이동, 침습, 형질전환, 종양 미세환경 재형성 및/또는 염증 조절을 비롯한 암의 수많은 중요한 과정에 영향을 미치는 신호 분자로 작용합니다.
콜레스테롤은 유동성에 영향을 미치는 세포막의 핵심 구성 요소이며, 특정 영역(지질 뗏목)을 안정화시켜 세포 내 세포 신호 전달 경로를 전달하고, 스테로이드 호르몬의 전구체입니다.
또한 지질은 오메가-6 AA 또는 항염증성 오메가-3 에이코사펜타엔산(EPA) 및 도코사헥사엔산에서 합성되는 전염증성 프로스타글란딘 또는 트롬복산과 같은 신호 분자이며, 이는 식단에서 제공되는 지질에 따라 다릅니다.
식이에서 높은 수준의 포화 FA를 섭취하는 것은 여러 유형의 암의 위험 요소이므로 지방 분해를 줄이는 전략과 건강한 식이의 촉진도 고려해야 합니다.
새로운 지방 생성 및 콜레스테롤 생성 의 활성화
지질 대사 변화는 종양 세포 증식뿐만 아니라 화학 요법 약물에 대한 전파 및 내성에도 영향을 미칩니다.
대부분의 성인 조직은 식이에서 FA, 콜레스테롤 및 지질을 얻습니다.
한편, FA와 콜레스테롤의 새로운 합성은 간과 지방세포로 제한됩니다.
종양은 종종 콜레스테롤과 FA의 새로운 합성을 활성화하여 외부에서 제공되는 지질로부터 더 독립적으로 만드는 능력을 나타 냅니다.
중요하게도, 새로운 지방 생성 및/또는 메발로네이트 경로와 관련된 표적 효소 가 종양 성장을 억제하는 것으로 나타났습니다.
FA는 포도당, 글루타민 또는 아세테이트에서 생성된 시트레이트에서 생성된 세포질 아세틸-CoA(AcCoA)에서 합성됩니다.
(그림 2 ).
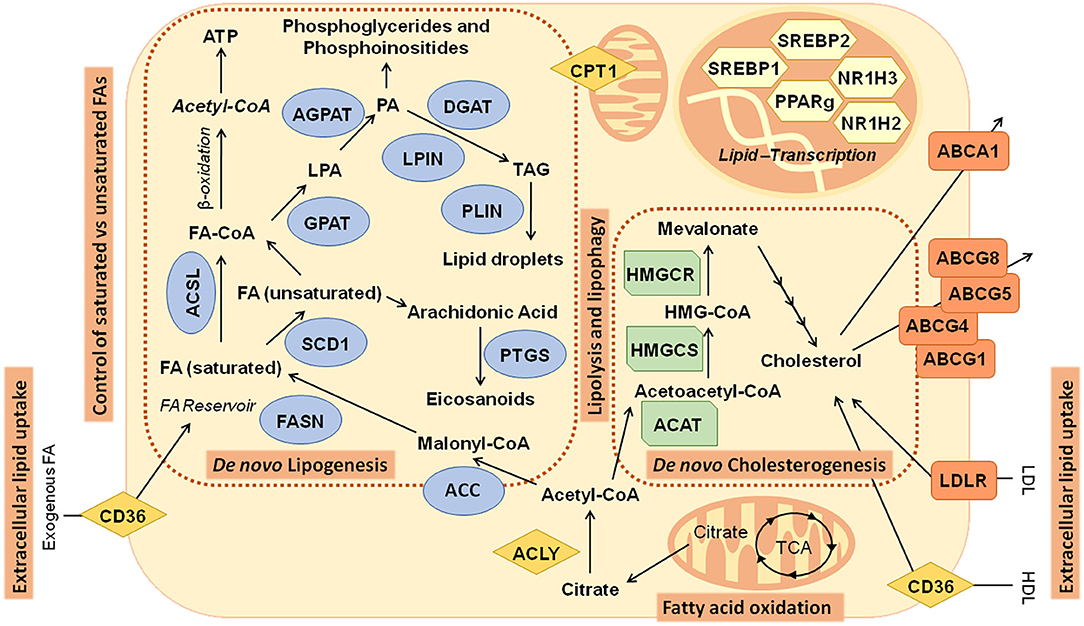
그림 2 . 암의 지질 대사와 관련된 주요 대사 경로: 새로운 지방 생성(지방산 및 콜레스테롤 생합성)과 관련된 경로 및 유전자의 그림 .
ABCA1, ATP-binding cassette subfamily A member 1; ABCG1, ATP-binding cassette subfamily G member 1; ABCG4, ATP-binding cassette subfamily G member 4; ABCG5, ATP-binding cassette subfamily G member 5;
ABCG8, ATP-binding cassette subfamily G member 8; ACAT, acetyl-CoA acetyltransferase;
ACC, acetyl- CoA carboxylase; ACLY, ATP citrate lyase; ACSL, acyl-CoA synthetase long chain;
AGPAT, 1-acylglycerol-3-phosphate O-acyltransferase; CD36, CD36 molecule;
CPT1, carnitine palmitoyltransferase; DGAT, diacylglycerol O-acyltransferase; F
A, Fatty acids; FASN, fatty acid synthase; GPAT, glycerol-3-phosphate acyltransferase;
HDL, high-density lipoprotein; HMGCR: 3-hydroxy-3-methylglutaryl-CoA reductase;
HMGCS, 3-hydroxy-3-methylglutaryl-CoA synthase; LDL, low-density lipoprotein;
LDLR, low-density lipoprotein receptor; LPIN, Lipin; NR1H2, nuclear receptor subfamily 1 group H member 2;
NR1H3, nuclear receptor subfamily 1 group H member 3; PLIN, perilipin;
PPARγ, peroxisome proliferator-activated receptor γ; PTGS, prostaglandin-endoperoxide synthase;
SCD1, stearoyl-CoA desaturase; SREBP1, Sterol regulatory element binding transcription factor 1; SREBP2, sterol regulatory element binding transcription factor 2; TCA, tricarboxylic acid cycle.
FASN은 전립선암과 유방암에서 상향조절되는 것으로 밝혀졌으며, ACLY는 종양 형성과 형질전환을 지원하는 것으로 나타났습니다
FASN, ACC1 및 ACC2와 같은 여러 가지 새로운 지방 생성 효소의 억제는 종양 성장 억제에 대한 관련성을 보여주는 여러 암 모델에서 테스트되었습니다
유사하게, 스타틴에 의한 하이드록시메틸글루타릴-CoA(HMGCoA) 환원효소(HMGCR)의 억제는 유방암 세포의 세포 증식 억제 및 여러 전임상 마우스 모델에서 종양 퇴행을 유도하며 임상 시험에서 테스트되고 있습니다
여러 연구에 따르면 콜레스테롤 합성을 표적으로 하는 것이 암세포 증식과 형질전환을 억제하는 것으로 나타났습니다.
FA의 새로운 합성과 콜레스테롤 생성은 PI3K/Akt( 57 ) 및 c-Myc( 47 ) 를 포함한 다운스트림 발암 경로인 SREBP에 의해 전사적으로 조절됩니다 ( 그림 2 ).
SREBP1은 지방 생성 유전자의 발현을 촉진합니다.
한편, SREBP2는 콜레스테롤의 합성, 흡수 및 유출에 관여하는 유전자의 발현을 조절합니다.
그럼에도 불구하고 SREBP1과 SREBP2는 겹치는 활동을 합니다.
SREBP1과 SREBP2는 모두 여러 암에서 과발현되는 것으로 발견됩니다.
콜레스테롤의 세포 내 함량 조절도 암세포 생존에 중요한 것으로 나타났습니다.
ATP 결합 카세트 운반체(ABCA1)는 ApoA 코팅 지단백질로의 콜레스테롤 유출을 조절합니다.
최근에, p53의 활성화가 SREBP2 성숙을 방지하기 위해 원형질막에서 ER로 콜레스테롤의 역행 수송을 증가시키는 것으로 입증되었습니다(.
스테롤 O- 아실트랜스퍼라제 1(ACAT1)에 의한 LD 저장을 위한 콜레스테롤의 에스테르화는 전립선암의 생존을 증가시키는 것으로 나타났습니다.
암의 지방산 산화
게다가 또FA와 콜레스테롤의 합성, 미토콘드리아에서 FAO에 대한 세포 내 FA의 동원은 암 생존 및 전파에 중요합니다.
종양 세포는 종양 세포가 아닌 것보다 더 높은 수준의 활성 산소 종(ROS)을 제공하여 암 진행 및 전파를 지원하기 위해 생존 및 상피에서 중간엽으로의 전환 프로그램을 활성화할 수 있다는 것은 잘 알려져 있습니다.
그럼에도 불구하고 과도한 ROS는 세포 사멸을 촉진할 수 있습니다.
세포내 중성 지질의 동원에 연루된 효소가 미토콘드리아에서 산화를 위한 FA 수준을 증가시키는 대사 유연성을 제공한다는 것이 입증되었습니다.
FAO는 포도당이 제한될 때 에너지를 제공할 뿐만 아니라 세포 내 NADPH 수준을 증가시켜 산화 스트레스를 더 잘 제어하는 데 기여합니다.
더욱이, FAO는 산화 스트레스로 인한 아노이키 또는 세포 사멸 을 유발하는 부착 손실을 겪을 때 고형 종양 세포의 생존에 중요한 것으로 나타났습니다.
또한, FAO는 전이 중 대사 스트레스를 제어하기 위해 ATP 및 NADPH 생성을 위한 지질을 제공하는 지방세포가 풍부한 omentum으로 우선적으로 전이하는 난소암의 경우와 같은 종양 미세 환경의 영향을 받습니다.
FA 저장 및 세포내 FA 동원의 조절(Lipolysis and Lipophagy)
암세포에서 FA의 새로운 합성은 지질 저장과 지질 동원 사이의 항상성을 보존하기 위해 세포 내 지질 함량의 증가를 수용하기 위한 추가 과정과 결합됩니다
새로운 지방 생성으로 인한 FA는 중성 지질(LD에 저장됨)과 인지질(막에 저장됨)에 축적됩니다.
LD-연관 단백질 중에는 스테롤 생합성 경로, 아실-CoA 대사(ACSL) 및 트리아실글리세롤(TAG) 생합성의 효소가 있습니다.
페리리핀(PLIN) 또는 카베올린과 같은 구조 단백질은 붕괴를 방지하고 지방분해로부터 보호하기 위해 LD의 무결성에 중요합니다( 그림 2 ).
암세포는 정상 세포보다 더 많은 양의 LD를 나타냅니다(
암 치료를 위한 잠재적인 약물 표적으로서 LD 관련 단백질을 지원합니다
암세포에서 FA의 새로운 합성 증가는 세포내 지질 함량을 수용하기 위해 효율적이고 상보적인 지질분해 메커니즘을 필요로 합니다 .
따라서, 지방분해는 저장된 지질을 인지질 및 지질 신호 전달 매개체의 합성에 사용할 수 있게 하고/하거나 필요할 때 ATP 또는 NADPH 수준을 증가시킵니다.
지방분해에 관여하는 여러 효소(지방 TAG 리파제(ATGL), 호르몬 민감성 리파제(HSL), 모노아실글리세롤 리파제(MAGL))가 종양 형성을 촉진하는 것으로 설명되었습니다
또한, 세포 내 지질 함량의 조절과 관련된 자가포식의 특정 기능인 지방포식이 암의 세포 사멸에 대한 저항성을 증가시키는 것으로 설명되었습니다
세포외 지질 흡수
또한 정상 세포와 유사하게 암세포는 새로운 지방 생성이 억제되면 외인성 지질을 흡수할 수 있습니다 .
분화 클러스터 36(CD36)( 그림 2 ) 과 같은 세포 표면 수용체의 상향조절은 전이를 증가시키는 것으로 밝혀졌습니다
더욱이, 저밀도 지단백질(LDL)의 내재화를 위한 저밀도 지단백질 수용체(LDLR)의 발현이 신장 세포 암종(RCC) 세포에서 상향 조절되는 것으로 밝혀졌습니다.
FA 결합 단백질(FABP)은 지질 흡수를 증가시킬 뿐만 아니라 암세포에서 세포 내 지질 이동을 증가시키는 데 기여합니다.
한편, FABP5는 전립선암에서 세포 증식과 성장을 증가시킵니다.
포화 대 불포화 FA의 제어
FAs의 공급원에 따라, 즉 de novo 지질 생성 또는 세포 외 지질 섭취에 따라 세포막의 인지질에 통합된 포화 FA의 수준이 다릅니다.
지방 생성 경로는 포화 및 MUFA로 세포막의 포화 수준을 증가시키며, 이는 주로 식이에서 얻어지는 다중불포화 아실 사슬(PUFA)에 비해 지질 과산화에 덜 민감합니다.
이런 식으로 새로운 지방 생성은 암세포의 산화 스트레스와 화학 요법에 대한 저항력을 높이는 데 기여합니다.
그럼에도 불구하고, 세포막에 포화 FA가 과도하게 축적되면 지방독성이 발생할 수 있습니다.
이와 관련하여, SCD1 억제는 암세포에서 ER 스트레스와 세포자멸사를 유도하고 결장암 및 폐암의 이종이식 모델에서 종양 성장을 감소시킵니다.
종양이 성장하는 동안 종양의 내부 부분은 저산소증에 직면하고 영양소 가용성이 감소합니다.
종양은 포화 및 불포화 FA 수준의 균형을 맞추기 위해 다양한 전략을 개발했습니다.
따라서 종양은 혈장에서 MUFA/PUFA의 흡수를 증가시켜 지방독성을 예상하며, 이는 LD에 추가로 저장되거나 세포막에서 인지질에 통합됩니다.
SCD1 활성은 산소를 필요로 하기 때문에 저산소 상태에서 일부 종양은 DGAT의 활성에 의존하여 MUFA를 TG로 통합하고, 이는 LD로 추가 축적됩니다.그림 2 ).
또한, 종양은 Lands 주기를 통해 세포막의 인지질에서 포화 대 불포화 FA 수준의 균형을 유지합니다.
최근에, Fenton 경로를 통한 산화를 통해 세포 사멸을 유도하는 세포막의 인지질에서 높은 수준의 MUFA/PUFA와 관련된 페로프토시스(ferroptosis)로 알려진 과정이 설명되었습니다.
장쇄 FA 활성화와 관련된 장쇄 FA 아실 CoA 합성효소(ACSL)는 고유한 동형이 고유한 기질을 사용하기 때문에 ferroptosis를 제어할 수 있습니다.
한편, ACSL4는 AA와 같은 주요 기질로 PUFAS를 가지고 있으며, ACSL3는 MUFA와 PUFA를 모두 활성화할 수 있어 인지질에서 PUFA의 과도한 축적을 더 잘 제어할 수 있습니다.
또한 ACSL3는 LD 저장 또는 β-FAO 간의 FA 분포를 더 잘 제어할 수 있게 하여 산화 스트레스를 더 잘 제어할 수 있게 합니다( 42 ).
지질 대사 변화 및 암 예후
암 조직은 새로운 지방 생성 및 콜레스테롤 생성 의 비정상적인 활성화를 나타 냅니다
극도로 증식하는 암세포는 식이성 또는 외인성 지질 및 지단백질의 흡수를 증가시키거나 지질 생성 또는 콜레스테롤 합성을 활성화함으로써 충족시키는 강렬한 지질 및 콜레스테롤 결합력을 나타냅니다
중요하게도, 이러한 비정상적인 지질 대사는 원발성 종양에 영향을 미칠 뿐만 아니라 종양 미세 환경에 의해 생성되는 외인성 지질도 악성 종양에 영향을 미칠 수 있습니다
게다가, 전이 중 세 가지 기본 단계인 이동, 침습 및 혈관신생은 지질 대사 조절의 영향을 받습니다.
또한 검색 가능한 거대한 데이터베이스에서 공개적으로 사용할 수 있는 "omics" 데이터를 통해 수천 명의 환자의 특정 의학적 문제를 쉽게 해결할 수 있습니다.
The Pathology Atlas 온라인 도구(https://www.proteinatlas.org/humanproteome/pathology)와 함께 Cancer Genome Atlas(TCGA) 유전자 발현 데이터 세트(https://www.cancer.gov/tcga) 및 The Human Protein Atlas 웹사이트 )는, TCGA 연구의 mRNA 데이터와 다양한 형태의 인간 암의 단백질 발현 데이터가 포함되어 있습니다.
암 예후 및 생존의 바이오마커로서의 지질 관련 전사 인자 변경
지질 대사 매개체의 발현을 조절하는 주요 전사 인자는 SREBP1, SREBP2, PPARγ, NR1H3 및 NR1H2입니다.
스테롤 조절 요소 결합 단백질 1(SREBP1)은 새로운 지방 생성 조절에 중요한 역할을 하는 지방 생성 유전자의 알려진 전사 인자 입니다 .
PPARγ는 지질 대사 매개체의 발현뿐만 아니라 염증 반응을 제어하는 핵 수용체이다.
또한, PPAR b/d 및 a 이소타입도 FAO, FA 저장 및 콜레스테롤 생성에 중요한 역할을 한다는 것이 입증되었습니다.
PPARγ의 감소된 발현은 많은 종양 유형에서 관찰되었습니다.
이러한 의미에서 종양 내 감소된 PPARγ 발현은 폐암 환자의 나쁜 예후와 관련이 있습니다.
중요하게도 한 연구에서는 세포질 PPARγ 발현이 원발성 유방암에서 불량한 예후의 독립적인 마커로 나타났다고 보고합니다.
TCGA 분석은 PPARγ를 신장 및 요로상피암에 대한 유리한 예후 마커로 제안했습니다( 표 1 ).
NR1H3 및 NR1H2 는 각각 간 X 수용체(LXR) α 및 LXR β를 인코딩합니다.
이들은 콜레스테롤 유출 및 FA 생합성을 제어하는 유전자의 전사를 향상시켜 세포내 콜레스테롤의 상승된 수준에 반응하는 밀접하게 관련된 핵 수용체입니다.
NR1H3 발현은 완전히 절제된 II기 및 III기 NSCLC 환자에서 더 나은 생존과 유의하게 상관관계가 있었습니다
암에서 변경된 지질 대사 표적화
(i) 지방생성 효소(FASN, ACLY, ACC);
(ii) 외인성 지질 흡수(LXR, CD36, FABP4/5);
(iii) 염증성 신호전달 경로(PTGS2);
(iv) 세포내 지질 항상성의 조절(PPARγ, CPT1a, lipin2, HSL, MAGAT, DAGAT…); 및/또는
(v) 포화 대 불포화 FA. 그들의 효능은 시험관 내 전임상 및 임상 연구 를 포함하여 수많은 암 모델에서 입증되었습니다 .
전임상 및 임상 연구에서 평가된 주요 약물을 표 2 에 정리하였다.
그럼에도 불구하고 이러한 연구 결과가 고무적이지만 지질 대사의 다양한 조절 메커니즘으로 인한 부작용은 여전히 큰 도전 과제입니다.

표 2 . 암에서 변경된 지질 대사를 표적으로 하는 주요 약물에 대한 전임상 및 임상 연구.
주요 과제는 게놈, 후성유전체, 전사체 및 면역 가변성에 의해 발생할 수 있는 종양 이질성을 정의하는 것입니다.
영양유전학은 식이 반응과 여러 질병의 위험에 대한 유전적 변이의 영향을 연구하는 것을 목표로 합니다.
예를 들어, CD36 유전자의 SNP는 다량의 지방을 섭취할 때 이상지질혈증과 연관됩니다.
에피갈로카테킨-3-갈레이트, 커큐민, 설포라판 및 제니스테인과 같은 천연 공급원의 식이 성분 및 영양소는 암과 관련된 유전자의 발현을 조절하는 항암 특성이 있는 것으로 나타났습니다.
폴리페놀은 지방 생성, 지방 분해 및 FAO와 관련된 유전자의 조절을 통해 비만 예방에 기여합니다( 248 – 251 ).
포화 FA를 많이 섭취하면 염증, 인슐린 저항성 및/또는 간 지방증과 관련된 유전자의 발현이 증가합니다.
대조적으로, 지중해식 식단은 산화 스트레스, 염증 및/또는 인슐린 신호 전달과 관련된 유전자의 발현을 하향 조절합니다.
중요하게도, 높은 수준의 트리글리세리드 및 LDL은 CRC 예후 및 원격 전이와 관련이 있습니다.
MUFA의 섭취 증가는 CRC 암의 염증 감소와 관련이 있습니다.
EPA 및 α-리포산으로 보충된 에너지 제한 식단은 FAO 유전자의 발현을 증가시켜 새로운 지방 생성 및 염증과 관련된 유전자의 발현을 감소시킵니다 ( 257 ) ( 표 3 ).

표 3 . 암에서 변경된 지질 대사 및/또는 관련 위험 인자(주로 비만 및 T2DM)를 표적으로 하는 천연 공급원의 생리활성 화합물을 사용한 전임상 및 임상 연구.
'암치료' 카테고리의 다른 글
| (Curcumin) 암 줄기 세포를 표적으로 하는 새로운 치료 전략으로서의 비정상적인 지질 대사 (0) | 2022.10.01 |
|---|---|
| 종양학에서의 지질 대사: 중요한 이유, 연구 방법 및 치료 방법 (0) | 2022.10.01 |
| 암세포가 지질 대사를 리모델링하는 방법: 전사 인자를 표적으로 하는 전략 (0) | 2022.09.29 |
| 지질 대사와 암 (0) | 2022.09.28 |
| 암의 지질 대사 환경과 새로운 치료적 관점 (0) | 2022.09.27 |