2021
https://www.mdpi.com/2072-6694/13/3/474/htm
Lipid Metabolism in Oncology: Why It Matters, How to Research, and How to Treat
Lipids in our body, which are mainly composed of fatty acids, triacylglycerides, sphingolipids, phospholipids, and cholesterol, play important roles at the cellular level. In addition to being energy sources and structural components of biological membrane
www.mdpi.com
Lipid Metabolism in Oncology: Why It Matters, How to Research, and How to Treat
대사 재프로그래밍은 암의 특징으로 주목받고 있습니다. 그러나 지질대사는 기술적인 문제로 인해 분석이 어려웠다. 최근에는 질량분석법과 같은 지질학 기술이 발전하여 암의 상세한 지질 프로필을 분석할 수 있게 되었습니다. 또한 지질 대사의 변화도 암과 주변 미세 환경 간의 상호 작용에 중요한 역할을 한다는 것이 분명해졌습니다.
주로 지방산, 트리아실글리세리드, 스핑고지질, 인지질, 콜레스테롤로 구성된 우리 몸의 지질은 세포 수준에서 중요한 역할을 합니다.
에너지원 및 생물학적 막의 구조적 구성요소인 것 외에도 여러 유형의 지질은 신호 분자 또는 2차 메신저 역할을 합니다.
대사 재프로그래밍은 암의 특징으로 인식되어 왔지만 암에서 지질 대사의 변화는 포도당이나 글루타민 대사에 비해 덜 주목받았습니다.
소위 "지질 대사 재프로그래밍"이라고 하는 지질 대사의 변화는 세포 주기, 증식, 성장 및 분화를 포함한 세포 기능에 영향을 미칠 수 있습니다. 발암으로 이어집니다. 또한, 변경된 지질 대사를 통한 암세포와 인접 면역 세포 간의 상호 작용은 종양 성장 및 진행을 지원하는 것으로 알려져 있습니다.
지질은 세포 소기관에 널리 분포되어 있으며 모든 막의 빌딩 블록 역할을 합니다.
지질은 생물학적 막의 구성 요소일 뿐만 아니라 에너지원, 신호 분자 및 2차 전달자로서 중요한 역할을 합니다.
신진대사의 변화는 암의 주요 특징으로 여겨져 왔습니다.
생물체에 필수적인 지질에 대한 연구는 물에 녹지 않기 때문에 제한적이다. 화학적으로 불안정한; 그리고 단백질과 달리 유전자에 의해 암호화되지 않으며 화학적 방법을 사용하여 직접 분석해야 합니다.
신기술에 의해 개척된 지질학 분야는 암에서 지질 대사 재프로그래밍에 대한 이해를 높이고 지질 대사에 초점을 맞춘 새로운 치료 표적이 확인되었습니다.
2. 암 진행에서 지질 대사 재프로그래밍의 세포 고유 효과
2.1. 지방산
2.1.1. 지방산 대사의 기초
지방산(FA)은 많은 지질의 기본 골격으로 중요합니다.
새로운 FA 합성 경로는 ATP 시트레이트 리아제(ACLY), 아세틸-CoA 카르복실라제(ACC) 및 지방산 합성효소(FASN)에 의해 촉매되는 순차적인 효소 반응을 통해 시트레이트를 팔미트산으로 전환합니다.
팔미트산은 연장효소(ELOVL)에 의해 연장될 수 있습니다. 이러한 FA는 또한 스테아로일-CoA 불포화 효소(SCD)에 의해 포화되어 단일불포화 지방산(MUFA)으로 전환될 수 있습니다.
드 노보 합성 외에도 세포는 세포 외 공급원에서 흡수를 통해 FA를 획득합니다.
지질 흡수는 지방산 수송 단백질-1(FATP1), 지방산 트랜스로카제(CD36) 및 간 지방산 결합 단백질(L-FABP)을 포함하는 막 관련 수송 단백질을 통해 수행됩니다.
FA 대사와 관련된 이러한 효소의 발현은 주로 지방 생성의 마스터 전사 인자로 알려진 스테롤 조절 요소 결합 단백질 1(SREBP-1)에 의해 조절됩니다.
대사 경로에서 FA를 사용하려면 유리 FA를 아실-CoA로 전환시키는 ACSL(acyl-CoA synthetase)에 의해 FA가 활성화되어야 합니다.
지방산 산화(FAO) 과정에서 속도 제한 단계는 미토콘드리아 막을 가로지르는 아실-CoA의 전위입니다.
이 전위를 통해 아실-CoA는 먼저 카르니틴 팔미토일트랜스퍼라제 1(CPT1)에 의해 카르니틴에 접합을 통해 아실카르니틴으로 전환됩니다.
그런 다음 아실카르니틴은 카르니틴 아실카르니틴 트랜스로카제(CACT)를 통해 미토콘드리아로 전위되고 최종적으로 CPT2에 의해 다시 아실-CoA로 전환됩니다.
그런 다음 Acyl-CoA는 FAO 경로로 들어가고 트리카르복실산(TCA) 회로가 뒤따릅니다( 그림 1 ).

그림 1. 지질 대사 경로.
ABCA1, ATP-binding cassette transporter A1; ACAT1, acetyl-CoA acetyltransferase 1; ACC, acetyl-CoA carboxylase; Acetyl-CoA, acetyl-coenzyme A; ACLY, ATP citrate lyase; ACS, acyl-CoA synthetase;
Acyl-CoA, acyl-coenzyme A; ATGL, adipose triglyceride lipase; CACT, carnitine acylcarnitine translocase;
CE, cholesterol ester; CPT1, carnitine palmitoyltransferase 1; CPT2, carnitine palmitoyltransferase 2;
DAG, diasylglycerol; DGAT, diglyceride acyltransferase; FA, fatty acid; FAO, fatty acid oxidation;
LDLR, low-density lipoprotein receptor; LXR, liver X receptor; LXRE, LXR response element;
MUFA, monounsaturated fatty acid; PC, phosphatidylcholine; SCD, stearoly-CoA desaturase;
SRE, sterol regulatory element; SREBP, sterol regulatory element-binding protein;
SQLE, squalene epoxidase; TAG, triacylglycerol; TCA, tricarboxylic acid.
2.1.2. 암세포에서 재프로그래밍된 지방산 대사
새로운 지방산 합성은 여러 암에서 활성화되며 다른 곳에서 광범위 하게 검토 되었습니다.
따라서 암세포에서 de novo FA 합성의 변화에 대해 간략하게 언급합니다.
ACLY, ACC, FASN 및 SCD를 포함한 새로운 FA 합성을 촉매하는 효소는 수많은 암에서 상향 조절됩니다.
표 1 에 이러한 억제제를 요약합니다 .
표 1. 암 치료를 위한 de novo FA 합성 경로를 표적으로 하는 약물.
Target Drugs Development Stage References
| ACLY | Hydroxycitric acid | preclinical | [15] |
| Cucurbitacin B | preclinical | [16,17] | |
| ACC | TOFA | preclinical | [18,19] |
| Soraphen A | preclinical | [20] | |
| ND-646 | preclinical | [21,22] | |
| MK-4074 | clinical phase 1 (for treatment of NAFLD) | [23] | |
| ND-630 | clinical phase 2 (for treatment of NAFLD) | [21,24] | |
| FASN | TVB-2640 | clinical phase 2 (monotherapy and/or co-treatment) | [25,26] |
| Orlistat | FDA-approved (as an anti-obesity drug) | [27,28] | |
| C75 | preclinical | [29,30] | |
| GSK2194069 | preclinical | [31,32] | |
| Fasnall | preclinical | [33] | |
| SCD | A939572 | preclinical | [34,35] |
| MF-438 | preclinical | [36,37] | |
| CAY10566 | preclinical | [38,39] | |
| BZ36 | preclinical | [40] | |
| SREBP1 | Fatostatin | preclinical | [41] |
| FGH10019 | preclinical | [42] |
드 노보 합성 외에도 FA 흡수를 차단하는 것이 암 치료에 효과적인 것으로 알려져 있습니다.
CD36 발현은 난소암, 위암, 교모세포종 및 구강 편평 세포 암종에서 상향 조절됩니다.
SCD 억제제의 항종양 효과는 외인성 올레산에 의해 역전될 수 있지만 CD36 녹다운 유방암 세포에서는 그 효과를 역전시킬 수 없습니다.
ABT-510과 CVX-045라는 두 가지 CD36 표적 약물이 임상 시험에 도달했지만 심각한 부작용과 불만족스러운 효능으로 인해 결국 모두 실패했습니다.
암세포는 FAO와 관련된 효소의 변화를 자주 나타냅니다.
FAO는 증식, 전이, 줄기세포 및 치료에 대한 내성을 촉진하는 많은 암에서 중요한 생체 에너지 경로입니다.
CPT1의 과발현은 유방암, 위암 및 전립선암과 같은 여러 유형의 암에서 종양 진행과 관련이 있습니다.
에토목시르(etomoxir), 펙실린(phexiline)과 같은 CPT1 억제제는 항종양 효과가 있을 것으로 예상되었지만 강한 부작용으로 인해 임상 연구로 진행되지 않았다.
반면에, FAO의 억제는 때때로 암세포 성장에 유익합니다.
발암에서 FAO의 역할이 암의 유형과 주변 미세환경에 따라 다르다는 것을 시사한다.
참고로 우리는 CPT2의 하향 조절로 인한 변경된 혈청 아실카르니틴 프로파일이 NASH 환자에서 HCC를 예측하는 데 유용한 마커임을 발견했습니다.
2.2. 콜레스테롤
2.2.1. 콜레스테롤 대사의 기초
콜레스테롤은 모든 세포막에 존재하며 막 기능 조절에 중요한 역할을 합니다.
콜레스테롤 함량은 막의 유동성과 유연성을 제어할 수 있습니다.
또한, 스핑고지질과 함께 존재할 때 두 가지 형태는 지질 뗏목으로 알려진 클러스터를 형성하여 막 단백질의 2차원 분포를 조절합니다.
일반적으로 신호 전달 관련 단백질은 이러한 뗏목에 의존하는 것으로 믿어집니다.
포유류 세포에서 콜레스테롤은 메발로네이트 경로를 통해 아세틸-CoA에서 합성됩니다.
먼저, 3개의 아세틸-CoA 분자로부터 하이드록시메틸글루타릴-CoA(HMG-CoA)가 합성됩니다.
HMG-CoA는 HMG-CoA 환원효소(HMGCR)에 의해 메발로네이트로 환원됩니다.
일련의 효소 반응에서 메발로네이트는 파르네실 피로포스페이트(FPP)로 전환됩니다.
두 개의 FPP 분자는 스쿠알렌으로 축합된 다음 스쿠알렌 에폭시다제(SQLE)에 의해 2,3-에폭시 스쿠알렌으로 산화되고, 이는 라노스테롤로 고리화됩니다.
라노스테롤은 결국 콜레스테롤로 전환됩니다.
콜레스테롤 생합성 외에도 대부분의 세포는 LDL 수용체(LDLR)를 통해 저밀도 지단백질(LDL)로부터 세포외 콜레스테롤을 획득합니다.
반면에 과잉 콜레스테롤은 ABCA1 및 ABCG를 포함한 ATP 결합 카세트(ABC) 수송체에 의해 세포에서 내보내지거나 아실 CoA:콜레스테롤 아실트랜스퍼라제(ACAT)에 의해 독성이 덜한 콜레스테릴 에스테르(CE)로 전환됩니다.
이러한 CE는 LD에 저장되거나 지단백질로 분비됩니다.
콜레스테롤 농도는 SREBP-2, 간 X 수용체(LXR) 및 핵 인자 적혈구계 2 관련 인자-1(NRF1)에 의해 엄격하게 제어됩니다.
콜레스테롤 및 콜레스테롤 유래 옥시스테롤의 축적은 인슐린 유도 유전자(INSIG)를 통해 소포체(ER)에서 SREBP 절단 활성화 단백질(SCAP)-SREBP-2 복합체의 보유를 유도하여 SREBP-2 경로를 비활성화하고, 콜레스테롤의 생합성과 흡수를 하향 조절합니다.
반면 데스모스테롤과 옥시스테롤은 LXR에 결합하여 활성화시켜 콜레스테롤 유출에 관여하는 유전자의 발현을 증가시킨다.
높은 콜레스테롤 수치는 NRF1의 핵 전위를 억제하고 NRF1에 의해 차단된 LXR 경로를 복원합니다.
콜레스테롤 결핍에서 세 가지 조절 경로는 조정된 방식으로 작동하여 콜레스테롤 생합성 및 흡수를 증가시키면서 콜레스테롤 유출 및 에스테르화를 감소시킵니다( 그림 1 ).
2.2.2. 암세포에서 재프로그래밍된 콜레스테롤 대사
암세포는 빠르게 증식하기 때문에 높은 수준의 콜레스테롤이 필요하며 콜레스테롤 생합성 증가는 많은 암의 특징입니다( 그림 2 ).
SREBP2와 그 표적 유전자는 전립선암, 유방암 및 간세포암종에서 현저하게 상향조절됩니다.
콜레스테롤 생합성은 또한 sonic hedgehog and Notch pathway를 활성화하여 암 줄기 세포의 유지에 중요한 역할을 합니다.

그림 2. 재프로그래밍된 콜레스테롤 대사 및 치료 표적.
10번 염색체에서 제거된 PTEN, 포스파타제 및 텐신 상동체.
새로운 콜레스테롤 합성은 시간과 에너지를 소모하기 때문에 교모세포종 및 췌장암과 같은 일부 암은 외인성 콜레스테롤을 사용합니다.
일부 역형성 대세포 림프종은 SQLE가 부족하고 LDLR을 공격적으로 상향 조절하여 콜레스테롤을 획득합니다.
또한, SQLE의 손실은 막성 다가불포화 지방산(PUFA)의 적절한 구성을 유지함으로써 세포를 ferroptosis로부터 보호하는 스쿠알렌의 upstream accumulation으로 이어집니다.
CE의 축적은 암의 또 다른 특징입니다.
ACAT1은 췌장암과 림프구성 백혈병에서 종양 촉진 역할을 합니다.
옥시스테롤은 종양 미세 환경(TME)에서 풍부하게 발견되는 다른 콜레스테롤 대사 산물입니다.
한편, 산화된 스테롤은 LXR 리간드로 알려져 있으며 세포 증식을 억제한다.
27HC, 24(R/S) 및 25-에폭시콜레스테롤은 LXR 신호전달을 활성화하여 위암의 성장과 전이를 억제합니다.
따라서 암에서 27HC의 역할은 여전히 모순적입니다.
종양 유전자의 획득 및 종양 억제 유전자의 손실은 콜레스테롤 대사의 변화와 관련이 있습니다.
간세포에서 종양유전자인 c-Fos의 형질전환 발현은 LXR 신호전달을 억제하고 콜레스테롤 및 옥시스테롤 및 담즙산과 같은 콜레스테롤 대사산물의 합성을 증가시킵니다.
이것은 염증과 간암 발생을 증가시킵니다.
전립선암에서 포스파타제 및 텐신 동족체(PTEN)의 손실은 PI3K-Akt 경로를 활성화하고 콜레스테롤 흡수 및 에스테르화를 증가시켜 CE 축적을 유도합니다.
콜레스테롤 대사의 억제는 가능한 항종양 요법으로 간주되었습니다.
HMGCR 억제제로 잘 알려진 스타틴은 진단 전후 사용 여부에 관계없이 다양한 암 유형에서 사망률을 감소시키고, 임상 시험에서 항종양제로도 연구된 바 있다.
또 다른 콜레스테롤 합성 효소인 SQLE는 항종양 치료의 표적으로 여겨진다.
SQLE에 대한 여러 약물이 항진균제로 인증되었으며 항종양제로 사용하기 위해 조사되고 있습니다.
LXR 작용제로 콜레스테롤 흡수를 표적화하면 LDLR 분해를 일으키고 ABCA1의 발현을 증가시켜 수많은 암에서 종양 세포 사멸을 촉진할 수 있습니다.
콜레스테롤 에스테르화의 억제도 효과적인 접근법입니다.
ACAT1 억제제 아바시미브에 의한 CE 억제는 이마티닙 내성 골수성 백혈병에서 MAPK 신호전달을 하향 조절함으로써 종양 성장을 억제하고 이마티닙 감수성을 회복시킵니다.
전립선암에서 아바시미브는 Wnt-β-카테닌 경로를 차단하여 전이를 억제합니다.
2.3. 트리아실글리세롤/지질 방울=Triacylglycerol/Lipid Droplet
2.3.1. 트리아실글리세롤/지질 방울 대사의 기초
트리아실글리세롤(TAG)은 글리세롤 분자에 에스테르화된 3개의 지방산으로 구성됩니다.
이 분자의 기본 역할은 지방산을 저장하고 효율적인 수송을 촉진하는 것입니다.
TAG의 가장 큰 공급원은 식이이며, 각 세포는 TAG를 FA로서 차지(Take up?-시작?)합니다.
지방세포와 간세포에서 이러한 FA는 TAG로 재합성될 수 있습니다.
그런 다음 TAG는 LD 내에서 격리됩니다.
LD는 인지질 단층으로 둘러싸인 중성 지질 코어를 갖는 소기관입니다.
내부 지질은 주로 TAG로 구성되지만 CE와 아실 세라마이드도 포함합니다.
LD의 형성은 ER의 지질 이중층 사이의 TAG와 CE의 새로운 합성으로 시작됩니다.
충분한 지질이 ER 막간 수정체에 축적되면 세포질로 방출되어 LD를 형성합니다.
LD는 세포 외 영양 환경에 반응하여 동적으로 합성되고 분해됩니다.
LD는 주로 lipolysis와 lipophagy의 두 가지 메커니즘에 의해 분해됩니다.
지방분해에서 FA는 지방 트리글리세리드 리파제(ATGL), 호르몬 민감성 리파제(HSL) 및 모노아실글리세롤 리파제(MAGL)와 반응하여 TAG로부터 공급될 수 있습니다. ( 그림 1 ).
Lipophagy는 LD가 autophagosomal 막에 통합되고 lysosome과 융합되고 가수분해되는 autophagy의 최근에 발견된 형태입니다.
LD의 분해에 의해 공급되는 FA는 다양한 세포에서 영양 결핍 조건 동안 미토콘드리아 산화 대사에 연료를 공급합니다.
반면에 지방분해는 지방독성을 유발할 수 있습니다.
과도한 지방 분해는 세포질에서 유해한 유리 FA를 증가시키고 미토콘드리아에서 FA 산화를 증가시켜 ROS를 생성합니다.
Perilipin 5는 ATGL 매개 지방분해를 억제하고 이러한 형태의 산화 스트레스로부터 조직을 보호합니다.
2.3.2. 암세포에서 재프로그래밍된 트리아실글리세롤/지질 방울 대사
발암 기간 동안 FA에 대한 수요는 급속한 증식을 지원하기 위해 증가합니다.
FA는 새로운 합성 증가뿐만 아니라 세포외 공급원으로부터의 증가된 흡수 및 지질 방울의 기여를 필요로 하는 자가포식을 통한 세포내 지질의 재활용에 의해 공급됩니다.
지질 방울은 또한 ROS를 방어하고 저산소증 및 영양 부족과 같은 가혹한 주변 환경으로부터의 스트레스에 대한 저항력을 개발하는 데 중요한 역할을 합니다.
지질 방울은 다양한 유형의 암에 축적되는 것으로 알려져 있으며, 지질 방울이 고농축된 종양은 유방암 및 췌장암에서 나쁜 예후와 관련이 있습니다.
따라서 지질 방울 대사의 변화도 암의 중요한 특징입니다.
저산소증에 노출된 간세포암종 세포와 자궁경부 선암 세포는 HIF-1α 의존적 방식으로 Lipin 1의 발현을 직접 자극하여 지질 방울을 축적합니다.
저산소증에 노출된 암세포는 FABP3/7을 통해 FA 흡수를 상향 조절하고 지질 방울을 축적하여 산소 결핍 동안 ER 및 산화 환원 항상성을 가능하게 하고, 미토콘드리아 에너지 생산을 위한 FA를 공급하고 재산소화 후 세포 증식을 촉진하는 것으로 알려져 있습니다.
최근 연구에 따르면 저산소증은 지질 방울 분해와 관련된 여러 지질 방울 관련 단백질의 발현에 영향을 미칠 수 있습니다.
HILPDA(Hypoxia-inducible lipid droplet-associated protein)/HIG2(hypoxia-inducible lipid droplet-associated protein)는 지질 방울 표면에 위치하며 저산소 상태에서 HIF-1에 의해 상향 조절되는 ATGL의 억제제입니다.
HIG2에 의한 ATGL 억제는 지질 방울 분해를 억제하고 미토콘드리아 산화 및 ROS 생성으로부터 FA를 분리하여 저산소 조건에서 암 생존을 허용했습니다.
따라서 ATGL에 의한 지질 방울 분해는 저산소 상태에서 암세포를 손상시킬 수 있으며 ATGL 활성을 증가시키는 것은 새로운 치료 전략이 될 수 있습니다.
실제로, ATGL 과발현은 흑색종, 결장암, 간세포암종 및 폐암 세포주의 증식을 억제하고, 또한 간세포암종 세포주에 대한 항암제의 반응을 향상시킵니다.
암에서 lipophagy의 역할은 불분명합니다.
여러 보고에서 lipophagy의 종양 촉진 효과가 나타났지만, 대부분은 lipophagy가 종양 형성을 억제한다고 말합니다.
2.4. 인지질
2.4.1. 인지질 대사의 기초
인지질(PL)은 세포막의 구성 요소이며 다양한 화학 구조와 기능을 가지고 있습니다.
PL은 항상성, 세포 부착 및 이동, 신호 전달, 소포 수송, 세포자멸사 및 번역 후 변형과 같은 다양한 세포 기능을 조절합니다.
글리세로인지질(GPL)은 극성 헤드 그룹의 유형에 따라 phosphatidylcholine (PC), phosphatidylethanolamine (PE), phosphatidylserine (PS), phosphatidylglycerol (PG), phosphatidylinositol (PI), and phosphatidic acid (PA)으로 알려진 하위 분류로 분류됩니다. .
막 인지질의 지방 아실 부분은 사슬 길이와 포화도에서 상당한 다양성을 보여줍니다.
이 두 매개변수는 유동성, 곡률 및 하위 도메인 구조와 같은 세포막의 생물물리학적 특성을 결정합니다.
새로운 PL 합성의 경우 FA는 먼저 PL의 주요 전구체인 phosphatidic acid(PA)에 의해 흡수됩니다.
Kennedy 경로는 가장 풍부한 PL 헤드 그룹 클래스인 phosphatidylcholine (PC) 합성을 위한 기본 경로입니다.
다음으로 가장 일반적인 PL은 PE이며, 이는 새로 합성할 수 있지만 헤드 그룹 교환에 의해 PS에서 생성할 수도 있습니다.
새로운 합성 및 헤드 그룹 교환 외에도 인지질 조성은 Lands' 사이클이라고 하는 탈아실화 및 재아실화 리모델링 과정을 통해 유지됩니다.
Lysophosphatidylcholine acyltransferase(LPCAT)는 여러 세포 및 조직 유형에서 다양한 PC 종을 조절함으로써 지질 대사 및 항상성에 중요한 역할을 합니다.
2.4.2. 암세포에서 재프로그래밍된 인지질 대사
PL 합성 및 리모델링에 관여하는 많은 효소가 암에서 과발현됩니다.
예를 들어, PL 합성의 속도 제한 단계를 조절하고 퍼옥시좀 증식자 활성화 수용체(PPAR) 및 SREBP와 같은 전사 인자의 공동 조절자인 리핀-1은 고급 전립선암, 결장암, 폐암, 유방암을 포함한 다양한 암 유형 하위 집합에서 상향 조절됩니다.
높은 수준의 Lipin-1 발현은 불량한 예후 및 염증과 관련이 있으며, Lipin-1의 하향 조절은 ER 스트레스 및 세포자멸사를 유도하고 이종이식 마우스 모델에서 종양 성장을 약화시킵니다.
PC 및 PE 합성을 위한 케네디 경로의 첫 번째 수임 효소인 콜린 키나제 알파(ChoKalpha)는 다양한 종양 유형에서 과발현되고 다양한 발암성 사건에 의해 활성화됩니다.
ChoKalpha의 활성화 및 과발현은 PC에 대한 세포 요구량 증가와 관련이 있습니다. ChoKα의 녹다운 또는 화학적 억제는 세포 사멸을 유발하고 생체 내 종양 성장을 약화시킵니다.
많은 암에서 영향을 받는 것으로 보이는 또 다른 새로운 종류의 효소는 LPCAT입니다.
LPCAT1의 과발현은 투명 세포 신세포 암종 및 HCC 세포주에서 세포 증식, 이동 및 전이를 증가시키는 것으로 나타났습니다
3. 변경된 지질 대사 및 종양 미세 환경
암 세포 외에도 종양에는 termed tumor-infiltrating immune cells(TII)라고 하는 다양한 면역 이펙터 및 면역억제 세포가 있습니다.
TII는 항종양에서 종양 촉진 기능에 이르기까지 다양하며 종양의 유형과 단계에 따라 다릅니다.
TII에는 T 림프구, B 림프구, 종양 관련 대식세포(TAM), 수지상 세포(DC), 골수 유래 억제 세포(MDSC), 호중구 및 자연 살해(NK) 세포가 포함됩니다( 그림 3 ).
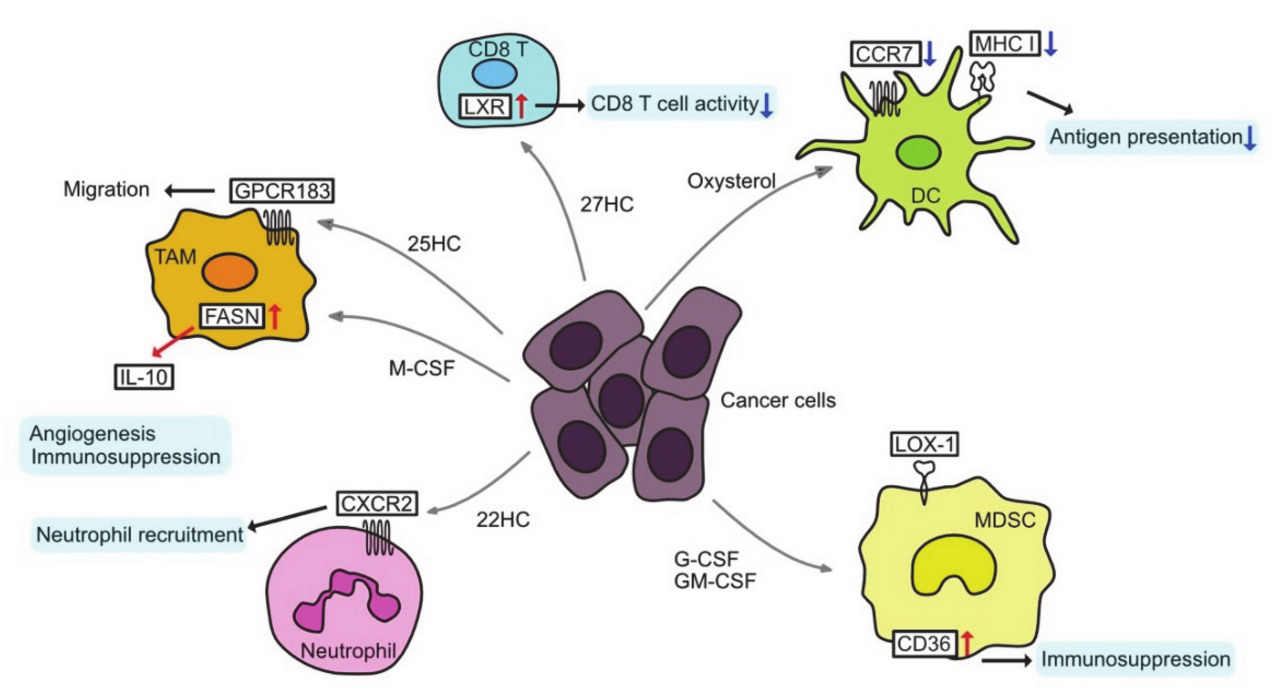
그림 3. 변경된 지질 대사 및 종양 미세 환경.
CCR7, C-C chemokine receptor type 7; CXCR2, C-X-C chemokine receptor type 2; DC, dendritic cell;
G-CSF, granulocyte colony-stimulating factor; GM-CSF, granulocyte macrophage colony-stimulating factor; GPCR 183, G-protein-coupled receptor 183; HC, hydroxycholesterol; IL-10, interleukin-10;
LOX-1, lectin-like oxidized low-density lipoprotein (LDL) receptor-1;
M−CSF, macrophage colony stimulating factor; MDSC, myeloid-derived suppressor cell;
MHC I, major histocompatibility complex class I; TAM, tumor-associated macrophage.
3.1. 종양 관련 대식세포=Tumor-Associated Macrophages
TAM은 콜레스테롤 대사 변화의 결과로 재프로그래밍될 수 있습니다.
종양 세포는 TAM에서 콜레스테롤 유출을 증가시키는 히알루로난 올리고머를 분비하여 TAM을 M2 유사 표현형으로 이끌고 종양 진행을 가속화합니다.
더욱이, FA 대사의 변화와 관련하여 TAM은 친종양 표현형으로 양극화될 수 있습니다.
종양 세포에서 분비되는 대식세포 집락 자극 인자(M-CSF)는 TAM에서 FASN 발현을 상향 조절하여 PPARβ/δ 활성화와 항염증 사이토카인인 IL-10 발현을 유도합니다.
3.2. TME의 T 세포
CD8 T 세포에서 SREBP2 신호전달은 증식 및 효과기 기능에 필수적인 반면 LXR 신호전달은 T 세포 활성화를 부정적으로 조절합니다[ 154 , 155 ]. 따라서 옥시스테롤이 풍부한 TME에서 T 세포 종양 면역은 LXR 활성화에 의해 억제될 수 있습니다. 다른 한편으로, 증가된 콜레스테롤 합성 및 T 세포에 의한 흡수는 T 세포의 항종양 효과를 향상시킬 수 있습니다. CD8 T 세포에서 ACAT1을 억제하면 콜레스테롤 합성이 변경되고 원형질막에 유리 콜레스테롤이 축적됩니다[ 156 ]. 이 콜레스테롤은 T 세포 수용체에 직접 결합하고 나노클러스터링을 촉진하여 콜레스테롤 생합성과 흡수를 증가시키는 항원 유도 신호를 유발합니다[ 157]. 또한, 이 콜레스테롤은 종양 세포의 표적 사멸을 위한 성숙한 면역학적 시냅스의 형성에 역할을 합니다. ACAT1 억제제인 아바시미브는 세포독성 CD8 T 세포의 비율을 증가시켜 키메라 항원 수용체(CAR)-T 세포의 치료 효과를 향상시킨다[ 158 ]. 반면, TME의 콜레스테롤 축적은 ER 스트레스를 유발하고 T 세포 고갈을 더욱 증가시키는 것으로 나타났습니다[ 159 ]. 따라서 내인성 및 외인성 콜레스테롤의 기능이 다를 수 있습니다.
3.3. 종양 관련 수지상 세포=Tumor-Associated Dendritic Cells
여러 암세포의 조건 배지는 수지상 세포에서 LXR-알파 신호전달을 활성화하고 CC 케모카인 수용체-7(CCR7)의 세포 표면 발현을 감소시킵니다.
그 결과, 종양 부위에서 림프절로의 수지상 세포의 이동이 억제되고 T 세포에 대한 종양 항원의 제시가 억제됩니다.
종양 보유 마우스에서 콜레스테롤 합성 억제 또는 SULT2B1b(옥시스테롤을 불활성 황산화 옥시스테롤로 전환시키는 효소)의 발현 억제를 통한 LXR-α 리간드의 불활성화는 수지상 세포 기능 및 항종양 반응을 회복시킨다.
그러나 어떤 옥시스테롤이 이 효과에 책임이 있는지는 아직 명확하지 않습니다.
종양 유래 인자는 CE, TAG 및 FA와 같은 산화된 지질의 축적을 초래하여 수지상 세포 표면의 MHC(주요 조직 적합성 복합체) 클래스 I 복합체를 감소시키고 항원 제시를 감소시킨다.
DC의 LD 축적은 또한 신장, 갑상선, 난소, 두경부암에서 항원 제시 능력을 억제합니다.
결장직장암에서 LPCAT-2 의존성 지질 방울 축적은 칼레티쿨린 격리를 유발하고 원형질막에 대한 노출을 방지하여 DC 성숙 및 후속 CD8 T 세포 침윤 및 화학요법 하에서 면역원성 세포 사멸을 방지합니다.
3.4. 면역억제 세포
호중구는 TME에서 중요한 면역억제 집단으로 간주됩니다.
22HC는 다양한 암세포의 조건 배지에 풍부하고 CD11bhighGr1high 호중구를 동원할 수 있습니다
췌장 신경내분비 종양은 HIF1α에 의해 유도된 24S-HC 수준의 증가가 호중구와 혈관신생을 유도한다는 것을 보여줍니다.
27HC는 고콜레스테롤 식이 섭취 유방암 모델에서 다형핵 호중구와 γδ T 세포를 유인하고 세포독성 CD8 T 세포를 감소시켜 전이를 촉진합니다.
MDSC는 호중구와 매우 유사하며 면역 억제 선천 세포 집단으로 간주됩니다.
독특한 특성을 가지고 있으며, 최근 LOX-1(렉틴형 산화 LDL 수용체-1)이 호중구와 구별되는 중요한 표지자로 특징지어지고 있다.
LOX-1의 과발현은 여러 암에서 발견되었으며 불량한 예후와 관련이 있습니다. LOX-1은 LDL 수용체로, MDSC에서 콜레스테롤 대사가 변경되었음을 시사합니다.
LXR 작용제 RGX-104는 MDSC를 고갈시키고 APOE의 상향 조절을 통해 T 세포 활성을 향상시킵니다.
LXR 활성화는 면역 관문 억제제 및 입양 T 세포 이식과 같은 면역 요법의 효능을 향상시킵니다
STAT3 또는 STAT5 억제 또는 CD36 결실은 지질 대사를 하향 조절하고 MDSC의 면역 억제 기능을 방지하는 것으로 알려져 있습니다.
'암치료' 카테고리의 다른 글
| 지질 대사 및 암 진행:전이성 암 치료에서 누락된 표적 (0) | 2022.10.01 |
|---|---|
| (Curcumin) 암 줄기 세포를 표적으로 하는 새로운 치료 전략으로서의 비정상적인 지질 대사 (0) | 2022.10.01 |
| 암의 지질 대사 변화: 예후 및 치료에 미치는 영향(허브 포함) (1) | 2022.09.30 |
| 암세포가 지질 대사를 리모델링하는 방법: 전사 인자를 표적으로 하는 전략 (0) | 2022.09.29 |
| 지질 대사와 암 (0) | 2022.09.28 |