2014
Lipid metabolism and cancer progression: The missing target in metastatic cancer treatment
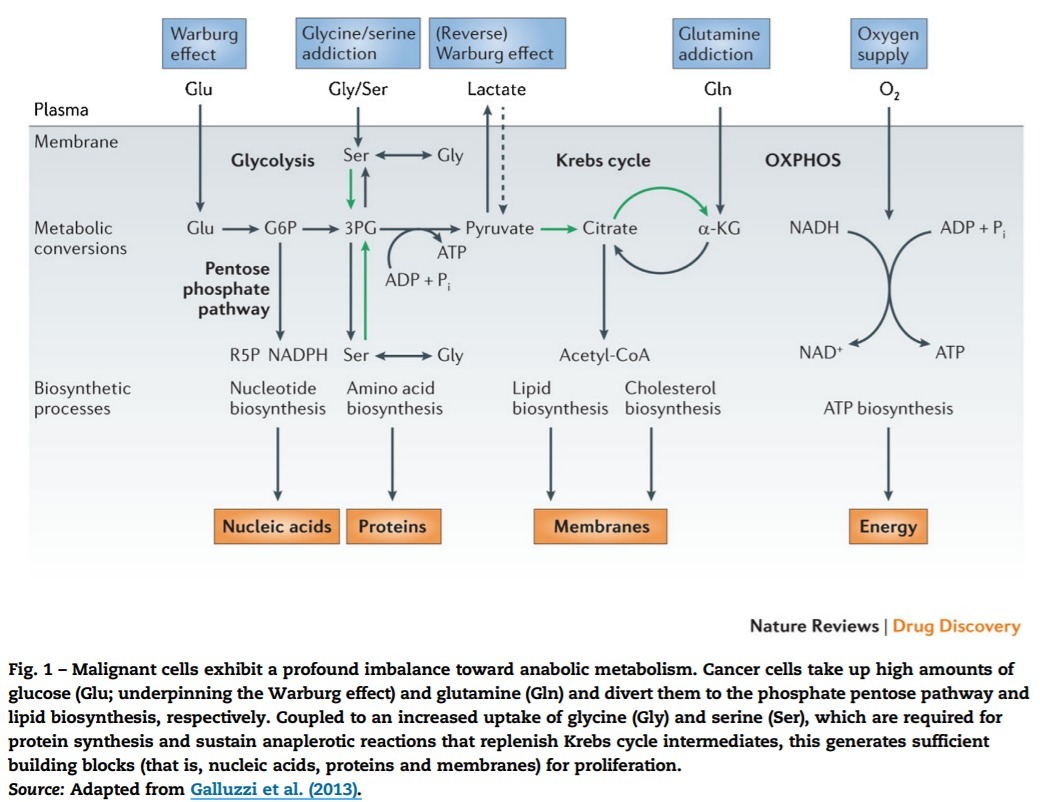
악성 세포는 동화 대사에 대한 심각한 불균형을 나타냅니다.
암세포는 많은 양의 포도당(Glu, Warburg 효과를 뒷받침함)과 글루타민(Gln)을 흡수하여 각각 인산 오탄당 경로와 지질 생합성으로 전환합니다.
단백질 합성에 필요한 글리신(Gly)과 세린(Ser)의 증가된 섭취와 결합하여 크렙스 회로 중간체를 보충하는 보충 작용 반응을 유지함으로써 증식을 위한 충분한 빌딩 블록(즉, 핵산, 단백질 및 막)을 생성합니다.
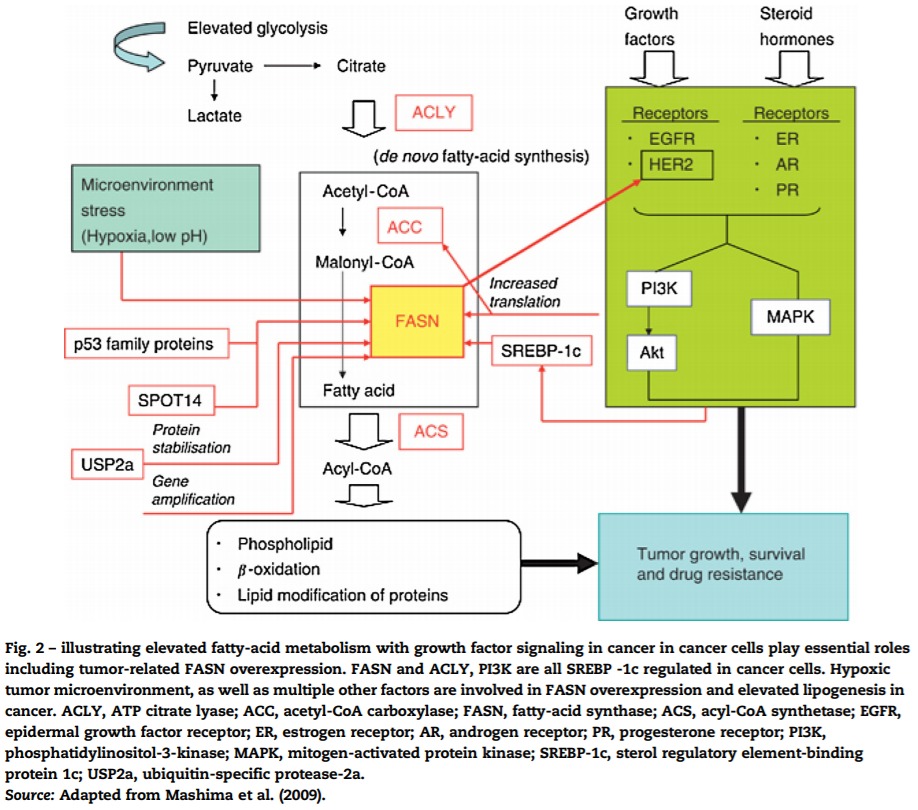
암 세포의 암에서 성장 인자 신호 전달과 함께 상승된 지방산 대사를 설명하는 것은 종양 관련 FASN 과발현을 포함하여 필수적인 역할을 합니다.
FASN 및 ACLY, PI3K는 모두 암세포에서 조절되는 SREBP-1c입니다.
저산소 종양 미세 환경 및 여러 다른 요인이 암에서 FASN 과발현 및 지방 생성 증가에 관여합니다.
ACLY, ATP 시트레이트 리아제; ACC, 아세틸-CoA 카르복실라제; FASN, 지방산 합성효소; ACS, 아실-CoA 합성효소; EGFR, 표피 성장 인자 수용체; ER, 에스트로겐 수용체; AR, 안드로겐 수용체; PR, 프로게스테론 수용체; PI3K, 포스파티딜이노시톨-3-키나제; MAPK, 미토겐 활성화 단백질 키나제; SREBP-1c, 스테롤 조절 요소 결합 단백질 1c; USP2a, 유비퀴틴 특이적 프로테아제-2a.
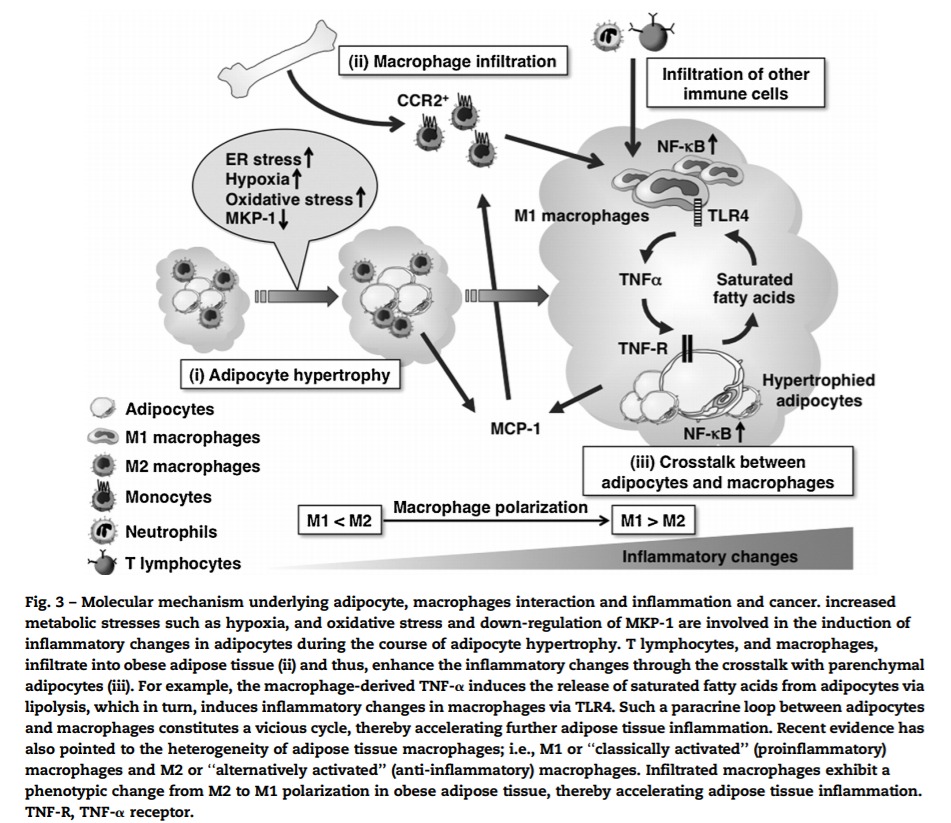
지방 세포, 대 식세포 상호 작용 및 염증 및 암의 기본 분자 메커니즘.
저산소증과 같은 대사 스트레스 증가, 산화 스트레스 및 MKP-1의 하향 조절은 지방 세포 비대 과정에서 지방 세포의 염증 변화 유도에 관여합니다.
T 림프구와 대식세포는 비만 지방조직에 침투하여
(ii), 실질 지방세포와의 누화를 통해 염증 변화를 증가시킨다
(iii). 예를 들어, 대식세포 유래 TNF-α는 지방분해를 통해 지방세포로부터 포화 지방산의 방출을 유도하고, 이는 차례로 TLR4를 통해 대식세포의 염증 변화를 유도합니다.
이와 같은 지방세포와 대식세포 사이의 측분비 루프는 악순환을 구성하여 추가적인 지방 조직 염증을 가속화시킨다.
최근의 증거는 또한 지방 조직 대식세포의 이질성을 지적했습니다. 즉, M1 또는 '고전적으로 활성화된''(전염증성) 대식세포 및 M2 또는 '대체로 활성화된'(항염증) 대식세포.
침윤된 대식세포는 비만 지방 조직에서 M2 극성화에서 M1 극성화로의 표현형 변화를 나타내어 지방 조직 염증을 가속화합니다.
TNF-R, TNF-α 수용체
'암치료' 카테고리의 다른 글
| (중복)암세포의 지질 대사 리모델링: 전사 인자를 표적으로 하는 전략 (0) | 2022.10.01 |
|---|---|
| 지질 대사를 표적으로 하는 천연 화합물의 치료 의미 (0) | 2022.10.01 |
| (Curcumin) 암 줄기 세포를 표적으로 하는 새로운 치료 전략으로서의 비정상적인 지질 대사 (0) | 2022.10.01 |
| 종양학에서의 지질 대사: 중요한 이유, 연구 방법 및 치료 방법 (0) | 2022.10.01 |
| 암의 지질 대사 변화: 예후 및 치료에 미치는 영향(허브 포함) (1) | 2022.09.30 |