2021
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-021-03122-8
Avenues of research in dietary interventions to target tumor metabolism in osteosarcoma - Journal of Translational Medicine
Osteosarcoma (OS) is the most frequent primary bone cancer, affecting mostly children and adolescents. Although much progress has been made throughout the years towards treating primary OS, the 5-year survival rate for metastatic OS has remained at only 20
translational-medicine.biomedcentral.com
Avenues of research in dietary interventions to target tumor metabolism in osteosarcoma
암세포의 신진대사를 표적으로 삼는 한 가지 방법은 식이 개입을 통한 것입니다.
그러나 일부 식이 요법은 전임상 연구에서 특정 종양 유형에 대한 항암 효과를 나타내었지만 아직까지 OS를 치료하는 것으로 테스트된 것은 없습니다.
종양 대사의 특징을 검토하고, OS 대사를 표적으로 하는 데 잠재적으로 효과적일 수 있는 전략에 대해 논의하면서 식이 중재 연구의 길을 제안합니다.
골육종 개요
일반적으로 CSC 표현형은 성장하는 종양을 둘러싼 기질인 종양 미세 환경(TME)에 의해 결정되는 변이와 함께 높은 정도의 가소성을 나타냅니다[ 27 , 39 ].
연구에 따르면 TME는 암 생존과 성장에 중요한 역할을 하며 암세포 자체만큼이나 이러한 과정에 중요합니다
TME는 산성 및 저산소성으로 특징지어지며, 이는 종양 성장 및 전파를 촉진하고 암세포의 대사 이상에 의해 형성됩니다.
종양의 성장과 전이를 촉진하는 종양과 종양의 TME 사이의 상호작용은 다량의 사이토카인과 성장 인자의 분비를 통해 TME-상주 세포, CSC 및 벌크 종양 세포 사이의 소통을 통해, 그리고 비암호화 RNA 및 기타 신호 분자를 포함하는 엑소좀을 통해 발생합니다.
이러한 모든 기능을 통해 암은 숙주 세포를 모집하고 면역 회피를 선호하는 표현형 변화로 "강제"하는 면역 억제 환경을 만들 수 있습니다.
종양 대사 및 골육종
정상 세포에서 에너지는 일반적으로 초기 분해(해당 분해)와 미토콘드리아 산화적 인산화(OXPHOS)에서 산물의 산화의 결합을 통해 포도당에서 얻습니다(그림 1 ).ㅏ).
반면에 대부분의 암세포는 이 두 경로를 분리하고 영양소와 산소 이용 가능성에 따라 대사 가소성을 나타냅니다.
암세포는 일반적으로 항산화제와 다량의 젖산염을 생성하면서 동화 상태를 위한 빌딩 블록 역할을 하는 중간 분자를 빠르게 얻는 선호하는 방법으로 호기성 해당 작용 을 사용 합니다 .
실제로 연구에 따르면 높은 세포 포도당 흡수는 (OS)을 포함한 여러 유형의 암에서 발생하며 많은 경우 종양 공격성과 관련이 있습니다
동시에, 이들 세포는 다른 영양소, 특히 아미노산(대부분 글루타민)으로 미토콘드리아의 트리카르복실산(TCA) 회로에 연료를 공급하고 이 경로의 중간체도 생합성을 위한 전구체를 제공합니다.
이것은 이들 세포가 ATP를 얻기 위한 수단으로 OXPHOS를 사용할 수 있도록 하며, 해당 과정에서 분리되어 높은 증식 속도를 유지합니다(그림 1B ) .
이러한 대사 가소성은 다양한 표현형의 일부로 CSC에서 특히 분명하며, 영양소 결핍, 저산소증 및 항종양 약물의 존재와 같은 스트레스에 적응하는 능력을 제공합니다
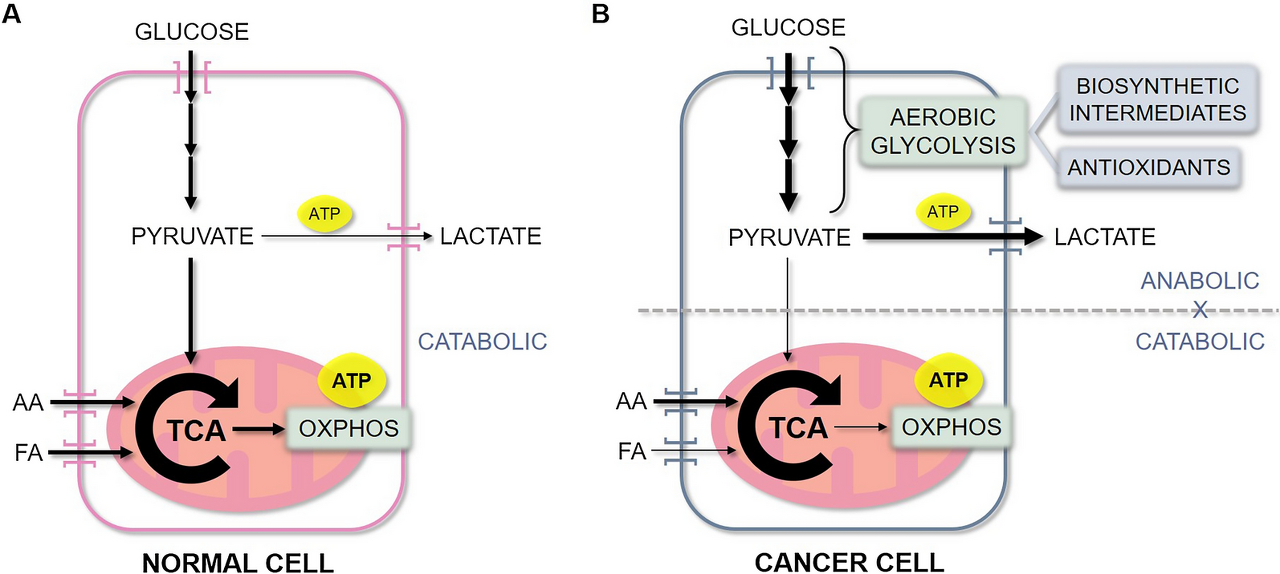
생합성 분자의 공급원인 동시에 항산화제와 다량의 젖산염을 생산합니다.
동시에, 이 세포는 아미노산과 지방산으로 TCA 회로에 연료를 공급하여 해당 세포가 해당 분해에서 분리된 상태에서 ATP의 대부분을 얻는 수단으로 OXPHOS를 사용할 수 있도록 합니다.
AA: 아미노산; FA: 지방산; TCA: 트리카르복실산 순환; OXPHOS: 산화적 인산화; ATP: 아데노신 삼인산
정상 세포 대 암세포의 에너지 대사.
A 정상 세포에서 ATP 형태의 에너지는 일반적으로 미토콘드리아 TCA 회로 및 OXPHOS에서 생성된 생성물의 산화와 초기 분해(글루코스 분자당 소량의 ATP-2 ATP 생성)의 결합을 통해 포도당으로부터 얻습니다. (대량의 ATP 생성 - 포도당 분자당 34ATP).
또는 TCA 회로와 OXPHOS에 연료를 공급하는 지방산과 아미노산에서 에너지를 얻을 수도 있습니다.
반면에 B 암세포는 이화작용 TCA 회로와 OXPHOS로부터 동화작용 해당 경로를 분리합니다.
그들은 호기성 해당 작용을 주요 방법으로 사용하여 포도당 섭취를 증가시킵니다.
OS를 포함한 암에서 일반적으로 변경되는 PI3K/Akt-mTOR 경로는 세포 포도당 흡수를 상향 조절하는 반면 발암 유전자 c-MYC 및 저산소증 유도 인자-1( HIF-1 )은 해당 효소를 상향 조절합니다.
증가된 수준의 인슐린 유사 성장 인자-1(IGF-1) 및 이의 수용체는 일반적으로 OS 및 기타 암에서 발생하며 또한 PI3K/Akt-mTOR 경로를 활성화하여 종양 성장을 촉진합니다.
일반적으로 암과 (OS)에서 발생하는 대사 재프로그래밍 은 숙주의 면역 반응에도 영향을 미치며, 이는 면역억제성 TME 생성에 중요한 역할을 합니다.
숙주의 이펙터 세포는 종양 세포와 유사한 대사 요구 사항을 가지고 있으므로 TME의 영양소, 특히 포도당 및 글루타민에 대해 이들과 경쟁합니다.
젖산에 의한 산증과 함께 영양소에 대한 이러한 경쟁은 TME를 TIL, TAM 및 MDSC에 유리하게 만들고 효과기 세포에 적합하지 않게 하여 면역 회피를 촉진합니다.
TIL 및 TAM은 항염증성 표현형을 가지며 인터루킨-10(Il-10), TGF-β, PD-1, 활성산소종(ROS) 및 아르기나제와 같은 면역억제 및 종양 침습을 촉진하는 인자를 분비하거나 유도합니다(그림 2 ).

암세포 대사는 TME에서 면역 억제를 유도합니다.
암세포는 영양소를 놓고 숙주의 이펙터 세포와 경쟁합니다.
조절되지 않는 대사는 포도당과 글루타민의 흡수를 증가시켜 이러한 영양소에서 효과기 세포를 고갈시켜 활성을 방해합니다.
또한 암세포는 많은 양의 젖산을 세포 외 공간으로 방출하여 산증을 유발합니다.
이것은 차례로 TME를 TIL, TAM 및 MDSC에 유리하게 만들고 효과기 세포에는 부적합하게 만듭니다.
TAM은 M2 항염증 표현형을 발현하도록 유도되어 Il-10 및 아르기나제를 분비합니다.
TIL은 또한 항염증성 표현형을 나타내어 Il-10 및 TGF-β를 분비하는 반면 MDSC는 Il-10, TGF-β 및 ROS를 분비합니다.
이러한 요인은 효과기 세포를 추가로 억제하여 면역 억제를 촉진합니다.
가장 많이 연구된 것은 2-deoxy-D-glucose, oleanolic acid 및 3-bromopyruvate와 같은 해당 경로에 관여하는 효소를 표적으로 하는 것입니다.
또 다른 중요한 그룹에는 수송 분자, 특히 포도당 및 글루타민 흡수, 젖산 수송에 관련된 억제제가 포함되며, c-MYC, mTOR 및 PI3K/Akt 억제제, AMPK 활성화제를 포함하여 종양 세포 대사를 조절하는 경로를 방해하는 약물도 연구되고 있습니다.
이종이식 OS 마우스 모델에서 글루타미나제 억제제를 메트포르민과 함께 사용했으며, 이 조합은 단독 치료 및 무치료 대조군보다 원발성 종양 성장 억제 및 전이 예방에 더 성공적이었습니다
암을 치료하기 위해 가장 많이 연구된 식단 기반 접근 방식은 칼로리 제한, 단식, 케톤 생성 식단, 그리고 식이 보조제의 사용입니다.
골육종을 표적으로 할 수 있는 식이 요법
칼로리 제한 다이어트
칼로리 제한(CR) 다이어트는 일반적으로 영양실조로 발전하지 않으면서 적절한 양의 비타민과 미네랄을 유지하면서 모든 다량영양소를 비례적으로 감소시키면서 정상 일일 권장 칼로리 섭취량을 약 30%까지 지속적으로 줄이는 것을 말합니다.
그러나 특히 체중 감소를 유발하고 암 환자가 악액질에 걸리기 쉬울 수 있다는 점을 고려하면 이 식단에 대한 환자의 내성에 대한 우려가 있습니다.
따라서 암 환자에서 이 식단을 활용하는 임상 연구에는 항상 신중한 영양 모니터링이 포함됩니다.
항종양 효과에 대한 주요 작용 기전은 IGF-1의 억제를 통한 것입니다.
그 결과 IGF-1/PI3K/Akt 신호전달 경로가 억제되어 세포자살을 유도하고 혈관신생, 세포주기 진행 및 전이를 감소시킨다
또한 AMP 활성 단백질 키나아제(AMPK)가 활성화되어 PI3K/Akt-mTOR 경로도 억제하고 결과적으로 동화 경로도 억제됩니다.
유방암에 대한 쥐 모델에서 CR은 종양 발달을 예방할 뿐만 아니라 암 진행을 예방하여 암 줄기세포에 대한 억제 효과를 입증했습니다.
또한 CR은 표준 화학 요법 및 방사선 요법의 보조제로 연구되어 치료 결과를 개선하는 능력을 보여줍니다.
단식 다이어트
단식은 특정 기간 동안 음식을 섭취하지 않고 물만 섭취하는 완전한 영양 결핍입니다.
그러나 임상적으로 가능한 금식에는 여러 버전이 있습니다.
가장 일반적인 것은 다양한 프로토콜로 수행할 수 있는 Fast-mimicking diet(FMD)입니다.
예를 들어, FMD은 음식에 대한 접근을 제한하는 주기를 통해 이어질 수 있습니다(매우 낮은 칼로리 섭취 – 일반적으로 하루 300-1100kcal – 예를 들어, 3개월 동안 한 달에 한 번 연속 5일).
또는 간헐적 단식(IF)을 통해 음식에 대한 제한 없는 접근 기간(예: 매일 16-18시간)으로 순환되는 완전한 영양 결핍의 특정 시간을 포함합니다.
항종양 요법으로 단식을 사용하는 근거는 암세포가 이용할 수 있는 포도당과 아미노산(AA)의 양을 제한하여 대사를 방해하기 위한 것입니다.
기계적으로, 공복 요법의 효과는 IGF-1이 감소되고 AMPK가 활성화되어 PI3K/Akt-mTOR 경로를 억제한다는 점에서 CR의 효과와 유사한 것으로 보입니다.
또한 포도당의 제한으로 인해 종양이 증식과 면역억제에 의존하는 호기성 해당작용도 억제됩니다
또한, AA 가용성의 제한은 일반적으로 세포 증식 및 생존을 위해 많은 양의 AA가 필요하다는 점을 감안할 때 암에도 영향을 미칩니다.
세포 내에서 비필수 AA를 합성할 수 있지만, 생산된 양이 세포 요구 사항에 충분하지 않기 때문에 여전히 필수 및 비필수 AA의 외인성 공급원이 필요합니다.
따라서 AA 대사를 방해하는 것은 금식의 또 다른 메커니즘입니다.
성상세포종(astrocytoma) 마우스 모델은 IF 프로토콜(24시간 격일로)을 받았고 대조군과 비교하여 유의하게 더 높은 생존율과 함께 유의하게 더 작은 종양을 나타냈다.
유사하게, 결장직장암 마우스 모델은 IF 요법을 받았고 상당히 느린 종양 성장을 보였습니다.
반면에 IF(24시간, 주 2회)는 전립선암 마우스 모델에서 항종양 효과를 나타내지 않았습니다.
결장직장암 마우스 모델도 FMD의 효과를 평가하는 데 사용되었으며, 2주 주기로 매주를 세 부분으로 나눴습니다.
1일째는 정상 칼로리 섭취량의 50%, 2-3일째는 정상 칼로리 섭취량의 10%입니다.
정상적인 음식 섭취로 4-7 일.
결과는 증식 억제와 유의하게 감소된 포도당 섭취와 함께 더 느린 진행을 다시 한 번 보여주었습니다.
또 다른 연구에서는 2주간의 2일 단식 요법이 대조군과 비교하여 마우스의 결장암 성장을 억제하는 동시에 세포가 해당 작용 기반 대사에서 산화적 인산화 기반 대사로 전환되었음을 입증했습니다.
이 같은 연구에서 병용 요법이 최상의 결과를 나타냄을 확인했습니다.
다른 연구에서도 다른 치료법과 함께 금식을 평가했습니다.
예를 들어, 폐암 마우스 모델에서 동물은 PD-1 면역 체크포인트 차단과 함께 48시간 단식 2주기와 24시간 단식 1주기를 거쳤습니다.
결과는 병용 치료가 치료되지 않은 대조군이나 식이 요법 또는 항-PD-1 단독 요법보다 더 효과적으로 종양 진행 및 전이를 억제하는 상승 효과가 있음을 나타냅니다.
중요하게도, 단기 금식(화학 요법 또는 방사선 요법 전후 48-60시간)은 동물 및 인간 연구에서 차등적 스트레스 저항을 유도하는 것으로 입증되었습니다.
이 메커니즘을 통해 정상 세포는 화학 요법이나 방사선 요법 또는 기타 독성 물질의 독성 효과에 대해 보호되고 느린 분열 상태를 얻는 반면 암세포는 여전히 취약합니다.
숙주 세포에 대한 이러한 낮은 독성에 기초하여, 많은 경우에 단식은 더 높고 따라서 더 효과적인 치료 용량을 사용할 수 있게 합니다.
케톤 생성 식단
케톤 생성 다이어트(KD)는 일반적으로 지방 대 단백질 및 탄수화물의 비율이 4:1인 고지방, 중간 단백질 및 저탄수화물 다이어트로 정의됩니다.
전신적으로, 낮은 포도당 농도는 인슐린을 억제하고 글루카곤 분비를 활성화하며, 신체는 케톤 생성 상태로 강제 전환되어 간 세포가 지방산을 산화시켜 케톤체, 즉 아세토아세테이트, β-히드록시부티레이트 및 아세톤을 생성합니다.
이들은 순환계에 들어가 TCA 회로에 들어간 후 다른 조직으로 분배되어 세포 대사의 연료 역할을 합니다.
이 식단은 처음에는 간질을 치료하기 위해 공식화되었으며 현재는 비만 치료에도 사용되고 있습니다 .
KD는 일반적으로 내약성이 우수하지만 혼수 및 메스꺼움과 같은 가벼운 부작용을 유발할 수 있습니다.
그러나 적절히 모니터링하면 쉽게 피할 수 있습니다.
KD로 인한 매우 적은 양의 포도당 섭취는 해당 경로를 사용하는 암세포를 포함한 세포의 능력을 차단합니다.
이것은 암의 증식을 위한 빌딩 블록의 주요 원천을 방해하여 증식률을 낮춥니다.
해당 경로의 제한은 또한 항산화제의 가장 중요한 공급원 중 하나에 영향을 미치며, 암세포가 많은 양의 ROS를 생성하여 잠재적으로 세포자멸사를 유발하기 때문에 더 높은 산화 스트레스를 유발합니다.
앞서 언급한 식이요법과 유사하게, KD는 IGF-1 수치를 감소시켜 AMPK의 활성화를 유도하여 PI3K/Akt-mTOR 경로를 억제할 수 있습니다.
포도당 섭취를 줄이는 것의 가능한 제한은 효과기 세포가 면역 반응을 시작하기 위해 포도당을 필요로 하기 때문에 숙주의 방어를 더욱 방해할 수 있다는 사실입니다.
그러나 효과기 세포는 낮은 양의 포도당에도 불구하고 여전히 면역 반응을 일으킬 수 있음이 입증되었습니다.
그 이유는 알려져 있지 않지만 이 세포는 포도당 대신 케톤체를 활용하고 대사 활동을 계속 유지할 수 있다고 가정했습니다.
혈액-뇌 장벽 때문에 뇌 조직은 지방산을 대사할 수 없습니다.
따라서 뇌는 포도당을 주요 에너지원으로 사용합니다.
포도당이 없을 때 뇌 세포는 케톤체를 대사할 수 있는 반면, 뇌종양은 케톤 대사에 결함이 있고 대부분 해당 대사에 의존하여 KD에 더 민감하게 만듭니다
KD로 치료한 종양은 대조군과 비교할 때 CD4+ T 세포 집단이 증가하고 조절 T 세포 집단이 감소한 반면 CD8+ T 세포에서 PD-1의 발현이 감소하여 면역 억제에 반대하는 것으로 나타났습니다
KD의 영향을 분석하는 연구는 거의 없었으며, 대부분이 타당성과 안전성을 결정하는 데 일차적인 초점을 두었습니다.
이 연구는 KD가 다양한 암 환자에게 전반적으로 안전하고 실현 가능하며 대부분의 경우 삶의 질을 향상시킨다고 결론지었습니다.
그러나 단독 치료로서 KD의 항종양 효과를 나타내는 것은 없었다
흥미로운 발견은 정상 식이 요법을 받은 환자와 비교하여 KD로 치료받은 환자의 두경부암에서 젖산 양이 유의하게 감소한 것으로, 이는 면역 억제에 대응할 수 있는 가능성을 확인할 수 있습니다.
식이 보조제: 케르세틴
사용 가능한 다양한 식이 보조제 중에서 퀘르세틴(전 세계적으로 주로 사용되며 과일, 야채, 차 및 와인에서 발견됨)은 어느 정도 잠재력을 보여주었습니다.
케르세틴은 항산화, 항에스트로겐 및 항증식 효과가 있는 생리활성 플라보노이드로, 치료 특성의 기초가 될 수 있습니다.
케르세틴 항암 특성의 정확한 기전은 명확하지 않지만 VEGF, 세포자멸사, PI3K/Akt/mTOR 및 Wnt/β-카테닌 신호 전달 경로의 조절을 통해 발생 하는 것으로 보입니다 . .
실제로, 케르세틴은 시험관 내 및 생체 내에서 OS에 대해 지속적으로 효과를 보여 왔습니다.
Lanet al. 는 케르세틴이 비히클 대조군과 비교할 때 HOS 및 MG-63 세포에서 HIF-1α, VEGF, MMP2 및 MMP9 발현의 하향 조절과 함께 세포 이동 및 침입을 약화시킨다는 것을 입증했습니다.
항암 효과를 얻기 위해 필요할 수 있는 정상 식이 섭취량보다 훨씬 높은 상당한 고용량을 고려할 때 안전성 고려 사항을 신중하게 평가해야 합니다.
결론 및 미래 전망
일반적으로 인간의 식단은 다른 항암 치료와 함께 사용할 때 더 효과적인 것으로 보입니다.
종양이 항암 요법에 내성을 갖는 이유 중 하나는 종양이 성장, 생존 및 전이를 촉진하는 다중 중복 경로를 나타내어 단일 표적 요법을 비효과적으로 만든다는 사실입니다.
'암치료' 카테고리의 다른 글
| 암 대사 및 식이 요법 (0) | 2022.10.07 |
|---|---|
| 암 대사에서의 식단과 운동 (0) | 2022.10.07 |
| 종양학에서의 영양 및 식이 중재 검토 (0) | 2022.10.07 |
| 식이와 암세포 대사의 분자적 연관성 (0) | 2022.10.07 |
| 암 대사 표적화: 식이 및 약리학적 개입 (0) | 2022.10.07 |