2020
https://www.sciencedirect.com/science/article/pii/S153561082030204X
Dietary Approaches to Cancer Therapy
The concept that dietary changes could improve the response to cancer therapy is extremely attractive to many patients, who are highly motivated to ta…
www.sciencedirect.com
Dietary Approaches to Cancer Therapy
암은 기원 조직, 미세 환경 및 유전 과 같은 요인의 영향을 받는 다양한 대사 요구 사항을 보여줍니다 .
따라서 식이 조절은 암과 치료 모두의 특정 특성과 일치해야 하며, 각 암의 대사 취약성을 결정하는 메커니즘에 대한 자세한 이해가 필요한 정밀한 접근 방식이 필요합니다.
건강 및 암 치료를 위한 식단
National Cancer Institute, Cancer Research UK, European Society for Clinical Nutrition and Metabolism(ESPEN)을 포함한 대부분의 국가 암 조직은 암 환자를 위한 건강한 식단과 적절한 영양소 섭취를 강조하는 식이 지침을 제공합니다.
일반적으로 이러한 권장 사항은 지방, 소금, 설탕 및 가공 식품을 제한하면서 신선한 과일 및 채소 및 통곡물 시리얼의 가치를 강조하는 일반 대중을 위해 개발된 권장 사항을 반영합니다.
암 환자는 칼로리 섭취를 유지하고 특히 고단백 식단을 채택하도록 권장됩니다
그러나 이러한 지침은 치료적 이점을 제공하기보다는 일반적인 건강을 강화하고 영양실조 및 대사 장애와 같은 치료 또는 종양의 부작용을 완화하기 위해 고안되었습니다.
기아와 칼로리 제한
접근 방식에는 체중 감소로 이어지는 경향이 있는 만성 칼로리 제한과 정상적인 식단을 재개할 수 있도록 하여 체중을 유지하고 순응도를 높이는 급성 간헐적 단식또는 단기 단식이 포함됩니다
단식의 효능을 뒷받침하는 기전은 IGF 결합 단백질 이 증가하면 순환 포도당, 인슐린 및 IGF-1의 감소와 같은 전신 반응을 포함한 일련의 반응을 반영할 가능성이 있습니다.
암 세포가 기아에 적응할 수 없으면 암 관련 취약성이 발생한다고 가정하는 차별적 스트레스 저항성 모델이 제안되었습니다.
단식이 암 환자에게 도움이 될 수 있는 메커니즘은 잘 문서화되어 있지만, 이 접근 방식에는 여전히 탐구해야 할 측면이 있습니다.
예를 들어, 칼로리 제한 mimetics와 그에 따른 자가포식 유도는 항종양 반응을 촉진할 수 있지만, 최근 연구에서는 숙주 자가포식이 순환하는 아르기닌을 공급하여 암 성장을 지원하는 데 중요한 역할을 한다는 것도 보여주었습니다.
그럼에도 불구하고 칼로리 제한이 암 치료를 향상시킬 수 있다는 좋은 증거가 있으며 간헐적 단식은 잘 견디는 접근 방식으로 나타났습니다.
그러나 이 검토의 나머지 부분에서 우리는 대체 치료 목표로 칼로리 제한 없이 선택적 영양소 제한의 보다 표적화된 접근을 고려합니다.
암 치료에 대한 정밀 영양 접근법
지방과 탄수화물의 균형 잡기
식이 탄수화물 과 설탕은 대부분 포도당과 과당으로 구성되며 최근 몇 년 동안 고과당 옥수수 시럽소비가 급격히 증가했습니다.
많은 암세포가 변경된 포도당 대사 를 보여 인접 정상 조직과 비교하여 종양에서 포도당 흡수가 높습니다( 그림 1 ).
포도당은 대부분의 세포에 중요한 에너지원이며 해당과정 은 많은 생합성 경로 에 기여합니다.
암세포에서 빠른 증식과 산화 환원 방어를 지원합니다.
과당은 포도당과 동일한 조절을 받지 않는 경로를 통해 대사되어, 조절되지 않은 해당과정과 지방산 합성 을 초래 합니다.
대조적으로, 특정 암에서 해당과정을 손상시키는 식이 만노스 보충은 종양 성장을 감소시켰습니다

그림 1 . 식이 탄수화물 이 종양 대사에 미치는 영향
많은 암이 증가된 포도당 섭취 와 해당과정 을 보여주며 , 이는 바이오매스 생성, 에너지 생산 및 항산화 방어를 지원하는 것으로 생각됩니다.
순환 과당이 증가하면 해당 과정이 촉진되고 암 발병이 악화될 수 있습니다.
단식, 케톤 생성 식이 또는 만노스 보충 을 포함한 다양한 식이 접근법을 통해 포도당 공급을 제한하고 해당 작용을 억제하면 암세포 성장을 제한할 수 있습니다.
단식 또는 케톤 생성식이 요법에 대한 반응 으로 순환 포도당 수준 의 제한은 또한 종양에 대한 인슐린 및 IGF-1의 가용성을 제한할 수 있습니다.
이 응답은 PI3K 의 활성화를 제한합니다.많은 암에서 과활성화되어 PI3K 억제제 에 대한 치료 반응을 향상시킵니다 .
케톤 생성 식단 은 또한 암에서 변경된 포도당 대사를 이용하기 위해 제안되었습니다( 그림 1 ).
이러한 고지방, 초저탄수화물 다이어트는 비만과 암 발병 증가를 초래하는 고지방, 고탄수화물 다이어트와 다르며 케톤 생성 다이어트는 암 진행 지연과 관련이 있습니다.
케톤 생성 식단의 저당 구성은 위에서 언급한 FMD와 유사하며, 이는 암 치료에 대한 공통적인 유익한 효과를 부분적으로 설명할 수 있습니다.
그러나 FMD와 달리 케톤 생성식이 요법은 칼로리 제한이나 낮은 단백질 섭취 가 필요하지 않습니다 .
케톤 생성 식단은 간에 의해 지방산의 베타 산화를 촉진하여 아세토아세테이트 , 베타-하이드록시부티레이트 및 아세톤 을 포함 하는 케톤체 를 생성 합니다.
케톤 은 혈류를 통해 조직으로 운반되고, 여기에서 아세틸-CoA로 전환되어 트리카르복실산 회로 에 연료를 공급합니다 .
케톤 생성 식이 요법에 대한 한 가지 반응은 순환 포도당 감소 및 순환 인슐린 및 IGF-1 수치 감소일 수 있으며, 이는 종양 에서 인슐린 수용체 다운스트림의 발암성 신호 전달 경로 의 비정상적인 활성화를 제한하는 데 도움이 될 수 있습니다(그림 1).
따라서 이러한 식이요법은 "인슐린 억제 식이요법"의 기능을 하며, 아래에서 논의되는 바와 같이 이것이 기능을 수행하는 중요한 메커니즘인 것으로 보입니다.
그러나 포도당 제한은 또한 세포가 미토콘드리아 대사 를 사용하도록 강제합니다 .
이 대사 스위치는 활성 산소종 (ROS)을 일부 고도로 해당되는 암세포에서 독성 수준으로 증가시킬 수 있습니다.
다른 종양은 케톤 생성식이 요법에 대한 반응으로 종양 산화 스트레스의 감소로 반응할 수 있다.
따라서 산화환원 스트레스 또한 일부 조건 하에서 케톤 생성 식단의 반응에 의할 수 있지만, 아미노산 대사 변화 또는 케톤체의 종양 유발 신호와 같은 케톤 생성 식단의 항종양 효과를 설명하는 다른 잠재적 메커니즘도 제안되었다.
케톤 생성식이 요법이 단독 요법으로 효과적이지는 않지만, 이 접근 방식의 전신 효과에 대한 더 명확한 이해는 케톤 생성식이 요법이 선택된 암의 특정 요법과 협력하고 환자를 선택할 수 있도록 하는 메커니즘 기반을 밝히기 시작했습니다.
케톤 생성 식단의 약속
기계론적 이해가 암 치료를 강화하기 위해 식이 요법을 사용하는 방법을 알려주는 훌륭한 예는 케토제닉 식이요법과 포스포이노시티드 3-키나아제(PI3K) 억제제의 조합입니다( 그림 1 ).
PI3K 캐스케이드는 암에서 가장 일반적으로 활성화되는 신호 전달 경로 중 하나이며 PI3K의 수많은 소분자 억제제가 개발되어 환자를 대상으로 테스트되었습니다.
그러나 이 경로의 중요성에 대한 명확한 증거에도 불구하고 이러한 약물은 단일 요법 시험에서 실망스러웠습니다.
PI3K 억제에 대한 임상 반응의 다양성은 저항 메커니즘의 유도를 시사하며, 여기서 PI3K 신호 전달은 정상적인 혈당을 유지하기 위해 간, 골격근, 지방 조직과 같은 인슐린 민감성 조직에서 인슐린의 작용을 매개하여 인슐린에 대한 반응에 핵심적인 역할을 한다는 것을 이해하는 것이 중요해진다.
따라서, Pan-class IP3K 억제제의 사용은 포도당 항상성을 변화시키고 인간에서 일시적인 고혈당을 유발하는 것으로 나타났으며, 이에 대한 반응은 인슐린 생산량을 증가시킨다
인슐린은 종양 증식의 강력한 조절자로 잘 알려져 있으며, Hopkins et al. (2018) 은 PI3K 억제제 치료에 의해 유도된 인슐린의 피드백 증가가 종양 세포에서 PI3K 신호전달을 재활성화하여 약물의 효과를 극복할 가능성을 조사했습니다.
실제로, 인슐린의 PI3K 억제제 유도 스파이크는 종양에서 PI3K 신호 전달을 회복시키는 것으로 나타났으며, 이는 억제제의 유익한 치료 효과를 분명히 무효화하는 반응입니다.
그러나 케톤 생성식이 요법을 한 쥐는 고혈당이 감소하고 인슐린 분비 가 감소했습니다.
PI3K 억제제를 사용한 후속 치료 후 종양에서 인슐린 수용체의 활성화를 감소시킵니다.
이 조합 요법은 다양한 PI3K 유발 종양이 있는 마우스의 생존율을 향상시켰으며 인간에서 이 접근법을 테스트하기 위한 임상 시험이 현재 진행 중입니다.
흥미롭게도 위에서 논의된 연구에서, 급성 골수성 백혈병 모델은 생쥐가 케톤 생성 식단으로 변경되었을 때 질병 진행 이 증가 하는 것으로 나타났으며, 다른 여러 설치류 모델에서는 케톤 생성 식단이 종양 성장을 가속화하는 것으로 다시 나타났습니다.
MEK-1에 대한 발암성 돌연변이 BRAF의 결합을 촉진하기 위해 순환하는 아세토아세테이트(케토제닉 식단에서 증가됨)의 능력 및 세포 성장을 촉진하거나 히스톤 아세틸화를 유발하는 β-하이드록시부티레이트(케톤체의 성분)의 차등 효과를 포함하여 다양한 기계론적 설명이 제안되었습니다.
추가 연구에 따르면 케톤 생성 식이 요법에 노출되는 시기도 반응에 영향을 미칠 수 있습니다.
아마도 당연하게도 초기 단계의 질병에서 또는 질병이 시작되기 전에 케톤 생성 식단을 사용하는 것이 인간과 쥐 모두에서 가장 효과적입니다.
암 치료에 대한 보조제로서 케톤 생성 식이의 효능을 평가하는 임상 시험은 제한적이며.
대규모 코호트, 표준화된 프로토콜 및 준수에 대한 명확한 표시를 사용한 강력한 연구가 관심을 가지고 기다리고 있습니다.
단백질 제한
케톤 생성식이 요법은 탄수화물 소비를 낮추면서 지방 섭취를 촉진하는 것을 목표로 하지만 저단백 식단도 암 발병을 제한하는 것으로 나타났습니다.
IGF-1 수준의 조절 및 PI3K/AKT/mTOR 신호전달의 제한을 포함하여 단백질 제한에 대한 다양한 반응이 이러한 관찰을 설명할 수 있습니다.
자가포식 활성화 및 순환 FGF21 유도감소된 단백질 섭취에 대한 반응으로 수치가 나타나기도 하지만 이것이 암 발병의 제한이나 촉진에 어떻게 기여할 수 있는지는 불분명합니다.
식이 단백질(탄수화물 아님)의 적당한 감소는 암세포에서 소포체 스트레스 의 활성화를 유도하여 항종양 T 세포 반응의 유도를 촉진하는 것으로 나타났습니다.
흥미롭게도 높은 수준의 동물성 단백질은 식물성 단백질보다 건강에 더 해로운 것으로 나타났으며, 이는 식단의 특정 아미노산 함량이 전체 단백질 수준보다 더 중요할 수 있음을 시사합니다.
아미노산 조절
단백질 생성 아미노산은 모든 단백질의 빌딩 블록이며 성장, 산화환원 조절, 단백질 및 핵산 변형에 필요한 거대분자 합성에도 핵심적인 역할을 합니다 .
필수 아미노산 (EAA)은 포유류 세포 에서 합성할 수 없으므로 정상 조직과 암 모두 외인성 공급에 의존합니다.
대조적으로, 비필수 아미노산 (NEAA)은 새로 합성될 수 있습니다 .,
그리고 대부분의 정상 세포는 이 아미노산 그룹의 식이 공급에 의존하지 않습니다.
암세포가 NEAA에 대한 수요 증가를 자주 보여주기 때문에 연구의 관심은 NEAA의 식이 조작에 집중되었으며, 이는 두 가지(반드시 배타적이지 않은) 방법 중 하나로 충족될 수 있습니다.
일부 암은 이러한 아미노산을 생산하는 능력을 증가시키고 성장과 생존을 위해 NEAA의 새로운 생산에 의존 하게 될 수 있습니다.
이 종양 그룹은 이러한 경로의 소분자 억제제에 대한 좋은 표적입니다.
대조적으로, 여러 가지 이유로 많은 암은 높은 흡수율과 NEAA의 외인성 공급에 대한 의존도를 보입니다.
본질적으로, 이러한 NEAA는 암세포(정상 세포는 아님)에 필수적이 되어 이러한 아미노산의 종양 이용 가능성을 제한할 수 있는 접근 방식에 대한 유익한 치료 창을 엽니다.
종양에 대한 이러한 아미노산의 가용성을 제한할 수 있는 접근법에 대해 설명합니다( 그림 2 ).
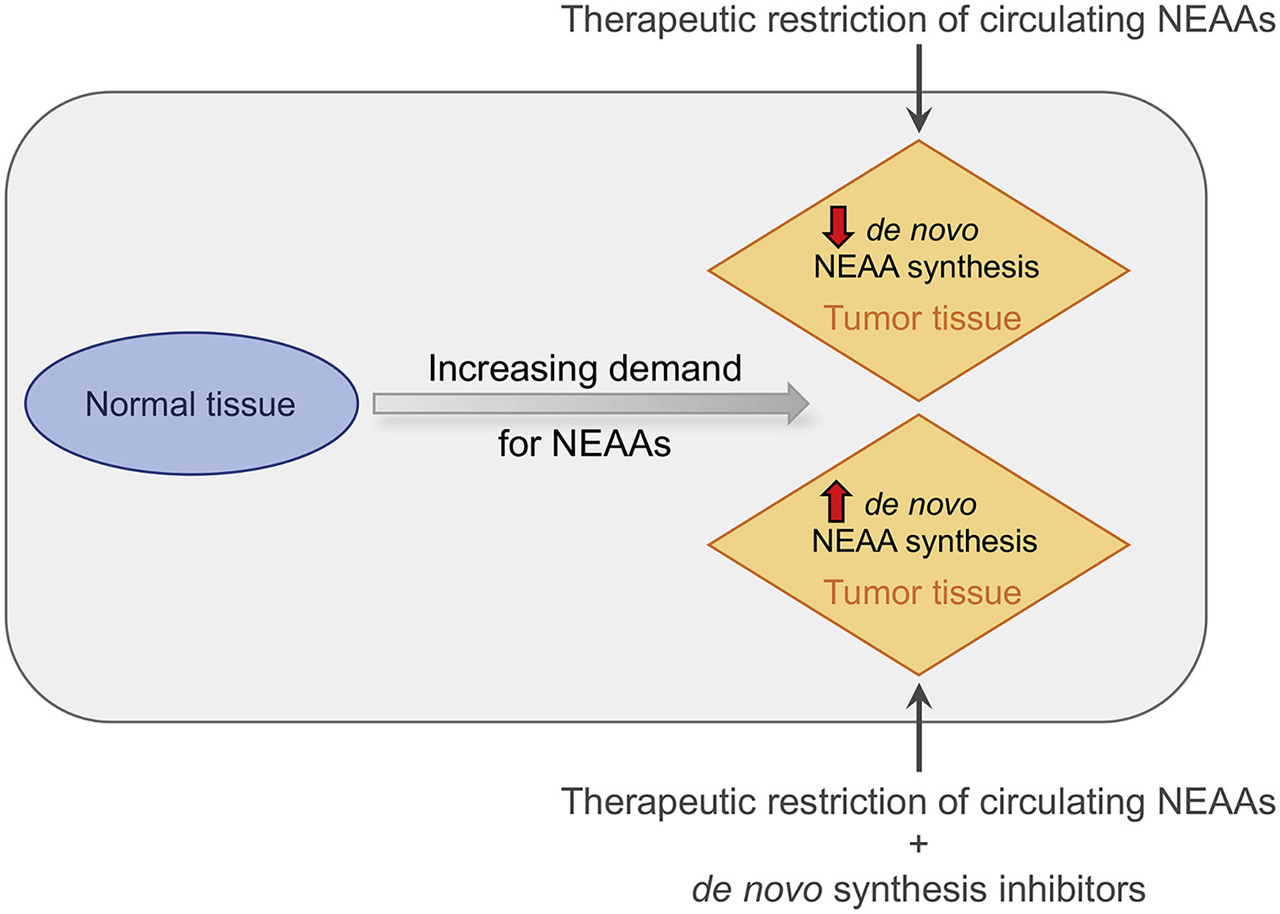
그림 2 . 암에 대한 비필수 아미노산 가용성을 제한하기 위한 치료 가능성
정상 조직과 비교할 때 암의 성장 및 증식 요구는 비필수 아미노산(NEAA)에 대한 요구량을 증가시킬 수 있습니다.
일부 암 관련 변화는 종양 세포가 새로운 합성 경로를 사용하는 능력을 방해하여 다른 NEAA의 외인성 공급에 더 의존하게 만들 수 있습니다.
이는 de novo 합성 경로의 고유 결함(예: ASNS 또는 ASS1 발현 의 손실이 아스파라긴 또는 아르기닌 영양요구성으로 이어짐) 또는 de novo NEAA 합성 경로에 의한 플럭스를 제한할 수 있는 NAD + /NADH 비율의 파괴로 인한 것일 수 있습니다.
결과적으로 식이 제한이나 아미노산 분해 효소 치료와 같이 순환하는 NEAA 수준을 제한하기 위한 치료적 접근은 정상 세포보다 암세포 에 더 독성이 있습니다.
반대로, 일부 발암성 변화는 합성 경로 효소(예: 세린 합성 을 유도하는 PHGDH)의 상향 조절을 통해 NEAA를 만드는 종양 세포의 능력을 증가시킬 수 있습니다 .
이러한 암에서 효과적인 치료 반응을 위해서는 순환 NEAA의 제한과 새로운 합성 경로 효소의 약리학적 억제제의 조합이 필요할 수 있습니다 .
이 시점에서 암이 순환하는 영양소에 어떻게 접근하는지 고려할 가치가 있습니다.
종양 혈관구조 가 정상 조직에 혈액을 공급하는 것과는 다르고 일반적으로 덜 효과적이라는 것은 잘 알려져 있습니다.
실제로 최근 연구에서는 순환계와 종양 환경 사이의 영양소 수준의 차이, 국소 영양소 이용 가능성을 결정하는 데 종양 유형 및 위치의 중요성을 강조했습니다.
그러나 중요한 것은 이 연구에서 순환하는 영양소 수준을 변경하는 것 외에도 식이요법이 종양 미세 환경에 존재하는 대사 산물 수준에 중대한 영향을 미칠 수 있음을 보여주었습니다.
흥미롭게도, 순환 및 종양 간질액의 영양 수준의 식이 유발 변화는 유사한 방향으로 경향이 있었으며, 이는 혈청 대사 산물의 평가가 종양 간질액의 반응에 대한 대용물이 될 수 있음을 시사합니다
특정 아미노산의 순환 이용 가능성의 선택적 제한은 분해를 위해 아미노산을 표적으로 하는 효소를 사용하거나 식단에서 아미노산을 제거함으로써 달성할 수 있습니다.
중요하게, 이러한 식단은 총 아미노산 섭취량을 유지하면서 아미노산 풀의 구성만 변경하는 것을 목표로 하여 위에서 논의한 저단백 식단과 구별됩니다.
그러한 식단을 제공하려면 단백질 섭취를 엄격히 통제하고 제한되지 않은 아미노산 칵테일을 보충해야 합니다.
이 접근법은 페닐알라닌 대사의 결함으로 이어지는 선천적 대사 오류인 페닐케톤뇨증을 가진 어린이의 치료에 성공적으로 사용되었습니다
그러나 이러한 증상은 페닐알라닌이 부족한(또는 매우 낮은) 식단으로 치료하면 완전히 구제될 수 있습니다.
그러나 다른 아미노산의 제한은 잘 견디지 못할 수 있으며 암 치료는 다른 표적 또는 기존 치료 요법과 조화를 이루는 단기간의 식이 중재만 필요할 것으로 예상됩니다.
필수 아미노산
메티오닌 제한
메티오닌 은 메틸 공여체 S-아데노실메티오닌(SAM)의 전구체로서 중추적인 역할을 하는 EAA입니다.
SAM 주기를 통해 메티오닌은 메틸화 반응, 폴리아민 생성, 시스테인과 글루타티온 합성에 기여합니다 ( 그림 3 ).
세포는 주로 식단에서 메티오닌을 얻지만 , 각각 1탄소 및 폴리아민 경로와 교차하는 반응인 호모시스테인 또는 메틸티오아데노신으로부터 메티오닌을 재생성할 수도 있습니다.
중요하게도, 정상 세포는 호모시스테인이 공급되면 메티오닌 없이 성장할 수 있지만 암세포는 일반적으로 이러한 조건에서 생존할 수 없습니다.
대안적으로, 암에서 PI3K의 활성화는 시스틴 수송체 xCT 를 하향 조절하여 시스테인을 합성하기 위한 환류 경로 를 통해 호모시스테인의 우선적인 채널링을 유도하여 메티오닌 생성에 대한 가용성을 감소시킬 수 있습니다.

그림 3 . 치료 개입의 잠재적 포인트를 보여주는 SAM 과 엽산 주기 의 교차점
세린은 글리신으로 대사되어 테트라히드로 폴레이트 (THF)가 엽산 회로에 들어가도록 허용하는 탄소 1개 단위(C 1 )를 제공하므로 B 12 의존 반응 에서 퓨린 및 피리미딘 합성 또는 호모시스테인 으로부터 메티오닌 재생을 지원합니다 . .
SAM 주기를 통해 메티오닌은 메틸화 반응, 폴리아민 생성 및 황화 전이 경로 를 통한 시스테인 및 글루타티온 합성에 기여합니다..
빨간색으로 강조 표시된 이러한 주기 중 하나에 영향을 미치는 식이 조절은 암에 대한 치료적 접근 방식으로 가능성을 보여주었습니다.
게다가, 산화환원 항상성 과 핵산 생산 에 대한 SAM 및 엽산 주기의 기여는 식이 중재와 화학 요법 또는 방사선 요법 사이의 잠재적인 시너지 효과를 나타냅니다.
SAM, S-adenosylmethionine; SAH, S-adenosylhomocysteine.
낮은 메티오닌 식단은 침습과 전이 를 제한하는 것으로 나타났습니다
메티오닌 제한 식단은 일반적으로 잘 견딥니다.
이 영양학적 중재는 메티오닌 영양요구성이 잘 정의된 암 환자에게 특히 권장됩니다.
그러나 주의 사항으로 일부 설치류 모델에서 식이 메티오닌 제한(특히 콜린 고갈과 결합 시)은 비알코올성 지방간염 에서 나타나는 것과 유사한 간 손상을 촉진할 수 있습니다.
분지쇄 아미노산
3가지 분지쇄 아미노산(BCAA), 류신 , 이소류신 및 발린 의 순환 수준이 높으면 비만 및 인슐린 저항성과 관련이 있으며 췌장암 발병 초기에 발생합니다.
이러한 EAA의 식이 제한은 고지방/고당으로 처리 된 비만 마우스 에서 인슐린 저항성 발병을 방해하므로 암 발병을 제한하는 데 도움이 될 수 있습니다.
그러나 식이 BCAA 보충은 간암 발병을 제한하는 것으로 나타났으며, 이 분야에 대한 추가 연구의 요구 사항을 강조합니다.
비필수 아미노산
아스파라긴 및 글루타민 제한
최근 연구에서는 아스파라긴이 암 증식을 촉진할 수 있는 과정을 조절하는 방법을 보여주었습니다.
아미노산 교환 인자로 작용하는 아스파라긴은 다른 아미노산(예: 세린 , 아르기닌, 히스티딘)의 흡수를 촉진할 수 있습니다.
이 메커니즘을 통해 아스파라긴은 mTORC1 활성과 세린 흡수를 모두 조절할 수 있으므로 단백질과 뉴클레오티드 합성을 조정하는 데 도움이 됩니다.
아스파라긴의 중요한 역할은 또한 암 세포가 암 발병에서 종종 고갈되는 아미노산인 글루타민에 굶주릴 때 설명되었습니다.
글루타민 기아가 암세포에서 세포자멸사를 유도할 수 있지만, 이는 아스파라긴 보충에 의해 효율적으로 예방되며, 이는 아스파라긴이 대사 스트레스 하에서 종양에서 항세포자멸사 역할을 할 수 있음을 시사합니다.
이 관찰은 아스파라긴 이 외인성 글루타민이 없을 때 세포 증식 을 구제한다는 연구에 의해 더욱 뒷받침되었습니다 .
이러한 조건에서 세포는 새로운 글루타민 합성 능력을 갖지만 아스파라긴은 단백질 합성 을 위한 EAA가 됩니다..
아스파라긴 은 또한 상피에서 중간엽으로 의 전환을 유도하여 유방암 세포의 전이를 촉진하는 것으로 나타났습니다 .
따라서 아스파라긴 가용성을 조절하는 것은 여러 단계에서 암 진행을 억제하는 역할을 할 수 있습니다.
유방암의 마우스 모델에서 L-아스파라기나제 치료 또는 아스파라긴의 식이 제한은 원발성 종양 성장에 영향을 미치지 않으면서 혈청 아스파라긴 수준을 감소시키고 전이 부담을 감소시켰습니다.
종양은 대체 대사 경로를 동원하여 글루타민 대사의 억제에 적응하는 것으로 나타났습니다.
이는 글루타민의 식이 제한의 효능을 제한하지만 추가 치료 표적을 제공할 수도 있습니다.
아르기닌 제한
건강한 성인에서 NEAA 아르기닌은 요소 회로 효소 에 의해 내인적으로 합성될 수 있습니다 Argininosuccinate synthase (ASS1)는 citrulline 과 aspartate의 arginosuccinate로의 전환을 촉매하고, 이는 나중에 argininosuccinate lyase 에 의해 arginine과 fumarate 로 전환됩니다 .
아르기닌은 단백질 합성에 필요하며 산화질소 생산 및 뉴클레오타이드 합성 , 폴리아민, 크레아틴 , 프롤린 , 글루타메이트 또는 요소 와 같은 다른 대사 경로에도 참여 합니다.
아르기닌은 또한 mTORC1 활성을 자극하여 단백질 번역 을 촉진할 수 있습니다.
아르기닌의 이러한 중요한 역할에도 불구하고 일부 간세포 암종, 흑색종 및 중피종 을 포함한 여러 암 유형은 ASS1 발현의 손실을 보입니다.
아르기닌 합성 경로의 이러한 결함은 RNA 및 DNA 합성 을 지원하기 위해 세포질 아스파르테이트를 피리미딘 생산에 사용할 수 있게 함으로써 종양 세포에 유리합니다.
이 리모델링은 DNA 합성과 종양 세포 복제를 지원하는 데 도움이 될 수 있지만 최근에는 신생항원의 생성을 유도하여 잠재적으로 이러한 종양을 면역 관문 차단에 더 취약하게 만드는 것으로 나타났습니다
중요한 것은 이 대사 결함이 있는 종양 세포가 치료에 악용될 수 있는 취약성인 외인성 아르기닌 공급에 의존하게 된다는 것입니다.
아르기닌 고갈로 이익을 얻을 가능성이 있는 환자를 식별하는 것은 아르기닌을 만드는 종양 세포의 능력에 대한 정확한 평가에 달려 있습니다.
ASS1 발현의 손실은 민감한 종양에 대한 좋은 바이오마커이지만, 다른 발암성 변경도 반응할 종양을 정의할 수 있습니다.
예를 들어, MYC에 의해 유발되는 소세포 폐암(MYCL과 반대)은 아르기닌 경로에 의존하고 아르기닌 고갈 요법에 매우 민감합니다.
마지막으로, 푸마르산 수화효소 결핍 종양이 아르기닌 고갈에 민감할 수 있는데, 이는 아르기니노숙시네이트를 생성하는 아르기니노숙시네이트 분해효소의 역활성에 의해 아르기닌과 함께 사용되는 푸마르산의 축적을 반영하여 푸마르산 수화 효소 결핍 세포가 아르기닌에 대해 영양요구성이 되게 하는 것입니다.
순환하는 아르기닌 수치를 고갈시키기 위해 다양한 아르기닌 분해제가 개발되었으며, 가장 임상적으로 발전된 것은 아르기닌을 시트룰린과 암모니아로 분해 하는 미생물 효소 인 PEG화 아르기닌 데이 미나제(ADI-PEG20) 와 PEG화 재조합 인간 아르기나제 1 입니다.
다양한 마우스 종양 모델에 대한 여러 연구에서 아르기닌이 고갈된 식단이 종양 발달에 미치는 효과가 나타났습니다.
마지막으로, 간 자가포식의 손실이 순환하는 아르기닌의 감소와 ASS1 결핍 종양의 성장 억제로 이어진다는 연구에서 아르기닌 제한에 대한 흥미로운 접근 방식이 최근 확인되었습니다.
대조적으로, 아르기닌 보충은 면역 반응에 영향을 미침으로써 일부 상황에서 종양 형성을 억제할 수도 있습니다.
이러한 관찰은 식이 요법이 종양 세포에 영향을 미칠 뿐만 아니라 암에 영향을 미치는 숙주 기능에도 영향을 미칠 가능성이 있다는 중요한 고려 사항을 강조합니다.
Cyst(e)ine 제한
시스테인은 환류 경로를 통해 내생적으로 만들어지거나 여러 수송체를 통해 시스테인 또는 시스틴(산화된 형태)으로 수입될 수 있습니다( 그림 3 ).
L-시스테인은 시스테인, 글루타메이트 및 글리신으로 구성된 세포 내 주요 항산화제인 글루타티온 생성에 중요한 역할을 합니다.
암세포는 대사 및 신호 이상으로 인해 정상 세포에 비해 증가된 산화 스트레스를 경험하며 글루타티온 수준을 유지하는 것은 생존과 증식에 중요합니다.
따라서 종양 세포는 생존을 위해 세포외 시스틴에 의존하게 될 수 있습니다.
최근 관심은 시스틴(세포 내부에서 시스테인으로 환원됨)과 글루타메이트의 교환을 매개하는 시스틴/글루타메이트 항포터 xCT에 집중되었습니다.
xCT의 억제는 시스틴 흡수의 결함과 항산화 방어의 상실을 초래하여 ROS 및 철 의존적 형태의 세포 사멸을 촉진하여 페로프토 시스( ferroptosis )라고 합니다 .
시스틴 흡수 억제는 수많은 전임상 모델에서 종양 성장을 제한하는 데 효과적인 것으로 입증되었습니다.
흥미롭게도 증가된 세포 외 시스틴 수치와 항산화 방어를 위한 글루타티온 합성 증가는 세포 외 글루타민에 대한 요구 사항을 증가시켜 잠재적으로 또 다른 표적 가능한 의존성을 생성할 수 있습니다
L-시스테인과 L-시스틴을 분해하는 효소인 L-시스테인(e)inase의 사용은 순환하는 시스테인을 고갈시키고 암 성장을 억제하는 유망한 전략으로 떠올랐습니다.
이 치료가 정상 조혈 줄기 또는 전구 세포에 대한 감지 가능한 효과 없이 백혈병 줄기 세포의 선택적 박멸을 유도할 수 있다는 증거가 있습니다.
L-Cyst(e)inase 치료는 내약성이 높고 산화 스트레스가 높은 종양에서 특히 효과적이거나 산화 스트레스를 유도하는 것으로 알려진 기존의 화학요법제와 상승 작용을 일으킬 가능성이 높습니다( 그림 3 ).
시스틴과 시스테인의 식이 고갈은 인간의 혈장 시스틴 수치를 낮춥니다.
메티오닌과 시스틴의 식이 제한은 누드 마우스 에서 신경교종 세포 의 성장을 억제합니다 .
이 접근법은 가능성을 보여주지만, 최근에 내인성 황화경로 활성이 암세포의 시스테인 풀에 기여할 수 있어 세포외 시스테인 농도가 낮아질 때 세포 생존을 촉진할 수 있음이 밝혀졌습니다.
이 활성은 메틸화 반응을 통해 SAM을 S-아데노실호모시스테인으로 전환하는 암세포의 능력에 따라 달라집니다( 그림 3 ).
따라서, 전이 효소를 발현하고 메틸화 반응을 수행하는 암세포의 고유 능력은 시스테인 저하 요법의 효능을 조절할 수 있습니다.
세린 제한
세린은 여러 대사 경로에서 중요한 역할을 하며 엽산 주기에 대한 핵심 탄소 1개 제공자이므로 뉴클레오티드 합성, 메틸화 반응 및 항산화 방어에 기여합니다( Yang and Vousden, 2016 )( 그림 3 ).
세린은 세린 합성 경로(SSP)를 구성하는 일련의 세 가지 반응을 통해 포도당으로부터 세포에 의해 합성될 수 있습니다. 일부 종양은 SSP의 증폭을 보여 성장과 생존을 위해 SSP에 의존하는 반면, 다른 암세포는 외인성 세린의 이용 가능성에 의존합니다( 그림 4).
마우스에서 세린과 글리신의 식이 제한은 순환하는 세린 수준을 낮추고 여러 모델에서 종양 성장을 제한하는 것으로 나타났습니다.

그림 4 . 세린 합성 경로의 조절 및 치료 기회
세린은 뉴클레오타이드 및 지질 합성, 메틸화 반응 및 글루타티온 합성 을 통한 항산화 방어를 포함한 수많은 대사 경로에서 중요한 역할을 합니다 .
암세포 는 세린 합성 경로(SSP)의 3단계를 통해 외인성 세린을 흡수하거나 새로운 세린을 합성할 수 있습니다.
세린과 글리신의 식이 제한은 환경적 세린 가용성을 제한하고 종양 성장을 제한할 수 있습니다.
그러나 이 치료 효과는 SSP 효소의 증폭 또는 조절 해제 또는 다양한 발암성 변경(녹색 상자)에 대한 반응으로 SSP의 보상적 상향 조절에 의해 제한됩니다.
새로운 세린 합성으로 의 전환 은 산화 스트레스 증가를 동반합니다.
증가된 ROS 에 대해 세포를 더 취약하게 만듭니다 .
p53의 손실은 SSP 효소 발현 을 촉진할 수 있지만, p53 의 항산화 기능은 세린 기아에 대한 반응으로 새로운 세린 합성으로의 전환을 지원하는 데 도움이 됩니다 .
SSP의 첫 번째 단계인 PHGDH를 억제하는 약물 또는 ROS를 촉진하는 중재(예: p53 손실 또는 화학요법)는 세린/글리신 고갈 식이의 효능을 증가시킬 수 있습니다.
3-PG, 3-phosphoglycerate; 3-PHP, 3-phosphohydroxypyruvate; 3-PS, 3-phosphoserine; PHGDH, phosphoglycerate dehydrogenase; PSAT1, phosphoserine aminotransferase 1; PSPH, phosphoserine phosphatase.
종양 세포가 세린에 접근하는 방법에 대한 이해가 높아짐에 따라 식이 세린 제한이 얼마나 효과적인지 합리적으로 예측할 수 있습니다( 그림 4 ).
강화된 세린 생성 능력을 획득한 종양은 외인성 세린의 한계에 덜 민감할 수 있고 동시에 이 경로에서 효소의 소분자 억제제에 더 민감할 수 있습니다.
이러한 새로운 세린 합성 능력의 증가 는 SSP 효소 자체의 증폭 또는 KRAS, NRF2, MDM2 또는 MYCN의 활성화를 유도하는 것과 같은 발암성 드라이버 돌연변이에 대한 반응을 반영할 수 있습니다.
중요하게도, SSP의 첫 번째 효소인 PHGDH의 증가된 발현은 세린 이용 가능성이 낮을 때 종양 성장을 지원할 수 있습니다.
또한 기원 조직이 세린 고갈에 대한 종양의 민감도에 영향을 미친다는 것이 분명하며, 제한된 세린 가용성을 가진 조직에서 발생하는 종양이 세린 드 노보 합성 능력을 증가시키는 변화를 획득할 가능성이 더 높다는 증거가 있습니다 .
그러나 새로운 세린 합성 으로 전환하는 세포의 능력에는 한계가 있습니다 .
세린 합성(다른 많은 생합성 반응과 함께)은 NAD + 를 소모하고 전자 전달 사슬 활성(NAD+를 재생 함 ) 또는 NAD + 회수 경로의 억제는 세포가 자체적으로 세린을 만드는 능력을 방해합니다.
실제로, 비구 아나이드 펜포르민 (복합체 I 억제제)은 종양 발달을 제한하는 데 세린이 고갈된 식단과 협력하는 것으로 나타났습니다
세린이 없는 식단은 백혈병 모델에서 글루타미나제 억제제 치료와 협력하는 것으로 나타났습니다.
암에서 매우 흔한 유전적 변화 중 하나 는 종양 억제인자 p53의 야생형 기능 상실이며, 이는 세린 기아에 대한 반응에 여러 영향을 미칩니다( 그림 4 ).
p53은 PHGDH 전사를 부정적으로 조절 하여 세린 기아 상태에서 야생형 p53을 발현하는 흑색종 세포 의 사멸에 기여합니다.
그러나 p53은 또한 세포가 포도당, 글루타민 및 세린 기아를 포함한 다양한 형태의 영양 스트레스에 적응하도록 도울 수 있습니다.
이 활동은 부분적으로 SSP로 전환하는 동안 필요한 항산화 방어를 지원하는 p53의 능력을 반영합니다.
외인성 세린 제한에 대한 반응 동안 ROS 조절의 중요성은 종양 발달을 제한하는 데 세린이 없는 식단과 TIGAR (항산화 방어 유전자) 의 유전적 결실 간의 협력에 의해 강조됩니다( Maddocks et al., 2017 ). .
보다 일반적으로, 세린 결핍 식단은 현재 사용되는 많은 화학 요법과 마찬가지로 산화 스트레스를 유발하는 약물과 협력할 것으로 예측됩니다.
더욱이, 세린이 없는 식단과 SSP 억제제를 결합하는 것도 종양 세포에 상당한 영향을 미칠 것이지만, 이러한 세린 대사의 전체적인 차단은 수용할 수 없는 부작용을 수반할 수 있습니다.
기타 개입
비타민
일부 비타민의 적절한 제한은 암이 의존하는 대사 경로를 방해하는 데 사용될 수도 있습니다.
예를 들어, 비타민 B 12 (코발라민) 또는 B 9 (엽산)를 제한하면 1탄소 대사와 퓨린 및 티미딜산 합성 능력이 제한됩니다 ( 그림 3 ).
코발라민 결핍은 또한 메티오닌 재활용에 결함을 일으켜 암세포가 메티오닌 기아 전략에 더 민감하게 만들 수 있습니다( 그림 3 ).
비타민 E와 C는 주로 항산화 기능에 기반하여 암 발병을 예방할 수 있는 식이 보충제로 오랫동안 선전되어 왔습니다.
그러나 암세포가 증가된 산화 스트레스에 어떻게 선택적으로 취약할 수 있는지에 대한 우리의 증가하는 기계론적 이해는 항산화제가 완전히 발달된 질병이 있는 환자에게 역효과를 낼 수 있음을 시사하고 비타민 E 보충의 임상 시험이 건강한 사람에서 전립선암 발병 위험이 증가한 이유를 설명합니다 .
반면에 비타민 C를 보충하면 전임상 시험에서 고무적인 결과를 얻을 수 있습니다.
그러나 흥미롭게도 고용량 비타민 C의 항암 효과는 산화된 형태의 비타민 C 흡수에 의존하여 암세포의 ROS를 증가시키는 것으로 생각됩니다.
비타민 C 기능의 대체 메커니즘에는 TET 단백질과 같은 후성 유전적 조절인자의 향상된 활성과 HIF1 활성의 억제가 포함됩니다( Ngo et al., 2019 ).
식이보충제
일부 조건에서는 다른 영양소의 순환 수준을 높이는 것도 도움이 될 수 있습니다.
예를 들어, 히스티딘을 이용한 식이 보충제 는 히스티딘 분해 경로를 향상시켜 엽산 풀 중간체의 가용성을 고갈시킵니다.
마우스 모델에서 이 반응은 테트라히드로폴레이트 생성을 억제하는 메토트렉세이트 치료에 암을 더 민감하게 만들었습니다.
대조적으로, 초파리 모델에서 히스티딘의 식이 고갈은 MYC 의존성 신경 종양의 성장을 선택적으로 제한했습니다.
이러한 식이 개입에 대한 반응에서 맥락의 중요성을 강조합니다.
위에서 언급한 바와 같이 만노스의 식이 보충제는 해당과정을 방해함으로써 종양 성장을 제한할 수 있는 반면, 글리신 보충은 잠재적으로 혈관신생 을 억제함으로써 다양한 암 모델에서 종양 성장을 지연시킵니다 .
흥미롭게도, 세린이 없을 때 과도한 글리신 은 시험관 내에서 암세포의 성장을 억제하는 것으로 나타났습니다 .
이 경우 글리신에서 세린이 합성되면 탄소 1개 풀이 고갈됩니다.
임상 연구에 따르면 증가된 식이 글리신은 내약성이 우수하고 순환 글리신 수준을 증가시킬 수 있어 이 접근법의 가능성을 강조합니다.
효능과 메커니즘이 아직 결정되지 않았지만 다양한 기타 식이 보조제가 임상 시험에서 테스트되고 있습니다( Vernieri et al., 2018 ).
암과 식이 중재에 대한 숙주의 반응
국소 종양-숙주 상호작용
종양 미세 환경과 국소 영양소 가용성(종양이 위치한 조직에 따라 다름)이 종양 발달 및 치료 반응에 중대한 영향을 미친다는 것은 잘 알려져 있습니다.
다른 조직에서 대사 산물 가용성의 본질적인 차이는 다양한 방식으로 식이 요법의 효과에 영향을 미칠 것입니다.
영양이 풍부한 기관에서 식이 제한만으로는 종양 성장에 영향을 미칠 만큼 중요한 대사 물질을 충분히 감소시킬 수 없습니다.
반면에 영양이 부족한 장기나 부위에서 발생한 종양에는 식이 제한이 더 효과적일 수 있습니다.
암의 영양 요구를 충족시키기 위해 암은 세포내 이입 , 엔토 시스 , 미세 음세포작용 또는 엑소좀 의 흡수를 통해 간질액, 간질 세포 또는 세포외 기질에서 단백질, 펩티드 및 지질을 제거하는 것으로 나타났습니다 .
암 또는 주변 기질 세포에서 자가포식을 유도하는 것도 암 발병에 필요한 영양소를 유지하는 데 도움이 됩니다.
또한 종양 세포는 주변 기질 세포의 행동을 능동적으로 조작하여 암세포 자체의 성장과 생존을 지원하도록 자극합니다( 그림 5 ).
이는 암 대사의 영향 하에 기질 세포가 상처 치유와 유사한 반응으로 유도되어 종양 세포 성장을 지원한다는 관찰에 반영될 수 있습니다.
섬유아세포 또는 지방 세포와 같은 기질 세포 는 종양에 다양한 영양소를 제공할 수 있습니다
예를 들어, 골수 중간엽 세포에 의한 아스파라긴 생산 또는 지방 세포에 의한 글루타민 분비는 둘 다 아스파라긴 고갈로부터 암세포를 보호할 수 있습니다.
종양 미세 환경의 암모니아는 유방암 세포에서 아스파르테이트 및 프롤린과 같은 아미노산을 합성하는 데 사용할 수 있습니다
기질 세포는 또한 시스테인을 만성 림프구성 백혈병 세포 에 제공하여 글루타티온 생산과 항산화 방어를 지원하여 암세포가 ROS 유도 요법에 더 저항하도록 만듭니다.
흥미롭게도, 기질 세포의 이러한 지지 활동은 암세포 자체에 의해 유발될 수 있습니다.
예를 들어, 백혈병 세포에 의한 IGFBP7 생산은 골수 기질 세포에 의한 아스파라긴 생산 증가를 유발할 수 있습니다..
유사하게, 난소암 세포는 암 관련 섬유아세포에 의한 글루타민 생산을 향상시켜 자신의 글루타민 수요를 충족시킬 수 있는 반면, 췌장암 세포는 췌장 성상 세포 에서 자가포식 및 알라닌 분비 를 자극할 수 있습니다 .
종합하면, 영양 제한에 대한 식이 접근법의 성공은 종양 세포가 주변 기질 로부터 제한 영양소를 얼마나 잘 동원할 수 있는지에 달려 있다는 것이 분명해 보입니다 ( 그림 5 ).
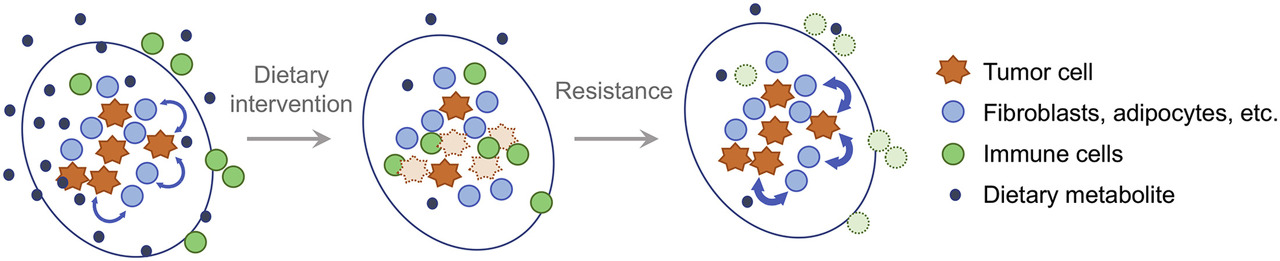
5 . 식이 요법에 대한 반응으로 종양과 기질 세포 간의 대사 상호 작용
암은 섬유아세포, 지방세포 및 면역 세포 를 포함하는 종양 및 기질 세포의 혼합물로 구성됩니다 .
이러한 서로 다른 세포 사이에는 복잡한 상호 작용이 있습니다.
예를 들어, 종양 세포는 면역 반응에 영향을 미치고 간질 세포가 암을 지원하는 영양소를 제공하도록 유도할 수 있습니다.
순환 대사 산물은 이러한 각 세포 집단과 서로 상호 작용하는 능력에 영향을 줄 수 있습니다.
식이 요법은 순환하는 영양소의 가용성을 제한하고 암의 성장을 제한하여 간질과의 상호 작용에 영향을 미치고 잠재적으로 항종양 면역 반응의 재활성화를 허용할 수 있습니다.
그러나 식이 조작은 또한 면역 세포에서 필수 영양소를 박탈하여 종양에 반응하는 능력을 약화시킬 수 있을 뿐만 아니라 영양소에 접근하기 위한 대체 메커니즘을 제공하는 기질 구획의 다른 구성 요소에서 경로를 활성화할 수 있습니다.
숙주 면역 시스템에 미치는 영향
암의 대사는 주변 정상 조직의 대사와 구별되는 경우가 많지만 T 세포 확장, 조직 복구 또는 줄기 세포 유지 동안의 급속한 증식과 같은 일부 정상적인 생리학적 상황에서 채택된 대사의 버전을 나타낼 가능성이 높습니다.
따라서 우리는 전신 영양소 이용 가능성의 조작을 통해 종양 대사를 표적으로 하도록 설계된 식이 중재가 일부 정상 조직의 행동에도 영향을 미치며 그러한 접근의 결과에 잠재적으로 중요한 결과를 초래할 것이라는 점을 고려해야 합니다.
이러한 교란 효과는 암 진행의 조절에 중요한 역할을 하는 면역계에 의해 잘 설명됩니다.
실제로, 가장 효과적인 새로운 치료법 중 일부는 항종양 면역 세포 기능을 회복함으로써 기능합니다.
영양 상태와 면역 항상성 사이에는 명확한 연관성이 있습니다 .
암 성장을 제한하도록 설계된 식이 요법의 부수적 영향 가능성을 높입니다.
예를 들어, 강화된 만노스 소비는 마우스에서 조절 T 세포의 비율을 증가시켜 암 면역 반응의 효능에 상당한 영향을 미칠 수 있습니다.
케톤 생성식이 요법은 설치류와 인간에서 렙틴 아디포카 인의 순환 수준을 증가 또는 감소시킬 수 있으며 , 대부분의 인간 연구에서 전반적인 비만에 대한 식단의 영향을 반영할 수 있는 렙틴 수준의 감소를 보여줍니다
중요하게도, 렙틴은 복합적인 방식으로 선천 면역과 후천 면역을 모두 조절하는 면역 체계의 다용도 조절자로 설명되었습니다.
항종양 면역의 맥락에서 렙틴의 잠재적인 중요성은 최근 연구에 의해 강조되었다.
렙틴은 종양을 가진 생쥐에서 T 세포 소진을 촉진하고 CD8+ T 세포 이펙터 기능을 하향 조절하여 항종양 면역 반응을 저해할 수 있다
분명히, 케톤 생성 식단, 렙틴 및 항종양 면역 반응 사이의 누화는 암에서 케톤 생성 식단의 치료 가능성을 평가하는 것을 목표로 하는 향후 연구에서 더 많은 관심을 기울일 가치가 있습니다.
췌장암 모델의 종양 간질액에서 고갈된 여러 아미노산(예: 아르기닌, 트립토판 및 시스틴)은 효과적인 면역 반응과 다양한 순환 아미노산 감소에 필요합니다.
이러한 관찰은 식이 개입을 통한 이러한 아미노산의 추가 제한이 항암 면역을 억제하는 해로운 영향을 미칠 가능성을 시사합니다(그림 5 ).
아르기닌 제한이 일부 암세포의 성장에 미치는 영향에도 불구하고, 페길화된 형태의 아르기나제 1을 사용한 아르기닌 고갈은 생체 내에서 T 세포 증식을 억제하는 반면, 아르기닌의 식이 보충은 선천적 및 적응적 면역 반응을 강화함으로써 종양 발생 억제와 관련이 있다..
유사하게, 순환하는 세린 수치의 식이 유도 감소는 T 세포 확장과 병원체 제거 능력을 현저히 낮추는 것으로 나타났으며, 세포외 알라닌은 T 세포 활성화 및 기억 T 세포 재자극에 필요합니다.
이러한 연구는 아르기닌이나 세린과 같은 영양소의 식이 제한이 항암 면역 반응을 감소시키고 종양 치료를 위한 그러한 식단의 사용을 방해할 수 있다는 우려를 제기합니다.
그러나 세린/글리신이 없는 식단의 항종양 효능은 면역 능력이 있는 마우스와 암의 전임상 모델로 자주 사용되는 T 세포 결핍 마우스에서 입증되었습니다.
식이 중재는 또한 항종양 면역 반응을 개선하기 위해 맞춤화될 수 있습니다.
우리는 앞서 종양에 대한 T 세포 반응 개선에 대한 저단백 식이의 잠재적 효과에 대해 언급했습니다.
유사하게, 케톤 생성식이 요법은 종양 반응성 면역 반응을 증가시키기 위해 제안되었으며, 단백질 또는 구체적으로 메티오닌 및 시스틴 제한은 종양 관련 대식세포를 재프로그래밍하여 암 사멸 능력을 향상시킬 수 있습니다.
면역 세포와 암세포 사이의 또 다른 흥미로운 상호 작용에서, 암 면역 요법 에 의해 활성화된 CD8 + T 세포종양 세포에서 xCT 시스템의 소단위의 발현을 하향 조절하여 시스틴을 흡수하는 능력을 감소시킬 수 있습니다.
그 결과 면역요법(PD-L1 차단)은 cyst(e)inase 치료와 상승작용을 일으켜 종양 성장을 억제하는 것으로 나타났습니다
악액질
암 환자의 식이요법을 고려할 때 환자의 전반적인 상태를 고려해야 합니다.
악액질 은 특히 질병의 진행 단계에서 많은 암 환자에게 영향을 미치는 다인성 증후군이며 골격근 및 지방 손실로 인한 상당한 체중 감소와 관련이 있습니다.
악액질에서 나타나는 근육 소모 는 단백질 합성(감소)과 분해(증가) 간의 불균형과 관련이 있습니다.
아미노산 및 관련 대사 산물의 혼합물(근육 단백질 합성을 자극하기 위해)의 경구 보충은 진행성 암 환자의 악액질을 부분적으로 역전시키는 것으로 나타났습니다.
유사하게, 류신이 풍부한 식단은 암 환자의 근육 단백질 합성을 자극할 수 있는 것으로 나타났습니다.
BCCA 보충은 또한 환자의 체질량을 증가시키고 수행 상태를 개선할 수 있으며 암 악액질에서 단백질 대사 를 촉진하는 것으로 제안되었습니다 - 일부 암에서 종양 성장을 제한하기 위해 BCAA 보충의 가능성을 고려하는 흥미로운 관찰.
근육량 유지는 암 환자의 삶의 질과 결과를 개선하는 데 중요한 것으로 보이며, 이는 암 환자에게 고단백 식단을 채택할 것을 권장합니다.
따라서 암 치료를 위한 전신 아미노산 제한 전략에 대한 주의 사항은 이러한 접근 방식이 악액질 동안 근육량 손실을 악화시킬 수 있다는 가능성입니다
이러한 우려는 암 환자의 적절한 질소 균형 유지와 근육량 보존을 보장하기 위해 단백질 섭취의 총 수준과 아미노산 풀(특히 류신과 BCAA)의 조성을 신중하게 고려함으로써 완화될 수 있다..
아르기닌 결핍은 근육에서 아르기닌과 글루타민을 동원하여 악액질에 기여할 수 있지만, 마우스에서 ADI-PEG 20 처리를 통한 아르기닌 고갈은 체중, 체성분 또는 근육의 부분 단백질 합성 속도에 영향을 미치지 않았습니다.
유사하게, 메티오닌 제한 식이요법을 하는 암 환자는 영구적인 체중 감소를 겪지 않았습니다.
흥미롭게도, 췌장암 마우스 모델의 악액질은 케톤 생성식이 요법에 대한 반응으로 개선되었으며, 잠재적으로 종양 세포의 대사에 대한 케톤체의 영향에 대한 반응으로 나타났습니다.
분명히, 이러한 모든 식이 접근법은 환자의 악액질 매개변수에 미치는 영향에 대해 신중한 평가가 필요합니다.
미생물군집
암 치료를 위한 식이 변화를 포함하는 접근 방식은 장내 미생물 다양성 에 대한 잠재적 영향을 고려해야 하며 , 이는 암 발병 및 진행에 영향을 미치는 것으로 나타났습니다.
식이 변화는 미생물군 의 구성과 다양성에 영향을 미칠 수 있으므로 잠재적으로 암 치료에 대한 반응을 조절할 수 있습니다.
장내 미생물 총이 암 발병에 미치는 영향은 적어도 부분적으로는 면역 체계에 영향을 미치는 능력과 관련이 있으며, 여러 연구에 따르면 미생물총을 조작하면 면역 요법에 대한 반응에 강한 영향을 미칠 수 있습니다
식단의 장기 및 단기 변화는 모두 장내 미생물군집 구성에 강한 영향을 미칠 수 있습니다.
예를 들어, 고지방/저섬유질과 저지방/고섬유질 식단 사이의 2주 전환은 암 위험에 영향을 미치는 것으로 알려진 미생물군의 상호 변화를 초래했습니다.
흥미롭게도, 케톤 생성식이에 의해 유도 된 장내 미생물의 변화는 암 모델에서 면역 체크 포인트 차단에 대한 반응을 회복시킬 수있는 박테리아 인 Akkermansia muciniphila의 상대적 풍부도의 증가와 관련이있다.
특정 아미노산의 식이 조절은 또한 장내 미생물을 변경합니다.
예를 들어, 식이 메티오닌/시스틴 섭취 감소에 따른 장내 세균의 변화는 이 식이 요법에서 볼 수 있는 항종양 면역 반응의 증가를 뒷받침하는 것으로 제안되었습니다.
마찬가지로, 식이 아르기닌의 증가는 대장염의 실험 모델에서 손상 감소와 상관관계가 있는 미생물 함량 변화를 초래한다
이러한 관찰은 특정 식단이 미생물군유전체를 조절하여 암 치료에 영향을 미칠 가능성을 강조합니다.
미생물군은 영양소를 소비하고 순환 가용성에 영향을 미칩니다.
그러므로 미생물 반응이 식이 개입의 효과를 제한할 수도 있습니다.
그러나 미생물군은 또한 아미노산(필수 및 비필수 모두) 및 단쇄 지방산과 같은 영양소를 합성하고 이를 숙주에 제공할 수 있으며, 따라서 잠재적으로 식단에서 아미노산 활용의 감소를 피할 수 있다..
흥미롭게도 비만 환자의 미생물총 전달은 마우스에서 BCAA의 순환 수준을 증가시키는 것으로 나타났습니다
그러나 위에서 논의한 여러 연구의 관찰 결과 식이 아미노산 조작이 순환 아미노산 수준을 변경할 수 있으며 그러한 보상 메커니즘이 이러한 접근 방식을 좌절시카지 않을 것임을 시사합니다.
결론
식이 요법과 약리학적 요법 사이의 치료적 시너지 효과를 예측하는 모델의 개발에서 상당한 진전이 이루어졌지만( 그림 6 ), 기존 요법과 표적 요법을 지원하기 위한 식이 조절의 최선의 사용에 대해 많은 질문이 남아 있습니다.
외인성 영양소 수준이 암세포 성장에 미치는 영향에 대한 우리의 이해는 암세포가 생체 내에서 마주치는 환경을 반영하지 않는 세포 배양 배지의 광범위한 사용으로 인해 어느 정도 방해를 받았습니다.
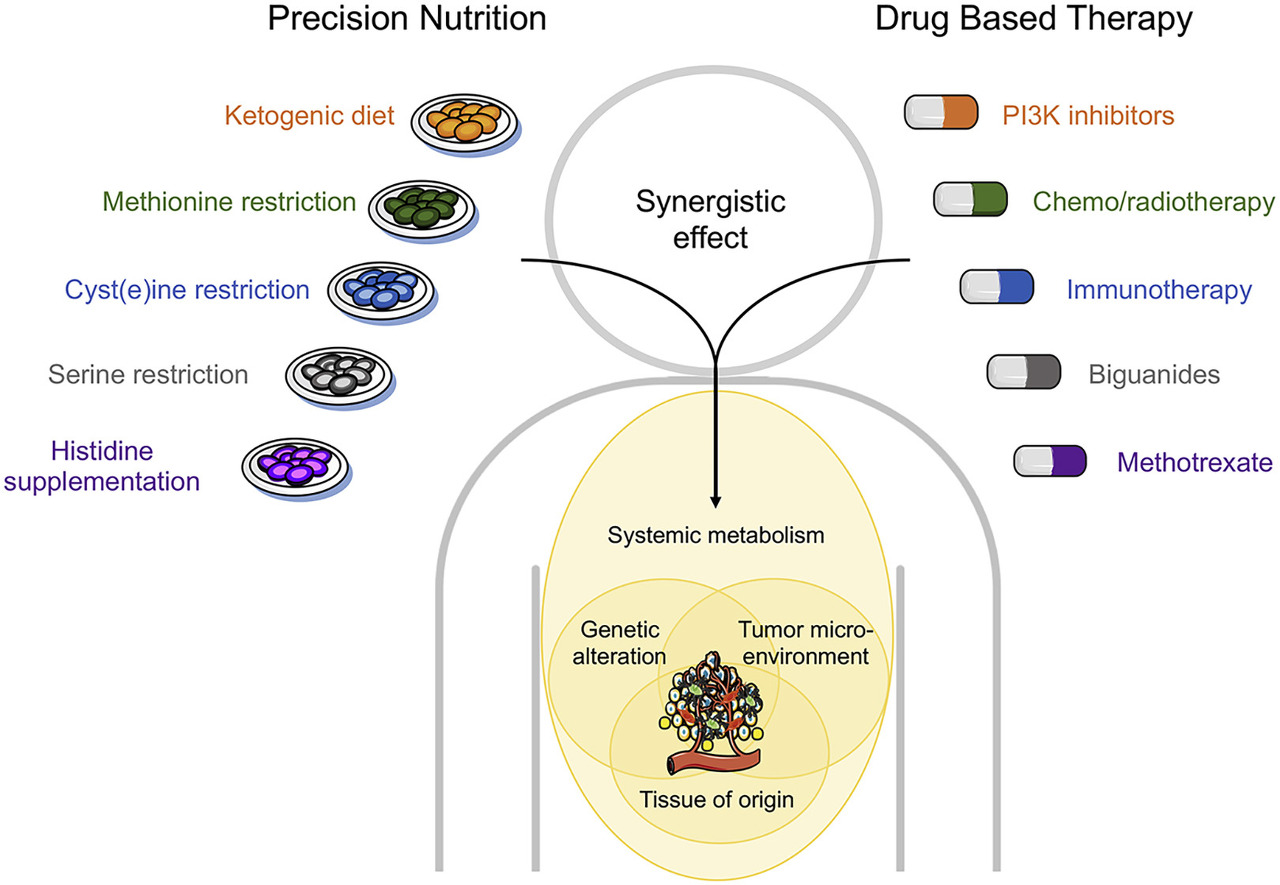
그림 6 . 식이 요법과 약물 기반 요법의 합리적인 조합
특정 식이요법(왼쪽)을 포함하는 정밀 영양은 다양한 암의 대사 취약성에 대한 이해를 기반으로 하는 소분자 치료제(오른쪽)와 일치할 수 있어 암 치료에 대한 맞춤형 접근 방식이 가능합니다.
이러한 접근법의 치료 효능은 유전학, 기원 조직 및 암의 환경과 숙주의 전신 반응에 의해 결정됩니다.
모든 치료법과 마찬가지로 식이 영양소 고갈에 대한 내성이 발생하지만 종양 세포에서(예를 들어, 새로운 합성 증가를 유도하기 위해) 또는 전신적으로(예를 들어 제한 영양소의 대체 공급원을 제공하기 위해) 대사 재배선이 필요 합니다 . —목표로 삼을 수 있는 취약점을 추가로 유발할 수 있는 변경 사항.
많은 암세포 유형에 광범위하게 영향을 미칠 수 있는 기존의 화학 요법과 식이 요법을 결합하면 치료 내성의 위험을 줄이는 데 도움이 될 수 있습니다.
또 다른 중요한 고려 사항은식이 요법이 종양 자체에 국한되지 않고 일반적으로 면역 체계 및 전신 항상성과 같은 다른 기질 플레이어에도 영향을 미치는 전신 반응으로 이어질 것이라는 점입니다.
따라서 기능적 항종양 면역 반응을 유지하고 악액질의 발병을 피하는 것을 목표로 하는 식이 제한의 효과에 대한 전체적인 관점을 취해야 합니다.
암 치료를 위한 식이 조절은 단기적일 가능성이 있으며 다른 치료 요법과 조정될 수 있음을 명심하는 것이 중요합니다.
제한된 식이요법에 소요되는 시간을 제한하면 원치 않는 부수적 영향을 줄이고 환자의 순응도를 높일 수 있습니다.
중요한 것은 종양 발달을 억제하는 금식 주기 또는 FMD 주기의 효능이 이미 확립되어 있다는 것입니다(Brandhorst et al., 2015 , Lee et al., 2012 ),
'암치료' 카테고리의 다른 글
| 암 다이어트: 암 치료 중 추가 및 피해야 할 음식 (0) | 2022.10.07 |
|---|---|
| 암 치료를 위한 식이 요법 (0) | 2022.10.07 |
| 암 치료제로서의 식이요법 (0) | 2022.10.07 |
| 설탕 외에: 암세포가 자라기 위해 필요한 것 (0) | 2022.10.07 |
| 암 치료를 위한 아미노산의 식이 제한 (0) | 2022.10.07 |