2021
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8392841/
Understanding the Therapeutic Potential of Ascorbic Acid in the Battle to Overcome Cancer
Cancer, a fatal disease, is also one of the main causes of death worldwide. Despite various developments to prevent and treat cancer, the side effects of anticancer drugs remain a major concern. Ascorbic acid is an essential vitamin required by our bodies
www.ncbi.nlm.nih.gov
Understanding the Therapeutic Potential of Ascorbic Acid in the Battle to Overcome Cancer
몸은 아스코르빈산을 합성할 수 없지만 식품 및 기타 천연 공급원을 통해 자연에 풍부하며 영양 식품 보조제로도 존재합니다.
항암제 개발에서 아스코르빈산은 활성산소종(ROS) 소거, 선택적으로 ROS를 생성, 종양 세포에 대한 세포독성 촉진, 포도당 대사 방지, 후성유전학적 작용 조절기, 및 종양 세포에서 HIF의 발현 조절등 다양한 기전을 통해 암의 진행을 억제하는 중요한 역할을 하고 있습니다. .
인간은 포도당과 갈락토오스로부터 아스코르빈산을 생성하는 데 필요한 글루코노락톤 산화효소가 없기 때문에 체내에서 아스코르빈산을 생성할 수 없습니다.
따라서 인간은 생리적 필요를 충족시키기 위해 다양한 공급원에서 식단을 통해 아스코르브산을 섭취하는 것이 필수적입니다.
아스코르브산의 공급원.
1.1. 천연 소스
아스코르브산은 비타민 C로도 알려져 있으며 감귤류, 딸기, 토마토, 브로콜리, 방울양배추, 피망, 고추, 순무 및 기타 잎이 많은 채소에서 널리 발견됩니다,
소량은 생선과 우유에서도 발견되었습니다,
1.2. 식이 보충제
복용량과 투여 경로에 따라 아스코르브산은 항산화 또는 항암 활성을 나타냅니다.
낮은 농도에서는 항산화제, 높은 약리학적 농도에서는 산화촉진제로 작용합니다.
아스코르브산은 산소, 질소, 황의 불안정한 자유 라디칼을 감소시키고 또 다른 항산화제인 토코페롤(비타민 E)의 활성을 향상시켜 항산화제의 역할을 합니다.
따라서 아스코르브산은 자유 라디칼에 의해 유도된 산화로부터 DNA, 아미노산 잔기 및 지질을 보호하고 무결성을 유지하여 유해한 돌연변이로부터 보호합니다.
약리학적 농도에서 아스코르빈산은 유기금속 반응을 통해 암세포에서 H2O2를 생성하고 암세포 에 선택적 세포 독성을 유발합니다..
암 사망의 약 90%는 전이에 기인합니다.
전이에서 암 세포는 혈액과 림프관을 통해 원발성 종양 부위에서 주변 조직 및 먼 장기로 퍼집니다.
암은 원발성 종양 부위를 넘어 퍼진 후 매우 치명적이고 치료가 불가능합니다.
시험관 내 연구에서 고농도의 아스코르브산이 세포 이동 및 모세관과 같은 관 형성을 억제하는 것으로 관찰되었습니다/
따라서, 아스코르브산은 종양 세포의 추가 성장 및 확산을 방지하는 데 유용할 수 있습니다.
또한, 아스코르빈산은 항산화제로서 활성산소로부터 우리 몸을 보호하고 산화촉진제로서 암세포를 손상시킬 뿐만 아니라 콜라겐 형성, 상처 치유, 신체 조직 복구, 뼈, 연골 및 치아의 양육에 관여합니다..
또한, 아스코르브산은 정상 세포에 대해 덜 독성이 있습니다.
저렴하고 쉽게 구할 수 있습니다.
따라서 항암제 개발에 이상적인 약제가 될 수 있다.
2. 대사
생리학적으로 아스코르브산은 L-아스코르빈산과 L-데히드로아스코르빈산 형태로 존재한다.
나중에 오탄당 인산 경로를 통해 주요 대사에 들어갑니다. .
L-데히드로아스코르브산은 복잡한 화학적 특성으로 인해 신체 생리학 및 질병 병리학에 기여할 수 있는 여러 가지 생성물을 생성할 수 있으며, 여기에는 렌즈 단백질을 당화하는 반응 물질인 3-디옥시트레오손과 옥살산 칼슘을 형성하여 신장 결석의 발달에 기여하는 옥살산 등이 포함된다.(그림 3) [ 27 ].
아스코르브산의 대사 산물은 주로 소변을 통해 제거됩니다.
여기에서 활성화를 위해 세포로 아스코르브산염의 수송을 매개하는 SVCT 역할을 언급하는 것이 적절합니다.

대사 과정에서 아스코르브산이 다양한 산물로 분해됩니다.
4. 암 치료의 가능한 중재
1976년 Ewan Cameron과 Linus Pauling이 암 환자에게 아스코르빈산을 투여하면 생존율이 증가한다고 보고했을 때, 아스코르빈산은 항암 활성을 가질 수 있는 가능성으로 인해 상당한 주목을 받았습니다.
암에서 영향을 받은 세포는 신체의 다른 부분에 있는 정상 세포를 더 침범합니다.
암세포는 성장과 침입을 위한 몇 가지 보조제를 가지고 있습니다.
즉, 포도당 수송체(GLUT), 저산소증 유발 인자(HIF) 및 텐-일레븐 전위(TET) 단백질입니다.
GLUT는 포도당을 암세포로 운반하여 성장과 침입을 향상시킵니다.그림 5).
HIF는 암세포의 혈관신생, 항세포자멸 활성, 줄기세포 재생, 전이 및 치료 저항성과 관련된 유전자의 발현을 조절합니다.
TET 단백질은 세포의 대사 및 후성 유전학적 프로파일을 변경함으로써 암 줄기 세포의 활성화와 관련이 있습니다.
항암 잠재력에 비추어 연구에서는 아스코르브산염이 GLUT, HIF 및 TET 기전의 중요한 기능과 관련되어 있음을 뒷받침합니다.
다른 연구에서 아스코르브산은 다음과 같은 작용 기전에 의해 암과 싸우는 것으로 관찰되었습니다.
4.1. 저산소 유도 인자의 하향 조절자로서
암 환자에서 심각한 저산소증과 함께 산소 결핍이 관찰되었습니다.
세포 의 지속적인 O 2 결핍은 저산소증 유발 인자(HIF)의 자극을 유도하여, 수많은 유전자의 발현을 변형시켜 혈관 신생 및 적혈구 생성 줄기 세포의 발달을 유발합니다.
정상 산소 환경에서 HIF 발현은 특수 산소 반응성 프롤릴 하이드록실라제 도메인 효소(PHD)에 의해 강력하게 제어됩니다.
Ascorbate는 철 이온(Fe 2+ )을 재활용하고 유지하기 위해 PHD에 대한 보조 인자로 작용합니다.
따라서 아스코르브산염의 존재는 HIF 기능에 영향을 줄 수 있으며, 이는 차례로 종양 진행에 영향을 줄 수 있습니다.
Wilkes et al.은 약리학적 아스코르브산염이 HIF-1α의 분해를 유도하여 췌장암에서 전이성 발달을 감소시킨다는 것을 밝혔습니다,
고용량에서 아스코르브산은 HIF-1α 수준의 분해를 통해 DNA 손상과 돌연변이를 감소시킵니다.그림 6) .
이것은 암세포에서 고용량의 아스코르브산염이 HIF 수산화효소의 작용을 강화하여 HIF-1α 활성을 억제하여 종양 성장을 억제함을 시사합니다.
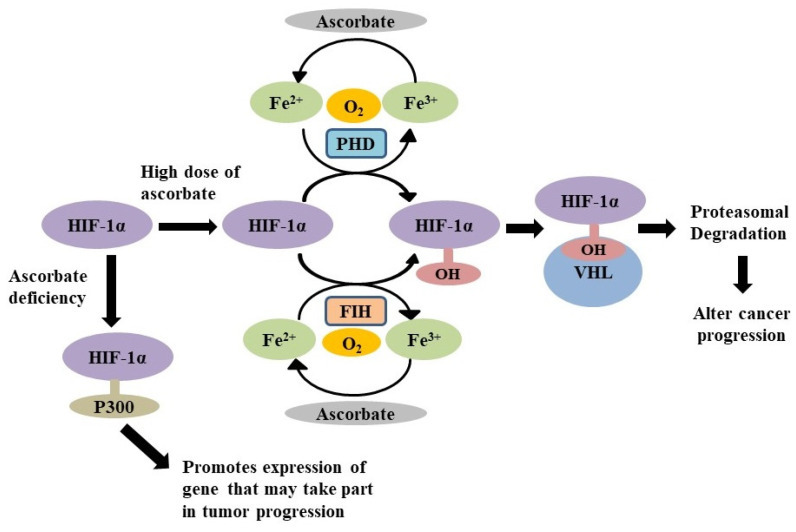
Ascorbate 는 PHD와 FIH의 기능에 필요한 Fe 2+ 를 재활용하여 HIF-1α를 조절 하여 암 진행을 변화시킵니다
4.2. 암세포의 포도당 대사 장애
1900년대 초, Otto Warburg와 동료들은 풍부한 산소가 없는 상태에서 종양 세포가 해당 작용을 위해 더 많은 양의 포도당을 소비한다는 것을 관찰했습니다.
이것은 Warburg 효과로 알려져 있습니다.
이는 저산소 환경에서 종양 생존 및 증식의 중요한 특성입니다.
해당 특성의 이러한 변화로 인해 종양 세포는 정상 세포보다 200배 더 빠른 해당 속도를 겪을 수 있습니다.
바르부르크 효과는 암세포의 중요한 대사 특성입니다.
Yu 등은 암세포에서 KRAS 또는 BRAF 유전자의 돌연변이가 Warburg 효과를 촉진하는 포도당 수송체-1(GLUT1) 유전자를 상향 조절한다는 것을 관찰했습니다.
낮은 포도당 조건에서 암세포는 GLUT1의 선택적 상향 조절로 인해 증가된 해당 작용을 통해 생존하며, 이는 암 치료에 대한 잠재적인 접근이 될 수 있습니다.
고농도의 아스코르빈산 정맥 주사는 돌연변이된 KRAS 또는 BRAF를 선택적으로 방해하여 해당과정의 GLUT1 조절을 유도하고 암세포를 죽이는 것으로 인식되었습니다.
체내에 투여된 후, 아스코르브산은 디히드로아스코르브산(DHA)으로 산화됩니다.
포도당과 구조적 유사성으로 인해 DHA는 암세포에서 KRAS 또는 BRAF 돌연변이 GLUT1에 의해 흡수됩니다.
일단 세포에 들어가면 니코틴아미드 아데닌 디뉴클레오티드 포스페이트(NADPH)와 글루타티온(GSH)이 있는 상태에서 DHA가 다시 아스코르브산으로 환원됩니다..
이 환원 과정에서 GSH와 NADPH가 각각 GSSG(glutathione disulphide)와 NADP+(oxidated nicotinamide adenine dinucleotide phosphate)로 바뀌면 세포의 ROS가 발생합니다.
상승된 ROS 수준은 글리세르알데히드 3-포스페이트 탈수소효소(GAPDH)를 니코틴아미드(NAM)로 전환하는 데 중요한 보조인자인 니코틴아미드 아데닌 디뉴클레오티드(NAD+)를 고갈시키는 폴리(ADP-리보스) 중합효소(PARP)의 DNA 유도 활성화를 손상시킵니다.
KRAS 또는 BRAF 돌연변이 세포에서 GAPDH의 이러한 방해는 에너지 부족으로 이어지고 미토콘드리아가 ATP를 덜 생산하기 때문에 세포 사멸로 이어집니다.
위암과 신장암에서는 해당작용이 높은 GLUT1의 발현이 높고 고용량의 아스코르브산염 치료에 민감하여 암세포를 선택적으로 죽이는 것으로 관찰되었습니다.그림 7).
따라서 아스코르빈산은 포도당 대사를 손상시켜 암세포에 독성을 유발할 수 있습니다.
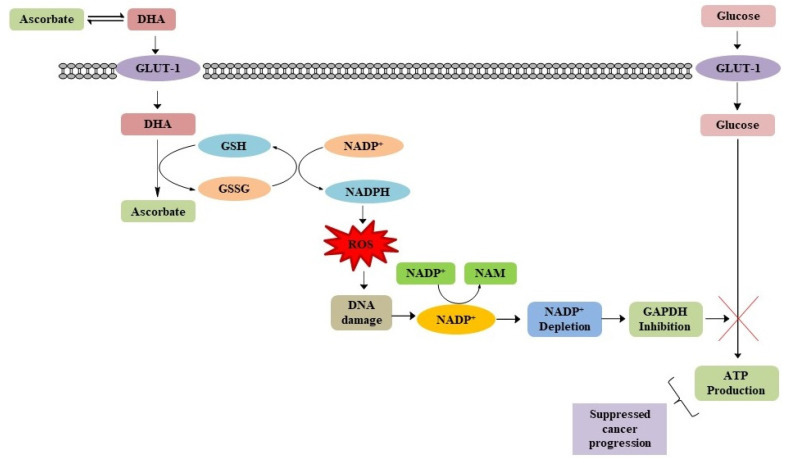
암세포에서 포도당 대사를 손상시키는 아스코르브산염의 역할
4.3. 후성유전 조절자로서
변경된 유전 및 후성 유전학적 프로파일은 암과 암 진행을 유발했습니다.
후성유전학적 변형에서는 DNA 서열에 직접적인 변이가 없습니다.
오히려 DNA 메틸화/탈메틸화와 같은 일련의 유전자 발현이 있습니다.
저메틸화 는 암 형성을 촉진하는 다양한 핵내 전사 인자를 촉발하고, 과메틸화는 종양 억제 유전자의 프로모터를 제한함으로써 종양 형성을 촉진합니다.
TET(ten-eleven translocation) 단백질 패밀리의 돌연변이 및 변형된 발현은 암 형성에 기여하는 비정상적인 DNA 메틸화로 이어집니다.
조혈 악성 종양에서 TET(TET2)는 일반적으로 돌연변이됩니다.
이러한 효소는 활성을 발휘하기 위해 보조인자 아스코르브산이 필요합니다.
TET의 효소 활동 전반에 걸쳐 아스코르브산염은 Fe3+에서 Fe2+로의 회복을 촉진하는 보조인자 역할을 합니다. (그림 8) [ 64 ].
TET 효소는 암 진행의 중요한 주역을 차단하고 아스코르브산염 접근성이 활성에 영향을 미칩니다.

TET 효소 조절에서 아스코르브산염의 역할
4.4. 항산화제로
인체에서 활성 산소종(ROS)은 생리학적 및 병리학적 과정에서 생성되지만, 높은 수준의 ROS는 발암에 기여합니다.
ROS는 세포 DNA를 공격하여 손상과 게놈 불안정성을 유발하고 신생물 특성의 발달을 포함하는 돌연변이를 유발합니다.
건강한 인간에서 40-80μM 혈장 농도의 아스코르브산염은 항산화 활성을 나타냅니다.
이 농도에서 아스코르브산염은 자유 라디칼에 전자를 제공하고 잠재적인 손상 효과를 감소시킵니다.
이 과정에서 아스코르브산은 자체적으로 상당히 반응성이 없는 아스코르브산 라디칼로 산화되고, NADH/NADPH 의존적 환원효소를 통해 아스코르브산으로 다시 전환됩니다.그림 9) [ 30 ].
비타민 E와 결합된 아스코르브산염은 공동 항산화제로 작용하여 ROS에 의한 지질 과산화로부터 LDL을 보호하고이 과정의 최종 산물인 산화 스트레스의 2차 메신저 4-히드록시노넨알(4-hydroxynonenal, HNE)의 형성을 방지합니다.
Ascorbate는 또한 지질 산화를 억제한 후 체내에서 비타민 E 수치를 유지합니다.
또한 화학요법 중 항산화제로서 아스코르빈산을 보충하면 치료에 대한 종양 반응이 증가하고 생존율도 증가합니다.
Suh 등은 시험관 내에서 아스코르브산염이 철 유도 지질 과산화를 방지함으로써 항산화제 역할을 한다는 것을 관찰했습니다 .
Chen et al.은 철분 과부하가 있는 기니피그에 경구로 보충된 아스코르브산염이 지질 산화를 억제하여 항산화제 역할을 한다고 보고했습니다.
따라서 낮은 농도의 아스코르빈산은 항산화제 역할을 하여 활성산소로 인한 신체 손상을 방지하고, 또한 화학요법의 효과를 높여 비타민 E의 분해를 방지합니다.

아스코르브산의 항산화 메커니즘
4.5. 산화 촉진 역할
마이크로몰(μM) 농도의 아스코르브산은 항산화제로 작용하지만 더 높은 밀리몰(mM) 농도에서는 산화촉진제로도 작용합니다.
비타민 C의 정맥내 투여는 종양 세포에 대한 세포독성을 유도합니다.
이는 경구 대응물보다 70배 더 높은 혈장 농도를 생성할 수 있기 때문입니다.
고용량 아스코르브산의 항종양 잠재력은 과산화수소(H 2 O 2 )를 생성하는 능력에 뿌리를 두고 있는 것으로 관찰되었습니다.
동물에서 밀리몰 농도의 아스코르브산염은 구리와 철 금속에 전자를 제공하여 과산화수소와 유사한 ROS인 슈퍼옥사이드를 생성합니다.
ROS는 DNA 손상을 유도하여 궁극적으로 암세포에 세포독성을 유발합니다.
정맥 투여 시 아스코르브산 염(Ascorbate, AscH-)은 단백질 중심의 전이 금속 이온, 즉 제2철(Fe 3+ ) 및 제2구리(Cu 2+ ) 이온과 반응합니다.
실제로, 전환 금속의 수준이 상당히 낮기 때문에 더 높은 농도의 비타민 C가 필요합니다.
Ascorbate는 Fe 3+ /Cu 2+ 를 ferrous(Fe 2+) /cuprous(Cu+) 이온으로 환원시키고, Ascorbate free radical(Asc-)로 산화합니다.
환원된 Fe 2+ /Cu+ 이온은 산소와 반응하여 슈퍼옥사이드 라디칼과 같은 ROS를 형성하고, 수소가 존재하는 경우 디스뮤테이션을 거쳐 과산화수소(H 2오 2 ). 또한, H 2 O 2 는 Fe 2+ /Cu+ 에 의해 촉매되는 펜톤 유사 반응을 거쳐 과산화수소 라디칼(HO⋅을 생성하여 암세포에 손상을 줄 수 있습니다.
AscH− + Fe 3+ /Cu 2+ → Asc•− + Fe 2+ /Cu+
Fe 2+ /Cu+ + O 2 → Fe 3+ /Cu 2+ + O 2 •−
O 2 • − + O 2 •− + 2H+ → H 2 O 2 + O 2
Fe2 + /Cu+ + H2O2 → Fe3 + / Cu2 + + H2O •
종양 조직은 간질액에 단백질을 함유하고, 세포외액에 손상된 단백질은 철, 구리와 같은 촉매 금속을 함유하고 있다고 보고되었다.
정상 내피와 비교하여 종양 혈관은 더 큰 투과성을 갖고, 촉매 전환에 필요한 금속 이온을 증폭하고 아스코르브산의 H2O2로의 전환을 향상 시킵니다.
여러 연구에 따르면 빠르게 증식하는 암세포에 대한 DNA 복제 효소의 보조인자이기 때문에 암에서 구리 수치가 증가했다고 보고했습니다.
암에서, 원소의 전신 분포가 변경된 증가된 구리 농도는 암 세포가 구리와 아스코르브산의 ROS 생성 선택적 세포독성에 취약하게 만들었습니다.
또한 철의 경우 건강한 사람에서는 당단백질 페리틴에 의해 저장되지만 암 염증과 같은 병리학적 조건에서는 조직에서 세포외 철 킬레이트가 증가하여 아스코르브산염 유도 ROS 독성에 취약합니다.
Chen 등은 아스코르브산이 H 2 O 2 생성을 통해 정상 세포에 어떠한 손상도 일으키지 않고 종양 성장을 선택적으로 방해한다는 것을 관찰했습니다.
백 등은 또한 아스코르브산이 ROS의 생성을 통해 암세포에 독성을 유도함을 관찰하였다.
다른 연구에서 다량의 아스코르브산은 ROS, 특히 과산화수소의 생성을 통해 악성 세포의 세포 사멸을 촉발했습니다.
따라서, 밀리몰 농도의 아스코르브산은 ROS의 생성을 통해 다양한 암세포에 독성을 유도하며, 이는 자체적으로 세포 구성 요소를 손상시키고 다양한 중요한 세포 메커니즘을 방해합니다.
6. 암 치료의 새로운 트렌드
치료 효과를 향상시키기 위한 요구로서, 다른 캡슐화된 전달 시스템에 분자를 통합하는 것이 중요합니다.
이는 분자를 화학적 분해로부터 보호하기 때문입니다.
6.1. 리포솜
리포솜은 천연 또는 합성 인지질과 콜레스테롤로부터 생성된 생분해성 소형 인공 구형 소포입니다.리포솜을 구성하는 인지질과 콜레스테롤은 친수성 머리와 친유성 꼬리로 구성된 양친매성입니다.
극성 머리 부분과 소수성 꼬리 부분은 각각 소수성 및 친수성 영역에 지용성 및 수용성 성분을 가두는 데 도움이 되는 이중층을 형성합니다.
따라서 소수성 및 친수성 특성으로 인해약물, 허브 및 단백질의 약동학적 특성을 조정할 수 있습니다(그림 12)
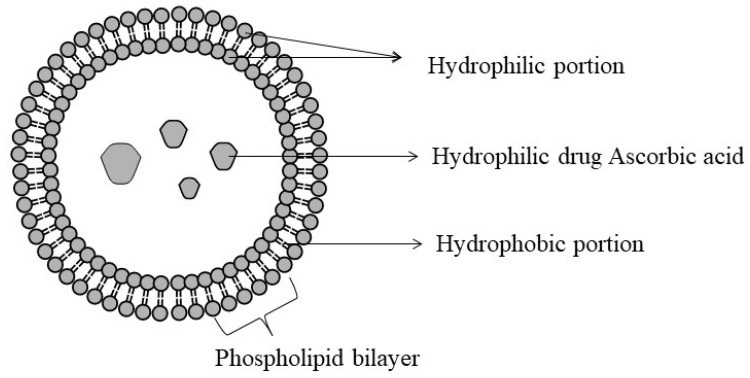
리포솜의 구조.
6.2. 나노입자
나노입자(NP)(그림 13)은 일반적으로 입자 크기가 1~100nm인 광범위한 재료로 구성된 입자입니다.
연구원들은 물질의 물리화학적 특성이 입자 크기에 의해 영향을 받는다는 것을 관찰했습니다.
세포는 크기가 1~10μm인 물질을 흡수합니다.
따라서 나노 입자는 조직에 쉽게 들어가고 세포에 흡수되어 부작용이 적거나 미미한 표적 위치에서 효과적인 약물 작용을 보장합니다.
치료적으로, 나노입자는 봉입된 화합물의 용해, 약물 표적화, 흡수 및 분해 및 약물의 제어 방출을 개선하는 데 사용됩니다.
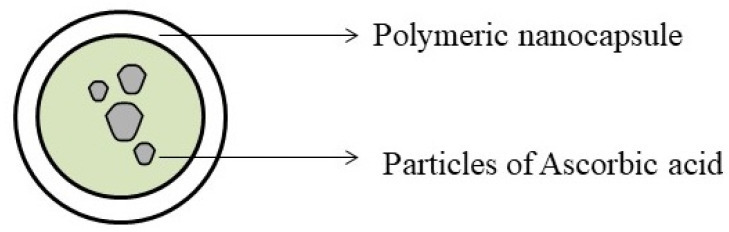
약물 입자를 포함하는 나노 입자.
8. 도전과제 및 현황
아스코르브산을 활용하기 위해서는 높은 pH, 수성 매질, 산소 및 금속 이온에 노출되면 단순히 분해되기 때문에 안정성이 주요 과제입니다.
안정성을 개선하기 위해 L-ascorbyl-6-palmitate, L-ascorbic acid 6-phosphate, L-ascorbic acid 2-glucosidase와 같은 안정한 아스코르브산 유도체를 생성하기 위해 아스코르브산 분자를 일부 수정했습니다.
모 화합물보다 더 안정함에도 불구하고 직접적인 항산화 활성이 없고 생체 내에서 L-아스코르브산으로의 효소적 전환이 필요합니다.
국소적으로 사용되는 경우, 이러한 유도체는 또한 모 화합물인 아스코르브산에 비해 피부를 통한 투과성이 더 낮습니다.
권장 복용량에서 아스코르브산은 건강한 사람에게 안전합니다.
비타민 C의 일일 권장 섭취량은 약 100mg입니다.
그러나 중환자의 경우 비타민 C 투여가 여전히 문제입니다.
1일 2g 이상 섭취하면 옥살산 결정 신병증을 유발할 수 있다는 문서화된 사례가 있습니다.
어떤 경우에는 480mg/일의 낮은 경구 섭취 또는 45mg의 정맥내 단회 투여가 옥살산 결정 신병증을 유발할 수 있는 것으로 관찰되었습니다.
신장 결석의 병력이 있는 개인에서 하루 1g 이상의 양은 신장 결석 재발의 위험을 유의하게 높입니다.
대사 과정에서 아스코르빈산은 조직에서 디히드로아스코르빈산으로 분해된 다음 디케토굴론산으로 분해되고 궁극적으로 옥살산으로 분해되어 소변으로 배설됩니다.
세뇨관의 과포화 옥살산 염은 결정으로 유리하게 침착되어 돌로 발전하여 차례로 세뇨관 상피를 손상시킵니다.
Ascorbic acid로 인한 oxalate nephropathy는 장기 투석이나 이식이 필요한 만성 신질환, 심지어 사망까지 이르는 심각한 결과를 초래할 수 있다.
기저 질환이 있는 환자에서 섭취한 아스코르빈산의 기간과 용량은 급성 신장 손상의 발병에 영향을 미칩니다.
9. 향후 전망 및 결론
위에서 다룬 아스코르브산의 잠재적 기능은 효과적인 분포를 통해 종양 환경에서 종양 세포와 아스코르브산염의 충분한 접촉과 관련이 있습니다.
따라서 고용량의 아스코르빈산이 항암 효과를 발휘하는 데 중요합니다.
그러나 암 치료에 대한 보편적인 모델로 간주되어서는 안 됩니다.
경구 및 정맥내 투여는 상이한 혈장 약동학을 초래하기 때문에, 암 환자에 대한 많은 사례 연구와 임상 시험에서 아스코르브산 단독 또는 화학 요법과 함께 고용량의 아스코르브산이 독성이 적으면서 삶의 질을 향상시키는 것으로 나타났습니다.
비타민 C는 HIF, GLUT1 및 TET 와 같은 다양한 취약한 노드를 표적으로 하여 암 진행을 억제합니다.
Wang et al.은 위암 및 전이성 결장직장암 환자의 1상 임상 연구에서 다른 항암제와 함께 고용량의 아스코르브산이 잠재적으로 개선된 효능과 적절하게 감소된 부작용을 보여 환자의 삶의 질을 향상시킨다는 것을 관찰했습니다.
Lv 등은 수술 후 간세포 암종 환자에 대한 후향적 연구에서 정맥내 아스코르브산 투여가 무병 생존 기간을 연장한다는 것을 관찰했습니다.
Zhao et al.은 급성 골수성 백혈병이 있는 고령 환자에 대한 임상 연구에서 다른 항암제와 함께 아스코르브산이 항암제 단독에 비해 실질적인 독성 없이 더 나은 완전 관해율(CR) 및 전체 생존율을 보이는 것을 목격했습니다.
현재 여러 전임상 및 임상 시험에서 비경구 아스코르브산염이 간섭 없이 화학 요법 또는 방사선 요법과 상승적으로 작용하는 능력이 지적되었습니다.
따라서 고용량 정맥내 아스코르브산염 및 그 유도체는 항암 요법에 대한 저렴한 대안을 의미합니다.
또한, 독성이 낮고 쉽게 구할 수 있으며 비용이 저렴하기 때문에 단독 또는 조합으로 임상 시험에서 잠재적인 항암제로 더 탐구해야 합니다.
아스코르브산은 근본적으로 암 발달 및 진행에 관여하는 HIF, TET, GLUT-1, FIH 및 PHD의 기능에 중요한 역할을 합니다.
'암치료' 카테고리의 다른 글
| 육종 대사체학 (0) | 2022.10.31 |
|---|---|
| MDM2 (0) | 2022.10.24 |
| 특허 문헌 및 과학 논문을 기반으로 한 항암 천연물의 연구 현황 및 핫스팟 (1) | 2022.10.10 |
| 식물추출물의 생리활성 화합물의 암 치료 및 항암 효과 관련 기전 (0) | 2022.10.10 |
| 고형암 치료를 위한 천연물의 역할과 다중 표적 접근법 (0) | 2022.10.10 |
