2021
Shutting Down the Power House of Cancer
Scientifically based strategy to fight cancer with repurposed drugs and food supplements, including discussion on dose and application
www.cancertreatmentsresearch.com
Shutting Down the Power House of Cancer
우리가 선택한 전략은 우리가 결정한 핵심 치료와 일치해야 합니다.
예를 들어, 화학 요법이나 방사선 요법을 선택하는 경우 산화 촉진 전략을 중심 전략으로 선택하고 이를 중심으로 치료법을 구축할 수 있는 반면, 혈관 신생 억제제 약물을 선택하는 경우 "영양소 고갈' 전략을 최우선 과제로 삼았습니다.
칵테일을 만들기 위해 일관된 방식으로 치료법을 통합하는 것은 실제로 종양학 업계의 추세이며 현재 두 가지 이상의 약물을 포함하는 최근의 많은 임상 과정에서도 반영됩니다.
효과에 한계가 있는 현재의 치료법을 개선해야 할 필요성이 생겨난 추세입니다.
암 환자들이 대사성 질환으로서 암과 싸울 수 있는 가능성을 점점 더 자각하게 됨에 따라 환자들이 가능한 모든 생존 경로를 동시에 억제하려고 시도하는 경향이 있기 때문에 일관성 및 우선순위에 대한 요점을 지속적으로 강조하고 있습니다.
그러나 실제로 이것은 두 가지 주요 이유 때문에 불가능하지는 않더라도 달성하기 어렵습니다.
첫째, 우리가 암의 생존 경로를 모두 알지 못할 가능성이 있습니다.
둘째, 억제에 대한 공정한 기회를 얻기 위해 각 메커니즘은 고용량의 보충제/약물을 필요로 하며, 이를 해결하기 위한 메커니즘의 수를 곱하면 대부분의 환자가 복용할 수 없는 매우 많은 수의 캡슐/정제가 너무 많아 집니다.
중앙 전략 으로 암의 발전소 폐쇄
다행스럽게도 세포 내부에 에너지 공장이 두 개뿐이므로 그다지 복잡하지 않습니다.
- 미토콘드리아를 통한 호흡
- 세포질에서의 발효
일단 이 전략과 메커니즘을 우선순위로 선택하면 이 전략을 집중적으로 다루고 지방산, 글루타민 및 포도당 억제를 낮은 우선순위 수준에 두는 것을 선호합니다.
포도당, 글루타민 및 지방산이 에너지(ATP)로 전환되기 위해서는 기능적 엔진(호흡 및 발효)이 필요하기 때문입니다.
따라서 예를 들어 호흡(엔진)을 차단하면 글루타민(연료)이 에너지로 전환될 수 없습니다.
실제로 다양한 연구에서 발효와 호흡의 동시 억제가 대부분의 암 유형에는 치명적이지만 정상 세포에는 치명적이지 않다는 것이 입증되었습니다.
다음은 이러한 연구의 몇 가지 예입니다.
- 발효 억제제 Gossypol + 호흡 억제제 Phenformin : gossypol을 사용한 ALDH 억제와 펜포르민을 사용한 미토콘드리아 복합체 I 억제는 암 세포에서 ATP 생산의 최대 80% 고갈을 초래했으며 동물 이종이식 모델에서 NSCLC 종양의 상당한 성장 퇴행을 동반했습니다. 정상 세포는 ATP 생산 손실이 없습니다( Ref .)
- 발효 억제제 + 호흡 억제제 메트포르민 : 젖산 수송체 MCT1 및 MCT4의 이중 억제는 암세포의 NAD+ 고갈로 인해 메트포르민과 합성 치명적 입니다 .
- 발효 억제제 디클로페낙 또는 디플루니살 + 호흡 억제제 메트포르민 : 메트포르민 및 NSAIDs와 결합된 대사 표적화 디플루니살 및 디클로페낙은 급성 골수성 백혈병 세포에서 세포자멸사를 유도합니다( 참고 .)
- 발효 억제제 디클로페낙 + 호흡 억제제 메트포르민 : 신경교종에서 메트포르민과 디클로페낙에 의한 종양 대사의 복합 조절( 참고 문헌 )
- 발효억제제 옥사메이트 + 호흡억제제 P henformin : Phenformin과 Oxamate의 시너지 항암 효과 ( Ref .)
- 발효 억제제 시로싱고핀 + 호흡 억제제 메트포르민 : 시로싱고핀은 암세포를 메트포르민에 의한 사멸에 민감하게 합니다 .
- 발효 억제제 2-Deoxyglucose + 호흡 억제제 Metformin : 암세포 대사를 표적으로 식도 편평 세포 암종에서 2-Deoxyglucose와 Metformin의 조합에 의한 세포 사멸 유도 ( Ref .)
- 발효 억제제 2-Deoxyglucose + 호흡 억제제 Metformin : 암세포 대사를 표적으로 메트포르민과 2-deoxyglucose의 조합은 전립선암 세포에서 p53 의존성 세포사멸을 유도합니다. ( 참조 .)
- 발효 억제제 비타민 C + 호흡 억제제 독시사이클린 : 비타민 C와 독시사이클린: 암 줄기 세포(CSC)의 대사 유연성을 목표로 하는 합성 치사 복합 요법( Ref .)
- 발효 억제제 비타민 C + 호흡 억제제 독시사이클린 및 아지트 로마이신 : 독시사이클린, 아지트로마이신 및 비타민 C(DAV): 미토콘드리아를 표적으로 하고 암 줄기 세포(CSC)를 박멸하기 위한 강력한 병용 요법( Ref .)
- 발효 억제제 비타민 C + 호흡 억제제 베르베린 : 도데실 -TPP 는 미토콘드리아를 표적으로 하고 암 줄기 세포(CSC)를 강력하게 근절: FDA 승인 약물 및 천연 화합물(비타민 C 및 베르베린)과의 시너지 효과( 참고 .)
따라서 발효 및 호흡 억제제를 결합하는 것은 암과 싸우는 매우 적절한 전략 중 하나입니다.
이 두 가지 메커니즘을 각각 효과적으로 해결하기 위해 목표에 도달하는 데 효과적일 것으로 예상되는 용량을 사용하여 동시에 각각 최소 2~3개의 억제제로 문제를 해결하는 것을 고려할 것입니다.
제 생각에는 경구로 복용할 수 있는 약물과 보충제를 살펴보면 발효에 비해 호흡을 억제하는 더 효과적인 도구가 있습니다.
이것이 내가 2/3개의 호흡 억제제와 더 많은 수의 발효 억제제(포도당 수송체 억제제 포함)를 사용하는 이유입니다.
아래는 내가 선택한 일부 약물과 보충제를 포함하여 에너지 엔진을 차단하는 기본 전략을 보여주는 그림입니다.
이 라인을 따라 사용할 수 있는 약물 및 보충제에 대한 더 많은 아이디어는 발효 억제제 및 호흡 억제제 를 참조하십시오..
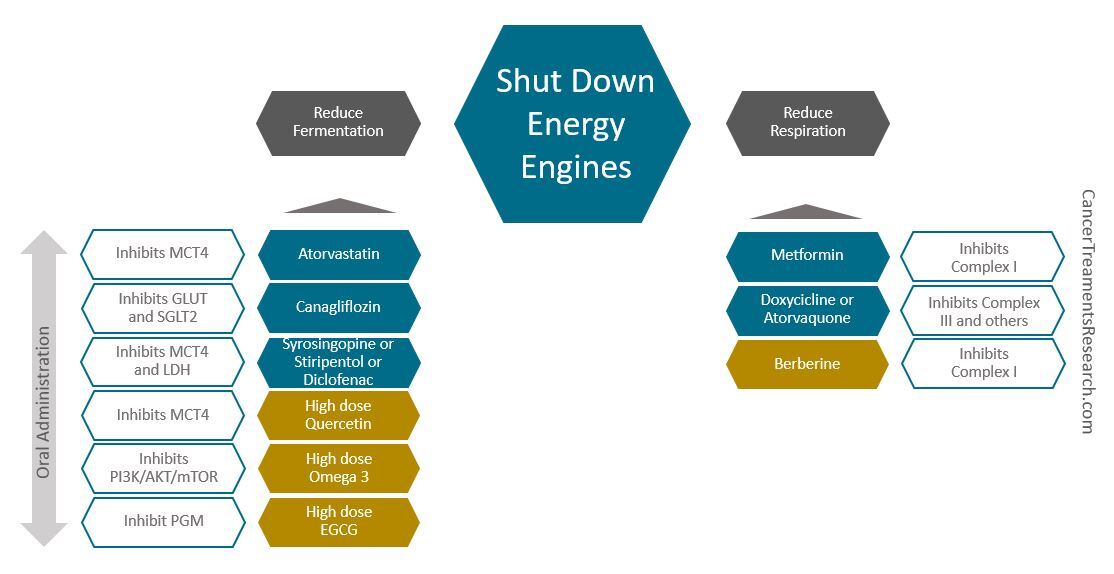
위 그림을 참고하세요.
- 각 약물 또는 보충제에 대해 이 전략과 관련된 주요 목표만 언급됩니다(그렇지 않으면 대부분의 약물 및 보충제에는 다중 목표가 있습니다. 예를 들어 Metformin은 발효에도 영향을 미치고 Canagliflozin은 미토콘드리아에도 영향을 미칩니다)
- 파란색 육각형은 용도 변경 약물을 나타내고 머스타르색 육각형은 천연 추출물을 나타냅니다.
위에서 고려할 일일 복용량의 예(경구 투여):
나는 항상 목표 복용량을 향해 단계별로 각 약물 보충제를 시작하고 한 번에 모두 시작하지는 않습니다.
예를 들어, 나는 2일마다 하나의 새로운 약물이나 보충제를 추가하고(원하지 않는 반응이 있는 경우 확인하기 위해) 예를 들어 2주 동안 목표 용량을 향해 증량합니다.
아래 그림에서 알 수 있듯이 위의 전략을 더욱 개선하기 위해 다음과 같은 정맥 주사를 추가하는 것도 고려할 것입니다.
1. 여기서 논의된 고용량 비타민 C

이 전략을 화학 요법과 결합하는 경우 화학 요법 3일 전에 모든 발효 억제제(Metformin/Berberine도 발효에 영향을 미치지만 Doxycicline 또는 Atorvaquone에는 영향을 미치지 않음)를 중단하고 화학 요법 기간 동안 Metformin으로 시작하여 화학 요법 당일에 다시 시작합니다.
화학 요법의 날, 그리고 다른 사람들은 그것을 단계적으로 백업합니다.
첫 재가동은 용도변경 약품이며 약 3일 후 퀘르세틴, EGCG 등의 식물추출물이다.
Omega 3, 나는 그것을 계속 ON으로 유지할 것입니다.
이 전략이 방사선 요법과 결합되는 경우, 저는 방사선 치료 3일 전에 모든 식물 추출물을 중단하고 약 3일 후에 다시 시작합니다.
오메가 3를 포함한 다른 모든 것, 특히 호흡 억제제는 계속 켜두겠습니다.
고용량 비타민 C 치료를 수행하는 경우 GLUT1 수송체가 암세포 내에서 비타민 C 흡수에 필요하기 때문에 비타민 C 투여 몇 시간 전에 GLUT1 억제제(예: 카페인 등)를 복용하지 않을 것입니다( 참고 .).
*****************************************************************
Drugs and Supplements that Block Fermentation and Help Fight Cancer - Cancer Treatments - from Research to Application
Energy production inside cells In order to maintain normal function including biosynthesis and transport of molecules across cell membranes, cells require energy (called ATP). There are two “engines” inside the cells that they can use to produce energy
www.cancertreatmentsresearch.com
발효 억제제=Fermentation Inhibitors
발효를 억제하려고 할 때 아래에서 설명하는 억제제 중 하나가 아닌 세 가지를 동시에 콤보로 사용합니다.
이는 일부 약물/보충제가 일부 환자에서 잘 흡수되지 않거나 다르게 대사될 수 있거나 종양 위치에 따라 종양에 도달하거나 도달하지 않을 수 있기 때문입니다.
여기에 나열된 일부 약물의 잠재적인 부작용에 대처하기 위해 나는 아마도 몇 주마다 순환할 것입니다.
즉, 몇 주마다 다른 콤보로 전환합니다.
포도당 수송체(GLUT 및 SGLT) 억제제
GLUT 및 SGLT 수송체는 포도당을 세포외 공간에서 세포내 공간으로 수송하는 역할을 합니다.
당연히 이러한 수송체의 활동을 줄이면 세포에 들어가는 포도당의 양이 줄어듭니다.
여기( Ref .) 및 여기( Ref .)에서 더 자세히 논의되는 나트륨 의존성 포도당 공동수송체(SGLT)라고 하는 또 다른 유형의 포도당 수송체가 있다는 점에 유의하십시오 .
- Phloretin 및 Phlorezin – GLUT1 및 SGLT 억제제 – 천연 추출물. 접근하기 어렵지만 접근 가능합니다. 좋은 활동을 달성하기 위해 정맥 주사를 할 수 있습니다. 그렇지 않으면 생물학적 이용 가능성이 제한됩니다. 여기에서 전용 게시물에서 이러한 천연 추출물에 대해 논의했습니다( Ref .)
- 제니스테인 – GLUT1 및 GLUT4 억제제( 참고 .)
- Canagliflozin – GLUT1 및 SGLT1 억제제 – FDA 승인 약물 – 사용 가능( Ref .)
- 리토나비르 – GLUT1 및 GLUT4의 비선택적 억제제 – FDA 승인 HIV 약물 – 사용 가능( 참조 .)
- 암프레나비르(Agenerase), 아타자나비르(Reyataz), 다루나비르(Prezista), 포삼프레나비르(Telzir, Lexiva), 인디나비르(Crixivan), 로피나비르/리토나비르(Kaletra, Aluvia), 넬피나비르(Viracept), 리토나비르(Norvir), 사퀴나비르(Invirase) , 티프라나비르(Aptivus)( 참고 .)
- 퀘르세틴 – GLUT1 억제제( Ref .) – 천연 추출물 – 온라인에서 식품 보조제로 이용 가능.
- GLUT 억제제로 발견된 다른 천연 추출물은 카페인( Ref .), 실리빈/실리비닌, 커큐민( Ref .), 레스베라트롤(Resveratrol ) , 멜라토닌, 그라비올라 추출물( Ref .)입니다. 더 많은 GLUT1 억제제가 여기에 나열되어 있습니다( 참조 .1, 참조 .2).
- Verapamil – GLUT1 억제제( 참고 .) – 마음에 듭니다. 접근 가능하지만 GLUT1 억제제 목록에 없습니다. 좋은 MDR 억제제입니다.
- 펜벤다졸 – GLUT4 억제제 – 이 웹사이트에서 자세히 논의됨( 참조 .)
- Naringenin – 자몽의 천연 추출물은 세포 내 구획에서 원형질막으로의 인슐린 유도 GLUT4 전좌를 방해합니다( 참고 .)
- Diclofenac – GLUT1, LDHA 및 MCT1 억제( Ref .) – 항진통제로 사용되는 FDA 승인 약물 – 일반의약품
- Na + / K + -ATPase 억제제인 강심 배당체(예: 협죽도, 부팔린 등)는 SGLT1 및 SGLT2의 기능을 간접적으로 낮춥니다( 참고 .)
- Oleuropein – 올리브 잎의 주요 생리 활성 페놀 성분은 GLUT1을 억제합니다( 참고 .)
헥소키나제(HK) 억제제:
이것은 포도당이 포도당-6-인산(Glu-6-P)으로 전환되는 해당작용의 첫 번째 단계를 촉진하는 효소입니다.
- 3 BP – 중간 접근성 및 효과적인 당분해 억제제. 여기에서 이 웹사이트에 대해 자세히 설명합니다( Ref .)
- 2 DG - 중간 접근성 및 효과적인 자일로클리시스 억제제( 참고 .). 2-DG는 헥소키나제에 의해 인산화될 수 있지만 Glucose-6-phosphate isomerase(GPI)에 의해 대사될 수 없습니다. 여기에서 이 웹사이트에 대해 자세히 설명합니다( Ref .)
- Methyl Jasmonate – HK에 결합하여 미토콘드리아 외막에서 HK를 방출시키는 천연 추출물( Ref .)
- Clotrimazole – FDA 승인 약물, 항진균제( 참고 .)
- D-만노헵툴로오스는 HK를 억제하여 해당 작용을 감소시키는 아보카도 과일에서 일반적으로 발견되는 7탄당입니다 .
- 프로프라놀롤 – HK 억제( Ref .) – 이전에 이 웹사이트에서 논의된 FDA 승인 약물( Ref .)
- Mannose – HK 억제( Ref .) – 온라인에서 제공되는 영양 보충제
Manose는 포도당(GLUT)과 동일한 수송체를 사용하여 세포에 들어가고 헥소키나아제(HK)에 의해 만노스-6-인산으로 전환되는 당의 한 형태입니다.
다음으로 PMI(phosphomannose isomerase)라고 불리는 또 다른 효소는 만노스-6-인산을 과당-6-인산으로 전환시킵니다.
이 경우 마노스는 포도당과 같은 경로로 더 나아가 에너지로 전환됩니다.
그러나 대장암과 같은 일부 유형의 암은 PMI 효소 수치가 낮아 만노스-6-인산이 축적됩니다.
또한 낮은 수준의 PMI는 PMI 억제제로 유도될 수 있습니다.
PMI 억제 로 인한 만노스-6-포스페이트의 축적은 포도당 대사를 매개하는 세 가지 효소인 HK, GPI(아래 참조) 및 G6PD(PPP 경로에서)를 억제할 수 있습니다..).
Manose는 여기에서 매우 유망하지만 PMI 억제제와만 함께 사용할 것입니다.
여전히 하나의 PMI 억제제를 찾아야 합니다.
2020년 2월 9일 업데이트: 아래의 Darle 의견 덕분에 이제 EDTA( Ref .) 및 Silver( Ref .) 의 두 가지 액세스 가능한 PMI 억제제가 있습니다 .
EDTA는 종종 킬레이트제로서 정맥주사로 투여되는 클리닉에서 사용됩니다.
그리고 Silver와 그 적용은 이전에 이 웹사이트 https://www.cancertreatmentsresearch.com/a-silver-bullet-to-kill-cancer/ 에서 논의되었습니다.
Glucose-6-phosphate isomerase(GPI) 억제제:
phosphoglucose isomerase/phosphoglucoisomerase(PGI) 또는 phosphohexose isomerase(PHI)로도 알려진 Glucose-6-phosphate isomerase(GPI)는 포도당-6-인산(Glu-6-P)을 과당-6-인산으로의 전환을 담당합니다.
- 만노스 – 위에서 설명한 대로
- Suramin – 아프리카 수면병 및 강변 실명증 치료에 사용되는 약물( 참고 .)
- 아가리크산 – 과도한 발한을 멈추기 위해 의약에서 무취제로 사용됨( 참고 .)
PFK(Phosphofructokinase) 억제제:
포유류 세포에는 두 가지 유형의 6-phosphofructokinase(PFK) 효소가 존재합니다
--6-phosphofructo-1-kinase(PFK1)는 fructose-6-phosphate가 ructose-1,6-bisphosphate로 비가역적으로 전환되는 것을 촉진합니다.
--6-phosphofructo-2-kinase(PFK2), fructose-2,6-biphosphate의 합성 및 fructose-6-phosphate로의 변환을 조절하는 이중 기능 효소
PFK2(FBPase라고도 함)는 4개의 동위효소로 구성되며, PFKFB1-4(Ref.)
PFKFB3은 F-2,6-BP 수준을 강력하게 증가시키고 당분해를 통해 포도당 이용을 촉진하지만 PPP로의 포도당 진입을 감소시킵니다. 반대로 PFKFB4는 PPP를 통해 더 많은 포도당을 리디렉션합니다.
- 고용량 구연산 - 이전에 이 웹사이트에서 논의된 내용( 참조 .)은 PFK를 억제합니다( 참조 .) 구연산이 고려되는 경우 이것도 읽어 보십시오( 참조 .).
- 설포라판 – PFKFB4 및 PFKFB3 억제( 참고 .) – 온라인 보충제로 발견된 브로콜리 추출물
- 아세틸살리실산 및 살리실산은 PFK를 억제합니다( 참고 .) - 전형적인 아스피린 - FDA 승인 약물
- (n-(8-methoxy-4-quinolyl)amino)pentyl nitrate (5MPN)는 매우 효과적인 PFKFB4 억제제인 것으로 보이지만( 참고 .) 불행히도 사용할 수 없습니다.
- 레스베라트롤 – PFK 억제제( Ref .) – 온라인 식품 보충제로 이용 가능
- 세포의 산도 증가(즉, 세포 내 pH 감소를 의미)는 또한 PFK 를 억제 합니다 .
알돌라제(ALD) 억제제:
ADL은 과당-1,6-비스포스페이트를 글리세르알데히드-3-포스페이트(G3P) 및 디하이드록시아세톤-포스페이트(DHAP)로 가역적으로 전환시키는 것을 촉진합니다. 3개의 알돌라제 동종효소가 포유류에 존재하며, 3개의 다른 유전자에 의해 암호화되고 다른 우세한 조직 분포를 가집니다: 골격근의 ALD-A, 간장의 ALD-B, 뇌의 ALD-C. ( 참조 .)
- ALD를 억제하는 접근 가능한 약물이나 보충제가 아직 발견되지 않음
글리세르알데하이드 3-인산 탈수소효소(GAPDH) 억제제:
GAPDH는 글리세르알데하이드-3-인산(G3P)을 1,3-비스포스포글리세르산(1,3-BPG)으로 가역적으로 전환하는 것을 촉진합니다.
활성 산소 종 축적은 글리세르알데하이드 3-인산 탈수소효소(GAPDH)를 비활성화합니다 ( 참고 .).
- 고용량 비타민 C ( 참고 ) - 이전에 이 웹사이트에서 논의한 바 있습니다.( 참조 ) GLUT1 억제제와 함께 사용해서는 안 됩니다. 암 세포에서 비타민 C의 흡수를 감소시키기 때문입니다.
- 3BP ( 참조 .)
- Methylglyoxal ( Ref .) – 이전에 이 웹 사이트에서 논의된 내용은 여기 ( Ref .)
- 뉴캐슬병 바이러스( Ref .)
- Dimethyl Fumarate ( Ref .) – 자가 면역 반응을 치료하는 데 사용되는 FDA 승인 약물은 이전에 여기에서 논의되었습니다 ( Ref .)
- Rasagiline 및 Selegiline ( Ref .) – 파킨슨병 증상 치료에 사용되는 약물
포스포글리세르산 키나제(PGK) 억제제:
1,3-비스포포글리세르산(1,3-BPG)을 3-포스포글리세르산(3PG)으로 가역적으로 전환하는 것을 촉진합니다.
- PGK를 억제하는 접근 가능한 약물이나 보충제는 아직 발견되지 않았습니다.
PGM(포스포글리세르산 뮤타제) 억제제:
3-포스포글리세르산(3-PG)을 2-포스포글리세르산(2-PG)으로 전환
- 에피갈로카테킨-3-갈레이트(EGCG)는 PGM( Ref .)을 억제합니다 – 온라인에서 보충제로 구할 수 있는 녹차 추출물
에놀라제(ENO) 억제제:
2-포스포글리세르산(2-PG)에서 포스포에놀피루브산(PEP)으로의 가역적 전환을 담당합니다.
세 가지 유형: 간, 신장, 비장 및 지방 조직에서 발견되는 ENO1; ENO2; ENO3. ENO1은 HIF-1 표적이며 다양한 암 유형에서 발현이 증가하는 것으로 나타났습니다( 참고 .)
피루베이트 키나아제(PK) 억제제:
PK는 포스포에놀피루베이트(PEP)를 피루베이트(PYR)로 비가역적으로 전환시킵니다. 포유류에는 PKL, PKR, PKM1, PKM2의 네 가지 PK 유형이 있습니다. PKM2는 종양 형성 중에 발생하는 반면 PKM1은 하향 조절됩니다. 따라서 PKM2 는 종양 특이적 피루베이트 키나아제( Ref .) 로 표시되었습니다. PKM2는 이전에 이 웹사이트에서 더 자세히 논의된 바 있습니다 .
- 부티르산 나트륨 – 이전에 이 웹사이트에서 논의됨( 참고 ) – 온라인에서 발견된 매우 나쁜 냄새가 나는 보충제
- 비타민 K3 및 K5 – 이전에 이 웹사이트에서 논의된 내용은 여기( Ref .)
- Shikonin – 이전에 이 웹사이트에서 논의한 내용은 여기( Ref .)
- 퀘르세틴 ( Ref .) – 이 웹사이트에서 이전에 논의된 내용은 여기( Ref .)
- Benserazide – PKM2 억제제( 참고 ) – 파킨슨병 관리에 사용되지만 미국에서 승인되지 않은 약물
- 올레아놀산( Ref .)
- Oleuropein – 올리브 잎의 주요 생리활성 페놀 성분은 PKM2를 감소시킵니다( 참고 .)
피루베이트 탈수소효소 키나아제(PDK) 억제제
피루베이트 탈수소효소(PDH)는 피루베이트를 아세틸-CoA로 전환시킵니다. PDK는 PDH를 억제하고 암에서 과발현됩니다. 결과적으로 피루브산은 미토콘드리아에 접근할 수 없으며 발효 경로에서 세포에서 추가로 처리됩니다. 나는 PDK 억제제를 발효 억제제로 보지 않고 미토콘드리아 활성화제로 봅니다.
- DCA – 이전에 이 웹사이트에서 논의된 FDA 승인 약물( 참조 .)
- Alpha Lipoic Acid ( Ref .) - 온라인에서 구할 수 있는 보충제 - 강력한 항산화제이므로 이 게시물에 나열된 많은 발효 억제제를 포함하는 proxidant 요법과 병용해서는 안 됩니다.
- 고용량 구연산 - 이전에 이 웹사이트에서 논의된 내용은 여기( Ref .) 구연산이 고려되는 경우 이 부분도 읽으십시오( Ref .).
- 레스베라트롤( Ref .) – 식품 보충제로 온라인에서 구할 수 있는 식물 추출물
젖산 탈수소효소(LDH) 억제제 :
피루브산을 젖산으로 전환합니다.
– LDH는 LDHA 및 LDHB 서브유닛으로 구성되며, 5개의 다른 조합으로 조립할 수 있습니다(LDH1은 4개의 LDHB 서브유닛으로 구성됨, LDH2는 3개의 LDHB 및 1개의 LDHA 서브유닛을 포함, LDH3은 2개의 LDHB 및 2개의 LDHA 서브유닛을 포함, LDH4는 1개의 LDHB 및 3개의 LDHA를 포함합니다. LDH5는 4개의 LDHA 서브유닛을 포함합니다)
– 암세포에 존재하는 LDH5 동위효소는 피루브산을 젖산으로 전환시키는 반면, LDH1 동위효소는 젖산을 가져와 이를 피루브산으로 전환할 수 있는 세포에 존재합니다( 참고 . )
- Diclofenac – GLUT1, LDHA 및 MCT1 억제( Ref .) – 항진통제로 사용되는 FDA 승인 약물 – 일반의약품
- Machilin A – 천연 제품 라이브러리의 480개 화합물 중 LDHA의 효소 활성에 대한 가장 강력한 억제제. MA는 lactate dehydrogenase에 결합하는 NADH cofactor의 억제를 통해 LDHA 활성을 억제했습니다( Ref .). 온라인에서 Nutmeg로 찾을 수 있는 검은 잎이 달린 상록수( Ref .)인 Myristica fragrans(향기로운 육두구 또는 진정한 육두구)에서 찾을 수 있습니다.
- 녹차의 에피갈로카테킨 ( Ref .1, Ref .2, Ref .3)
- 옥사메이트( 참조 .1, 참조 .2) – 사용할 수 없음.
- 목화씨 추출물인 Gossypol(AT-101이라고도 함)은 NADH의 결합을 차단하는 LDH(LDHA 및 LDHB)의 비선택적 억제제입니다( 참고 문헌 .). 쉽게 구할 수 없습니다.
- Galloflavin은 LDH(LDHA 및 LDHB) 이소형( 참고 )을 모두 억제합니다. 쉽게 구할 수 없습니다.
- 스티리펜톨 – LDH1 및 LDH5 억제( 참고 .) – 항 경련제 FDA 승인 약물( 참조 .)
- 크로세틴 – LDH5 억제( Ref .) – 사프란의 색상을 담당하는 화합물
- 비타민 C – LDHA 억제( 참고 .) – 온라인에서 보충 가능 – 스트레스에 대한 반응으로 LDHA 발현 억제( 참고 .)
- 프로프라놀롤 - 스트레스 유발 LDHA 발현을 억제할 수 있는 FDA 승인 약물( 참고 .) - 이전에 여기에서 논의됨( 참고 .)
참고로 만성 스트레스와 LDHA 활성화 및 유방암을 연결하는 최근 기사 가 있습니다 . LDH 억제제는 이를 역전시킬 수 있습니다( 참조 ). 이것은 녹차와 비타민 C가 만성 스트레스의 결과로 암 발병률을 줄이는 방법의 한 예입니다.
MCT(Monocarboxylate transporters) 억제제 :
발효가 끝나면 젖산은 세포 외부로(젖산으로) 내보내져야 하며 그 일은 MCT에 의해 수행됩니다. MCT1은 주로 젖산염 및 케톤체 섭취에 관여하는 반면, MCT4는 젖산염 방출에 관여합니다( 참조 ). 간에서 포도당신생합성을 위한 젖산도 MCT1을 통해 흡수됩니다( 참고 .)
- 아토르바스타틴 ( 참고 .) – 이전에 이 웹사이트에서 논의된 FDA 약물, 여기( 참조 .)
- Loratadine ( Ref .) – FDA 승인 약물(알레르기 치료에 사용되는 약물)
- Syrosingopine ( Ref .) – FDA 승인 약물 – 약물에 접근하고 복용하는 방법은 여기에서 논의됩니다 ( Ref .)
- 아크리플라빈( Ref .)
- 계피산( Ref .)
- 퀘르세틴 ( Ref .) – 양파의 천연 추출물로 온라인에서 식품 보충제로 발견되며 이전에 이 웹사이트(여기( Ref .)) 에서 논의된 바 있습니다.
- Diclofenac – GLUT1, LDHA 및 MCT1 억제( Ref .) – 항진통제로 사용되는 FDA 승인 약물 – 일반의약품
- N-Acetylcysteine(NAC)은 MCT4 간질 발현을 감소시킵니다( Ref .1, Ref .2) – 온라인에서 보충 가능 – 강력한 항산화제이므로 이 게시물에 나열된 많은 발효 억제제를 포함한 proxidant 요법과 결합해서는 안 됩니다.
다음은 해당과정/발효에 대한 간단한 대화형 경로 맵입니다. 그리고 여기 또 다른 훌륭하고 간단한 것이 있습니다. 더 복잡한 지도는 여기에서 액세스할 수 있습니다 .
발효를 간접적으로 억제하기 위해 돌릴 수 있는 몇 가지 추가 "손잡이":
PI3K/AKT/mTOR 억제제:
PI3K/AKT 신호는 고친화성 포도당 수송체(즉, GLUT1 및 GLUT4)의 발현 및 세포 표면 발현과 헥소키나아제 2(HK2) 및 6-포스포프럭토키나아제 1(PFK1)의 활성화를 유도합니다 . 1, Ref .2.)
mTOR는 세포 대사 및 성장을 광범위한 환경 입력과 연결하는 중앙 세포 성장 조절기입니다( Ref .) 참고: mTOR 억제제는 자가포식을 자극합니다(제 생각에는 발효와 호흡이 억제된다).
- 퀘르세틴 은 PI3K/AKT( 참고 .) – 양파의 천연 추출물로, 온라인에서 식품 보충제로 발견되며 이전에 이 웹사이트에서 논의되었습니다( 참조 .)
- 메트포르민은 AMP-활성화 단백질 키나아제(AMPK)의 활성화를 통해 mTOR를 억제 합니다 .
- Curcumin은 mTOR 를 억제 합니다 .
- Berberine은 mTOR( Ref .)를 억제합니다 – 온라인 식품 보충제로 이용 가능
- 레스베라트롤은 mTOR( 참고 )를 억제합니다 – 온라인 식품 보충제로 이용 가능
- 말차 녹차는 mTOR( Ref .)를 억제합니다 – 온라인 식품 보충제로 이용 가능
- 오메가 3 오일은 PI3K/AKT/mTOR( Ref .)를 억제합니다 – 온라인 식품 보충제로 이용 가능
- Nitazoxanide는 mTOR를 억제합니다( 참고 .) - FDA 승인 광범위 구충제
- Papaverine은 포도당 결핍 상태에서 성장하는 종양 세포에서 mTOR를 억제합니다( 참조 ) – FDA 승인 약물
- 낮은 세포질 pH는 mTOR 를 억제 합니다 .
- Bufalin은 PI3K/AKT/mTOR( 참고 )를 억제합니다.
HIF-1α 억제제:
저산소증 유도 인자 1-알파는 산소 센서입니다( 참고문헌 ). 2019년 노벨 의학상은 HIF-1α 관련 발견과 관련하여 William Kaelin, Jr., Sir Peter Ratcliffe 및 Gregg Semenza 에게 수여 되었습니다 . 유량. 산소가 존재하면 HIF-1α가 분해되고 산소가 감소하면 HIF-1α가 핵에 축적되어 세포 증식과 생존, 포도당 및 철 대사에 관여하는 유전자의 전사를 유도합니다. 또한 혈관 신생을 활성화하여 산소가 없는 저산소 영역으로 산소 전달을 증가시킵니다.이러한 맥락에서 HIF-1α는 F2,6BP 수준을 증가 시키고 PFK1을 활성화하기 위해 이기능성 효소 6-phosphofructo-2-kinase/F2,6BP(PFKFB3)를 유도합니다 . MCT4( 참고 .) 따라서 HIF-1α를 억제하면 발효와 혈관신생이 모두 억제될 수 있습니다.
- Sulforaphane ( Ref .) – 온라인에서 보충제로 발견된 브로콜리 추출물
- Digoxin( Ref .) 과 같은 심장배당체 . 다른 강심 배당체는 egOleander, Ouabain, Bufalin 입니다.
- 아크리플라빈( Ref .)
- 알벤다졸 ( 참고 .) – 항기생충 활성이 있는 FDA 승인 약물. 나는 그것을 좋아하지만 장기간 사용하면 간에 부정적인 영향을 미칠 것입니다.
- 메나디온(비타민 K3) 및 에타크린산(FDA 승인 약물)( 참고 .)
- 실리비닌/실리빈( Ref .) – 밀크 시슬의 표준화된 추출물인 실리마린 의 주요 활성 성분 – 온라인에서 식품 보충제로 발견됨
- 아토르바스타틴 ( Ref .) – 이전에 이 웹사이트에서 논의된 FDA 승인 약물, 여기( Ref .)
- Luseogliflozin ( Ref .) – 제2형 당뇨병(T2DM) 환자 치료를 위해 일본에서 승인된 약물( Ref .)
c-Myc 억제제:
세포 대사 및 증식의 "주요 조절자" - 악성 변화를 유발하는 많은 변화를 담당하는 유전자. c-Myc가 해당과정의 조절에 중요한 역할을 한다는 것이 관찰되었는데 젖산탈수소효소 A(LDHA)였다. 그러나 포도당 수송체 GLUT1, hexokinase 2(HK2), phosphofructokinase(PFK) 및 enolase 1(ENO1)을 포함한 많은 포도당 대사 유전자는 c-Myc에 의해 직접 조절됩니다. 또한, c-Myc는 미토콘드리아 기능도 증가시키는 것으로 보입니다( 참조 ). c-Myc 활동은 mTOR에 의해 조절됩니다. 참고로 c-Myc는 글루타민분해 증가 과정과도 관련이 있습니다.
- Diclofenac은 c-Myc를 억제합니다( 참고 .) – 항진통제로 사용되는 FDA 승인 약물 – 일반의약품
- Phenylbutyrate는 c-Myc를 억제할 가능성이 있음( Ref .) – FDA 승인 약물
- 그것은 또한 mTOR 억제제일 수 있습니다 – 연구에 따르면 아미노산은 mTOR의 활성화에 중요하며 Phenylbutyrate로 유도된 글루타민 고갈은 mTOR를 억제할 수 있으며 mTOR가 c-Myc를 조절하므로 c-Myc를 추가로 억제할 수 있습니다.
- Sodium Butyrate는 c-Myc( Ref .)를 감소시킵니다 – 매우 나쁜 냄새가 나는 온라인 보충제
- Nitazoxanide는 c-Myc를 억제합니다( Ref .) – FDA 승인 광범위 구충제
기타:
증식하는 암세포의 대사를 조절하는 PI3K/AKT/mTOR/c-Myc 및 PI3K/AKT/mTOR/HIF-1과 같은 신호 경로는 이 기사 의 그림 2 에 간단한 방식으로 제시되어 있습니다.
위 목록을 계속 업데이트하고 귀하의 의견과 제 연구를 바탕으로 더 많은 억제제를 추가할 것입니다.
************************************************************************
호흡억제제 = respiration inhibitors
https://www.cancertreatmentsresearch.com/a-list-of-mitochondria-inhibitors/
A List of Mitochondria Inhibitors, Disrupting Cancer Cell Function - Cancer Treatments - from Research to Application
When looking at cancer as a metabolic disease, mitochondria (the engine of the cell) plays a key role in tumor development (Ref.). As a result, mitochondria inhibitors are important tools to be included in an anticancer treatment strategy. There is vast am
www.cancertreatmentsresearch.com
A List of Mitochondria Inhibitors, Disrupting Cancer Cell Function
암을 대사 질환으로 볼 때 미토콘드리아(세포의 엔진)는 종양 발달에 핵심적인 역할을 합니다( 참고 문헌 .).
결과적으로 미토콘드리아 억제제는 항암 치료 전략에 포함되는 중요한 도구입니다.
“많은 유형의 종양에서 표적 요법 또는 화학 요법 약물로 치료한 후 발생하는 약물 내성 세포는 감수성 세포와 구별되는 대사 프로필을 나타냅니다.
현재 치료법에 민감한 빠르게 성장하는 종양 세포는 일반적으로 에너지 및 생합성 요구를 지원하기 위해 포도당 섭취 및 포도당의 젖산염으로의 해당 분해의 향상된 활동을 보여줍니다.
대조적으로, 많은 치료법에서 발생하는 내성 하위 집단은 생합성 및 생체 에너지 필요를 위해 미토콘드리아 대사 활동인 크렙스 주기 및 산화 인산화(OXPHOS)에 크게 의존하는 느리게 성장하는 집단입니다.
이러한 저항성 세포는 종양을 전이하고 개시하는 더 큰 능력을 가지고 있으므로, 저항성 하위 집단을 근절하는 것은 현대 항암제 개발의 중요한 측면입니다.
미토콘드리아 대사 활동에 대한 내성 집단의 의존성은 OXPHOS를 표적으로 하는 대사 조절제에 매우 민감하게 만들고, OXPHOS 조절제의 조합은 다양한 전임상 연구에서 종양의 재발을 억제하는 데 효과적인 치료 옵션임이 입증되었습니다.” ( 참고 .)
여기에서 논의한 바와 같이( Ref .) 최근 미토콘드리아 억제제가 화학요법 효과를 높이기 위해 화학요법 당일에 투여하는 것이 가장 좋은 것으로 나타났습니다.
그와 대조적으로 화학 요법 전에 투여하면 화학 요법 효과가 감소할 수 있습니다
(확인하기 위해 Rafael Pharmaceuticals에 연락했지만 응답이 없었습니다).
그럼에도 불구하고 미토콘드리아 억제제만으로는 종양을 죽이기에 충분하지 않을 수 있지만, 위에서 인용한 임상 시험에서 알 수 있듯이 화학 요법, 방사선과 같은 다른 치료법(또한 2-dg, 3-dg, 3-dg, BP 등), 결과는 매우 관련이 있을 수 있습니다.
다음은 내가 알고 있는 미토콘드리아 억제제 목록이며, 이들이 방해하는 미토콘드리아 관련 메커니즘에 따라 그룹화됩니다
( 그림 9는 산화적 인산화와 관련된 미토콘드리아 전자 수송 사슬 복합체를 보여주는 좋은 그림입니다).

그림 9. 산화적 인산화에 관여하는 미토콘드리아 전자 수송 사슬 복합체.
미토콘드리아 복합체 I 억제제:
- Berberine ( Ref .) - 온라인 식품 보조제로 이용 가능한 천연 추출물
- Papaverine ( Ref .1, Ref .2) – 미토콘드리아 복합체 I의 억제제 – 내장 경련 및 혈관 경련의 치료에 주로 사용되며 때때로 발기 부전 치료에 사용되는 FDA 승인 약물
- Metformin ( Ref .) – 미토콘드리아 복합체 I의 억제제 – FDA 승인 약물 – 저렴하고 사용 가능
- Pyrvinium Pamoate , – 미토콘드리아 복합체 I의 억제제 ( 참고 .) – FDA 승인 약물 – 저렴하고 이용 가능하지만 인체 흡수율이 낮음
- Canagliflozin =SLGT2 억제제 ( Ref .) – FDA 승인 약물 – 저렴하고 사용 가능-인보카나(국내에 없음)
- Honokiol ( Ref .). – 천연 물질 – 온라인 보충제로 이용 가능 – 복합 I 억제( 참고 .)
- Niclosamide , Nitazoxanide , Closantel ( Ref .) – FDA 승인 약물 억제 복합체 I ( Ref .)
- Arctigenin ( Ref .) – 일반적으로 큰 우엉이라고 불리는 Arctium lappa에서 발견 – 또한 일부 암의 대체 치료를 위한 Essiac 차의 성분 ( Ref .) – 복합 I 억제
- Luseogliflozin =SLGT2 억제제 ( Ref .) – ( Ref .)(국내에 없음)
미토콘드리아 복합체 II 억제제:
- Lonidamine – Mitochondrial Complex II의 억제이지만 쉽게 구할 수 없음( Ref .)
미토콘드리아 복합체 III 억제제:
미토콘드리아 복합체 IV 억제제:
미토콘드리아 복합체 V 억제제:
- Meclizine , – Mitochondrial Complex V( Ref .1, Ref .2) 억제– FDA 승인 약물 – 저렴하고 사용 가능
- 베다퀼린 – FDA 승인 항생제는 미토콘드리아 ATP-합성 효소(복합체 V)를 억제합니다( 참조 .1, 참조 .2)
- 올리고마이신 ( Ref .). – 승인되지 않음 – 비싸고 안전하지 않으며 접근하기 쉽지 않음 – 미토콘드리아 ATP-합성 효소(복합체 V) 억제( 참고 .)
다중 복합체 억제제:
- 페노피브레이트 ( 참고 .) – FDA 승인 약물은 복합체 I, II+III 및 V( 참고 .) 를 억제합니다.
- Troglitazone ( Ref .) – FDA 승인 약물 – 저렴하고 시판되는 Complexes II+III, IV 및 V 억제 – Complex IV를 가장 강력하게 억제 ( Ref .)
- 퍼헥실린 ( Ref .1, Ref .2) – 아시아, 호주 및 뉴질랜드에서 항협심증제로 사용하도록 승인됨 – 복합체 I 및 II( Ref .) 및 지방산의 미토콘드리아 베타 산화( Ref . )
기타 미토콘드리아 억제 메커니즘:
- 아르테미시닌 – 미토콘드리아 기능 중단( Ref .1, Ref .2) – 이전에 이 웹사이트에서 논의된 식물 추출물( Ref .)
- Doxycycline , – FDA 승인 약물 – 저렴하고 이용 가능 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제( Ref .)
- Tigecycline ( Ref .) – FDA 승인 약물 – 주사 가능 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제 ( Ref .)
- Azithromycin – FDA 승인 약물 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제( 참고 .)
- Salinomycin ( Ref .) – 승인되지 않음 – 고가, 정맥주사, 이미 인체에 사용되었으며 암에 효과적인 것으로 나타났음 – 미토콘드리아의 빠른 과분극 및 미토콘드리아 매트릭스 산성화
알려지지 않은 정확한 메커니즘(적어도 나에게는):
- 프로프라놀롤 ( 참조 .1, 참조 .2, 참조 .3) – FDA 승인 약물 – 경구용, 저렴하고 사용 가능
- 프로폴리스 유래 카페산 페닐 에스테르 (Caffeic acid phenyl ester = CAPE)( Ref .)
기타:
- 페르페나진 및 트리플루오페라진( Ref .)
- 메틸글리옥살 ( 참조 )
- 리모닌 – 천연 추출물( Ref .)
- 다음은 추가 미토 억제제( Ref .) 를 포함하는 기사 이고 여기 또 다른 기사( Ref .) 가 있습니다.
- Graviola의 Bullatacin 및 기타 아세토게닌( 참조 .0, 참조 .1, 참조 .2)
- 많은 미토콘드리아 억제제 목록( Ref .)
다음은 암의 미토콘드리아를 표적으로 하는 천연 제품 목록입니다 .
No.Isolated CompoundOriginCell LineMechanismReference
| Terpenoids | |||||
| 1 | Ganoleuconin O | Ganoderma leucocontextum | Fatty acid immobilization, loss of the mitochondrial lipid cardiolipin | [30] | |
| 2 | Lupeol | Bombax ceiba | Mitochondrial hyper fission | [31] | |
| 3 | Betulinic acid | Betula alba | Cardiolipin modification, ROS generation, Bad, caspase 9 | [32,33] | |
| 4 | Alisol B-23-acetate | Alisma orientale | ROS generation, Bcl-2↓, Bax↑, activation of caspase-3, -9, release of cytochrome c/AIF | [34] | |
| 5 | Genipin | Gardenia jasminoides | Activation of dicarboxylate carrier, decreased activity of UCP1, UCP3, and complex III of the respiratory chain, UCP2 inhibition | [35] | |
| 6 | Alternol | Yew tree | Decrease of mitochondrial respiration, isocitric acid, fumaric acid and malic acid, ATP production | [36,37] | |
| 7 | Cyathin Q | Cyathus africanus | Bcl-2↓, Bax↑, Bcl-xL↓, ROS generation, release of cytochrome c | [38] | |
| 8 | 3α-hydroxy-19α-hydrogen-29-aldehyde-27-lupanoic acid | Potentilla discolor | Bcl-2↓, Bax↑, release of cytochrome c | [39] | |
| 9 | Uvedafolin | Smallanthus sonchifolius | MMP loss, release of cytochrome c | [40] | |
| 10 | Heteronemin | Hippospongia sp. | ROS generation | [41] | |
| 11 | Jatrogossone A | Jatropha gossypiifolia | MMP loss, ROS generation | [42] | |
| 12 | Walsuronoid B | Walsura robusta | ROS generation, mitochondrial and lysosomal dysfunction | [43] | |
| 13 | Ferruginol | Podocarpus ferruginea | ROS generation, MMP loss, Bcl-2↓ | [44,45] | |
| 14 | Lobocrassin B | Lobophytum crassum | Bcl-2↓, Bax↑, ROS generation, MMP loss, release of cytochrome c, activation of caspase-3 | [46] | |
| 15 | Aellinane | Euphorbia aellenii | Bcl-2↓, Bax↑, ROS generation, MMP loss | [47] | |
| 16 | Tingenin B | Maytenus sp. | Bcl-2↓, Bax↑, MMP loss | [48] | |
| 17 | 3-O-trans-p-coumaroyl alphitolic acid | Ziziphus jujuba | ROS generation | [49] | |
| 18 | Zerumbone | Zingiber zerumbet | Tubulin binding and crosstalk between endoplasmic reticulum stress and mitochondrial insult | [50,51] | |
| Flavonoids | |||||
| 19 | Isoquercitrin | Hibiscus cannabinus | LSD1-induced mitochondrial-mediated apoptosis pathway | [52,53] | |
| 20 | Luteolin | Cauliflower, peanut, and carrot | Inhibitor of Bcl-2, mitochondrial permeabilization | [54] | |
| 21 | Dihydromyricetin | Ampelopsis grossedentata | Akt/Bad signal pathway, mitochondrial apoptotic pathway, Bax↑, Bad↑, inhibition of the phosphorylation of Bad at Ser136 and Ser112 | [55,56] | |
| 22 | Artonin E | Artocarpus elasticus | Release of cytochrome c, Activation of caspases-3, -8, and -9, Bax↑, Bcl-2↓, HSP70↓, survivin↓ | [57] | |
| 23 | Myricetin | Fruits and vegetables | Bax/Bcl-2↑, release of AIF | [58] | |
| 24 | Xanthones | Garcinia xanthochymus | Bax↑, Bcl-2↓, Bcl-xL↓, Mcl-1↓, and survivin↓ | [59] | |
| 25 | Cycloartobiloxanthone | Artocarpus gomezianus | Bax↑, Bcl-2↓, Mcl-1↓ | [60] | |
| 26 | Paratocarpin E | Euphorbia humifusa | Bax↑, Bcl-2↓, release of cytochrome c | [61] | |
| 27 | Puerarin 6′’-O-xyloside | Pueraria lobata | Bax↑, Bad↑, Bcl-2↓, caspase-3 and -9 activation | [62] | |
| 28 | α-mangostin | Cratoxylum arborescens | ROS generation, MMP loss, release of cytochrome c | [63] | |
| 29 | Chrysin | Honey and propolis | ROS generation, MMP loss, release of cytochrome c, swelling in mitochondria | [64,65] | |
| 30 | Fisetin | Strawberries, apples, grapes, onions, and cucumbers | ROS generation, Ca2+ production, MMP loss, Bcl-2↓, Bax↑, Bid↑, release of cytochrome c, AIF, and Endo G | [66,67] | |
| 31 | Baicalein | Scutellaria baicalensis, Scutellaria radix | Combination therapy with baicalein and taxol had much higher antitumor effects compared with the monotherapy. Release of cytochrome c, and caspase-3 and -9 activation |
[68,69] | |
| 32 | Alpinetin | Zingiberaceous plants |
Bcl-2↓, Bax↑, Bcl-xL↓, XIAP↓, PI3K/Akt signaling pathway, sensitized drug-resistant lung cancer cells | [70,71] | |
| 33 | Chamaejasmin B | Stellerachamaejasme | Bcl-2↓, Bax↑, MMP loss, release of cytochrome c and AIF | [72] | |
| 34 | Mensacarcin | Streptomyces bacteria | Release of cytochrome c, energy production and mitochondrial function rapidly disturbed | [73] | |
| Saponins | |||||
| 35 | Gracillin | Dioscorea gracillima | Targeting mitochondrial complex II, suppressing ATP synthesis, ROS generation | [74] | |
| 36 | Polyphyllin I | Paris polyphylla | Mitochondrial translocation of DRP1, mitochondrial fission, release of cytochrome c, mitochondrial PTEN-induced kinase 1↑ | [75,76] | |
| 37 | Frondoside A | Cucumaria frondosa | Bcl-2↓, survivin↓, release of HtrA2/Omi and cytochrome c, ROS generation | [77] | |
| 38 | 3β-O-α-l- arabinopyranoside |
Clematis ganpiniana | Release of cytochrome c and Apaf-1, upregulation of caspase-9 and caspase-3 | [78] | |
| 39 | Sakuraso-saponin | Aegiceras corniculatum | Bcl-xL↓ | [79,80] | |
| 40 | Ginsenoside compound K | Panax ginseng | Bcl-2↓, Bcl-xL↓ | [81] | |
| 41 | Escin | Aesculus hippocastanum | G2/M arrest and ROS-modulated mitochondrial pathways | [82] | |
| 42 | α-Hederin | Hedera helix | NF-κB signaling pathway, Bcl-2↓, Bax↑, release of cytochrome c | [83,84] | |
| Alkaloids | |||||
| 43 | Cathachunine | Catharanthus roseus | ROS-dependent mitochondria-mediated intrinsic pathway, Bcl-2/Bax↓, ROS generation, MMP loss, release of cytochrome c | [85] | |
| 44 | Berberine | Rhizoma coptidis | ERK1/2-mediated impairment of mitochondrial aerobic respiration | [86,87] | |
| 45 | Papuamine | Haliclona sp. | Intracellular ATP depleted by causing mitochondrial dysfunction, mitochondrial superoxide production | [88] | |
| 46 | Bis (2-ethyl hexyl) 1H-pyrrole-3, 4-dicarboxylate | Tinospora cordifolia | ROS generation, increase in intracellular calcium, phosphorylation of p53, mitochondrial membrane depolarization, MPTP, and cardiolipin peroxidation, Bcl-2↓, Bax↑, release of cytochrome c, caspase activation, DNA fragmentation | [89] | |
| 47 | Unantimycin A | Found in the fraction library of microbial metabolites | Targeted inhibition of mitochondrial complex I | [90] | |
| 48 | NPL40330 | Found in chemical library | Targeted inhibition of mitochondrial complex III | [90] | |
| 49 | Boholamide A | Marine mollusks | Influx of Ca2+ | [91] | |
| 50 | Cernumidine | Solanum cernuum | Cytotoxicity and chemosensitizing effect of cernumidine to cisplatin. Bcl-2↓, Bax↑, MMP loss | [92] | |
| 51 | Lycorine | Amaryllidaceae plant family | mPTP opening, MMP loss, ATP depletion, release of Ca2+ and cytochrome c, caspase activation | [93] | |
| 52 | Lagunamides A | Lyngbya majuscule | MMP loss, ROS generation | [94] | |
| 53 | Cordycepin | Cordyceps | Downregulation of mitochondrial function and limitation of energy production; metastasis and migration suppressed | [95,96] | |
| Coumarins | |||||
| 54 | 2,3-Dihydro-7- hydroxy-2R*,3R*- dimethyl-2-[4,8-dimethyl-3(E),7- nonadienyl]-furo[3,2-c]coumarin |
Ferula ferulaeoides | MMP loss, Bcl-xL↓, Bcl-2↓, Bax↑, cleavage of Bid, FAS↑, FADD↑ | [97] | |
| 55 | Dentatin | Clausena excavate | Bcl-xL↓, Bcl-2↓, Bax↑, release of cytochrome c | [98,99] | |
| 56 | Aesculetin | Cortex Fraxini | Bcl-2↓, Bax↑ | [100] | |
| Quinones | |||||
| 57 | Quambalarine B | Quambalaria cyanescens | Inhibition of mitochondrial complex I and II, inhibition of mitochondrial respiration, metabolism reprogramming | [101,102] | |
| 58 | Plumbagin | Plumbago zeylanica | ROS generation, Bcl-2↓, Bax↑, Bcl-xL↓, and Bak↓, endoplasmic reticulum stress | [103] | |
| 59 | Shikonin | Lithospermum erythrorhizon | Bcl-2↓, Bax↑, survivin↓ | [104] | |
| 60 | 2,7-dihydroxy-3-methylanthraquinone | Hedyotis diffusa | Bcl-xl↓, Bcl-2↓, Bax↑, Bad↑, release of cytochrome c | [105] | |
| 61 | 3-hydroxy-1,5,6-trimethoxy-2-methyl-9,10-anthraquinone | Prismatomeris connate | Bcl-2↓, Mcl-1↓, Bax↑ | [106] | |
| 62 | Thymoquinone | Nigella sativa | Bcl-2↓, Bax↑, release of cytochrome c and AIF | [107] | |
| Miscellanea | |||||
| 63 | Methylsulfonylmethane | Fruits and vegetables | Bcl-xL↓, Bcl-2↓, Bax↑, release of cytochrome c, MMP loss | [108,109] | |
| 64 | Parameritannin A-2 | Urceola huaitingii | Enhanced doxorubicin-induced mitochondria-dependent apoptosis, inhibition of the PI3K/Akt, ERK1/2 and p38 pathways, Bcl-2↓, Bcl-xl↓, Bax↑, Bid↑, release of cytochrome c, caspase activation | [110] | |
| 65 | Resveratrol | Polygonum cuspidatum, Veratrum nigrum, Cassia obtusifolia |
Enhanced antitumor activities of cisplatin; Induced apoptosis |
[111,112] | |
| 66 | Oleuropein | Olea europaea | Bcl-2/Bax↓, release of cytochrome c, activation of caspase-3 | [113,114] | |
| 67 | Homoisoflavanone-1 | Polygonatum odoratum | Mitochondria-caspase-dependent and ER stress pathways, Bcl-2/ Bak↓ | [115] | |
| 68 | Gallic acid | Green tea, grapes, red wine |
ROS-dependent mitochondrial apoptotic pathway | [116] | |
| 69 | Hierridin b | Cyanobium sp. | Proteomics identified 21 differentially expressed proteins belonging to the categories protein folding/synthesis and cell structure and reduced mitochondrial activity and as confirmed by morphological analysis of mitochondrial parameters |
[117,118] | |
| 70 | Deoxyarbutin | Ecklonia cava | MMP loss, ATP depletion and ROS overload generation | [119] | |
| 71 | Magnolol | Magnolia officinalis | P53, Bcl-2/Bax↓, release of cytochrome c, caspase activation, ROS generation | [120] | |
| 72 | Oblongifolin C | Garcinia yunnanensis | Mitochondrial dysfunction | [121] | |
| 73 | Amorfrutin C | Glycyrrhiza foetida | mPTP opening, mitochondrial oxygen consumption and extracellular acidification increased | [122] | |
| 74 | Allyl isothiocyanate | Cruciferous vegetables | ROS and Ca2+ production, MMP loss, release of cytochrome c, AIF, and Endo G, Bcl-2↓, Bax↑ | [123,124] | |
| 75 | α-conidendrin | Taxus yunnanensis | ROS generation, p53↑, Bax↑, Bcl-2↓, MMP loss, release of cytochrome c, activation of caspases-3 and -9 | [125] | |
| 76 | Dehydrobruceine B | Brucea javanica | MMP loss, release of cytochrome c, cleavage of caspase-9, caspase-3, and poly (ADP-ribose) polymerase (PARP) | [126] | |
| 77 | Frugoside | Calotropis procera | ROS generation | [127,128] | |
| 78 | Methyl caffeate | Solanum torvum | Bcl-2↓, Bax↑, Bid↑, p53↑, cleavage of caspase-3 and PARP, release of cytochrome c | [129] | |
| 79 | Tetrahydrocurcumin | Curcuma longa | ROS generation, Bcl-2↓, PARP↓, Bax↑, release of cytochrome c, MMP loss | [130] | |
| 80 | Phloretin | Apple tree leaves and Manchurian apricot | Bcl-2↓, Bax↑ | [131] | |
| 81 | Sesamol | Sesame seeds | Bcl-2↓, Bax↑, MMP loss, H2O2 production, PI3K Class III/Belin-1 pathway | [132] | |
메모:
- mito 억제제를 해당작용(발효) 억제제와 결합하는 것은 서로 다른 암 세포 유형이 다른 생체에너지 변화를 겪을 수 있기 때문에 의미가 있습니다.
- 또한, mito 억제제만을 사용하면 해당작용과 전신 산도가 증가할 것으로 예상됩니다. 따라서 미토저해제를 장기간 사용한다면 당화억제제(예: 2DG , 고용량 비타민C 등) 및 양성자펌프억제제( 여기서 논의한 것 등 )와 알칼리화제를 병용하는 것이 좋을 뿐만 아니라 바람직할 수 있다. 보조제(예: Basetabs).
- 흥미롭게도 Salinomycin과 같은 양성자 이오노 포어=proton ionophore와 결합 된 Metformin과 같은 mito 억제제는 mito 억제제로 인해 초기에 당화로 전환되는 종양 세포에서 "Warburg trap"을 유도 할 것이라고 제안되었습니다 . 그러나 당화작용은 종양 주변의 산도를 증가시키는 것보다 낫습니다. 반면에 살리노마이신은 양성자 이노포어(proton inophore) 작용으로 인해 양성자를 암 세포가 좋아하지 않는 종양으로 되돌려 보낼 것입니다. 그래서 그들은 모든 에너지를 소비하는 세포 밖으로 양성자를 다시 밀어내려고 할 것입니다. 세포가 더 많은 에너지를 생산하려고 하면 다시 양성자 생산으로 이어지는 당분해를 통해서만 그렇게 할 수 있습니다. 이것이 바로 "워버그 트랩"이라 불리는 것으로 암세포가 세포내 높은 산도로 인해 느려지고 결국 죽게 되는 시점입니다.참조 .). 같은 논문에서 저자는 다음과 같이 말했습니다. 종양 재발 위험을 예방하기 위한 Wnt 신호.” 나는 이것이 두 개의 mito 억제제(메트포르민과 독시시클린)와 살 리노마이신을 양성자 이노포로 결합하는 치료 전략에 대한 좋은 아이디어라고 생각합니다 .
- 그러나 카나글리포진과 2DG의 병용에 대해서는 알려지지 않은 측면이 있다. 그것은 Canaglifozin의 주요 기능이 포도당 운반체를 억제하기 때문입니다. (Mito 억제는 약물에 대한 비표적 작용일 뿐입니다.) 이것이 오늘날 Canaglifozin이 항 당뇨병 약물로 사용되는 이유입니다 . 그리고 열린 질문은 두 가지를 결합하는 것이 좋은지 여부입니다.
- 단점은 Canaglifozin이 암세포의 2DG 흡수를 감소시킬 수 있다는 것입니다.
- 반면에 장점은 Canaglifozin이 암세포의 2DG 흡수뿐만 아니라 포도당의 흡수도 감소시킬 수 있다는 것입니다. 이렇게 하면 항암 효과는 더 높아지지만 정상 세포도 이 두 가지 약물의 영향을 받기 때문에 부작용도 높아질 수 있습니다.
2019년 7월 8일 업데이트: 최근 Nature에 발표된 논문에 따르면 FDA 승인 약물인 Heme(Panhematin으로 판매됨)에 의한 BACH1의 억제는 암세포가 미토콘드리아 호흡에 더 의존하게 하고 결과적으로 미토콘드리아 억제제에 더 취약하게 만듭니다(참고 . )
기타 참조:
미토콘드리아 대사 및 암 https://www.nature.com/articles/cr2017155#ref172
당분해는 오랫동안 암세포의 에너지 생산 및 단백 동화 성장을 위한 주요 대사 과정으로 여겨져 왔습니다.
그러한 견해가 여전히 클리닉에서 사용되는 강력한 이미징 도구의 개발에 도움이 되었지만, 이제 미토콘드리아가 발암에서 중요한 역할을 한다는 것이 분명해졌습니다.
미토콘드리아는 중추적인 생체 에너지 기능을 발휘하는 것 외에도 실제로 종양 동화 작용을 위한 구성 요소를 제공하고, 산화 환원 및 칼슘 항상성을 제어하고, 전사 조절에 참여하고, 세포 사멸을 제어합니다.
따라서 미토콘드리아는 새로운 항암제 개발을 위한 유망한 표적이 됩니다.
그러나 종양은 숙주 면역계와의 친밀한 누화 맥락에서 발생, 진행 및 치료에 반응하며 많은 면역 기능은 온전한 미토콘드리아 대사에 의존합니다.
종양성 미토콘드리아 에너지 대사를 표적화하고 투명 세포 육종에서 자가포식을 억제하기 위한 CPI-613의 치료 가능성. https://www.ncbi.nlm.nih.gov/pubmed/29879220
투명 세포 육종(CCS)은 높은 전이율과 관련된 공격적인 유형의 연조직 종양입니다.
흥미롭게도, 자가포식소체와 리소좀의 융합을 억제하는 클로로퀸과 함께 CPI-613은 시험관 내에서 HS-MM CCS 세포 성장의 괴사를 유의하게 유도했습니다.
Canagliflozin 매개 미토콘드리아 글루타메이트 탈수소효소 및 복합체 I의 이중 억제: 표적 외 부작용. https://www.ncbi.nlm.nih.gov/pubmed/29445145
최근 FDA 의약품 안전 커뮤니케이션(Drug Safety Communications)은 제2형 당뇨병 치료에 사용되는 글리플로진 계열의 나트륨/포도당 동시 수송 억제제로 치료받은 환자에서 급성 신장 손상 위험이 증가했다고 보고했습니다.
글리플로진을 중앙 탄소 대사 및 미토콘드리아 기능의 억제제와 대조하는 표적 대사체학 접근법은 카나글리플로진에 대한 이중 작용 방식을 밝혔지만 유사체 다파글리플로진 및 엠파글리플로진에 대해서는 그렇지 않았습니다.
카나글리플로진은 임상적으로 관련된 농도에서 글루타메이트 탈수소효소(GDH)와 미토콘드리아 전자 수송 사슬(ETC) 복합체 I을 억제했습니다.
이 이중 억제는 특히 글루타민에 의한 트리카르복실산 회로 대사 산물의 보충(아나필러시스)을 방지하여 보상적 트랜스아미네이션 반응을 증가시켜 아미노산 풀을 변경했습니다.
트로글리타존은 미토콘드리아 호흡을 억제하여 18F-FDG의 암세포 흡수를 자극하고 포도당 제한에 대한 민감도를 증가시킵니다 . https://www.ncbi.nlm.nih.gov/pubmed/26449833
우리는 troglitazone이 암세포의 포도당 대사와 (18)F-FDG의 흡수에 어떤 영향을 미치는지 평가하고, 분자 메커니즘과 약물의 항암 효과와의 관계를 조사했습니다.
결론:
Troglitazone은 손상된 미토콘드리아 산화 호흡에 대한 적응 반응으로 가능성이 있는 해당 플럭스로의 대사 이동을 통해 (18)F-FDG의 암 세포 흡수를 자극합니다.
암 줄기 세포(CSC): 식별 및 박멸을 위한 대사 전략 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5941316/
표현형 및 기능적 이질성은 다양한 종양 유형 내에서 암세포의 가장 관련성이 높은 특징 중 하나이며 치료 실패의 원인이 됩니다.
암 줄기 세포(CSC)는 암 세포 유형의 전체 레퍼토리를 생성하는 능력 때문에 종양 이질성의 근본 원인으로 간주되는 줄기 세포와 유사한 특성을 가진 세포 집단입니다.
또한 CSC는 전이성 전파 및 치료 저항성의 주요 동인으로 사용되었습니다.
이와 같이 CSC를 표적으로 삼는 것은 고전적인 항암 요법의 효과를 향상시키는 유용한 전략이 될 수 있습니다.
최근 신진대사는 CSC 생물학에서 중요한 역할을 하는 것으로 간주되고 있으며, 실제로 발암성 변화는 대사산물에 의한 CSC의 확산을 유발합니다.
더 흥미로운 사실은 CSC 유지에 있어 대사 경로의 작용이 단순히 게놈 변화의 결과만은 아닐 수 있다는 점입니다..
실제로, 특정 대사형 표현형=metabotypic phenotypes은 줄기 형질을 유지하는 데 원인적인 역할을 하여 줄기 형질의 조율자 역할을 할 수 있습니다.
여기에서는 CSC의 대사적 특징에 대한 최신 연구를 검토하여 CSC의 유지 및 번식에 관여하는 생화학적 에너지 경로에 초점을 맞춥니다.
대사 생화학적 유연성 부족을 효과적으로 표적으로 삼기 위해 특정 대사 의존성 내에서 CSC를 '강제=force'할 수 있는 가능성과 함께 CSC를 식별하고 선택적으로 근절할 수 있는 포괄적인 대사 접근법의 잠재력에 대해 설명합니다.
마지막으로 미토콘드리아를 표적으로 삼아 CSC의 확산을 막고 암을 효과적으로 박멸하는 데 초점을 맞추고 있습니다.
미토콘드리아를 표적으로 하는 항생제는 여러 종양 유형에 걸쳐 암 줄기 세포를 효과적으로 박멸합니다. 전염병과 같은 암 치료 http://www.oncotarget.com/index.php?journal=oncotarget&page=article&op=view&path[0]=3174&path[1] =6141
독시사이클린과 아지스로마이신(암 세포가 아닌 암 관련 감염을 표적으로 함)을 사용한 최근 임상 시험은 암 줄기 세포를 박멸하는 능력이 아직 평가되지 않았지만 암 환자에게 이미 긍정적인 치료 효과를 보여주었습니다.
암 치료를 위한 티게사이클린의 사용 https://patents.google.com/patent/WO2011109899A1/en
암 치료의 새로운 표적으로서의 산화적 인산화 https://www.ncbi.nlm.nih.gov/pubmed/29420223
암세포는 정상 세포에 비해 해당작용을 상향 조절했으며, 이로 인해 많은 사람들이 모든 암에서 산화적 인산화(OXPHOS)가 하향 조절된다는 가정을 하게 되었습니다.
그러나 최근 연구에 따르면 OXPHOS는 백혈병, 림프종, 췌관 선암종, 높은 OXPHOS 아형 흑색종, 자궁내막 암종을 포함한 특정 암에서 상향조절될 수 있으며 이는 활성 해당작용에도 불구하고 발생할 수 있습니다.
따라서 OXPHOS 억제제는 OXPHOS가 상향 조절되는 암 아형을 표적으로 삼고 치료적으로 불리한 종양 저산소증을 완화하는 데 사용될 수 있습니다.
메트포르민, 아토바쿠온, 삼산화비소를 포함한 여러 약물이 비종양 적응증에 임상적으로 사용되지만, 새로운 데이터는 OXPHOS 억제제로서의 잠재적 용도를 보여줍니다.
휴면 종양 회전 타원체 영역의 세포를 표적으로 하는 화합물 식별을 위한 3D 고함량 스크리닝 https://www.sciencedirect.com/science/article/pii/S0014482714000263
NADH 자가형광, 암 줄기세포의 새로운 대사 바이오마커: "줄기"를 표적으로 하는 천연 제품으로서 비타민 C 및 CAPE 식별 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5400535/
여기에서 우리는 암 줄기 유사 세포(CSC)의 증식에서 대사 이질성의 역할을 조사하기 위해 광범위한 분자 "도구 키트"를 조립했습니다.
다양한 세포 집단을 "줄기 세포 활성"에 대해 기능적으로 평가했습니다.
우리의 결과는 증가된 PGC1α 활성, 높은 미토콘드리아 ROS/H2O2 생산 및 높은 NADH 수준을 가진 MCF7 세포의 하위 집단이 모두 더 높은 효율을 가진 맘모스피어를 형성한다는 것을 나타냅니다.
따라서, 미토콘드리아 산화 스트레스와 항산화제 반응은 모두 CSC에서 미토콘드리아 biogenesis 와 oxidative metabolism 촉진에 기여하는 것으로 보입니다.
특정 억제제를 사용하여 대사 과정(NAD+ salvage pathway=구제 경로, 해당 작용, 미토콘드리아 단백질 합성 및 OXPHOS)을 표적으로 삼아 CSC 증식을 크게 줄임으로써 추가 검증이 제공되었습니다.
결과적으로, 우리는 현재 임상적으로 승인된 다양한 약물(스티리펜톨), 천연 제품(카페산 페닐 에스테르(CAPE), 아스코르빈산, 실리비닌) 및 실험적 의약품(악티노닌, FK866, 2-DG)을 확인했습니다.
효과적으로 CSC 활동을 억제하는 데 사용됩니다.
CAPE(꿀벌 프로폴리스에서 추출)와 비타민 C를 잠재적인 자연 치료 방식으로 사용하는 방법에 대해 논의합니다.
이러한 맥락에서, 비타민 C는 암 줄기 세포를 표적으로 삼는 데 2-DG보다 약 10배 더 강력했습니다.
마찬가지로, 스티리펜톨은 2-DG보다 50~100배 더 강력했습니다.
.
화학저항성 난소암 치료를 위한 미토콘드리아 표적 https://www.mdpi.com/1422-0067/20/1/229/htm
난소암은 복강이라는 동일한 공간에서 발생, 전이 및 재발하는 독특한 형태의 고형 종양으로 복수, 저산소증 및 낮은 포도당 수치를 특징으로 하는 독특한 미세 환경이 됩니다.
암세포가 미토콘드리아 호흡에 적응하고 전환하는 것은 이러한 조건 하에서 생존에 중요하므로 화학 저항성 난소암에 대한 이상적인 대사 표적이 됩니다.
중요한 것은 미세 환경 요인과 무관하게 미토콘드리아 공간 재분배는 난소암의 종양 전이 및 화학저항과 관련이 있는 반면, 특정 유전자 돌연변이 세트는 가장 공격적인 난소암 아형에서 미토콘드리아 경로에 대한 비정상적인 의존성을 유발하는 것으로 나타났습니다.
이 검토에서 우리는 화학 저항성 난소암 치료를 위한 미토콘드리아 표적화와 난소암에서 미토콘드리아 호흡의 역할에 대한 현재 이해 상태를 요약합니다.
최근 미토콘드리아 경로가 고형 종양 진행을 유지하는 데 중요한 것으로 나타났음을 고려할 때 이것이 중요하고 시의적절한 주제라고 생각합니다.
암 줄기 세포 대사의 특징 https://www.nature.com/articles/bjc2016152
암세포는 높은 증식률에 대처하기 위해 세포 대사에 적응합니다.
주로 산화적 인산화(OXPHOS)를 사용하는 대신 암세포는 ATP 및 빌딩 블록(바르부르크 효과) 생산에 덜 효율적인 해당작용을 사용합니다.
그러나 종양은 균일하지 않고 기능적으로 이질적이며 줄기 기능을 가진 암세포의 하위 집합을 포함합니다.
이러한 암 세포는 전체 종양을 다시 채우는 능력이 있으므로 암 줄기 세포(CSC) 또는 종양 개시 세포(TIC)라고 합니다.
해당작용에 의존하는 분화된 벌크 종양 세포와 달리 CSC는 암 유형에 따라 해당작용이 높거나 OXPHOS에 의존할 수 있는 뚜렷한 대사 표현형을 보여줍니다.
두 경우 모두 미토콘드리아 기능이 중요하며 CSC 기능의 중심 단계를 차지합니다.
미토콘드리아 기능에 대한 CSC의 명백한 의존성은 주요 대사 표현형에 관계없이 이전에 인식되지 않은 치료 개입을 위해 수정 가능한 아킬레스 건을 나타냅니다.
미토콘드리아 기능 억제를 통해 많은 암의 원인이 되는 고도의 화학 저항성 CSC를 제거하면 질병의 재발을 방지하고 따라서 환자의 장기적인 결과를 개선할 수 있는 가능성이 있습니다.
*************************************************************************
"에너지 엔진 차단" 전략 확장
아래 그림에서 "에너지 엔진 차단" 전략이 주요 전략에 표시되고 오른쪽에는 우선 순위에 따라 주요 전략을 지원할 수 있는 가능성이 높은 것으로 간주되는 다른 전략이 표시됩니다. 물론 우리가 "에너지 엔진 차단" 대신 다른 중앙 전략을 선택한다면 이 그림은 바뀔 것입니다.

위의 전략을 좀 더 개선할 수 있는 방법을 찾는다면 첫 번째로 좋은 추가 전략은 암세포를 산성화하는 전략입니다.
이 전략은 여기에서 구체적으로 논의 되었습니다 .
구체적 논의
https://www.cancertreatmentsresearch.com/ph-cancer-a-top-treatment-strategy/
pH in Cancer & Tumor Acidification: A Top Treatment Strategy - Cancer Treatments - from Research to Application
Summary: pH and Cancer is an intensively discussed subject both in the alternative treatment arena and fortunately more and more in the scientific arena. In terms of treatments, when we speak about pH in cancer I am thinking of treatments involving e.g.
www.cancertreatmentsresearch.com
암 및 종양 산성화의 pH: 최고의 치료 전략
요약:
pH와 암은 대체 치료 분야와 다행스럽게도 과학 분야에서 점점 더 많이 논의되는 주제입니다.
치료 측면에서 암의 pH에 대해 이야기할 때 저는 예를 들어 잘 알려진 중탄산나트륨 , 염화세슘 , 게르마늄 등과 관련된 치료를 생각하고 있습니다.
또한 알칼리성 식단과 같은 식단도 생각하고 있습니다.
그러나 이들 모두는 고유한 관련성이 있지만 이 기사에서 논의하려는 접근 방식은 아닙니다.
대신, 어떤 사람들에게는 새롭지만 이 세상에서 가장 열린 마음을 가진 종양 전문의가 암 환자를 치료하면서 훌륭한 결과를 달성하기 위해 이미 사용한 치료법에 대해 논의할 것입니다.
저는 pH를 조절하는 것이 암과 싸우는 주요 방법이라고 굳게 믿습니다.
pH 조작은 단독 항암 전략과 관련이 있을 뿐만 아니라 화학 요법에 대한 종양의 주요 저항 메커니즘 중 일부를 줄이거나 제거하는 방법이 될 수도 있습니다( Ref.1 Ref2 , Ref3 , Ref4 , Ref5 , Ref6 ) . .
2017년 4월 2일 업데이트: pH 조작은 화학 요법의 유형과 선택한 pH 전략에 따라 화학 요법의 효과에 양방향으로 영향을 미칠 수 있습니다.
이에 대해서는 "메커니즘" 섹션에서 자세히 설명합니다.
메커니즘:
첫째, pH에 대해 말할 때 많은 사람들이 암의 pH가 낮다고 생각한다는 사실을 깨닫는 것이 중요합니다.
그것은 사실이지만 부분적으로만 그렇습니다.
그것은 실제로 pH가 종양 주변에서는 낮지만 종양 세포 내부에서는 그렇지 않기 때문입니다. 대신 암세포의 세포 내 pH는 일반적으로 정상 세포에 비해 높습니다.
이것은 암 세포가 에너지를 생성하면서 많은 산도(예: 양성자)를 생성한다는 점에서 약간 "이상합니다".
실제로 암세포가 존재에 필요한 에너지 및 기타 요소를 생산하기 위해 많은 양의 포도당을 사용하고 있다는 것은 잘 알려져 있습니다.
세포의 엔진(미토콘드리아)이 평소보다 느리게 작동하거나 경우에 따라 전혀 작동하지 않기 때문에 암세포는 다른 메커니즘을 사용하여 에너지 및 기타 구성 요소를 생성합니다.
이 대체 메커니즘을 당분해(glycolysis)라고 부르거나 발효로 더 잘 알려져 있습니다.
그러나 발효는 일반적인 세포 호흡에 비해 덜 효과적인 메커니즘이며 결과적으로 동일한 양의 에너지를 생산하는 데 더 많은 포도당이 필요합니다.
이러한 포도당의 집중적 사용은 에너지 생산으로 이어질 뿐만 아니라 부작용으로 많은 양의 양성자(즉, 산도)를 생성합니다.
암 세포는 높은 pH(즉, 낮은 산도)를 내부(즉, 세포질 ) 에 갖고 싶어하기 때문에 모든 것을 세포 외부로 밀어내는 방법을 개발했습니다.
산도를 밀어내기 위해 암세포는 정상 세포에 비해 훨씬 더 많은 산도 수송체를 개발했습니다.
가장 관련성이 높고 잘 알려진 운송업체는 다음과 같습니다.
- 나트륨/수소 교환,--세포가 양성자를 나트륨으로 교환할 수 있도록 하는 역수송체(예: 나트륨 유입 및 산성 유출) – 아마도 pH 균형에 가장 관련이 있음 – 많은 암에서 과발현되는 것으로 잘 알려져 있습니다. 암 환자가 소금을 많이 먹으면 우리 몸에 충분한 나트륨이 추가되어 이 펌프가 잘 작동할 수 있다고 주장할 수도 있습니다. 이는 우리가 원하는 것이 아닙니다.
- Carbonic anhydrase 9 (CAIX) --이것은 세포외 CO2가 HCO3(중탄산염 이온)이 되도록 돕는 효소입니다. 이 중탄산염 이온은 중탄산염 수송체를 통해 세포로 들어가고 (CAII 효소를 통해) 양성자와 결합하여 최종적으로 세포막을 통해 밀려나는 CO2 및 H20을 생성합니다. 이것은 암 세포가 세포내 양성자를 소멸시키고 따라서 증가된 세포내 pH를 유지하는 방법입니다. 많은 암에서 과발현되는 것으로 잘 알려져 있습니다( 참조 .1, 참조 .2, 참조 .3).
- Vacuolar-type (V-type) H(+)-ATPases – 이것은 원형질막을 가로질러 양성자를 펌핑하는 것으로 확인된 세 가지 유형의 ATP 구동 H+ 펌프 중 하나입니다( 참조 .)
- 모노카르복실레이트 4(MCT4) – 당화 작용의 또 다른 결과물인 젖산염과 양성자를 젖산으로 종양 환경으로 내보내는 수송체입니다 – 많은 암에서 과발현되는 것으로 잘 알려져 있습니다( 참고 문헌 .)
pH를 전환하고 조절하는 다른 "손잡이"는 다음과 관련이 있습니다.
- ATP 합성효소( Ref )
- 리소좀( 참조 )
- Na/K 교환( 참조 )
- H/K ATPase( Ref )
- Na/H 교환을 조절하는 것으로 보이는 갑상선 호르몬의 경우에도 마찬가지입니다( 참고 ).
- BCT(bicarbonate transporter family)( 참조 )
- 히스톤 탈아세틸화효소, HDAC( Ref .)
- 탄산탈수효소 12(CAXII)( Ref.1 , Ref.2 )
- 종양의 산성화는 또한 정상 조직에 비해 종양으로의 혈류 감소에 의해 달성될 수 있습니다 .
흥미롭게도 위의 "손잡이"를 조절하는 약물은 모두 pH 조절 이외의 다양한 메커니즘을 통해 강력한 항암 효과를 나타내는 것으로 알려져 있습니다.
그러나 최근에야 공통적으로 pH에 미치는 영향이 확인되었습니다.
다음은 세포 내 과정을 설명하는 그림에 대한 링크입니다.
- http://www.nature.com/nature/journal/v491/n7424/fig_tab/nature11706_F1.html
- http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3826530/figure/F2/
따라서 위에서 언급한 것과 같은 메커니즘을 이용하여 암세포는 균형 잡힌 내부 pH가 유지되도록 산성도를 내부에서 외부로 밀어내고 있습니다.
결과적으로 종양은 정상 조직(7.4)보다 세포외 pH(6.7–7.1)가 낮습니다. ( 참고 .)
세포내 pH가 암세포의 정상적인 기능에 필요한 수준으로 유지된다는 사실 외에도 이 산도 수출은 다음과 같이 종양에 추가로 도움이 됩니다.
- 젖산은 젖산을 가져와 정상적인 호흡을 통해 에너지를 생산하는 데 사용할 수 있는 능력을 가진 다른 암세포의 연료 역할을 합니다.
- 산도는 전이 과정을 촉진합니다
- 산도는 예를 들어 T 세포에서 MCT1을 억제하거나( Ref 1, Ref2 ) 대식세포에 영향을 미침으로써( Ref .) 면역 체계를 억제합니다 ( Ref .) .
- 산도는 주 단위인 화학 요법의 효과를 감소시키거나 취소합니다.
- 그리고 훨씬 더 ....
최근에 세포내 산도를 증가시킬 수 있는 모든 약물이 암과 매우 관련이 있는 메커니즘인 Wnt 신호( Ref .) 를 감소 및 억제할 수 있음이 밝혀졌습니다 ( Ref .).
이 연구에서 세포내 산도를 증가시키기 위해 사용된 약물은 예를 들어 미토콘드리아 억제제로도 알려진 Metformin, Papaverine이었습니다( 참조 .).
2019년 8월 26일 업데이트 : 암세포가 세포 내부의 pH를 조절하기 위해 사용하는 또 다른 메커니즘을 나타내는 논문 https://www.nature.com/articles/cddis2014587
저자들은 암세포가 글루타민 분해 경로를 사용하여 암모니아를 생성하여 종양 세포 증식과 관련된 과도한 산성화의 균형을 맞춘다고 제안합니다.
이 메커니즘은 glutaminolysis에서 생성된 암모니아가 요소로 추가 대사되고 배설되는 암모늄 이온을 형성하는 데 중요한 세뇨관 상피 세포의 메커니즘과 유사합니다.
따라서 글루타민 분해를 억제하는 것이 더 도움이 될 것입니다.
여기에서 나는 그들 중 몇 가지에 대해 논의했지만 녹차의 메트포르민과 EGCG 추출물(온라인 보충제로 발견됨)이 도움이 될 수 있습니다.
생체 외 V-ATPase 활성을 차단하면 면역 억제가 덜한 종양 미세 환경이 확립됩니다( 참고 문헌 ).
산도 및 화학 요법
2017년 4월 2일 업데이트: pH 조작은 화학 요법의 유형과 선택한 pH 전략에 따라 두 가지 방식으로 화학 요법의 효과에 영향을 미칠 수 있습니다.
사용된 화학 요법이 약한 기초(예: Gemcitabine, Doxorubicin, Daunorubicin, Mitoxantrone, Epirubicin, Idarubicin, Valrubicin, Bleomycin, Vinca 알칼로이드(예: Vinorelbine 등))인 경우(참고 .1, 참고 .2) 종양 주변 의 낮은 pH 화학 요법이 종양에 접근하기 전에 "비활성화"되기 때문에 화학 요법의 효과를 감소시키거나 억제할 수 있습니다( 참조 ).
따라서 이러한 화학 요법을 사용할 때 화학 요법 전에 pH를 높이는 전략(즉, 낮은 산도)을 사용하면 화학 요법의 효과를 높일 수 있습니다( 참조 .1, 참조 .2, 참조 3)
예를 들어 에피루비신은 pKa가 8.1인 약염기성 약물로 알칼리성 환경에서 암에 대한 효능이 증가하는 것으로 나타났습니다. ( 참조 .)
독소루비신과 같은 약기초 화학요법은 세포질 내의 산성 소포로 이온 트래핑 및 격리를 겪는 것으로 나타났습니다. 이 과정은 약물 내성과 관련이 있습니다( 참조 및 여기 에서 pdf로 제공됨).
쉽게 말해 약염기성 항암제가 산성 환경을 통과해 암세포에 들어가면 자석처럼 세포 내 일부 저장실에 항암제가 유인돼 비활성화될 수 있다(참고 ) .
이 저장소(리소좀)는 산성이기 때문에 항암제를 끌어당깁니다.
리소좀의 산도를 낮추고 화학 물질의 포획을 막기 위해 리소좀 산도를 낮추는 것으로 알려진 약물을 사용하는 것을 고려할 수 있습니다.
이러한 약물 중 하나는 오메프라졸입니다.( Ref .)
다음은 미톡산트론(Mitoxantrone)과 같은 화학약품이 pH 증가에 초점을 맞춘 전략에 의해 뒷받침될 때 실제로 어떻게 높은 항암 효과로 이어질 수 있는지를 보여주는 동물에 대한 훌륭한 임상 연구입니다 https://www.ncbi.nlm.nih.gov/ pmc/기사/PMC3264547/
반면에 항암화학요법이 약산성(Cyclophosphamide, 5-Flourouracil * , Chlorambucil, Cisplatin ** , Carboplatin, Mitomycin C, Melphalan 등)인 경우( Ref.1 , Ref.2) 낮은 세포외 pH (즉, 더 높은 산도) 흡수 및 세포독성이 향상됩니다( 참조 .1, 참조 .2, 참조 3).
약산( Ref .)인 Capecitabine(Xeloda)( Ref .)에도 동일하게 적용되는 것으로 보입니다.
따라서 이러한 또는 유사한 화학 요법의 경우 양성자 펌프 억제제를 피하는 것이 가장 좋습니다.
탁솔의 경우와 같이 화학요법 사용이 중립적이라면 세포외 산도는 화학요법 효과에 영향을 미치지 않을 것입니다( 참고 .).
* 흥미롭게도 5FU는 약한 염기( Ref . )이지만 세포외 pH가 낮을 때 암세포 내부에 축적이 증가합니다 .
다른 한편으로는 더 높은 세포외 pH를 유도하는 약물인 오메프라졸이 5FU https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3101238/ 에 도움이 될 수 있다는 연구 결과가 있습니다.
이 측면을 논의 하는 기사는 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4502609/ 에 있습니다.
** 시스플라틴은 약산이지만( 참고 .1), 일부 경우 세포외 pH 증가에 초점을 맞춘 전략에 의해 강화되기도 하는 것으로 보입니다( 참고 .).
그러나 Platins가 다음 참조( Ref .)에 따라 산성 또는 염기성 측면에 있는지는 나에게 매우 명확하지 않으며 일부는 그것이 염기( Ref .)이고 다른 일부는 산성( Ref .)이라고 주장하는 다양한 논문도 있습니다.
이 기사는 시스플라틴이 산성임을 암시합니다: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4502609/
2019년 8월 업데이트: 이 기사, 시스플라틴이 그 자체로 나트륨/수소 교환 억제제 역할을 하는 양성자 펌프 억제제일 수 있다는 과학적 증거가 있음을 친절하게 설명합니다.
"따라서 시스플라틴에 의한 NHE-1 억제는 항신생물 효과에 중요한 역할을 할 수 있습니다." ( 참고 .).
이것은 시스플라틴을 다른 양성자 펌프 억제제와 결합하면 다른 실험에서 관찰된 항암 효과가 증가하는 이유를 설명합니다.
세포외 pH는 파클리탁셀 세포 독성 에 영향을 미치지 않습니다 ( 참고 .)
치료 전략:
지금까지 우리가 본 것은 다음과 같습니다.
- 암세포는 내부 pH가 정상 세포 내부보다 상대적으로 높은 것을 좋아합니다.
- 암세포는 에너지 생산 과정에서 산도를 집중적으로 생성하는데, 이를 암세포 밖으로 밀어내야 합니다.
이러한 암세포의 특정 특성을 바탕으로 암세포에 대해 작용할 수 있는 다음과 같은 치료 전략을 상상할 수 있습니다.
- Intracellular Alkalinization : 암 세포의 세포 내 pH를 암 세포가 지속할 수 없는 수준으로 추가로 증가시킵니다(예: 염화세슘 , 게르마늄 사용).
- 세포내 산성화 : 암세포가 지속할 수 없는 수준으로 암세포의 세포내 pH를 감소시킵니다.
- 세포외 알칼리화 : 세포외 pH를 증가시켜(예: 중탄산나트륨, 알카리성 식이요법 등) 암의 성장에 부적합한 환경을 조성하고 면역체계를 활성화시킵니다. ( 참조 .)
내 생각에 가장 강력한 기술 중 하나는 세포 내 pH를 더 낮추는 것, 즉 내부 산성화에 초점을 맞추는 것입니다.
암 세포가 지속적으로 산도를 생성하기 때문에 내부 pH를 더 높이는 전략(알칼리화)에 비해 개념이 매우 간단하고 달성하기 더 쉬울 수 있습니다.
세포내 산성화는 위에서 논의한 주요 산도 수송체의 일부 또는 전부를 억제함으로써 달성될 수 있습니다.
실제로 이 전략은 바나나나 감자를 자동차 배기관에 밀어넣어 연기가 나가지 못하게 하는 것으로 볼 수 있다.
일부 암은 여러 개의 "배기 파이프"를 사용할 수 있으므로 최상의 효과를 위해 이러한 모든 파이프를 억제해야 할 수 있지만 흑색종과 같은 다른 암에서는 하나의 "파이프"만 억제(MCT 억제만)하면 충분할 수 있습니다.
같은 맥락에서 난소암의 경우 나트륨/수소 억제로 충분했습니다( 참고 .)
이 전략은 세포내 산성화로 인해 암세포에 압력을 가할 뿐만 아니라 면역 활성화( 참조 ), 화학 및 방사선 치료 효과를 높이고 전이 가능성을 줄입니다.
다음은 MCT4 억제가 면역 체계의 활동에 어떻게 도움이 되는지 자세히 설명하는 훌륭한 박사 논문입니다. 진행성 전립선암 치료를 위한 MCT4 표적화
세포내 산성화와 그 응용:
다음은 다양한 간행물에 표시된 대로 주요 산도 수출체 및 관련 용량을 줄이거나 억제하는 데 중점을 두고 단독으로 또는 조합하여 사용할 수 있는 몇 가지 요소입니다.
- 나트륨/수소 교환 억제제:
- 탄산탈수효소 9(CAIX) 억제제:
- Vacuolar-type(V형) H(+)-ATPases 억제제:
- 오메프라졸 또는 판토프라졸 또는 란소프라졸. Lansoprazole 이 더 효과적 일 수 있습니다 . DCA는 또한 같은 계열에 작용할 수 있습니다( 참고 .)
오메프라졸은 약 40~80mg/일 이상의 용량으로 제공됩니다.
- 오메프라졸 또는 판토프라졸 또는 란소프라졸. Lansoprazole 이 더 효과적 일 수 있습니다 . DCA는 또한 같은 계열에 작용할 수 있습니다( 참고 .)
- 모노카르복실레이트(MCT):
- Simvastatin, Quercetin ( Ref .), Phloretin/Phlorizin , Ibuprofen, Aspirin, Syrosingopine ( Ref .), Acriflavine ( Ref .), Cinnamic acid ( Ref .) 등 의 스타틴.
Quercetin 은 5g 2x/day (total 10g/day) 일) 또는 3g 3회/일(총 9g/일) - 충분히 흥미롭게도, 이 연구( Ref .)는 DMSO가 항암 특성을 가진 세포내 산성화제이기도 하며 MCT에 대한 영향으로 인한 것으로 제안되었음을 보여줍니다.
- 2019년 10월 업데이트: 다음은 다양한 암에서 MCT의 발현과 위에서 논의한 것과 같은 억제제에 대해 논의하는 최근 연구입니다( 참고 .)
- 로니다민( Ref .)
- Simvastatin, Quercetin ( Ref .), Phloretin/Phlorizin , Ibuprofen, Aspirin, Syrosingopine ( Ref .), Acriflavine ( Ref .), Cinnamic acid ( Ref .) 등 의 스타틴.
종양의 산성화는 또한 정상 조직에 비해 종양으로 가는 혈류의 감소에 의해 달성될 수 있습니다 .
혈관 확장제 하이드라라진은 동맥 평활근에 작용하는 것으로 생각되며, 종양 혈관의 상당 부분이 평활근이 없기 때문에 약물에 반응하지 않습니다..
결과적으로 이것이 종양에서 심박출량의 재분배로 이어져 종양의 혈류를 선택적으로 감소시키고 결과적으로 종양의 pH를 감소시킨다고 주장되어 왔습니다.
실제로 RIF-1 종양 보유 마우스에 하이드랄라진을 정맥내 투여한 후 20-40분 후에 종양 pH에서 0.4 pH 단위 하락이 나타났습니다( 참조 .1, 참조.2)
참고: 저는 화학 요법과 함께 하이드랄라진을 사용하지 않을 것입니다.
이는 종양으로 가는 혈류를 감소시켜 종양 부위에서 사용할 수 있는 약물이 적어지기 때문입니다.
세포외 알칼리화:
경구 중탄산염은 혈액 pH가 인체의 다양한 메커니즘에 의해 지속적으로 조절되고 안정된 값으로 유지되기 때문에 경구 중탄산염이 종양 세포 외 pH의 변화를 유도할 수 없다고 주장하는 많은 사람들의 주장과 달리 실제로 경구 중탄산염 은 실제로 종양 부위의 pH를 변경할 수 있고 pH 구배를 역전시킬 수도 있습니다( 참조 ).
세포외 pH는 세포외 환경의 극심한 산도가 표준인 방광암, 신장암 및 식도-위암의 치료에서 특히 중요합니다( Ref .).
경구 완충 요법을 통해 종양 내(세포 외) pH를 높이면 면역 요법에 대한 반응을 개선하고( 참고 .) 전이 형성을 줄일 수 있습니다( 참고.).
중탄산염은 또한 경동맥 화학색전술(TACE)에 가치를 더하는 것으로 나타났습니다.
간암종 환자에 대한 파일럿 임상 조사가 수행되었으며, 여기서 환자는 종양에 중탄산염 국소 주입을 포함하거나 포함하지 않고 TACE로 치료를 받았습니다.
중탄산염과 병용한 TACE는 100% 객관적 반응률(ORR)을 산출한 반면, TACE 단독으로 치료한 ORR은 44.4%(비무작위) 및 63.6%(무작위)였습니다.
생존 데이터는 중탄산염이 실제로 생존 이점을 추가할 수 있음을 시사했습니다( 참조 .1, 참조 .2).
안전:
아밀로라이드를 사용하면 혈중 칼륨이 증가하여 위험할 수 있습니다.
그래서 의사가 2주마다 혈액 검사를 통해 환자를 추적하고 있는지 확인합니다.
오메프라졸과 같은 PPI를 복용할 때는 칼슘 수치를 관찰하는 것이 현명합니다.
인간에 대한 적용:
간헐적 고용량 프로톤 펌프 억제제는 전이성 유방암에서 화학 요법의 항종양 효과를 강화합니다 . http://www.ncbi.nlm.nih.gov/pubmed/26297142
배경: 산도는 악성 종양의 특징이며 매우 효율적인 화학 저항 메커니즘을 나타냅니다.
고용량의 양성자 펌프 억제제(PPI)는 화학저항성 인간 종양 세포와 종양을 세포독성 분자에 민감하게 만드는 것으로 나타났습니다.
방법: 등록된 환자는 3개 군에 무작위로 할당되었습니다: 군 A, d4에 도세탁셀 75mg/m(2) 다음에 시스플라틴 75mg/m(2), 최대 6주기로 21일마다
에소메프라졸(ESOM) 80 mg po bid에 앞서 동일한 화학 요법. ESOM의 매주 간헐적 투여(3일 4일 휴무)는 최대 66주까지 유지되었습니다.
시너지:
클로로퀸: 세포외 산성 pH는 클로로퀸의 자가포식 억제 활동을 중화합니다: 암 치료에 대한 의미. http://www.ncbi.nlm.nih.gov/pubmed/24492472
국부 온열요법 ( 참조 1, 참조 2 , 참조 3 , 참조 4 )
방사능
시메티딘 : "일반적으로 종양 환자에게 탄산칼슘과 같은 다른 제산제 또는 라니티딘 또는 시메티딘과 같은 H2 수용체 길항제와 같은 제산제를 전처치하여 위산 분비를 억제함으로써 종양 부위에 도달할 수 있는 PPI의 농도를 높이고 위장에 남는 농도를 최소화하는 것이 바람직합니다.
따라서 제산제로 치료하면 체내 산성 부위만 상당히 감소하거나 적어도 가장 중요한 부위가 일시적으로 중화되거나 개선되므로 산성 종양에 대한 PPI 전달을 증가시키는 데 효과적입니다.
” http://www.google.com/patents/EP1713481B1?cl=ko
참조:
잠재적으로 선택적 항암제로서의 Cariporide 및 기타 새롭고 강력한 NHE1 억제제 – 100년 간의 암 연구 후 통합된 분자/생화학적/대사/임상 접근 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3826530 /
반려동물의 암 치료를 위한 양성자 펌프 억제제 . http://www.ncbi.nlm.nih.gov/pubmed/26337905
최근의 치료적 접근법은 양성자 펌프 억제제(PPI)를 사용하여 세포 밖으로 수소 수송을 차단함으로써 종양 미세 환경의 변경된 산도를 이용합니다.
세포외 pH의 변화는 종양 세포를 죽이고 약물 내성을 역전시키며 암 전이를 감소시킵니다.
암 치료에서 양성자 펌프 억제제 사용에 대한 증거 기반 지원. http://www.ncbi.nlm.nih.gov/pubmed/26597250
우리는 Warburg의 발견을 통해 암세포가 당발효에 기초한 신진대사를 통해 미세환경을 산성화하고 이 진행성 산성화는 선택적 압력을 유도하여 암세포가 생성한 적대적인 미세환경에서 생존할 수 있도록 완전히 무장한 매우 악성 세포로 발전한다는 사실을 알게 되었습니다.
자신의 신진대사. 산성 종양 미세 환경에서 생존하는 가장 메커니즘 중 하나는 세포 외부 또는 내부 액포 내에서 H(+)의 지속적인 제거를 통해 세포 내 산성화를 허용하지 않는 양성자 교환기입니다.
이 기사는 소화성 궤양 치료 및 위 보호를 위해 전 세계적으로 이용되는 양성자 펌프 억제제(PPI) 계열이 실제로 화학 증감제라는 전임상 시연을 통해 PPI가 확실한 배경과 근거를 가지고 새로운 항암 전략에 포함될 수 있습니다.
진화적 악의로서의 종양 산성도 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3756368/
대부분의 암 세포는 대사 경로를 파스퇴르 효과를 반영하는 대사에서 바르부르크 효과를 반영하는 대사로 전환합니다. 이러한 변화는 종양 주위에 산성 미세 환경을 만들고 양성 발암 피드백 루프의 원동력이 됩니다. 종양 산도의 결과로 종양 미세 환경은 다른 세포 유형에 해를 끼치면서 이 부식성 환경에서 생존할 수 있는 특정 세포 표현형의 선택을 장려합니다.
항종양제로 양성자 펌프 억제제를 사용하는 근거. http://www.ncbi.nlm.nih.gov/pubmed/22360553
종양 형성이 단순히 빠르게 증식하고 유전적으로 돌연변이된 세포의 축적에 의해 특징지어지는 것이 아니라는 것이 점차 인정되고 있습니다.
저산소증 및 산도와 같은 미세 환경 생물 물리학 적 요인은 암 세포를 극적으로 조절하고 악성 세포에 대한 선택적 힘으로 작용하여 호기성 해당 작용으로의 대사 재 프로그래밍을 통해 적응합니다.
그렇지 않으면 세포 생존에 해로운 젖산 및 양성자의 세포 내 축적을 피하는 것이 악성 세포가 세포 pH 항상성을 유지하는 데 중요합니다.
여러 pH 조절 시스템의 상향 조절된 발현 및/또는 기능의 결과로 암 세포는 알칼리성 세포내 pH(pHi) 및 산성 세포외 pH(pHe)를 나타냅니다.
pH 조절 단백질 중 양성자 펌프는 약물 내성과 전이 확산에 중요한 역할을 합니다.
암 치료 전략으로 종양 산성화를 조작합니다. http://www.ncbi.nlm.nih.gov/pubmed/21155627
종양의 세포외 및/또는 세포내 pH의 조작은 암 치료에서 상당한 잠재력을 가질 수 있습니다.
대부분의 종양의 세포외 공간은 풍부한 젖산 생성으로 인해 약산성입니다.
주로 저산소증 유도 인자-1(HIF-1)의 만성 활성화에 기인하는 호기성 해당작용과 종양 저산소증이 이 현상의 주된 원인입니다.
종양의 산도는 암의 공격성과 상관관계가 있는 경향이 있습니다.
부분적으로 이것은 침입성과 혈관신생을 촉진하는 HIF-1의 능력을 반영합니다.
그러나 세포외 산도 자체가 암세포의 침습성과 전이 능력을 증가시킨다는 증거가 늘어나고 있습니다.
더욱이 이 산도는 암세포가 약염기성인 화학요법 약물의 높은 비율에 상대적으로 저항성을 갖게 하고 종양의 면역 거부를 방해할 수 있습니다.
따라서, 종양의 세포외 pH를 높이기 위한 실용적인 전략은 치료적 유용성을 가질 수 있습니다.
설치류에서 중탄산나트륨의 경구 투여는 종양의 세포외 pH를 상승시킬 수 있으며, 이는 전이 억제 및 특정 세포독성 물질에 대한 반응성 개선과 관련된 효과입니다.
이 전략의 임상 적용이 가능해 보입니다.
대체 접근법으로, 암세포에서 양성자 펌프를 억제하는 약물은 암세포의 세포내 pH를 낮추면서 세포외 종양 산도를 완화할 수 있습니다.
세포내 pH의 감소는 다양한 암 세포주에서 증식을 늦추고 세포사멸을 촉진합니다.
양성자 펌프 억제제 에소메프라졸의 내약성 용량은 인간 흑색종을 이식한 누드 마우스에서 종양 성장 및 연장된 생존을 현저하게 방해했습니다.
치료 반응에 대한 종양 pH의 영향 http://ff-imt.com/assets/download/publications/extrac_pH_Tumor_response.pdf
종양 내 미세환경은 주로 종양 세포에 의한 호기성 및 혐기성 해당작용의 증가로 인한 젖산 축적으로 인해 본질적으로 산성입니다.
일반적으로 인간 종양의 세포외 pH(pHe)는 7.0 미만인 반면 세포내 pH(pHi)는 강력한 pHi 제어 메커니즘에 의해 중성 범위, 즉 >7.0으로 유지됩니다.
낮은 pHe와 pHi 사이의 상당한 구배는 화학 요법, 방사선 요법 및 온열 요법과 같은 다양한 치료에 대한 종양의 반응에 현저하게 영향을 미칩니다.
예를 들어, 산성 pHe는 사이클로포스파마이드 및 시스플라틴과 같은 약산성 약물의 세포 흡수를 증가시켜 약물의 효과를 증가시키는 반면, 산성 pHe는 독소루비신 및 빈블라스틴과 같은 약염기성 약물의 흡수를 지연시켜 약물의 효과를 감소시킵니다.
방사선 유발 세포 사멸은 산성 환경에 의해 억제되는 반면 온열 유도 세포 사멸은 산성 환경에 의해 강화됩니다.
종양에서 pHe 및 pHi의 제어 메커니즘에 대한 더 나은 이해는 인간 종양의 장치 효과적인 치료 전략으로 이어질 수 있습니다.
Vacuolar H(+)-ATPase: 구조 및 기능
http://atlasgeneticsoncology.org/Deep/V-ATPaseInCancerID20104.html
Vacuolar H+-ATPase(V-ATPase)는 고도로 진화적으로 보존된 효소로 원형질막과 엔도좀, 리소좀 및 분비 소포와 같은 일부 소기관의 막에 분포합니다.
V-ATPase의 주요 기능은 세포막을 가로질러 세포외 환경으로 또는 소기관 막을 가로질러 세포내 구획으로 양성자를 펌핑하는 것입니다.
세포 표면에 위치한 V-ATPase는 대부분의 생리학적 과정에 필수적인 세포질 pH를 ~7.0으로 조절하는 중요한 양성자 수송체 역할을 하는 반면, 세포막 내 V-ATPase는 수용체 매개 세포 내 이동, 막 이동, 단백질 처리 또는 분해, 영양소 섭취와 같은 세포 과정에 관여합니다.(Nishi et al., 2002; Forgac et al., 2007; Toei et al., 2010; Cruciat et al., 2010).
잘못된 V-ATPase는 종양을 비롯한 여러 질병과 밀접한 관련이 있습니다.
점점 더 많은 증거가 V-ATPase가 악성 변형, 성장 및 증식, 침입 및 전이, 다제 내성 획득 등과 같은 발암 및 암 진행을 촉진한다는 것을 나타내며, 이는 V-ATPase가 항암 전략의 효과적인 표적이되어야한다는 것을 강력하게 뒷받침합니다.(Fais et al., 2007).
암의 저산소증 신호와 종양 퇴행을 강화하기 위한 접근법
http://www.ncbi.nlm.nih.gov/pubmed/16724055
종양 세포는 세포 성장과 생존을 촉진하는 신호 회로의 유전적 변형의 결과로 나타나는 반면, 종양 세포의 확장은 영양소 공급에 의존합니다.
산소 제한은 혈관신생, 포도당 대사, 생존 및 종양 전이를 조절하는 데 핵심적입니다.
이 다발성 작용은 영양 스트레스 신호 전달의 마스터 전사 인자인 저산소증 유도 인자(HIF)에 의해 조율됩니다.
세포내 pH(pH(i)) 조절, 신진대사, 세포 침입, 자가포식 및 세포 사멸에서 HIF의 역할을 이해하는 것은 새로운 항암 요법을 개발하는 데 중요합니다.
종양 대사 및 pH(i) 제어 시스템을 대상으로 하여 괴사성 세포 사멸 및 종양 퇴행을 시행하는 새로운 접근법이 있습니다.
암 대사가 어떻게 증식을 위해 조정되고 중단에 취약하게 하는 방법http://www.nature.com/nature/journal/v491/n7424/full/nature11706.html
발암성 신호 경로와 대사 활동 사이의 수많은 연결이 등장함에 따라 암에서 대사 재프로그래밍의 중요성이 점점 더 인식되고 있습니다.
암 세포의 대사적 약점을 식별하는 것은 암 치료 전략을 만드는 데 사용되어 왔지만 암 대사를 목표로 하는 약물을 임상에 도입하는 데에는 여전히 해결해야 할 과제가 있습니다.
모노카르복실레이트 수송 억제는 대장암 세포에서 5-플루오로우라실의 세포독성 효과를 강화합니다
인간 흑색종의 세포내 pH 조절: 잠재적인 치료적 의미 http://mct.aacrjournals.org/content/1/8/617.long
중증 복합 면역결핍 마우스에서 성장한 DB-1 인간 흑색종 이종이식편을 사용한 생체외 실험은 NHE-1이 아닌 MCT-1이 DB-1 종양 세포 pH i 의 주요 결정 인자임을 발견했습니다 .
따라서 MCT 억제제는 악성 흑색종에 특히 효과적일 수 있습니다.
케르세틴, 젖산 수송 억제제 및 HeLa 세포의 고열 증감제
고열에 대한 감작에서 낮은 세포내 또는 세포외 pH의 역할
유방암에서 잠재적인 치료 표적으로서의 모노카르복실레이트 수송체: 시험관내 모델에서의 억제 연구
스타틴 유도 세포독성에서 Monocarboxylate Transporter 4 발현의 관여
http://www.jpharmsci.org/article/S0022-3549(16)00310-5/pdf
그러나 스타틴은 다양한 골격근 문제를 일으킬 수 있으며 운동은 스타틴 유발 근육 손상을 증가시킵니다. .
Atorvastatin은 생존 가능한 세포의 수를 감소시키고 농도 의존적 방식으로 MCT4 mRNA 수준을 상향 조절했지만 MCT1은 그렇지 않았습니다.
세포 pH 조절제: 암 화학 요법을 위한 잠재적으로 유망한 분자표적http://www.ncbi.nlm.nih.gov/pubmed/14585264
성공적인 암 치료의 주요 장애물 중 하나는 고형 종양 발달의 복잡한 생물학입니다.
세포내 pH의 조절이 많은 세포 기능에 결정적으로 중요한 것으로 나타났지만, pH 조절은 암 분야에서 완전히 조사되지 않았습니다.
그러나 세포의 pH는 세포 증식, 침입 및 전이, 약물 내성 및 세포 사멸과 같은 생물학적 기능에 결정적인 역할을 하는 것으로 나타났습니다.
저산소 상태는 종종 고형 종양이 발생하는 동안 관찰되며 세포 내 및 세포 외 산증을 유발합니다.
세포성 산증은 세포사멸의 초기 단계에서 방아쇠가 되는 것으로 나타났으며 DNA 단편화를 유도하는 엔도뉴클레아제의 활성화를 유도합니다.
이러한 조건에서 세포내 산성화를 피하기 위해, pH 조절제는 종양 세포에서 상향 조절되는 것으로 생각됩니다.
4가지 주요 유형의 pH 조절기가 확인되었습니다:
양성자 펌프,
나트륨-양성자 교환기 계열(NHE),
중탄산염 수송체 계열(BCT) 및
모노카르복실레이트 수송체 계열(MCT).
암의 새로운 특징: pH 기울기 역전 https://www.sciencedaily.com/releases/2016/01/160125114243.htm
pH 기울기 역전은 아마도 아주 일찍 발생하는 가장 뚜렷한 암 특이 사건으로 간주될 수 있습니다.
모든 종류의 암세포와 조직에서 나타나는 필수 현상입니다.
종양의 생존과 증식에 필수적입니다.
과일과 채소가 풍부한 알칼리성 저염식은 pH 기울기 역전을 최소화하여 종양의 공격성과 치료 저항성을 줄입니다.
이 지식은 기존의 더 독성이 강한 비선택적 요법을 대체하는 데 유용할 수 있습니다.
종양 산도의 중화는 면역 요법에 대한 항종양 반응을 향상시킵니다
http://cancerres.aacrjournals.org/content/76/6/1381
면역 체크포인트 차단 또는 adoptive T-cell transfer과 같은 암 면역 요법은 임상에서 지속적인 반응을 이끌어 낼 수 있지만 정의되지 않은 억제 메커니즘으로 인해 반응률은 여전히 낮습니다.
고형 종양은 항종양 면역의 효과를 둔화시킬 수 있는 고도로 산성인 미세 환경을 특징으로 합니다.
이 연구에서 우리는 면역 요법의 효능에 대한 종양 산도의 영향을 직접 조사했습니다.
산성 pH 환경은 T 세포 활성화를 차단하고 체외에서 해당 작용을 제한했습니다..
전반적으로 우리의 연구 결과는 경구 완충 요법을 통해 종양 내 pH를 높이는 것이 면역 요법에 대한 반응을 개선할 수 있는 방법을 보여줍니다.
중탄산염은 종양 pH를 증가시키고 자연 전이를 억제합니다. http://www.ncbi.nlm.nih.gov/pubmed/19276390
고형 종양의 외부 pH는 포도당 대사 증가와 관류 불량의 결과로 산성입니다.
우리는 구강 NaHCO(3)가 종양의 pH를 선택적으로 증가시키고 전이성 유방암의 마우스 모델에서 자발적인 전이의 형성을 감소시킨다는 것을 보여줍니다.
이 치료 요법은 (31)P 자기 공명 분광법에 의해 종양의 세포외 pH를 유의하게 증가시키는 것으로 나타났으나 세포내 pH는 증가시키지 않고 윈도우 챔버에서 성장한 종양의 형광 현미경에 의해 성장하는 종양으로부터 산을 방출하는 것으로 나타났습니다.
중화 종양 산성 환경은 면역 표적 요법을 향상시킵니다
https://www.sciencedaily.com/releases/2016/03/160317114538.htm
새로운 기사에서 연구원들은 산성 종양 환경을 중화하면 여러 면역 표적 암 치료법의 효능이 증가한다고 보고했습니다.
생체 내 기능 상실 스크리닝은 원발성 췌장 종양에서 종양 개시 잠재력의 핵심 조절인자로서 탄산 탈수효소 IX를 밝혀냅니다.
http://www.ncbi.nlm.nih.gov/pubmed/26152355
에너지 대사의 재프로그래밍은 암의 새로운 특징 중 하나입니다.
에너지 대사 경로의 상향 조절은 종양 질환의 주요 특징인 세포 성장 및 분열을 촉진하고 특정 대사 경로에 대한 의존성을 유발할 수 있습니다.
따라서 에너지 대사 경로를 표적으로 삼는 것은 새로운 치료법의 기회를 제공할 수 있습니다.
흥미롭게도, CAIX는 종양 개시 세포 집단에서 과발현되었다.
CAIX 발현 단독은 고도의 종양형성 세포 하위 집단과 상관관계가 있었습니다.
MCT4 유전자: 진행성 전립선암 치료를 위한 새롭고 잠재적인 표적.
http://www.ncbi.nlm.nih.gov/pubmed/26755530
젖산 분비를 억제하는 MCT4 표적 ASO는 암의 새로운 특징인 암의 재프로그래밍된 에너지 대사를 방해할 수 있기 때문에 CRPC 및 기타 암의 치료에 유용할 수 있습니다.
암 생성 젖산: 새로운 치료 접근법 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4765265/
암 치료에서 양성자 교환 억제제의 조합에 대한 재고 http://www.mdpi.com/2218-1989/8/1/2/htm
암의 대식세포 및 에너지 대사: 케톤 생성 연결 https://www.hormonesmatter.com/macrophages-energy-metabolism-cancer-ketogenic-connection/
암 치료를 위한 세포내 pH 취약성의 시스템 분석 https://www.nature.com/articles/s41467-018-05261-x
역 pH 구배는 세포외 산증 및 세포내 알칼리화로 나타나는 암 대사의 특징입니다.
세포외 산증의 결과는 알려져 있지만 세포내 알칼리화의 역할은 불완전하게 이해되고 있습니다.
효소 pH 의존적 활동 프로파일을 세포 특정 게놈 규모 대사 모델로 재구성하고 통합함으로써 우리는 세포 내 pH(pHi)가 대사를 조절할 수 있는 방법을 탐구하는 전산 방법론을 개발합니다.
우리는 in silico에서 알칼리성 pHi가 해당작용 증가와 저산소증에 대한 적응(즉, Warburg 효과)과 결합된 암세포 증식을 최대화하는 반면, 산성 pHi는 이러한 적응을 비활성화하고 종양 세포 성장을 손상시킨다는 것을 보여줍니다.
Monocarboxylate transporter inhibitor인 Quercetin은 Glioblastoma Multiforme의 마우스 모델에서 세포내 산성화를 유도합니다: 자기공명영상을 이용한 체내 검출. https://www.ncbi.nlm.nih.gov/pubmed/30101388
아교모세포종에서 디클로로아세테이트 유도 세포내 산성화: 9.4 테슬라에서 AACID-CEST MRI를 사용한 생체 내 검출. https://www.ncbi.nlm.nih.gov/pubmed/29143921
Topiramate는 교모세포종에서 급성 세포내 산성화를 유도합니다. https://www.ncbi.nlm.nih.gov/pubmed/27613534
Ellagic Acid가 인간 자궁내막암 세포에서 세포질 pH 조절 및 당분해 플럭스에 미치는 부정적인 영향 . https://www.ncbi.nlm.nih.gov/pubmed/28467979
Carbonic Anhydrase IX가 종양 성장 및 전이를 촉진하는 메커니즘의 특성화 https://open.library.ubc.ca/cIRcle/collections/ubctheses/24/items/1.0166209#downloadfiles
암 줄기 세포의 치료적 표적화: 산성 환경 통합 및 활용
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6433943/
암 줄기 세포(CSC) 또는 종양 개시 세포는 자가 재생 및 다능성과 같은 체세포 줄기 세포와 기능을 공유하는 종양 벌크 내의 세포의 작은 하위 집단을 나타냅니다.
임상적 관점에서 CSC는 치료 저항성과 원거리 장기로의 전파를 지원함으로써 환자의 종양 재발의 주요 동인으로 생각됩니다.
게놈 불안정성과 미세 환경 기반 선택은 종양 이질성을 지원하고 치료가 적용될 때 줄기와 같은 특성을 가진 저항성 세포의 출현을 가능하게 합니다.
저산소증과 영양 결핍 외에도 산증은 종양 미세 환경(TME)의 또 다른 선택 장벽으로, 보다 공격적이고 적합한 암세포 표현형을 형성할 수 있는 허용 틈새를 제공합니다.
시스플라틴의 예상치 못한 치료 효과 https://www.ncbi.nlm.nih.gov/pubmed/31098602
시스플라틴은 암종 및 육종과 싸우기 위해 임상적으로 승인된 널리 사용되는 화학요법제입니다.
난소암과 전이성 고환암 치료에 비교적 높은 효율을 보인다.
시스플라틴 항암 작용의 주요 메커니즘은 DNA 손상이라는 것이 일반적으로 받아들여지고 있습니다.
그러나 시스플라틴은 전이성 암에도 효과적이므로 어떤 식으로든 느리게 순환하는 암 줄기 세포에 영향을 주어야 합니다.
이 검토에서는 좋은 치료 반응을 지원할 수 있는 시스플라틴의 대체 효과에 중점을 두었습니다.
첫째, 세포 내 pH 및 세포 기계적 성질의 변화와 같은 세포 수준에서 시스플라틴의 효과에 주목하였다.
인간 간세포 암종에서 종양 면역 미세 환경을 표적으로 하는 pH 조절제 https://www.ncbi.nlm.nih.gov/pubmed/29900055/
종양 대사를 방해하는 것은 표준 요법에 내성이 있는 암을 치료하기 위한 새로운 전략입니다.
빠른 증식 속도와 악화된 해당 작용을 특징으로 하는 간세포 암종(HCC)은 젖산과 탄산의 과도한 생성으로 고도의 저산소 미세 환경을 만듭니다.
이러한 대사 상태는 질병 공격성과 암 관련 면역 억제를 촉진합니다.
pH 조절 분자는 종양 세포와 주변 환경 사이의 다리 역할을 합니다.
여기에서 우리는 pH 조절 분자 CAIX, CAXII 및 V-ATPase가 HCC 미세 환경에서 과발현되고 경로를 방해하여 항 종양 활성을 발휘한다는 것을 보여줍니다.
중요하게도, V-ATPase 복합체는 M2 유사 종양 관련 대식세포에 의해 발현되었습니다.
생체 외 V-ATPase 활동을 차단하면 면역 억제가 덜한 종양 미세 환경이 확립되고 HCC의 간엽 기능이 역전됩니다.
따라서 종양 세포와 pH 조절 분자에 의해 수행되는 종양 미세 환경 사이의 독특한 혼선을 표적으로 삼는 것은 HCC 진행을 제어하고 저산소/산성 대사에 의해 매개되는 면역억제 압력을 감소시키는 전략으로서 유망합니다.
암에서의 모노카르복실레이트 수송체 https://www.ncbi.nlm.nih.gov/pubmed/31395464
젖산 및 MCT, 특히 MCT1 및 MCT4는 종양 공격성에 중요한 기여자입니다.
흑색종 및 기타 종양 개체의 면역 요법에 대한 저항성을 극복하기 위한 L-젖산 대사 표적화
https://www.hindawi.com/journals/jo/2019/2084195/
면역 요법이 종양 요법에서 중요한 역할을 하지만, 그 효능은 면역 억제 종양 미세 환경에 의해 손상됩니다.
전구체 미세환경에 기여하는 분자는 대사산물인 젖산입니다.
젖산은 저산소증이나 유사저산소증에 대한 반응으로 암 세포에 의해 대량으로 생성되며, 젖산이 과도하게 존재하면 면역 세포의 정상 기능이 변경됩니다.
젖산 대사에 관여하는 주요 효소는 젖산 탈수소효소(LDH)입니다.
베이스라인 LDH 혈청 수치 상승은 특히 흑색종 환자에서 현재 항암(면역) 요법의 불량한 결과와 관련이 있습니다.
따라서 젖산 대사에 관여하는 LDH 및 기타 분자를 표적으로 삼으면 면역 요법의 효능을 향상시킬 수 있습니다.
종양 내 세포 외 pH 및 산 매개 침습을 줄이는 데 있어 전신 완충제의 잠재적 역할
https://www.ncbi.nlm.nih.gov/pubmed/19276380/
많은 연구에서 암의 세포외 pH(pHe)가 일반적으로 정상 조직의 pH보다 낮으며 산성 pH가 원발성 및 전이성 암에서 침습성 종양 성장을 촉진한다는 사실이 밝혀졌습니다.
여기에서 우리는 pH 버퍼의 증가된 전신 농도가 종양내 및 종양주위 산증을 감소시키고 결과적으로 악성 성장을 억제한다는 가설을 조사합니다.
종양 산성 pH 미세 환경에 대한 약물 내성 및 세포 적응
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3230683/
생체이물 수송체 또는 결합 부위 돌연변이에 의해 매개되는 생화학적 저항성 외에도 저항성은 생리학적일 수 있습니다.
종양의 물리적 미세 환경의 결과로 발생합니다.
이 검토는 세포외 산증, 높은 당분해 플럭스 및 불량한 혈관 관류의 최종 결과에 초점을 맞춥니다.
낮은 세포외 pH, pHe는 "이온 트래핑" 현상으로 설명되는 생리학적 약물 장벽을 형성합니다.
우리는 산 외부 plasmalemmal pH 구배가 약한 염기 화학 요법의 약물 효능에 부정적인 영향을 미치지만 약산성 치료제에 더 적합한 방법을 설명합니다.
우리는 또한 종양 세포가 세포외 산증에 반응하여 겪는 생리학적 변화를 탐구할 것입니다.
이는 감소된 세포사멸 잠재력, 유전적 변화, 다약물 수송체, p-당단백, pGP의 증가된 활성을 포함하여 약물 내성에 기여합니다.
낮은 pHe는 고형 종양의 특징이므로 이 상태를 극복하거나 이용하기 위해 고안된 치료 전략을 개발할 수 있습니다.
종양의 산도는 암이 퍼지는 데 어떻게 도움이 됩니까? https://www.medicalnewstoday.com/articles/324767
*******************************************************************************
"에너지 엔진 차단" 전략을 강화하기 위해 "암 세포 산성화" 전략 추가
이것이 왜 좋은 생각이라고 생각하나요?
"에너지 엔진 차단"에 초점을 맞춘 전략에는 호흡 억제제가 포함되어 있습니다.
호흡을 효과적으로 억제하면 발효 경로에서 에너지 생산을 다른 곳으로 돌릴 수 있고, 이것이 여전히 활성화되면(즉, 보충제와 약물로 효과적으로 억제되지 않으면) 암세포는 암세포 사멸을 피하기 위해 많은 양의 양성자(산성)를 생성하여 배출해야 합니다.
즉, 암이 발효를 탈출 경로로 사용할 수 있습니다.
이 경우 암세포가 양성자를 세포 밖으로 내보내는 데 사용하는 수송체/기전을 억제하면 암세포 내부에 양성자(산도)가 축적되고 발효가 중단되어 결국 암세포가 사멸하게 됩니다.
두 전략, 즉 "에너지 엔진 종료"와 "암 세포 산성화"에 필요한 약물과 보충제가 크게 중복된다는 점을 감안할 때 "암 세포 산성화"를 추가할 다음 전략으로 고려하는 것이 매우 합리적입니다.
예를 들어, Metformin, Doxycicline, Quercetin, Statins, Syrosingopine, Diclofenac은 이미 세포를 산성화하는 것으로 알려져 있습니다.
따라서 "암 세포 산성화" 전략을 비교적 잘 다루기 위해서는 최소한 한 가지, 아마도 두 가지 다른 약물만 필요할 것입니다.
용도가 변경된 약물은 다음과 같습니다.
- Amiloride(Na/H 교환 억제제로서) 복용량에 대한 자세한 내용 은 여기 를 참조하십시오 (참고: Amiloride를 사용할 때 칼륨의 혈중 농도는 위험한 수준으로 떨어지지 않도록 2주마다 확인해야 함)
- 아세타졸라미드(CA IX 억제제) 복용량에 대한 자세한 내용 은 여기 를 참조하세요.
"에너지 엔진 정지" 전략을 향상시킬 수 있는 다른 접근 방식
세포 내 산도의 증가는 또한 발효를 억제하고( Ref .), β-Catenin을 억제하고( Ref .), mTOR를 억제하고( Ref .) 자가포식을 유발합니다( Ref .).
그러나 위의 전략을 잘 처리하면 자가포식과 상관없이 종양이 파괴됩니다.
그럼에도 불구하고 자가포식 문제를 해결하려면 하루에 약 200mg의 Hydroxychloroquine 을 사용하는 것이 좋습니다(반감기가 길기 때문에 며칠에 한 번씩 복용해도 효과가 있음).
일반적으로 Hydroxychloroquine은 약염기 프로필과 결합된 종양 주변의 일반적 산도 때문에 종양 위치에 도달하는 데 심각한 문제가 있습니다
그러나 Hydroxychloroquine을 위의 양성자화 전략과 결합하면 발효가 감소하거나 양성자가 암세포 내부에 축적되기 때문에 더 이상 문제가 되지 않을 수 있습니다.
제 생각에는 하이드록시클로로퀸 이 영양소 고갈 전략의 일부입니다.
"에너지 엔진 차단" 전략을 확장하는 데 더 나아가 콜레스테롤 생산을 해결하는 데 특히 중점을 둔 "세포 구성 요소 억제"의 일부를 추가하는 것도 고려할 수 있습니다.
이는 "에너지 엔진 종료" 전략의 확장에서 고려하는 것도 의미가 있습니다.
다시 한 번 "에너지 엔진 종료" 및 "세포 빌딩 블록 억제"라는 두 가지 전략에 사용되는 보충제와 약물이 많이 겹치기 때문입니다. ".
보다 구체적으로, 콜레스테롤 생성 억제에는 여기에 논의된 바와 같이 스타틴, 메트포르민, 독시시클린, 오메가 3, 베르베린도 포함됩니다( Ref .).
이 전략을 더 완성하기 위해 HCA와 Dipyridamole을 추가하는 것을 고려할 것입니다.
요약하면 "에너지 엔진 종료" 전략의 확장에는 다음이 포함됩니다.
- 양성자 펌프 억제제 Amiloride 또는 Acetozolamide 중 적어도 하나 , 바람직하게는 둘 다
- 자가포식 억제제 하이드록시 클로로퀸
- HCA 및 가능한 경우 디피리다몰
마지막으로, 치료 전략에 관계없이 중앙 전략과 병행하여 항상 약물 및 보조제 사용을 고려합니다.
- 메벤다졸 과 같은 기생충을 처리하고 빠른 세포 분열을 억제합니다 .
- 커큐민 , 베이비 아스피린 , 올리브잎 추출물 등 염증 감소 및 전이 억제
- 비타민 D , 밀크씨슬 , 황기 등의 중요한 장기와 면역 체계를 지원합니다 .
'암치료' 카테고리의 다른 글
| 암세포 기능을 방해하는 미토콘드리아 억제제 목록 (0) | 2022.11.03 |
|---|---|
| 대사를 차단하고 암 퇴치를 돕는 약물 및 보조제 목록 (0) | 2022.11.03 |
| 방사선 치료와 시너지 (0) | 2022.11.01 |
| 육종 대사체학 (0) | 2022.10.31 |
| MDM2 (0) | 2022.10.24 |