2018
A List of Mitochondria Inhibitors, Disrupting Cancer Cell Function - Cancer Treatments - from Research to Application
When looking at cancer as a metabolic disease, mitochondria (the engine of the cell) plays a key role in tumor development (Ref.). As a result, mitochondria inhibitors are important tools to be included in an anticancer treatment strategy. There is vast am
www.cancertreatmentsresearch.com
A List of Mitochondria Inhibitors, Disrupting Cancer Cell Function
암을 대사 질환으로 볼 때 미토콘드리아(세포의 엔진)는 종양 발달에 중요한 역할을 합니다( Ref .).
결과적으로 미토콘드리아 억제제는 항암 치료 전략에 포함되어야 하는 중요한 도구입니다.
"많은 유형의 종양에서 표적 요법 또는 화학 요법 약물로 치료한 후 발생하는 약물 내성 세포는 감수성 세포와 구별되는 대사 프로파일을 보여줍니다.
현재 요법에 민감한 빠르게 성장하는 종양 세포는 일반적으로 에너지 및 생합성 요구를 지원하기 위해 포도당 흡수 및 포도당의 젖산으로의 해당 분해의 향상된 활성을 보여줍니다.
대조적으로, 많은 치료 치료에서 발생하는 내성 하위 집단은 생합성 및 생체 에너지 요구를 위해 미토콘드리아 대사 활동(크렙스 주기 및 산화적 인산화(OXPHOS))에 크게 의존하는 느린 성장자입니다.
이 내성 세포는 종양을 전이하고 개시하는 더 큰 능력을 가지고 있으므로, 내성 하위 집단을 근절하는 것은 현대 항암 약물 개발의 중요한 측면입니다.
저항성 집단의 미토콘드리아 대사 활성 의존성은 OXPHOS를 표적으로 하는 대사 조절제에 매우 민감하게 하며, OXPHOS 조절제의 조합은 다양한 전임상 연구에서 종양의 재발을 억제하는 효과적인 치료 옵션으로 입증되었습니다." ( 참조 .)
미토콘드리아 억제제는 화학 요법의 효과를 높이기 위해 화학 요법 당일에 가장 잘 투여되는 것으로 나타났습니다.
이와는 대조적으로, 화학 요법 전에 투여하면 화학 요법 효과가 감소할 수 있습니다(나는 Rafael Pharmaceuticals에 연락하여 확인했지만 응답이 없었습니다).
그럼에도 불구하고 미토콘드리아 억제제만으로는 종양을 죽이기에 충분하지 않을 수 있지만 위에 언급된 임상 시험에서 알 수 있듯이 화학 요법, 방사선과 같은 다른 요법과 결합할 경우(또한 2-dg, 3-BP 등)와 같은 해당 분해 억제제를 포함한 새로운 요법, 결과는 매우 관련이 있을 수 있습니다.
다음은 제가 알고 있는 미토콘드리아 억제제 목록입니다.
미토콘드리아 억제제가 방해하는 미토콘드리아 관련 메커니즘에 따라 분류됩니다( 그림 9 는 산화적 인산화와 관련된 미토콘드리아 전자 수송 사슬 복합체를 보여주는 멋진 그림입니다).
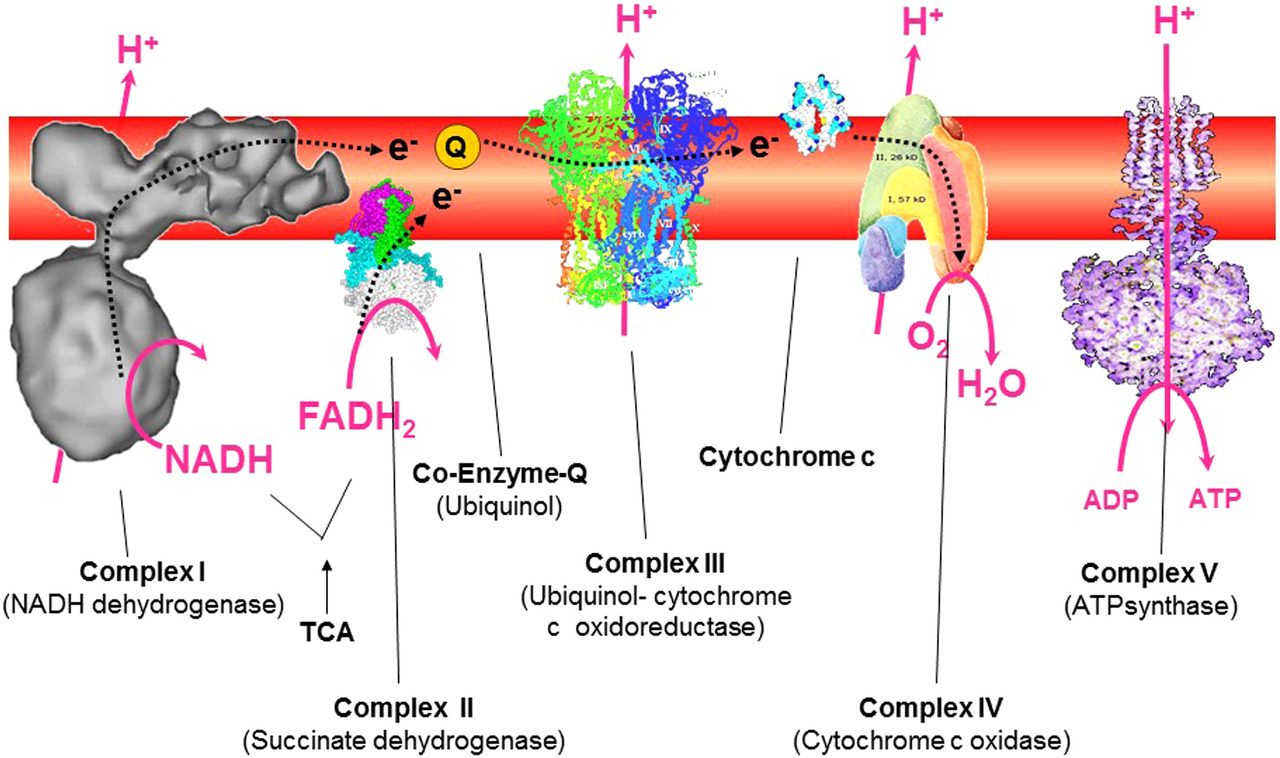
미토콘드리아 복합체 I 억제제:
- Berberine ( Ref .) – 온라인 식품 보충제로 사용 가능한 천연 추출물
- Papaverine ( Ref .1, Ref .2) – 미토콘드리아 복합체 I 억제제 – 주로 내장 경련 및 혈관 경련 치료에 사용되며 때때로 발기 부전 치료에 사용되는 FDA 승인 약물
- Metformin ( Ref .) – 미토콘드리아 복합체 I 억제제 – FDA 승인 약물 – 저렴하고 이용 가능
- Pyrvinium Pamoate , – 미토콘드리아 복합체 I 억제제 ( Ref .) – FDA 승인 약물 – 저렴하고 이용 가능하지만 인체 흡수율이 낮음
- Canagliflozin ( Ref .) – FDA 승인 약물 – 저렴하고 이용 가능
- 호노키올 ( Ref .). – 천연 물질 – 온라인 보충제로 이용 가능 – 복합 I 억제( Ref .)
- Niclosamide , Nitazoxanide , Closantel ( Ref .) – FDA 승인 약물 억제 복합체 I ( Ref .)
- Arctium lappa에서 발견되는 Arctigenin ( Ref .) - 일반적으로 우엉이라고 불리는 일부 암의 대체 치료를 위한 Essiac 차의 성분( Ref .) - 복합 I을 억제합니다.
- Luseogliflozin ( Ref .) – 일본에서 제2형 당뇨병(T2DM) 환자의 치료를 위해 승인된 약물( Ref .)
미토콘드리아 복합체 II 억제제:
- Lonidamine – Mitochondrial Complex II의 억제, 그러나 쉽게 구할 수 없음( Ref .)
미토콘드리아 복합체 III 억제제:
미토콘드리아 복합체 IV 억제제:
미토콘드리아 복합체 V 억제제:
- Meclizine , – 미토콘드리아 복합체 V의 억제( Ref .1, Ref .2) – FDA 승인 약물 – 저렴하고 이용 가능
- 베다퀼린 – FDA 승인 항생제는 미토콘드리아 ATP 합성효소(복합체 V)를 억제합니다( Ref .1, Ref .2)
- 올리고미신 ( 참고 .). – 승인되지 않음 – 비싸고 안전하지 않으며 접근하기 쉽지 않음 – 미토콘드리아 ATP 합성효소 억제(복합체 V) ( Ref .)
다중 복합체 억제제:
- Fenofibrate ( Ref .) – 및 FDA 승인 약물은 Complex I, II+III 및 V를 억제합니다( Ref .)
- Troglitazone ( Ref .) – FDA 승인 약물 – 저렴하고 이용 가능하며 Complexes II+III, IV 및 V 억제 – 가장 강력하게 Complex IV 억제 ( Ref .)
- Perhexiline ( Ref .1, Ref .2) - 아시아, 호주 및 뉴질랜드에서 항협심증제로 사용 승인 - 복합체 I 및 II( Ref .) 및 지방산의 미토콘드리아 베타 산화( Ref . )
기타 미토콘드리아 억제 메커니즘:
- Artemisinin – 미토콘드리아 기능의 파괴( Ref .1, Ref .2) – 이 웹사이트에서 이전에 논의된 식물 추출물( Ref .)
- Doxycycline , – FDA 승인 약물 – 저렴하고 이용 가능 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제 ( Ref .)
- Tigecycline ( Ref .) – FDA 승인 약물 – 주사 가능 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제 ( Ref .)
- Azithromycin – FDA 승인 약물 – Mito Biogenesis 억제 – 미토콘드리아 단백질 번역 억제 ( Ref .)
- Salinomycin ( Ref .) – 승인되지 않음 – 고가의 정맥 주사, 이미 인간에게 사용되었으며 암에 효과적인 것으로 나타났음 – 미토콘드리아의 급속한 과분극 및 미토콘드리아 기질 산성화
정확한 메커니즘은 알려지지 않았습니다(적어도 나에게는):
- Propranolol ( Ref .1, Ref .2, Ref .3) – FDA 승인 약물 – 경구용, 저렴하고 사용 가능
- 프로폴리스의 카페인산 페닐 에스테르 (CAPE)( Ref .)
기타:
- 페르페나진 및 트리플루오페라진( Ref .)
- 메틸글리옥살 ( 참조 )
- 리모닌 – 천연 추출물( Ref .)
- 여기에 추가 미토 억제제( Ref .)를 포함하는 기사가 있고 여기에 또 다른 것이 있습니다( Ref .)
- 그라비올라의 불라타신 및 기타 아세토게닌( Ref .0, Ref .1, Ref .2)
- 미토콘드리아 억제제의 큰 목록( Ref .)
다음은 암의 미토콘드리아를 표적으로 하는 천연물 목록입니다 .
https://www.mdpi.com/1420-3049/26/1/92/html
Natural Products Targeting the Mitochondria in Cancers
There are abundant sources of anticancer drugs in nature that have a broad prospect in anticancer drug discovery. Natural compounds, with biological activities extracted from plants and marine and microbial metabolites, have significant antitumor effects,
www.mdpi.com
No.Isolated Compound Origin Cell Line Mechanism Reference
| Terpenoids | |||||
| 1 | Ganoleuconin O | Ganoderma leucocontextum | Huh7.5 | Fatty acid immobilization, loss of the mitochondrial lipid cardiolipin | [30] |
| 2 | Lupeol | Bombax ceiba | SK-RC-45 | Mitochondrial hyper fission | [31] |
| 3 | Betulinic acid | Betula alba | HeLa | Cardiolipin modification, ROS generation, Bad, caspase 9 | [32,33] |
| 4 | Alisol B-23-acetate | Alisma orientale | A549, NCI-H292 | ROS generation, Bcl-2↓, Bax↑, activation of caspase-3, -9, release of cytochrome c/AIF | [34] |
| 5 | Genipin | Gardenia jasminoides | N18TG2 | Activation of dicarboxylate carrier, decreased activity of UCP1, UCP3, and complex III of the respiratory chain, UCP2 inhibition | [35] |
| 6 | Alternol | Yew tree | PC-3 | Decrease of mitochondrial respiration, isocitric acid, fumaric acid and malic acid, ATP production | [36,37] |
| 7 | Cyathin Q | Cyathus africanus | HCT116 | Bcl-2↓, Bax↑, Bcl-xL↓, ROS generation, release of cytochrome c | [38] |
| 8 | 3α-hydroxy-19α-hydrogen-29-aldehyde-27-lupanoic acid | Potentilla discolor | HepG2 | Bcl-2↓, Bax↑, release of cytochrome c | [39] |
| 9 | Uvedafolin | Smallanthus sonchifolius | HeLa | MMP loss, release of cytochrome c | [40] |
| 10 | Heteronemin | Hippospongia sp. | Molt4 | ROS generation | [41] |
| 11 | Jatrogossone A | Jatropha gossypiifolia | KOPN-8 | MMP loss, ROS generation | [42] |
| 12 | Walsuronoid B | Walsura robusta | Bel-7402, HepG2 | ROS generation, mitochondrial and lysosomal dysfunction | [43] |
| 13 | Ferruginol | Podocarpus ferruginea | MDA-T32 | ROS generation, MMP loss, Bcl-2↓ | [44,45] |
| 14 | Lobocrassin B | Lobophytum crassum | CL1-5, H520, BEAS-2B |
Bcl-2↓, Bax↑, ROS generation, MMP loss, release of cytochrome c, activation of caspase-3 | [46] |
| 15 | Aellinane | Euphorbia aellenii | Caov-4 | Bcl-2↓, Bax↑, ROS generation, MMP loss | [47] |
| 16 | Tingenin B | Maytenus sp. | MCF-7s | Bcl-2↓, Bax↑, MMP loss | [48] |
| 17 | 3-O-trans-p-coumaroyl alphitolic acid | Ziziphus jujuba | PC-3 | ROS generation | [49] |
| 18 | Zerumbone | Zingiber zerumbet | PC-3, DU-145 | Tubulin binding and crosstalk between endoplasmic reticulum stress and mitochondrial insult | [50,51] |
| Flavonoids | |||||
| 19 | Isoquercitrin | Hibiscus cannabinus | MDA-MB-231 | LSD1-induced mitochondrial-mediated apoptosis pathway | [52,53] |
| 20 | Luteolin | Cauliflower, peanut, and carrot | SW1990 | Inhibitor of Bcl-2, mitochondrial permeabilization | [54] |
| 21 | Dihydromyricetin | Ampelopsis grossedentata | HepG2 | Akt/Bad signal pathway, mitochondrial apoptotic pathway, Bax↑, Bad↑, inhibition of the phosphorylation of Bad at Ser136 and Ser112 | [55,56] |
| 22 | Artonin E | Artocarpus elasticus | SKOV-3 | Release of cytochrome c, Activation of caspases-3, -8, and -9, Bax↑, Bcl-2↓, HSP70↓, survivin↓ | [57] |
| 23 | Myricetin | Fruits and vegetables | SNU-80 | Bax/Bcl-2↑, release of AIF | [58] |
| 24 | Xanthones | Garcinia xanthochymus | HepG2 | Bax↑, Bcl-2↓, Bcl-xL↓, Mcl-1↓, and survivin↓ | [59] |
| 25 | Cycloartobiloxanthone | Artocarpus gomezianus | H460 | Bax↑, Bcl-2↓, Mcl-1↓ | [60] |
| 26 | Paratocarpin E | Euphorbia humifusa | MCF-7 | Bax↑, Bcl-2↓, release of cytochrome c | [61] |
| 27 | Puerarin 6′’-O-xyloside | Pueraria lobata | SW480 | Bax↑, Bad↑, Bcl-2↓, caspase-3 and -9 activation | [62] |
| 28 | α-mangostin | Cratoxylum arborescens | HeLa | ROS generation, MMP loss, release of cytochrome c | [63] |
| 29 | Chrysin | Honey and propolis | Mitochondria isolated from hepatocytes of HCC rats |
ROS generation, MMP loss, release of cytochrome c, swelling in mitochondria | [64,65] |
| 30 | Fisetin | Strawberries, apples, grapes, onions, and cucumbers | SCC-4 | ROS generation, Ca2+ production, MMP loss, Bcl-2↓, Bax↑, Bid↑, release of cytochrome c, AIF, and Endo G | [66,67] |
| 31 | Baicalein | Scutellaria baicalensis, Scutellaria radix | A2780 | Combination therapy with baicalein and taxol had much higher antitumor effects compared with the monotherapy. Release of cytochrome c, and caspase-3 and -9 activation |
[68,69] |
| 32 | Alpinetin | Zingiberaceous plants |
A549 | Bcl-2↓, Bax↑, Bcl-xL↓, XIAP↓, PI3K/Akt signaling pathway, sensitized drug-resistant lung cancer cells | [70,71] |
| 33 | Chamaejasmin B | Stellerachamaejasme | KB, KBV200 | Bcl-2↓, Bax↑, MMP loss, release of cytochrome c and AIF | [72] |
| 34 | Mensacarcin | Streptomyces bacteria | SK-Mel-28, SK-Mel-5, HCT-116 | Release of cytochrome c, energy production and mitochondrial function rapidly disturbed | [73] |
| Saponins | |||||
| 35 | Gracillin | Dioscorea gracillima | H226B, H460 | Targeting mitochondrial complex II, suppressing ATP synthesis, ROS generation | [74] |
| 36 | Polyphyllin I | Paris polyphylla | MDA-MB-231 | Mitochondrial translocation of DRP1, mitochondrial fission, release of cytochrome c, mitochondrial PTEN-induced kinase 1↑ | [75,76] |
| 37 | Frondoside A | Cucumaria frondosa | CA46 | Bcl-2↓, survivin↓, release of HtrA2/Omi and cytochrome c, ROS generation | [77] |
| 38 | 3β-O-α-l- arabinopyranoside |
Clematis ganpiniana | MCF-7, MDA-MB-231 | Release of cytochrome c and Apaf-1, upregulation of caspase-9 and caspase-3 | [78] |
| 39 | Sakuraso-saponin | Aegiceras corniculatum | LNcaP, 22RV-1, C4-2 | Bcl-xL↓ | [79,80] |
| 40 | Ginsenoside compound K | Panax ginseng | SK-N-BE(2), SH-SY5Y | Bcl-2↓, Bcl-xL↓ | [81] |
| 41 | Escin | Aesculus hippocastanum | 786-O, Caki-1 | G2/M arrest and ROS-modulated mitochondrial pathways | [82] |
| 42 | α-Hederin | Hedera helix | SW620 | NF-κB signaling pathway, Bcl-2↓, Bax↑, release of cytochrome c | [83,84] |
| Alkaloids | |||||
| 43 | Cathachunine | Catharanthus roseus | HL60 | ROS-dependent mitochondria-mediated intrinsic pathway, Bcl-2/Bax↓, ROS generation, MMP loss, release of cytochrome c | [85] |
| 44 | Berberine | Rhizoma coptidis | T98G, LN18 | ERK1/2-mediated impairment of mitochondrial aerobic respiration | [86,87] |
| 45 | Papuamine | Haliclona sp. | H1299 | Intracellular ATP depleted by causing mitochondrial dysfunction, mitochondrial superoxide production | [88] |
| 46 | Bis (2-ethyl hexyl) 1H-pyrrole-3, 4-dicarboxylate | Tinospora cordifolia | MDA-MB-231 | ROS generation, increase in intracellular calcium, phosphorylation of p53, mitochondrial membrane depolarization, MPTP, and cardiolipin peroxidation, Bcl-2↓, Bax↑, release of cytochrome c, caspase activation, DNA fragmentation | [89] |
| 47 | Unantimycin A | Found in the fraction library of microbial metabolites | Semi-intact cells with specific substrates for each complex of the mitochondrial electron transport chain |
Targeted inhibition of mitochondrial complex I | [90] |
| 48 | NPL40330 | Found in chemical library | Semi-intact cells with specific substrates for each complex of the mitochondrial electron transport chain |
Targeted inhibition of mitochondrial complex III | [90] |
| 49 | Boholamide A | Marine mollusks | U87MG | Influx of Ca2+ | [91] |
| 50 | Cernumidine | Solanum cernuum | T24 | Cytotoxicity and chemosensitizing effect of cernumidine to cisplatin. Bcl-2↓, Bax↑, MMP loss | [92] |
| 51 | Lycorine | Amaryllidaceae plant family | HepG2 | mPTP opening, MMP loss, ATP depletion, release of Ca2+ and cytochrome c, caspase activation | [93] |
| 52 | Lagunamides A | Lyngbya majuscule | A549 | MMP loss, ROS generation | [94] |
| 53 | Cordycepin | Cordyceps | OVCAR-3 | Downregulation of mitochondrial function and limitation of energy production; metastasis and migration suppressed | [95,96] |
| Coumarins | |||||
| 54 | 2,3-Dihydro-7- hydroxy-2R*,3R*- dimethyl-2-[4,8-dimethyl-3(E),7- nonadienyl]-furo[3,2-c]coumarin |
Ferula ferulaeoides | C6 | MMP loss, Bcl-xL↓, Bcl-2↓, Bax↑, cleavage of Bid, FAS↑, FADD↑ | [97] |
| 55 | Dentatin | Clausena excavate | HepG2 | Bcl-xL↓, Bcl-2↓, Bax↑, release of cytochrome c | [98,99] |
| 56 | Aesculetin | Cortex Fraxini | THP-1 | Bcl-2↓, Bax↑ | [100] |
| Quinones | |||||
| 57 | Quambalarine B | Quambalaria cyanescens | Jurkat E6.1 | Inhibition of mitochondrial complex I and II, inhibition of mitochondrial respiration, metabolism reprogramming | [101,102] |
| 58 | Plumbagin | Plumbago zeylanica | MG63 | ROS generation, Bcl-2↓, Bax↑, Bcl-xL↓, and Bak↓, endoplasmic reticulum stress | [103] |
| 59 | Shikonin | Lithospermum erythrorhizon | HGC-27 | Bcl-2↓, Bax↑, survivin↓ | [104] |
| 60 | 2,7-dihydroxy-3-methylanthraquinone | Hedyotis diffusa | SGC-7901 | Bcl-xl↓, Bcl-2↓, Bax↑, Bad↑, release of cytochrome c | [105] |
| 61 | 3-hydroxy-1,5,6-trimethoxy-2-methyl-9,10-anthraquinone | Prismatomeris connate | A549, H1299 | Bcl-2↓, Mcl-1↓, Bax↑ | [106] |
| 62 | Thymoquinone | Nigella sativa | T24, 253J | Bcl-2↓, Bax↑, release of cytochrome c and AIF | [107] |
| Miscellanea | |||||
| 63 | Methylsulfonylmethane | Fruits and vegetables | YD-38 | Bcl-xL↓, Bcl-2↓, Bax↑, release of cytochrome c, MMP loss | [108,109] |
| 64 | Parameritannin A-2 | Urceola huaitingii | HGC27 | Enhanced doxorubicin-induced mitochondria-dependent apoptosis, inhibition of the PI3K/Akt, ERK1/2 and p38 pathways, Bcl-2↓, Bcl-xl↓, Bax↑, Bid↑, release of cytochrome c, caspase activation | [110] |
| 65 | Resveratrol | Polygonum cuspidatum, Veratrum nigrum, Cassia obtusifolia |
H838, H520; K562 |
Enhanced antitumor activities of cisplatin; Induced apoptosis |
[111,112] |
| 66 | Oleuropein | Olea europaea | H1299 | Bcl-2/Bax↓, release of cytochrome c, activation of caspase-3 | [113,114] |
| 67 | Homoisoflavanone-1 | Polygonatum odoratum | A549 | Mitochondria-caspase-dependent and ER stress pathways, Bcl-2/ Bak↓ | [115] |
| 68 | Gallic acid | Green tea, grapes, red wine |
H446 | ROS-dependent mitochondrial apoptotic pathway | [116] |
| 69 | Hierridin b | Cyanobium sp. | HT-29 | Proteomics identified 21 differentially expressed proteins belonging to the categories protein folding/synthesis and cell structure and reduced mitochondrial activity and as confirmed by morphological analysis of mitochondrial parameters |
[117,118] |
| 70 | Deoxyarbutin | Ecklonia cava | B16F10 | MMP loss, ATP depletion and ROS overload generation | [119] |
| 71 | Magnolol | Magnolia officinalis | OS-RC-2, 786-O | P53, Bcl-2/Bax↓, release of cytochrome c, caspase activation, ROS generation | [120] |
| 72 | Oblongifolin C | Garcinia yunnanensis | QBC939 | Mitochondrial dysfunction | [121] |
| 73 | Amorfrutin C | Glycyrrhiza foetida | HT-29 | mPTP opening, mitochondrial oxygen consumption and extracellular acidification increased | [122] |
| 74 | Allyl isothiocyanate | Cruciferous vegetables | MCF-7, MDA-MB-231 | ROS and Ca2+ production, MMP loss, release of cytochrome c, AIF, and Endo G, Bcl-2↓, Bax↑ | [123,124] |
| 75 | α-conidendrin | Taxus yunnanensis | MCF-7 and MDA-MB-231 | ROS generation, p53↑, Bax↑, Bcl-2↓, MMP loss, release of cytochrome c, activation of caspases-3 and -9 | [125] |
| 76 | Dehydrobruceine B | Brucea javanica | A549, NCI-H292 | MMP loss, release of cytochrome c, cleavage of caspase-9, caspase-3, and poly (ADP-ribose) polymerase (PARP) | [126] |
| 77 | Frugoside | Calotropis procera | M14, A375 | ROS generation | [127,128] |
| 78 | Methyl caffeate | Solanum torvum | MCF-7 | Bcl-2↓, Bax↑, Bid↑, p53↑, cleavage of caspase-3 and PARP, release of cytochrome c | [129] |
| 79 | Tetrahydrocurcumin | Curcuma longa | MCF-7 | ROS generation, Bcl-2↓, PARP↓, Bax↑, release of cytochrome c, MMP loss | [130] |
| 80 | Phloretin | Apple tree leaves and Manchurian apricot | EC-109 | Bcl-2↓, Bax↑ | [131] |
| 81 | Sesamol | Sesame seeds | HepG2 | Bcl-2↓, Bax↑, MMP loss, H2O2 production, PI3K Class III/Belin-1 pathway | [132] |
다른 (충분히 강력한) 미토콘드리아 억제제를 알고 있다면 여기에 의견을 게시하십시오.
메모:
- 미토 억제제와 해당과정(발효) 억제제를 결합하는 것은 서로 다른 암세포 유형이 서로 다른 생체 에너지 변화를 겪을 수 있기 때문에 의미가 있습니다.
- 또한, mito inhibitor만을 사용하면 해당과정과 전신 산도가 증가할 것으로 예상됩니다. 따라서 미토 억제제를 장기간 사용하는 경우 해당 억제제(예: 2DG , 고용량 비타민 C 등) 및 양성자 펌프 억제제(예: 여기에서 논의됨) 및 알칼리화 억제제와 결합하는 것이 좋을 뿐만 아니라 바람직 할 수 있습니다 . 보조제(예: Basentabs).
- 흥미롭게도, 메트포르민과 같은 미토 억제제와 살리노마이신과 같은 양성자 이온 전달 물질이 결합된 종양 세포에서 미토 억제제로 인해 초기에 해당 작용으로 전환되는 "와버그 트랩"을 유도할 것이라고 제안되었습니다. 그러나 해당 과정은 종양 주변의 산도를 증가시킵니다. 반면에 살리노마이신은 양성자 이노포어(inophore) 작용으로 인해 암 세포가 좋아하지 않는 종양으로 양성자를 다시 되돌려줍니다. 그래서 그들은 모든 에너지를 소비하는 세포에서 양성자를 다시 밀어내려고 할 것입니다. 세포가 더 많은 에너지를 생산하려고 하면 해당 과정을 통해서만 에너지를 생산할 수 있으며, 이는 다시 양성자의 생산으로 이어집니다. 이것이 바로 '바르부르크 트랩(Warburg trap)'이라고 불리는 것으로, 높은 세포내 산성도 때문에 암세포가 느려지고 결국 죽어야 하는 시점입니다.참조 ). 같은 논문에서 저자들은 다음과 같이 기술합니다. “따라서 우리는 MCI 억제제 단독 또는 Warburg 트랩 약물 조합을 사용한 수술 후 치료가 지지 요법 구성 요소로 간주될 수 있으며, 특히 종양이 있는 환자의 경우 높은 점수를 받은 경우에 제안합니다. 종양 재발 위험을 방지하기 위해 Wnt 신호 전달." 나는 이것이 내가 두 가지 유사분열 억제제(메트포르민과 독시시클린)와 살리노 마이신을 양성자 억제물질로 결합하는 치료 전략에 대한 좋은 아이디어라고 생각합니다.
- 그러나 Canaglifozin과 2DG의 병용에 대해서는 알려지지 않은 측면이 있습니다. 카나글리포진의 주요 기능은 포도당 수송체를 억제하는 것이기 때문입니다. ( 미토 억제는 약물에 대한 표적을 벗어난 작용일 뿐입니다), 이것이 오늘날 Canaglifozin이 항당뇨병 약물로 사용되는 이유입니다 . 그리고 열린 질문은 두 가지를 결합하는 것이 좋은지 여부입니다.
- 단점은 Canaglifozin이 암세포에서 2DG 흡수를 감소시킬 수 있다는 것입니다.
- 반면에 Canaglifozin은 암세포의 2DG 흡수뿐만 아니라 포도당의 흡수도 감소시킬 수 있다는 장점이 있습니다. 이것은 차례로 더 높은 항암 효과로 이어질 수 있지만 정상 세포도 이 두 약물의 영향을 받기 때문에 부작용이 더 커질 수 있습니다.
기타 참조:
미토콘드리아 대사와 암 https://www.nature.com/articles/cr2017155#ref172
해당과정은 암세포에서 에너지 생산과 동화작용 성장을 위한 주요 대사 과정으로 오랫동안 여겨져 왔습니다.
이러한 견해가 클리닉에서 여전히 사용되는 강력한 이미징 도구의 개발에 중요한 역할을 했지만 이제 미토콘드리아가 종양 발생에서 핵심적인 역할을 한다는 것이 분명합니다.
중추 생체 에너지 기능을 발휘하는 것 외에도, 미토콘드리아는 실제로 종양 동화 작용을 위한 빌딩 블록을 제공하고, 산화 환원 및 칼슘 항상성을 제어하고, 전사 조절에 참여하고, 세포 사멸을 제어합니다.
따라서 미토콘드리아는 새로운 항암제의 개발을 위한 유망한 표적이 됩니다.
그러나 종양이 발생하고 진행되며 숙주 면역계와의 친밀한 누화의 맥락에서 치료에 반응하며 많은 면역학적 기능은 온전한 미토콘드리아 대사에 의존합니다. ,
비 산화 환원 활성 리포 에이트 유도체는 암세포 미토콘드리아 대사를 방해하고 생체 내에서 강력한 항암제입니다. https://www.ncbi.nlm.nih.gov/pubmed/21769686
우리는 잠재적인 항암제로 조사한 리포산(리포에이트) 유사체의 대규모 세트의 첫 번째 구성원인 CPI-613의 분석을 보고합니다. CPI-613은 배양 중 종양 세포에 대한 선택성을 통해 미토콘드리아 대사를 강력하게 방해합니다.
종양성 미토콘드리아 에너지 대사를 표적으로 하고 투명 세포 육종에서 자가포식을 억제하기 위한 CPI-613의 치료 가능성. https://www.ncbi.nlm.nih.gov/pubmed/29879220
투명 세포 육종(CCS)은 높은 전이율과 관련된 공격적인 유형의 연조직 종양입니다.
흥미롭게도 CPI-613은 자가포식소체와 리소좀의 융합을 억제하는 클로로퀸과 함께 시험관 내에서 HS-MM CCS 세포 성장의 괴사를 유의하게 유도했습니다.
CPI-613(25mg/kg)과 클로로퀸(50mg/kg)을 2주 동안 주 2일 복강 내 투여한 결과 주사 부위의 종양 성장이 유의하게 감소하고 전이가 사라졌습니다. 현재 결과는 CCS의 진행에 대한 CPI-613과 클로로퀸의 조합의 억제 효과를 의미합니다.
Canagliflozin 매개 미토콘드리아 글루타메이트 탈수소효소 및 복합체 I의 이중 억제: 표적 외 부작용. https://www.ncbi.nlm.nih.gov/pubmed/29445145
최근 FDA Drug Safety Communications는 제2형 당뇨병 치료에 사용되는 글리플로진 계열의 나트륨/포도당 동시 수송 억제제로 치료받은 환자에서 급성 신장 손상 위험이 증가했다고 보고했습니다.
글리플로진을 중심 탄소 대사 및 미토콘드리아 기능 억제제와 대조하는 표적 대사체학 접근법은 카나글리플로진에 대한 이중 작용 방식을 나타내었지만 그 유사체인 다파글리플로진 및 엠파글리플로진에 대해서는 그렇지 않았습니다.
Canagliflozin은 임상적으로 적절한 농도에서 글루타메이트 탈수소효소(GDH)와 미토콘드리아 전자 수송 사슬(ETC) 복합체 I을 억제했습니다.
이 이중 억제는 특히 글루타민(아나폴로시스)에 의한 트리카르복실산 회로 대사 산물의 보충을 방지하여 보상적 아미노기 전이 반응을 증가시켜 아미노산 풀을 변경했습니다.
이 발견은 GDH를 통한 글루타민 보충에 대한 증식하는 세포의 강한 의존성에 대한 증거입니다.
임상적으로 적절한 농도에서 신장 세포에서 GDH 및 ETC 복합체 I의 카나글리플로진 매개 동시 억제의 발견, 및
증식 중 괴사 세포 사멸에 대한 특정 감수성,은 기존의 만성 신장 질환 또는 지속적인 재생 관 상피 세포 증식을 특징으로 하는 이전의 신장 손상이 있는 환자에서 특히 관찰된 부작용에 대한 기계적 근거를 제공합니다.
Troglitazone은 미토콘드리아 호흡을 억제하고 포도당 제한에 대한 민감도를 증가시켜 18F-FDG의 암세포 흡수를 자극 합니다. https://www.ncbi.nlm.nih.gov/pubmed/26449833
트로글리타존이 암세포의 포도당 대사와 (18)F-FDG 흡수에 어떤 영향을 미치는지 평가하고, 트로글리타존의 분자 기전 및 약물의 항암 효과와의 관계를 조사했습니다.
결과:
20μM 트로글리타존을 1시간 동안 처리하면 여러 유방암 세포주에서 (18)F-FDG 흡수가 급격히 증가한 반면 HCT116 세포는 지연된 반응을 보였습니다.
T47D 세포에서, 반응은 퍼옥시좀 증식제 활성화 수용체-γ와 무관하게 용량 의존적(40μM까지 3배 증가) 방식으로 발생했고, 향상된 해당 흐름과 일치하는 락테이트 생산의 2배 증가를 동반했습니다.
Troglitazone 처리 세포는 산소 소비율의 심각한 감소를 보여 미토콘드리아 호흡의 억제를 나타냈으며, 이는 미토콘드리아 막 전위의 현저하게 감소하고 활성 산소 종의 농도 증가를 동반했습니다.
결론:
Troglitazone은 손상된 미토콘드리아 산화 호흡에 대한 적응 반응으로 해당 작용 플럭스로의 대사 이동을 통해 (18)F-FDG의 암세포 흡수를 자극합니다.
암 줄기 세포(CSC): 식별 및 근절을 위한 대사 전략 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5941316/
표현형 및 기능적 이질성은 다양한 종양 유형 내에서 암 세포의 가장 관련성이 높은 특징 중 하나이며 치료 실패에 대한 책임이 있습니다. 암 줄기 세포(CSC)는 암 세포 유형의 전체 레퍼토리를 생성할 수 있는 능력 때문에 종양 이질성의 근본 원인으로 간주되는 줄기 세포와 유사한 특성을 가진 세포 집단입니다. 더욱이, CSC는 전이성 전파 및 치료 내성의 주요 동인으로 사용되었습니다. 따라서 CSC를 표적으로 하는 것은 고전적인 항암 요법의 효과를 향상시키는 유용한 전략이 될 수 있습니다. 최근 신진 대사는 CSC 생물학에서 관련 선수로 간주되어 왔으며 실제로 발암 성 변화는 대사 산물에 의한 CSC의 보급을 유발합니다. 더 흥미롭게도, CSC 유지에서 대사 경로의 작용은 단순히 게놈 변경의 결과가 아닐 수 있습니다. 실제로, 특정 대사형 표현형은 줄기 특성을 유지하는 데 원인이 되는 역할을 하여 줄기의 조정자 역할을 할 수 있습니다. 여기에서 우리는 CSC 유지 및 전파와 관련된 생화학적 에너지 경로에 초점을 맞춘 CSC의 대사 기능에 대한 현재 연구를 검토합니다. 우리는 미세 환경 변화, 유전적 이상 및 약리학적 스트레스 요인에 대한 응답으로 CSC의 플라스틱 대사 행동에 대한 자세한 개요를 제공합니다. 또한, 우리는 이러한 대사 생화학적 유연성을 효과적으로 표적화하기 위해 특정 대사 의존성 내에서 CSC를 '강제'할 가능성과 함께 CSC를 식별하고 선택적으로 근절하기 위한 포괄적인 대사 접근법의 잠재력을 설명합니다.
미토콘드리아를 표적으로 하는 항생제는 여러 종양 유형에서 암 줄기 세포를 효과적으로 근절합니다: 암을 전염병처럼 치료 http://www.oncotarget.com/index.php?journal=oncotarget&page=article&op=view&path[0]=3174&path[1] =6141
여기에서 우리는 암 줄기 세포(CSC), 일명 종양 개시 세포(TIC)의 선택적 표적화를 통해 초기 암 병변 및 진행성 전이성 질환의 치료를 위한 새로운 전략을 제안합니다. 우리는 암 치료에 돌연변이 독립적인 접근 방식을 제공하기 위해 여러 종양 유형에 걸쳐 암 줄기 세포 사이에서 고도로 보존된 전역 표현형 특성을 검색했습니다. 이를 통해 우리는 암 줄기 세포를 표적으로 삼아 종양 조직 유형과 관계없이 암을 단일 "줄기 질환"으로 효과적으로 치료할 수 있습니다. 이 접근법을 사용하여 우리는 보존된 표현형 약점을 확인했습니다. 즉, 암 줄기 세포의 클론 확장 및 생존을 위해 미토콘드리아 생물 발생에 대한 엄격한 의존성입니다. 흥미롭게도 FDA 승인을 받은 여러 종류의 항생제는 알려진 "부작용"으로 미토콘드리아 생합성을 억제합니다. 대신 "치료 효과"로 활용할 수 있습니다. 이 분석을 바탕으로 FDA 승인 약물의 4~5가지 클래스를 사용하여 12가지 다른 암세포주에서 8가지 다른 종양 유형(유방, DCIS, 난소, 전립선 , 폐, 췌장, 흑색종 및 교모세포종(뇌)). 미토콘드리아를 표적으로 하는 이 5가지 종류의 항생제에는 에리트로마이신, 테트라사이클린, 글리실사이클린, 구충제 및 클로람페니콜이 포함됩니다. 개념 증명으로 아지트로마이신, 독시사이클린, 티게사이클린, 피르비늄 파모에이트 및 클로람페니콜과 같은 각 약물 클래스의 한 항생제에 대한 기능 데이터가 제공됩니다. 중요한 것은 이러한 약물 중 다수가 정상 세포에 독성이 없기 때문에 항암 요법의 부작용을 줄일 수 있다는 것입니다. 따라서, 우리는 이제 여러 종양 유형에 걸쳐 FDA 승인 항생제를 항암 요법으로 용도 변경하여 암을 전염병처럼 치료할 것을 제안합니다. 이러한 약물 종류는 특히 종양 재발 및 원격 전이 예방에 중점을 둔 예방 연구를 위해 고려되어야 합니다. 마지막으로, 독시사이클린과 아지스로마이신(암 관련 감염을 표적으로 하지만 암 세포는 대상이 아님)에 대한 최근 임상 시험은 암 줄기 세포를 박멸하는 능력이 아직 평가되지는 않았지만 암 환자에게 이미 긍정적인 치료 효과를 보여주었습니다.
암 치료를 위한 티게사이클린 사용 https://patents.google.com/patent/WO2011109899A1/ko
암 줄기 세포는 다른 암세포와 다른 대사 프로파일을 나타내므로 기존의 화학 요법제를 사용한 치료에 쉽게 반응하지 않습니다. 본 명세서에 개시된 연구는 이제 글리실사이클린 항생제 티게사이클린(테트라사이클린 유도체)이 암 줄기 세포에 대한 활성을 포함하는 항암 활성을 나타낸다는 것을 입증합니다. 이 항종양 활성은 암세포에서 미토콘드리아 단백질 합성의 억제로 인한 것으로 보입니다. 바람직한 실시양태에서, 치료될 암은 백혈병, 림프종 또는 골수종과 같은 혈액암이다.
암 치료의 새로운 표적으로서의 산화적 인산화 https://www.ncbi.nlm.nih.gov/pubmed/29420223
암세포는 정상 세포와 비교하여 해당 작용을 상향 조절했으며, 이로 인해 많은 사람들이 산화적 인산화(OXPHOS)가 모든 암에서 하향 조절된다는 가정을 하게 되었습니다. 그러나 최근 연구에 따르면 OXPHOS는 백혈병, 림프종, 췌관 선암종, 고 OXPHOS 아형 흑색종 및 자궁내막 암종을 포함한 특정 암에서도 상향조절될 수 있으며, 이는 활성 해당작용에도 불구하고 발생할 수 있음을 보여줍니다. 따라서 OXPHOS 억제제는 OXPHOS가 상향 조절되는 암 아형을 표적화하고 치료학적으로 불리한 종양 저산소증을 완화하는 데 사용될 수 있습니다. 메트포르민, 아토바쿠온 및 삼산화비소를 비롯한 여러 약물이 비종양학적 적응증에 임상적으로 사용되지만 새로운 데이터는 OXPHOS 억제제로서의 잠재적 사용을 보여줍니다.
휴면 종양 스페로이드 영역에서 세포를 표적으로 하는 화합물 식별을 위한 3D 고함량 스크리닝 https://www.sciencedirect.com/science/article/pii/S0014482714000263
암 줄기 세포를 위한 새로운 대사 바이오마커인 NADH 자가형광: "줄기"를 표적으로 하는 천연 산물로서의 비타민 C 및 CAPE 식별 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5400535/
여기에서 우리는 암 줄기 유사 세포(CSC)의 증식에서 대사 이질성의 역할을 조사하기 위해 광범위한 분자 "도구 키트"를 조립했습니다. 먼저, 우리는 형광 미토콘드리아 프로브를 사용하여 PCG1α 활성과 ROS 및 과산화수소(H2O2) 생산을 감지하여 유세포 분석에 의해 MCF7 세포를 "대사 분별"에 적용했습니다. NADH 수준은 또한 자동 형광에 의해 모니터링되었습니다. 그런 다음, 맘모스피어 분석(3D-스페로이드)을 사용하여 다양한 세포 집단을 "줄기 세포 활성"에 대해 기능적으로 평가했습니다. 우리의 결과는 증가된 PGC1α 활성, 높은 미토콘드리아 ROS/H2O2 생산 및 높은 NADH 수준을 갖는 MCF7 세포의 하위 집단이 모두 더 높은 효율로 맘모스피어를 형성함을 나타냅니다. 따라서, 미토콘드리아 산화 스트레스와 항산화 반응은 모두 CSC에서 미토콘드리아 생합성 및 산화 대사 촉진에 기여하는 것으로 보입니다. 특정 억제제를 사용하여 대사 과정(NAD+ 회수 경로, 해당 작용, 미토콘드리아 단백질 합성 및 OXPHOS)을 표적으로 하여 CSC 전파를 현저히 감소시킴으로써 추가 검증이 제공되었습니다. 그 결과, 우리는 이제 임상적으로 승인된 다양한 약물(스티리펜톨), 천연 제품(카페인산 페닐 에스테르(CAPE), 아스코르브산, 실리비닌) 및 실험 의약품(액티노닌, FK866, 2-DG)을 확인했습니다. CSC 활성을 효과적으로 억제하는 데 사용됩니다. 우리는 잠재적인 자연 치료 양식으로서 CAPE(꿀벌 프로폴리스에서 추출)와 비타민 C의 사용에 대해 논의합니다. 이러한 맥락에서, 비타민 C는 CSC의 표적화에 대해 2-DG보다 ~10배 더 강력했습니다. 유사하게, 스티리펜톨은 2-DG보다 50~100배 더 강력했습니다.
내화학성 난소암 치료를 위한 미토콘드리아 표적화 https://www.mdpi.com/1422-0067/20/1/229/htm
난소암은 서구 세계에서 부인과 악성 종양으로 인한 사망의 주요 원인입니다. 이는 부분적으로 수술 및 백금/파클리탁셀의 표준 치료에도 불구하고 대부분의 환자가 궁극적으로 화학 내성 질환으로 재발한다는 사실에 기인합니다. 난소암은 동일한 공간인 복강에서 발생, 전이 및 재발하는 독특한 형태의 고형 종양으로, 복수, 저산소증 및 낮은 포도당 수치를 특징으로 하는 독특한 미세 환경이 됩니다. 이러한 조건에서 암세포가 미토콘드리아 호흡에 적응하고 전환하여 생존에 결정적인 역할을 하므로 내화학성 난소암의 이상적인 대사 표적이 됩니다. 중요한 것은 미세 환경 요인과 무관하게, 미토콘드리아 공간 재분배는 난소암의 종양 전이 및 화학 내성과 관련이 있는 반면 특정 유전 돌연변이 세트는 가장 공격적인 난소암 하위 유형에서 미토콘드리아 경로에 대한 비정상적인 의존성을 유발하는 것으로 나타났습니다. 이 리뷰에서 우리는 화학 내성 난소암 치료를 위한 미토콘드리아 표적화와 난소암에서 미토콘드리아 호흡의 역할에 대한 이해의 현재 상태에 대해 요약합니다. 난소암이 여전히 가장 치명적인 부인과 질환이고 미토콘드리아 경로가 최근 고형 종양 진행을 유지하는 데 중요한 역할을 하고 있다는 점을 감안할 때 이것이 중요하고 시기 적절한 주제라고 생각합니다.
암 줄기세포 대사의 특징 https://www.nature.com/articles/bjc2016152
암세포는 높은 증식 속도에 대처하기 위해 세포 대사에 적응합니다. 암세포는 주로 산화적 인산화(OXPHOS)를 사용하는 대신 ATP와 빌딩 블록(Warburg 효과) 생성을 위해 덜 효율적인 해당과정을 사용합니다. 그러나 종양은 균일하지 않고 기능적으로 이질적이며 줄기 기능을 가진 암세포의 하위 집합을 보유하고 있습니다. 이러한 암세포는 전체 종양을 다시 채우는 능력이 있어 암 줄기 세포(CSC) 또는 종양 개시 세포(TIC)라고 불립니다. 해당 작용에 의존하는 분화된 벌크 종양 세포와 대조적으로, CSC는 암 유형에 따라 고도로 해당 작용 또는 OXPHOS 의존적일 수 있는 뚜렷한 대사 표현형을 보여줍니다. 두 경우 모두 미토콘드리아 기능은 중요하며 CSC 기능의 중심을 차지합니다. 이 젊고 새롭게 떠오르는 연구 분야에서 남아 있는 논쟁은 CSC 격리 기술 및/또는 덜 적합한 모델 시스템의 사용과 관련될 수 있습니다. 여전히 미토콘드리아 기능에 대한 CSC의 명백한 의존성은 1차 대사 표현형에 관계없이 치료 개입을 위해 수정할 수 있는 이전에 인식되지 않은 아킬레스건을 나타냅니다. 미토콘드리아 기능의 억제를 통해 많은 암의 근원인 고도의 내화학성 암 줄기세포를 제거하면 질병의 재발을 예방하고 환자의 장기적 결과를 개선할 수 있습니다. 치료 개입을 위해 수정될 수 있는 이전에 인식되지 않은 아킬레스건을 나타냅니다. 미토콘드리아 기능의 억제를 통해 많은 암의 근원인 고도의 내화학성 암 줄기세포를 제거하면 질병의 재발을 예방하고 환자의 장기적 결과를 개선할 수 있습니다. 치료 개입을 위해 수정될 수 있는 이전에 인식되지 않은 아킬레스건을 나타냅니다. 미토콘드리아 기능의 억제를 통해 많은 암의 근원인 고도의 내화학성 암 줄기세포를 제거하면 질병의 재발을 예방하고 환자의 장기적 결과를 개선할 수 있습니다.
'암치료' 카테고리의 다른 글
| 엑소좀( Exosome ) (0) | 2022.11.04 |
|---|---|
| 카페인과 화학 요법, 방사선 요법 및 면역 요법 (0) | 2022.11.04 |
| 대사를 차단하고 암 퇴치를 돕는 약물 및 보조제 목록 (0) | 2022.11.03 |
| 암의 발전소 폐쇄 (0) | 2022.11.03 |
| 방사선 치료와 시너지 (0) | 2022.11.01 |