https://www.sciencedirect.com/science/article/pii/S2213231717301386
Teaching the basics of cancer metabolism: Developing antitumor strategies by exploiting the differences between normal and cance
This review of the basics of cancer metabolism focuses on exploiting the metabolic differences between normal and cancer cells. The first part of the …
www.sciencedirect.com
<Teaching the basics of cancer metabolism: Developing antitumor strategies by exploiting the differences between normal and cancer cell metabolism>
하이라이트
•
정상 세포와 암 세포 간의 생화학 적 및 대사 적 차이를 이용합니다.
•
종양 기질 또는 미세 환경에서 역 Warburg 효과를 완화하여 종양 성장을 방해합니다.
•
해당 과정과 미토콘드리아 대사의 이중 표적화는 종양 세포 증식을 억제합니다.
요약
암 대사의 기초에 대한이 리뷰는 정상 세포와 암 세포 사이의 대사 차이를 활용하는 데 중점을 둡니다.
검토의 첫 번째 부분은 세포 에너지 또는 ATP를 생성하기 위해 정상 세포에서 사용되는 다양한 대사 경로 와 세포 구조를 구축하는 데 필요한 해당 중간체를 다룹니다 .
리뷰의 두 번째 부분은 호기성 해당 과정 또는 Warburg 효과 와 암세포에서 표적화 된 억제제를 개발하는 맥락에서 해당 과정,트리 카르 복실산 주기및 글루타민 분해를 포함하는 대사 재 프로그래밍에 대해 논의 합니다.
마지막으로, 암 미토콘드리아 대사 의 선택적 표적화잠재적 인 치료제로 양전하를 띤 친 유성 화합물을 사용하는 것과 정상 세포에서 기존 화학 요법 제의 독성 부작용을 완화하는 능력에 대해 논의합니다.
약어
ATP
아데노신 삼인산
BrP
브로 모피 루 베이트
CO 2
이산화탄소
CoA
아세틸-코엔자임 A
2-DG
2- 데 옥시 글루코스
기타
전자 수송 사슬
FAO
지방산 산화
일시적 유행
플라 빈 아데닌 디 뉴클레오타이드
FDG
불소화 데 옥시 글루코스
FFA
유리 지방산
GAPDH
글리 세르 알데히드 -3- 인산염
GIAN
학술 네트워크의 글로벌 이니셔티브
G-6P
포도당 -6- 인산
과다
포도당 수송기
H 2 O
물
홍콩
헥소 키나제
HIF-1
저산소증 유발 인자 1
IDH-2
이소 시트 레이트 탈수소 효소 -2
KRAS
V-Ki-ras2 Kirsten 쥐 육종
LDH
젖산 탈수소 효소
LN
로니 다민
MAGL
모노 아실 글리세롤 리파제
MCT
모노 카르 복실 레이트 수송기
MDR
다제 내성
NAD +
니코틴 아미드 아데닌 디 뉴클레오타이드
NADPH
니코틴 아미드 아데닌 디 뉴클레오티드 인산염
옥스 포스
산화 적 인산화
PHGDH
3- 포스 포 글리세 레이트 탈수소 효소
PDH
피루 베이트 탈수소 효소
PDK
피루 베이트 탈수소 효소 키나제
애완 동물
양전자 방출 단층 촬영
PK
피루 베이트 키나아제
TCA
트리 카르 복실 산
TPP +
트리 페닐 포스 포늄
VDAC
전압 의존 음이온 채널
2 . 암세포 대사 표적화 : 새로운 항암 치료 전략
암은 단일 질병이 아닙니다. 이것은 체내에서 비정상적이거나 돌연변이 된 세포의 통제되지 않은 성장에 의해 발생하며 암세포는 빠르게 성장하고 분열하는 능력과 통제되지 않은 증식을 겪는 능력이 특징입니다
정상 세포는 일련의 조직화 된 대사 프로그램을 따르지만 암세포는이“법칙과 질서”를 따르지 않습니다.
우리 몸의 대부분의 정상적인 세포는 유사 분열이라는 과정을 통해 질서 정연한 방식으로 복제됩니다
이러한 세포가 성장 중에 밀집되면 접촉 억제를 통해 성장을 멈 춥니 다.
세포에 결함이나 돌연변이가있는 경우, 프로그램 된 세포 사멸 ( "세포 자멸사"라고 함)을 통해 세포 기계에 의해 제거되고 돌연변이 된 죽은 세포가 새로운 세포로 대체됩니다 ( 그림 2).).
매일 정상 세포에서 발생하는 돌연변이의 수는 그다지 많지 않습니다.
약 천 개 정도입니다. 인체에 존재하는 엄청난 수의 세포 (100 조 정도)와 매일 형성되는 엄청난 수의 세포를 고려할 때 정상 세포에서 매일 발생하는 돌연변이의 수는 그리 높지 않습니다 [3] .
그러나 어떤 상황에서는 세포의 DNA 내의 돌연변이로 인해 세포 사멸에 대한 내성이 생기거나 더 빠른 복제가 진행됩니다.
이러한 조건 하에서 복제에 의해 형성된 새로운 세포는 여전히 동일한 돌연변이를 포함하여 궁극적으로 비정상 세포 덩어리 (신 생물)를 생성합니다 ( 그림 3 ) .).
종양 세포는 덩어리로 남아 있고 통제 할 수없는 상태로 성장하지 않는 한 양성으로 간주됩니다.
그러나 세포에 손상된 유전 정보가 포함 된 조건에서는 세포가 "무작정 뛰어 다니며"이웃 세포를 침범하는 경향이 있습니다.
이러한 침습성 돌연변이 세포는 암성이며 이러한 세포의 수집은 종양을 형성합니다.
암세포는 접촉에 의해 억제되지 않고, 빠르게 복제되고, 유전 적 이상을 나타내며, 세포 검사 점을 벗어나고, 세포 사멸에 대한 내성을 개발하고, 방대한 양의 세포 영양소를 소비합니다 [2] .
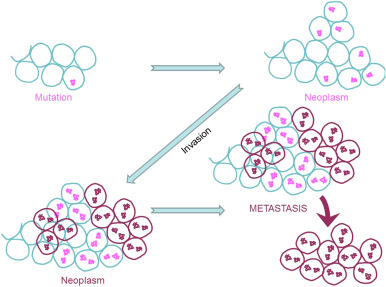
그림 3 . 암세포의 신 생물 형성, 침윤 및 전이.
대부분의 암에서 발생하는 또 다른 시나리오에서는 침윤성 암세포가 부서져 혈액 순환을 시작하고 그들이 거주하는 먼 기관으로 이동합니다. 이 과정 ( 즉 , 암세포가 일차 부위에서 멀리 퍼지는 능력)을 종양 전이라고합니다 ( 그림 3 ).
전이성 세포는 완전히 다른 돌연변이 세트를 가질 수 있으므로 화학 요법에 원발성 종양과 훨씬 다르게 반응 할 수 있습니다.
따라서 암은 실제로 다병이며, 완전히 치료하는 것이 더 어렵습니다.
증가 된 에너지 수요를 충족하기 위해 암세포는 여러 메커니즘을 사용하여 갈고리 또는 구부러진 방법으로 추가 영양소를 획득하려고 노력합니다 [3] , [4] .
모든 분열에서 암세포는 DNA, 인지질 및 기타 세포 기관과 같은 필수 세포 구성 요소를 조립해야합니다 .
암세포의 대사 특성과 대사적 요구를 획득하고 보충하는 경로는 대사 재 프로그래밍으로 인해 정상 세포와 다릅니다 [5] .
새로운 연구에 따르면 (정상 세포에 대해) 상대적으로 독성이없는 약물을 사용하여 만족할 수없는 대사가 필요한 암세포를 선택적으로 굶주 리면 암세포 증식을 선택적으로 억제 할 수 있습니다.,
따라서 암세포 대사에 대한 더 나은 이해는 (정상 세포에 대해) 더 효과적이고 독성이 적은 표적 항암제를 설계하는 길을 열 수 있습니다.
암 약물 발견의 최근 개발은 암세포에 의해 이용되는 대사 경로의 억제제에 초점을 맞추고 있습니다 [8] , [9] , [10] .
암세포를 죽이고 치료 후 종양이 빠르게 수축되는 세포 독성 요법 (화학 요법 및 방사선)과는 달리, 표적 요법은 암세포를 즉시 죽이지 않습니다 [11]. 오히려,
새로운 표적 치료법은 암 대사를 변경하거나 느리게함으로써 암세포 성장을 방해 하여 시간이 지남에 따라 암세포의 포도당 흡수 를 억제 합니다.
종양의 변화 또는 퇴행은 수일 또는 수개월 후에 발생합니다. 궁극적으로 표적 요법으로 치료받은 암세포는 죽습니다.
암 대사 화학 요법의 핵심 목표는 대사 억제제를 "표준 치료"화학 요법 제와 결합하고 정상 세포에 대한 세포 독성을 완화하여 종양 세포 세포 독성을 향상시키는 조합 화학 요법을 사용하는 것입니다.
3 . 영양소, 신진 대사 및 세포 에너지
우리 몸의 세포는 일련의 화학 반응이나 신진 대사를 통해 에너지를 얻습니다.
신진 대사는 동화 작용 (생성 )과 이화 작용 ( 분해 ) 사이의 균형으로 볼 수 있습니다 .
음식 (탄수화물, 단백질, 지방)은 신진 대사를 통해 에너지 (또는 아데노신 삼인산 [ATP])로 전환됩니다
정상 세포에서 ATP (세포 에너지 통화)는 그림과 같이 탄수화물, 단백질 및 지방의 이화 작용을 통해 생성됩니다.
탄수화물은 포도당으로 분해되어 피루 베이트와 아세틸 코엔자임 A (CoA)로 전환됩니다.
.아세틸 -CoA트리 카르 복실 산 (TCA) 경로 또는 "Krebs주기"에서 일련의 중간체로 대사되어 ATP 및 추가 ATP를 생성하는 고 에너지 담체 (니코틴 아미드 아데닌 디 뉴클레오타이드 포스페이트 [NADPH])를 방출합니다.
에너지는 호기성 포도당이 이산화탄소와 물로 산화 되는 동안 ATP 형태로 방출됩니다 .
단백질은 피루 베이트와 아세틸 -CoA 분자를 만드는 데 도움이되는 아미노산으로 분해됩니다.
지방은 피루 베이트 및 아세틸 -CoA 분자를 형성하는 데 도움이되는 소쇄 3 개 탄소 분자, 글리세롤 및 지방산으로 분해됩니다.
동화 작용과 이화 작용 경로는 모두 여러 호르몬 (글루카곤, 글루코 코르티코이드, 인슐린 및 성장 호르몬)에 의해 조절됩니다 [3] .
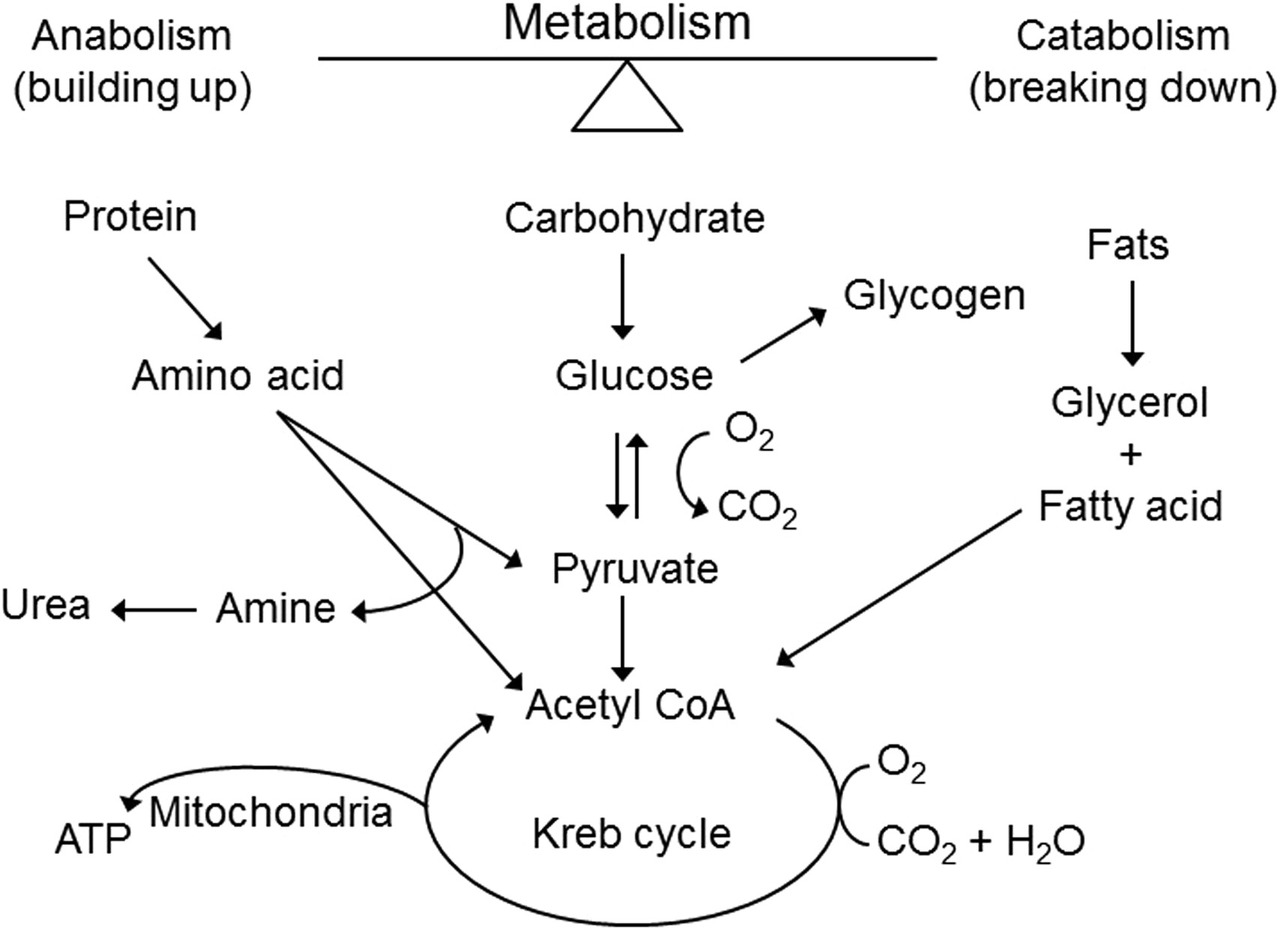
도 4 . 정상 세포에서 탄수화물, 단백질 및 지방의 대사로 인해 형성되는 세포 에너지.
치료 적 관점에서 암세포 대사를 이해하는 것은 매우 중요합니다.
암 치료를위한 치료 전략은 해당 과정 , 크렙스주기 , 산화 적 인산화 (OXPHOS), 글루타민 대사, 지방산 산화, 핵산 합성 , 지질 합성 및 아미노산 대사를 포함한 여러 대사 경로를 표적으로하는 것입니다 (그림 5).

그림 5 . 암 대사에서 다양한 에너지 경로를 표적으로 삼습니다.
4 . Warburg 효과 : 정상 세포와 암 세포 사이의 대사 차이의 기원
암세포에서 어떤 유형의 대사 재 프로그래밍이 발생합니까?
통제되지 않은 성장 속도를 유지하기 위해 암세포는 외부에서 에너지를 추출하는 다른 방식을 채택하고 있습니다.
정상 세포는 산소를 사용할 수있을 때 포도당을 젖산으로 대사하지 않습니다.
산소가 없거나 제한적일 때만 정상 세포는 혐기성 해당 과정에 의존 하거나 포도당을 젖산으로 대사 합니다.
반대로 암세포는 산소가 존재하더라도 포도당을 젖산으로 대사합니다 (호기성 해당 과정).
암세포가 변화된 신진 대사를 보인다는 아이디어는 원래 거의 100 년 전에 Otto Warburg에 의해 고안되었습니다 (Koppenol et al.에 의해 검토 됨) [14] .
호기성 (잘 산화 된) 조건에서 암세포가 포도당을 젖산으로 대사하는 경향 (호기성 해당 과정)은 Warburg 효과 로 알려져 있습니다 ( 그림 6 ).
Warburg는 종양 절편이 포도당을 소비하고 공기가있는 경우에도 정상 조직보다 더 높은 비율로 젖산을 분비한다는 사실을 관찰했습니다 (호기성 조건) [14] .
정상 세포는 ATP를 생성하기 위해 미토콘드리아 OXPHOS에 의존합니다.
호기성 조건에서 정상 세포와 조직은 포도당을 이산화탄소 (CO 2 )와 물 (H 2O) OXPHOS를 통해 저산소 상태 (저산소 상태)에서 포도당을 젖산 (당분 해)으로 전환합니다.
그러나 종양 조직은 호기성 조건에서도 포도당을 젖산으로 대사합니다.
대부분의 암세포 는 산소가 풍부하더라도 해당 과정에 의존 하여 OXPHOS 메커니즘의 사용을 줄이면서 상당히 적은 양의 ATP를 생성합니다 ..
이러한 대사 변화는 암세포의 생화학 적 특징으로 처음으로 인식 된 것 중 하나입니다.
일반적으로 암세포는 당 분해성이 높고 (포도당 중독) 외부에서 정상적인 세포보다 포도당을 더 많이 흡수한다는 점에서“sweet tooth”“달콤한 치아”를 가지고 있습니다.
포도당의 증가 된 흡수는 막 포도당 수송 체 (GLUT)의 여러 이소 형의 과발현에 의해 촉진됩니다.
Warburg 효과는 수십 년 전에 발견되었지만 해당 경로를 항암제 개발을위한 잠재적 표적으로 사용하는 것은 과학계에서 인정하지 않았습니다.
그러나 Warburg 효과는 암 진단 및 암 치료에서 약물 반응을 평가하는 데 사용되었습니다.
종양 및 전이에서 포도당의 더 높은 흡수에 대한 실험적 확인은 양전자 방출 단층 촬영 에서 비롯되었습니다.(PET)

그림 6 . 정상 세포와 암 세포 및 조직의 대사 차이.
그러나 암세포에서 해당 과정이 증가하는 이유 (Warburg 효과)는 완전히 명확하지 않습니다.
Warburg는 미토콘드리아 기능의 결함이 암세포가 생존을 위해 해당 과정에 의존하는 이유 일 수 있다고 가설을 세웠습니다 [14] , [18] .
그러나, 후속 연구는 암세포에서 미토콘드리아 대사 에 대한 강력한 역할을 분명히 함축하고 있습니다.
최근 연구에 따르면 Warburg 효과의 주요 이점은 해당 과정 ATP의 생성이 아니라 NADPH, 리보스-6-인산, 아미노산, 지질 및 기타 세포 에너지원(탄수화물, 단백질 및 지방의 새로운 합성)을 생성하는 오탄당 인산 경로와 같은 동화 과정의 전구체인 많은 해당 중간체 생성하는 데 있습니다.
해당 과정과 호흡은 모두 에너지를 생산하는 과정이기 때문에 선택적으로 표적화 된 약물을 사용하여 하나 또는 두 경로를 모두 억제하는 것은 잠재적으로 항암 메커니즘으로 작용할 수 있습니다.
Warburg와 유사한 메커니즘이 빠르게 증식하는 다른 세포와 조직 ( 예 : T- 림프구, 배아 조직) 에서도 작동한다고 제안되었습니다 [23] , [24] .
5 . 해당 경로
위의 논의에서 암세포는 생존과 성장을 위해 높은 수준의 해당 활성을 유지해야 함이 분명합니다.
따라서 해당 대사 산물 (및 ATP 생성)을 억제하면 암세포에 치명적인 영향을 미칠 수 있습니다.
세포질에서 발생하는 해당 경로는 항암제 개발을위한 고유 한 잠재적 치료 표적 배열을 제공합니다.
해당 경로에 관련된 단계에 대한 자세한 이해는 새로운 대사 항암 전략을 개발하는 데 도움이 될 수 있습니다 [25] .
해당 경로는 ATP와 니코틴 아미드 아데닌 디 뉴클레오타이드 (NAD + )에 의해 촉매되는 일련의 산화 반응 (정확히 10) 에서 피루 베이트에 대한 포도당 의 이화 작용 을 포함합니다 ( 그림 7 ) [3] .
첫 번째 단계는 비 이온성 포도당을 음이온 인 포도당 -6- 인산 (G-6P)으로 전환하는 것입니다.
이 반응은 헥소 키나제 (HK) 의 동형에 의해 촉매됩니다 .
G-6P는 phosphoglucose isomerase에 의해 fructose-6-phosphate 로 전환됩니다 .
ATP를 사용하여 fructose-6-phosphate 이 fructose-1,6-bisphosphate으로 전환됩니다 .
효소알 돌라 아제 는 fructose-1,6-bisphosphate를 글리 세르 알데히드 -3- 포스페이트 (GAPDH) 및 dihydroxyacetone phosphate 로 전환시키는 것을 촉매합니다 .
NAD + 와 결합 된 GAPDH 효소 는 GAPDH를 1,3-bisphosphoglycerate로 전환합니다.
이 시점까지이 해당 경로는 에너지 원으로 최대 2 개의 ATP를 사용하는 "투자"단계를 나타냅니다.
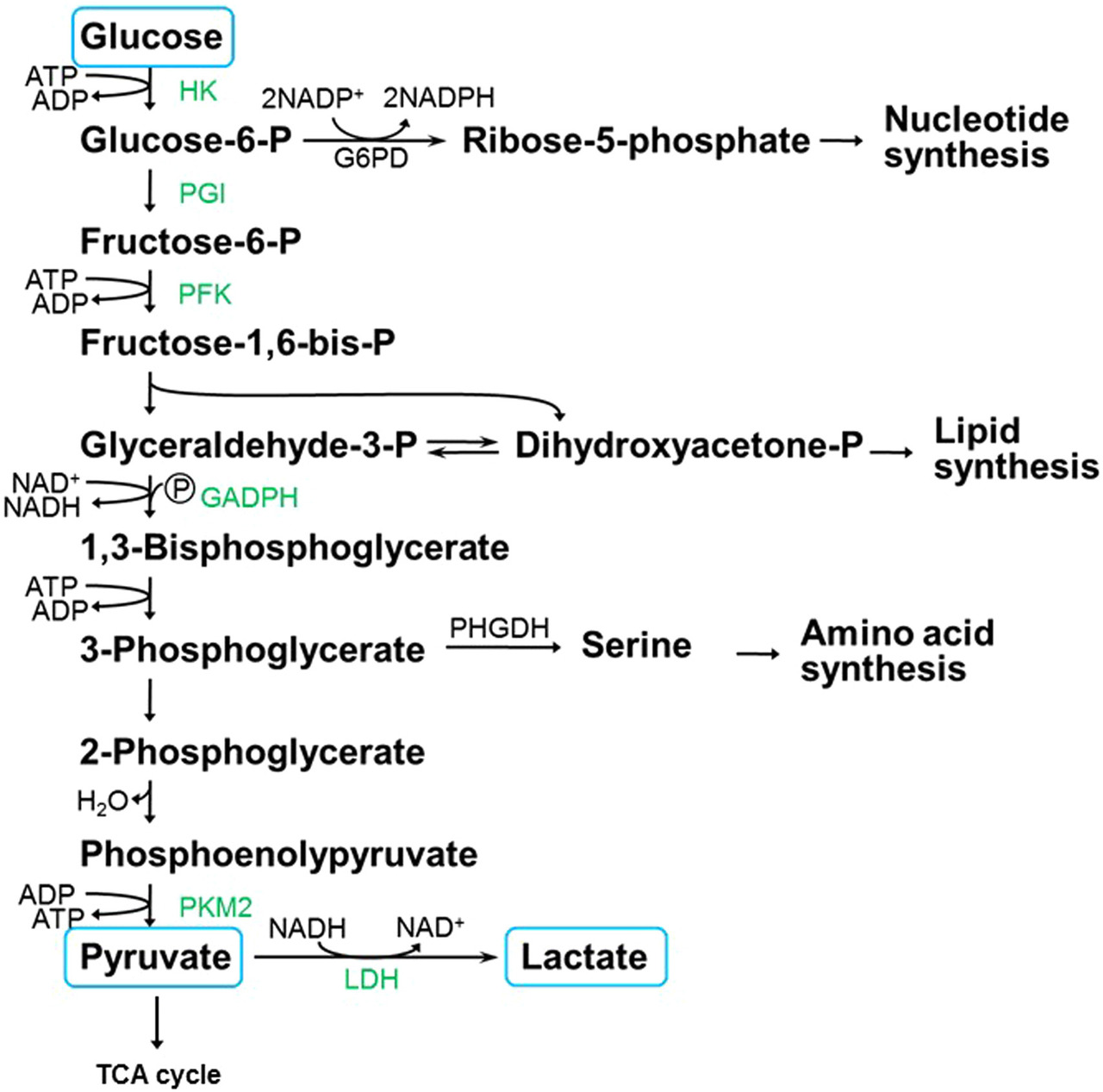
그림 7 . 이화 작용 및 동화 작용 중간체 및 포도당에서 파생 된 생성물을 보여주는 해당 경로.
다른 뉴클레오티드 , 지방산 및 아미노산은 해당 경로에서 합성됩니다 ( 그림 7 ).
예를 들어, G-6P는 뉴클레오티드 및 DNA 생합성 및 NADPH를 위한 전구체 분자인 리보스-5-인산을 생성하는 효소 G-6P 탈수소효소에 의해 촉매되는 오탄당 인산 경로로 전환될 수 있습니다
Glyceraldehyde-3-phosphate 또는 dihydroxyacetone phosphate는 세포막 성분, 인지질 및 트리글리세롤의 생합성 을 위한 전구체입니다 .
세린에서 유래된 아미노산(예: 세린), 시스테인 및 글리신은 3- 포스 포 글리세 레이트 탈수소 효소 (PHGDH)-촉매 된 3- 포스 포 글리세 레이트의 세린으로의 전환으로부터 생성된다.
앞서 논의한 바와 같이 암세포는 호기성 해당 과정으로 전환됩니다 .
그러나 OXPHOS에 비해 해당 과정에서 거의 18 배 낮은 ATP 생성 효율이 낮기 때문에 이러한 유형의 리 프로그래밍에 대한 이유는 처음에 불분명했습니다.
암세포에서이 스위치의 기능적 역할은 포도당 대사 또는 해당 과정이 세포 조립 및 성장에 필요한 뉴클레오티드와 아미노산의 생합성을 촉진 한다는 새로운 관점에서 더욱 명확 해졌습니다 (그림 7)[26].
해당 경로의 "수익" 단계에서 1,3-비스포스포글리세르산이 3-포스포글리세르산으로 전환되는 포스포글리세레이트 키나제 촉매 산화 동안 2개의 ATP(총)가 형성됩니다..
Enolase 는 2-phosphoglycerate를 phosphoenolpyruvate로 전환하는 역할을합니다.
이러한 해당 반응에는 분자 산소가 필요하지 않습니다.
피루 베이트 키나아제 (PK)는 포스포 에놀피루베이트로부터 피루 베이트의 형성을 촉매합니다.
피루 베이트는 해당 경로의 중요한 대사 산물이며 암세포에서 젖산 탈수소 효소 (LDH)에 의해 촉매되는 젖산 형성을 담당합니다 .
대안으로, 피루 베이트는 아래에 논의 된 바와 같이 크렙스주기에 들어가 미토콘드리아 대사를 자극 할 수 있습니다.
6 . 트리 카르복실산 회로(TCA)
해당 경로에서 생성 된 피루 베이트는 피루 베이트 탈수소 효소 (PDH) 효소에 의해 아세틸 -CoA 로 산화되며 , 이는 옥살로 아세테이트 분자와 결합하여 시트르산 또는 시트 레이트 를 형성합니다 [3] .
이것이 TCA 사이클의 시작입니다 ( 그림 8 ).
TCA주기 중간체는 고분자 (DNA, 단백질 및 지질)의 필수 구성 요소 인 지방산, 뉴클레오티드 , 헴 및 포르피린의 전구체 입니다.
구연산에서 형성되는 TCA 회로의 중요한 조절자는 이소시트르산에서 형성된 알파-케토글루타레이트, 숙시닐-CoA, 푸마레이트 및 말로네이트에서 형성된 석시네이트, 그리고 궁극적으로 TCA 회로를 유지하기 위해 아세틸-CoA와 결합하는 옥살로아세테이트입니다.
호기성 호흡 동안 아세틸-CoA의 CO2로의 산화는 TCA 주기 동안 NAD+ 및 플라빈 아데닌 디뉴클레오티드(FAD)의 환원을 동반합니다
중간 생성물인 NADH와 FADH2는 OXPHOS의 전자 수송 사슬(ETC) 조효소 역할을 합니다.
전자는 이후 미토콘드리아 내막에 위치한 미토콘드리아 복합체를 통해 NADH와 FADH2에서 산소로 전달되어 궁극적으로 ATP 형성을 촉매합니다
. (그림 9 ).

도 8 . 포도당과 글루타민에서 파생된 피루브산에 의해 연료가 공급되는 Krebs 주기 또는 TCA 주기

도 9 . 산화 적 인산화에 관여하는 미토콘드리아 전자 수송 사슬 복합체
7 . Glutaminolysis-글루 타민 분해
암세포는 또한 글루타민을 흡수하고 대사합니다. TCA의 기능을 중단없이 유지하기 위해 대사 산물을이주기에 공급할 수 있습니다.
예를 들어, 글루타민 분해는 글루타민을 글루타메이트으로 전환하는 글루타민 촉매 작용을 포함하며, 이는 TCA 회로에 들어가는 알파-케토 글루타레이트를 형성합니다 ( 그림 9 ).
글루타민은 또한 아마도 저산소증 유발 인자 1 (HIF-1) 활성화 를 통해 저산소 세포에서 지방산 합성 을 위한 기질입니다 .
글루타민은 순환하는 가장 풍부한 비필수 아미노산이며 글루타민에서 생성된 글루타메이트는 다른 비필수 아미노산(예: 아스파르테이트, 알라닌, 아르기닌, 프롤린)의 전구체이기도 합니다.
글루타민은 글리코실화된 분자와 뉴클레오타이드의 생합성을 위한 질소의 공급원이며, 저산소 세포 또는 HIF-1-알파 활성화 세포에서 지방산 합성을 위한 기질 역할을 합니다.
특정 암 환자에서 혈중 글루타민 수치가 향상됩니다 [28] .
정상적인 미토콘드리아에서 TCA주기는 시계 방향으로 계속되고 추가 옥 살로 아세테이트를 형성하여주기를 주도합니다.
그러나 기능 장애가있는 미토콘드리아 ( Krebs주기의 단백질 돌연변이로 인해 아세틸 -CoA 로의 피루 베이트 산화 가 방지 됨)에서는 글루타민으로부터 형성된 알파-케토글루타레이트는 이소시트레이트 탈수소효소-2(IDH-2) 의존 반응에서 증가된 환원성 카복실화를 통해 시트레이트로 전환됩니다.
글루타민의 구연산염으로의 환원성 카르 복 실화는 또한 지질 합성을 위한 대체 경로입니다.
글루타민은 세포 항산화 기계의 중요한 구성 요소 인 글루타티온의 합성을 담당합니다 .
바이러스 종양 유전자 인 V-Ki-ras2 Kirsten 쥐 육종 (KRAS) 은 TCA주기 를 통해 알파-케 토글 루타 레이트의 강화 된 형성을 통해 암세포 성장을 자극 합니다.
효소 인 글루타메이트 피루 베이트 트랜스아미나아제 의 활성 증가 가 암에서 관찰되었습니다.
따라서 글루타민 / 글루타메이트 대사는 매력적인 치료 표적을 제공합니다.
8 . 산화 적 인산화 / 전자 수송 사슬
OXPHOS는 내부 미토콘드리아 막을 가로 질러 확립 된 양성자 구배를 사용하여 ATP 합성 효소 (또는 복합체 V)에 의해 ADP와 인산염으로부터 ATP를 생성하는 것을 말합니다 .
ETC 또는 호흡 사슬 은 내부 미토콘드리아 막에 존재 하는 복합 I 또는 NADH 탈수소 효소 , 복합 II, 복합 III 및 복합 IV로 구성됩니다.
TCA 사이클에 의해 생성되는 환원 당량 인 NADH 및 FADH 2 는 각각 NAD + 및 FAD 로 산화됩니다 .
이것은 미토콘드리아 매트릭스 에서 내부 막 으로 양성자 또는 수소 이온 을 펌핑 하는 데 사용되는 에너지를 생성합니다.
복합물 I, III, IV, 그리고 궁극적으로 말단 전자 수용체 (산소)에 의해 두 분자의 물을 생성합니다 ( 그림 9 ).
복합체 II, 코엔자임 Q 또는 사이토 크롬 c 에서는 양성자 펌핑이 발생하지 않습니다 .
양성자 구배는 복잡한 V에 의한 ATP 생성을 촉진하는 큰 전기 구성 요소 (막 전위)를 생성합니다.
대부분의 ATP는 NADH와 FADH2의 산화(미토콘드리아 내부 막을 가로질러 미토콘드리아 복합체에 의해 형성되는 proton gradients 양성자 구배)와 산소가 물로 환원되는 이 과정에서 생성됩니다.
9 . 세린 생합성 경로
세린의 합성은 3- 포스포 글리세레이트 유래 3- 포스포 히드록시 피루베이트와 글루타메이트의 커플링을 통한 해당 과정 및 글루타민 분해 중간체 를 모두 포함합니다 .
해당 과정과 글루타민 분해 경로는 모두 여러 암에서 활성화됩니다.
따라서 세린 생합성 경로는 유방암에 필수적이며 유방암 환자의 5 년 생존율이 낮습니다 [32] .
최근에는 효소 PHGDH에 대한 관심이 집중되고있다.
세린 생합성 경로는 암에서 해당 과정 / 글루 타미노 분해 경로의 중요한 조절 자입니다.
10 . 글루타민으로부터 아스파르트 산 생합성에서 호흡의 역할
미토콘드리아 호흡 은 비 증식 세포에서 ATP를 생성하는 이화 작용의 발전소 역할을합니다.
그러나 최근보고에 따르면 호흡은 증식하는 암세포에서 아스파르테이트 생합성 을 자극한다는 점에서 단백 동화 역할을합니다 [33],[34] .
아스파테이트는 세포 단백질의 기본 구성 요소 중 하나 인 아미노산입니다.
아스파 테이트는 증식하는 세포 에서 뉴클레오티드 (DNA 및 RNA) 및 단백질 생합성 을 위한 충분한 공급에 필요합니다 .
순환하는 혈액은 cellular machinery세포 기계를 만드는 데 필요한 아스 파르 테이트를 제공 할 수 없습니다
11 . 반전 Warburg 효과
암세포 나 섬유 아세포에서 분비되는 해당 과정 산물 인 젖산은 인접한 암세포에서도 구연산 을 만들고 암의 진행을 유지 하는 데 사용됩니다 .
"역 Warburg 효과"는 "parasitic기생충"암 대사에 대한 새로운 용어입니다 ( 그림 10 ) .
암세포는 이화 과정을 유도하여 숙주 세포에서 영양분을 얻는다는 점에서 대사 기생충으로 작용한다고 제안되었습니다.
그러한 과정 중 하나 는 숙주 세포에서 호기성 해당 과정 입니다.
이 현상은 말라리아 및 샤가스 병과 같은 기생충 질병에서 일어나는 것과 유사하며, 여기서 세포내 기생충은 산화 스트레스의 유도 후 숙주 세포에서 연료 공급을 추출합니다.

도 10 . 암 대사에서 역 Warburg 효과 .
종양-숙주 상호 작용 또는 대사 결합은 암 진행에서 잘 받아 들여지는 현상입니다 [39] .
1889 년에 처음 제안 된“씨앗과 토양”가설은 암세포가 종자 역할을한다고 말한다.
그들은 성장을위한“비옥 한 토양”을 제공하는 숙주 장기 미세 환경에서 가장 잘 자랍니다 [39] .
그러나 종양이 자리를 잡으면 이웃은 엉망이됩니다.
섬유 아세포, 지방 세포, 내피 세포 및 대식세포로 구성된 종양 기질 또는 종양 미세 환경은 종양 성장을위한 연료의 원천이됩니다.
종양은 미세 환경에서 에너지가 풍부한 대사 산물을 "훔칩니다".
종양 세포는 지속적으로 미세 환경과 상호 작용합니다. [40].
해당 과정 외에도 암세포는 지방 세포 조직의 지방산을 에너지로 사용합니다.
산화 적 미토콘드리아 대사 와 상피암 세포에서 ATP 생산 을 촉진하는 다른 기질 유래 대사 산물 은 글루타민과 케톤입니다.
모노 카복실 레이트 수송 체 (MCT)는 암 관련 간질 세포 와 암 세포 사이에서 L- 락 테이트를 이동 시킵니다.
섬유 아세포에 존재하는 MCT4는 간질 세포에서 L- 락 테이트를 내보내는 역할을하며,
상피암 세포에 국한된 MCT1은 L- 락 테이트 흡수를 담당합니다.
12 . 종양 저산소증과 Warburg 효과 : 젖산 셔틀
종양은 호기성 및 저산소 영역을 포함하는 이질적특성을 가집니다.
종양 조직에 산소 구배가 존재한다는 것은 잘 받아 들여진 사실입니다.
도 11에 나타난 바와 같이 혈관을 둘러싼 종양 세포는 산소가 잘 공급되는 반면, 혈관에서 멀리 떨어진 종양 세포는 산소가 부족합니다.
최근 암세포의 저산소 및 호기성 영역 사이에 "대사 공생"의 존재를 증명 하였다.
저산소 세포의 해당 과정 에서 생성 된 젖산염이 분비됩니다.
MCT1을 통해 호기성 암세포에 흡수되고 LDH-B에 의해 피루 베이트로 전환됩니다.
기질 피루 베이트는 ATP를 생성하는 호기성 종양 세포에서 OXPHOS를 겪습니다.
이 메커니즘에 의해 저산소 암 세포 대사 및 생존을 위해 더 많은 포도당이 남습니다.
그러나 MCT1이 억제되면 호기성 암 세포는 더 이상 젖산을 흡수 할 수없고, 저산소 성 암 세포와 포도당을 놓고 경쟁하며, 저산소 성 암 세포에서 적절한 포도당 사용을 박탈 할 수 없습니다.
따라서 MCT1 억제제는 잠재적으로 표적 화학 요법 제 역할을 할 수 있습니다.
암세포에서 해당 작용 및 / 또는 미토콘드리아 대사 를 표적으로하는 약물 또는 인접 기질 세포 에서 이화 작용 을 표적으로하는 약물 은 종양 진행 및 전이를 억제하는 데 효과적입니다.

도 11 . 종양 세포와 정상 세포 사이의 젖산 셔틀 .
13 . 지방산 산화 / 종양 대사에 대한 지방의 역할
빠르게 성장하는 암세포의 에너지 수요를 따라 잡기 위해 포도당 소비가 비례 적으로 증가하지 않으면 세포는 지방산 산화 (FAO)에 의존합니다 .
전립선 암 세포에서 가장 많이 사용되는 생체 에너지 경로 중 하나는 팔미 테이트와 FAO의 흡수를 향상시키는 것입니다.
carnitine palmitoyltransferase 효소를 억제하는 약물 etornoxir를 사용한 FAO 억제는 유방암 이종 이식 마우스 모델에서 종양 성장을 차단했습니다.
정상 세포는 일반적으로식이 공급원을 통해 지방산을 얻습니다.
대조적으로, 종양 세포는 드 노보 지방산 합성 에서 현저한 증가를 보인다 .
더 중요한 것은 일부 종양 세포 (난소 종양 조직)가 모노 아실 글리세롤 리파제 (MAGL) 활성을 증가 시킨다는 것입니다. [44] .
MAGL은 진행성 난소 암 환자에서 상승했습니다.
이 효소는 모노 글리세롤을 가수 분해 하고 글리세롤과 유리 지방산 (FFAs)을 방출합니다 ( 그림 12 ).
공격성 암은이 메커니즘을 사용하여 FFA를 획득합니다.
MAGL은 FFA 수준을 증가시켜 종양 형성을 촉진하는 것으로 나타났습니다.
도시 된 바와 같이 도. 12 , MAGL 유도는 특정 FFA 유래 지질 시그널링 과 같은 포스 폰산 , 리소 포스 파티 산 및 프로스타글란딘 E (2) . 이 지질 분자는 종양 신호 메커니즘을 활성화합니다.
새로운 지방 생성 은 아세틸 -CoA의 전환을 포함합니다
지방산 합성 효소에 의해 촉매되는 팔미 테이트에 . 새로 합성 된 FFA는 아마도 중성 지질 저장소로 변환되어 MAGL에 의해 방출됩니다.
주된 메커니즘으로 작용 하는 해당 과정 외에도 지방산 의 산화 는 종양 세포의 생체 에너지 요구를 충족하기위한 대체 경로를 제공합니다.
연구에 따르면 MAGL은 유망한 표적 치료 암 치료제입니다

그림 12 . 지방산 및 암 발병을 제어하는 요인의 방출.
14 . 잠재적 인 항 종양 전략으로 해당 작용 억제
포도당은 암세포에서 가장 풍부한 에너지 원 중 하나입니다.
산소가있는 상태에서 포도당 한 분자가 분해되는 동안 ATP 형태의 에너지 외에도 6 분자의 이산화탄소와 물이 방출됩니다.
거의 34 ~ 38 개의 ATP 분자가 해당 과정 (4 개의 ATP), 크렙스주기 (2 개의 ATP) 및 미토콘드리아 호흡 (34 개의 ATP) 중에 생성됩니다 .
따라서 해당 과정과 미토콘드리아 대사를 표적으로하는 것은 암세포의 성장을 늦추거나 억제하기위한 전략적 접근법입니다 [6] , [46] , [47] .
15 . 포도당 섭취 억제
포도당의 세포로의 수송은 GLUT라고 불리는 막 결합 단백질 군에 의해 촉진됩니다.
여러 암에서 상향조절되는 여러 형태의 GLUT 단백질(GLUT 1, GLUT 3 등)이 있으며, 대부분 GLUT의 증가된 발현은 암 환자의 불량한 예후 및 생존과 관련이 있습니다..
암세포로의 포도당 흡수는 해당과정의 속도 제한 단계이므로, 작은 분자로 포도당 수송 채널을 차단하여 GLUT를 표적화하는 것은 종양에서 영양 결핍의 실행 가능한 메커니즘입니다.
이들 화합물 중 일부는 정상 세포에 상대적으로 덜 독성이있어 종양 치료에 대한 가능성을 보여줍니다
16. Targeting hexokinase
16.1 . 2- DG
첫 번째 항 당분 해 항 종양 전략 중 하나는 2-deoxyglucose (2-DG)를 사용하는 것입니다 ( 그림 13 ) [48] .
HK-2는 Warburg 메커니즘에서 중추적 인 역할을합니다 [49] .
HK-2는 정상 세포에서 낮은 발현 수준을 갖지만 많은 암세포와 근육 및 지방 세포와 같은 인슐린 민감성 세포에서 많이 발현되어 포도당에 대한 요구 증가와 일치합니다.
도 13에 도시 된 바와 같이 , 포도당 대사 의 첫 번째 단계 는 HK- 촉매, ATP 의존적 포도당의 G-6P 로의 인산화이다.
G-6P는 효소 반응에 필요한 뉴클레오티드 , 아미노산 및 지방산의 다른 구성 요소뿐만 아니라 ATP 생성에 중요한 대사 산물 입니다.
고도로 증식하는 암세포의 거대 분자 . HK에는 4 개의 isoform이 있습니다.
세 가지 이소 폼 HK1-3은 HK-4보다 포도당에 대해 250 배 더 높은 친 화성을 가지고 있습니다.
HK-2는 외부 미토콘드리아 막에 위치한 전압 의존성 음이온 채널 (VDAC)에 결합되어 있습니다 .
종양 세포는 VDAC의 발현 수준이 더 높습니다.

도 13 . 해당 경로의 억제제.
2-DG의 부작용 중 하나는 포도당을 에너지로 사용하는 정상 세포, 골격근 및 신경 세포에 대한 독성입니다.
2-DG는 포도당 사용을 부분적으로 만 차단합니다.; 결과적으로 해당 과정은 부분적으로 만 억제됩니다.
암 치료에서 단일 치료제로 사용되는 2-DG는 성공적이지 못했지만 복합 암 치료에서 가능성을 보여줍니다 [50] , [51] .
16.2 . 3- 브로 모피 루 베이트
이 약을 단독으로 사용하거나 다른 기존 화학 요법 제와 병용하기 전에 정상 조직의 부작용 및 독성 메커니즘에 대한 추가 연구가 필요합니다.
16.3 . 로니 다민
17 . 피루 베이트 산화 표적
피루 베이트는 세포 대사에서 "허브"대사 산물 ( 해당 분해 와 미토콘드리아 대사 의 경계에 있음)로 간주되며 특히 암세포에서 대사 재 프로그래밍을 조절하는 데 중심적인 역할을합니다 [56] .
PK는 호기성 해당 과정 의 마지막 단계에서 포스포 에놀 피루베이트가 피루베이트로 변환되는 것을 촉매합니다 .
암세포에서 해당과정 동안 피루브산의 합성은 PK(PKM2)의 스플라이스 변이체에 의해 촉매되어 형성을 감소시킵니다. 여러 형태의 PK(PKM1, PKM2 등)가 종양 형성에서 과발현됩니다.
PDH는 세포질 피루브산을 Krebs 주기의 첫 번째 기질인 미토콘드리아 아세틸-CoA로 전환하는 효소의 복합체를 나타냅니다.
PDH는 PDK(pyruvate dehydrogenase kinase)에 의해 부정적으로 조절되어 복합체를 형성하며 이 메커니즘은 포도당을 산화 대사에서 해당 대사로 전환합니다.
전임상 종양 이종 이식 연구와 교 모세포종 (공격적인 형태의 뇌종양)이있는 인간에서 유망한 화학 요법 효과를 보여준 약물 인 디클로로 아세테이트 (DCA)는 아마도 PDK를 억제하여포도당 대사를 해당 과정에서 산화 경로로이동시킵니다[59].
따라서 DCA는 PDK를 억제하여 PDH를 활성화하여 미토콘드리아 대사를 증가시킵니다..
저산소 조건에서 HIF-1- 알파는 해당 대사를 조절하는 관련 유전자의 전사를 활성화하여 산화에서 해당 재 프로그래밍으로의 전환을 촉진합니다.--피루브산을 아세틸 CoA로 전환하는 PDH를 비활성화하는 GLUT 및 PDK1 및 피루브산을 젖산으로 산화시키는 젖산 탈수소효소 A(LDHA)
세포 밖으로 피루브산을 내보내는 MCT4는 암세포에서도 상향 조절됩니다.
18 . 젖산 탈수소 효소 A 표적화
LDHA 는 NAD + 재활용 과 결합하여 피루 베이트를 젖산으로 전환시키는 주요 해당 효소 입니다.
LDHA는 c-Myc 및 HIF-1- 알파 의 표적 유전자에 의해 암호화되며 종양 유전자 (Myc , Ras 및 Akt) 의 활성화와 연결됩니다 .
LDHA는 여러 종양 세포에서 과발현됩니다 [61] , [62] .
피루 베이트의 젖산으로의 전진 및 후진 전환을 촉매 할 수 있습니다.
연구에 따르면 LDHA의 억제는 종양 형성을 현저하게 지연시킵니다.
LDHA 억제의 작용 기전은 피루 베이트가 미토콘드리아로 "강제" 되어 아세틸 -CoA로 탈 카복실 화 되어 미토콘드리아 활성이 강화 된다는 점에서 DCA의 작용 기전과 매우 유사합니다 .
19 . 암 대사에서 미토콘드리아의 역할
암세포가 에너지를 위해 호기성 해당 대사를 추구하는 이유는 수수께끼로 남아 있습니다.
Warburg는 암세포 미토콘드리아가 기능 장애를 일으켜 세포가 에너지를 위해 해당 과정 에 전적으로 의존하도록 강요한다고 가정했습니다 .
초기에 Chance와 동료들은 암세포가 미토콘드리아 호흡 을 수행하기 때문에 기능적인 미토콘드리아를 가지고 있으며 , 암세포가 높은 당분 해 활성을 나타내는 이유가 호흡 결핍이 아니라는 것을 분명히 보여주었습니다 ..
다른 설명은 해당 과정을 통한 ATP 생성 속도가 미토콘드리아 호흡을 통해 얻은 속도보다 높다는 것입니다.
암세포에는 높은 수준의 포도당이 소비되는 여러 경로가 있기 때문에 해당 경로는 증가 된 에너지 요구 (ATP, 뉴클레오타이드 및 단백질 생합성)를 충족하기에 충분할 수 있습니다.
종양 세포에서 미토콘드리아의 기능적 역할은 미토콘드리아 표적 화합물로 처리 된 암세포가 호흡 억제, 세포 증식 감소 및 ATP 형성을 보였을 때 더욱 분명해졌습니다 .
미토콘드리아 과분극은 많은 종양 세포주의 일반적인 특징입니다 [64] .
20 . 미토콘드리아 대사 표적화 : 비 국소화 된 친 유성 양이온의 선택적 축적
암세포에서 미토콘드리아 표적 약물이 상대적으로 더 많이 축적되고 증식이 감소하고 세포 독성이 증가하면 종양 세포가 항 당분 해제에 과민 반응하여 종양 세포에서 상승적으로 독성이 강화됩니다.
James Black은“신약을 개발하는 가장 좋은 방법은 오래된 약으로 시작하는 것입니다” [70] 라고 유명하게 말했습니다 .
종양 세포는 양전하를 띠는 화합물 또는 약물에 대한 유출 펌프 역할을하는 다중 약물 내성, 혈장 막 결합 p- 당 단백질 수준이 증가했습니다 [71] , [72] .
이것은 임상 적으로 중요한 p- 당 단백질 매개 다 약제 내성 (MDR)입니다.
모든 양이온 성 화합물이 MDR을 인식 할 수있는 것은 아니며 고도의 친 유성 유사체를 사용하면 양전하가 MDR에 의한 인식 및 후속 유출 메커니즘에 덜 중요해집니다 [73] .
연구에 따르면 MDR을 발현하지 않고 더 큰 미토콘드리아 막 잠재력을 가진 암세포 표현형은 비 국소화 된 친 유성 양이온과 미토콘드리아를 표적으로 한 양이온 성 물질에 더 민감 할 가능성 이 더 높습니다 ., [75] .
21 . 결론 및 향후 전망
암세포의 해당 작용 이 상당히 증가 했음에도 불구하고, 임상 시험에서 2-DG를 단일 치료제로 사용한 항 당분 해 표적화는 성공적이지 못했습니다.
이것은 암세포의 대사 가소성과 대사 재 프로그래밍을 통해 다른 대사 경로에 대한 포도당 의존성을 벗어나려는 경향을 반영합니다 .
최근 연구는 미토콘드리아 대사 가 종양 성장에 필수적 이라는 것을 암시합니다 [76] .
미토콘드리아 대사를 표적으로하는 것은 암 생물학의 새로운 연구 분야입니다.
암세포 미토콘드리아 막 잠재력 은 정상 세포 미토콘드리아보다 훨씬 더 음성입니다.
결과적으로 양이온 성 약물은 암세포에보다 선택적으로 표적화 될 수 있습니다.
화학 요법에서 미토콘드리아 표적 약물의 특정 측면은 단독으로, 그리고 크렙스주기의 항 당분 해제 및 억제제와 조합 하여 향후 기사에서 논의 될 것입니다.
'대사' 카테고리의 다른 글
| 암 치료를 위해 암 대사를 표적으로하는 새로운 역할 (0) | 2021.07.02 |
|---|---|
| 암 대사 : 현재의 관점과 미래 방향 (0) | 2021.07.02 |
| 대사 재 프로그래밍 : Warburg조차 예상하지 못한 암 특징 (0) | 2021.07.01 |
| 암 대사의 기초 (0) | 2021.07.01 |
| 암에서 변경된 에너지 대사 (0) | 2021.07.01 |