2019
The conundrum of dietary antioxidants in cancer chemotherapy
https://academic.oup.com/nutritionreviews/article/78/1/65/5549273?login=true
conundrum of dietary antioxidants in cancer chemotherapy
Abstract. Although chemotherapy succeeds in reducing tumor burden, the efficacy is limited due to acquired drug resistance and often irreparable side effects. S
academic.oup.com
일부 암은 화학 요법에 내성이 있으며 일부 종양의 경우 완전한 퇴행에도 불구하고 일정 기간 후에 재발이 발생하고 종양이 약물 내성이 되는 것으로 관찰되었습니다.
또한, 특히 종양 면역계의 약화를 통해 뇌, 심장, 신장 및 기타 기관에 대한 화학요법제의 세포독성 효과는 돌이킬 수 없습니다. 화학 요법 약물의 부작용을 보상하기 위해 일부에서는 항산화제 투여를 제안합니다.
부작용을 줄이기 위해 항산화제를 투여한 임상 연구에서 논란의 여지가 있는 효과가 보고되었습니다.
약물 내성은 방대한 연구 분야이지만 대부분의 암에서 약물 내성의 원인은 다제내성 수송체의 증가, 암세포의 이질성 및 암세포에서 새로 획득된 돌연변이인 것으로 제안되었습니다.
최근 암 줄기세포 가설과 암 휴면으로 인해 약물 내성이 재조명되고 있다.
휴면 종양 세포는 증식이 부족하기 때문에 화학 요법에 내성이 있습니다.
암세포가 화학 요법 후 즉시 성장을 재개하는지, 죽거나, 휴면 상태에 들어가는지를 결정하는 세포 및 분자 메커니즘은 잘 이해되지 않습니다.
여러 연구에서 산화 스트레스 신호 및 소포체(ER) 스트레스 신호가 암세포에서 성장 정지 및 약물 내성 유도를 조정하는 방법을 보여주었습니다( 그림 1 ).

화학요법제에 의해 생성된 산화 스트레스는 암과 정상 조직에서 다른 생체 기능을 가질 것입니다.
암세포 내 과도한 ROS는 휴면을 유도하는 반면, 정상 세포에서는 세포자멸사를 유도합니다.
이러한 휴면 암 세포는 종종 약물 내성으로 인해 치료할 수 없습니다.
항산화제의 투여는 휴면 경로를 차단하고 증식을 유도하여 화학 약물이 암세포에 다시 접근할 수 있도록 합니다.
화학요법제에 의해 생성된 산화 스트레스는 암세포와 정상 조직에서 생체 기능의 다른 메커니즘을 가질 것입니다.
항산화제 투여는 어떤 조건에서는 매우 효율적일 수 있지만, 다른 조건에서는 세포에 악영향을 미치고 악화시킬 수 있습니다.
암 예방의 활성 산소 종/항산화 상태
대부분의 경우 문헌은 ROS가 암을 유발하고 항산화제가 이 과정을 차단한다는 데 동의합니다.
자유 라디칼은 염증 반응 및 호기성 대사를 포함한 규칙적인 기본 생리학적 과정에 의해 생성됩니다.
그러나 부피가 증가하고 항산화 방어 메커니즘이 압도되면 세포 손상을 일으킬 수 있습니다.
ROS는 DNA를 손상시켜 돌연변이 유발과 발암을 유발할 수 있습니다.
과학자들은 임상 시험에서 볼 수 있듯이 항산화제가 암 발병을 예방할 수 있다는 데 동의 하지만 ,항산화제가 진행 및 침습적 기능을 차단할 수 있는 특성도 가지고 있다는 데에는 합의가 없습니다.
과도한 반응성 산소 종 및 암 세포의 적응
일부 연구에 따르면 암세포의 ROS 생산은 정상 세포보다 더 풍부합니다. 암세포에서 종양유전자 활성화, 종양 억제 활성(p53 단백질)의 손실, 신진대사 향상, 저산소증 및 ER 스트레스는 ROS의 축적으로 이어질 수 있으며, 이는 과활성 세포 신호 및 전-종양유발성 신호 이벤트를 허용합니다.
ROS는 혈관 신생, 전이 및 종양 세포 생존을 촉진할 수 있습니다.
따라서 암세포는 세포 사멸을 유도하지 않고 전-종양유발성 세포 신호를 허용할 만큼 충분히 높은 ROS 수준을 유지해야 합니다.
산화 스트레스를 중화하고 산화 손상과 세포 사멸을 방지하기 위해 암세포는 ROS 소거 시스템을 상향 조절하여 ROS 수준을 세포독성 수준 이하로 유지합니다. 그렇지 않으면 휴면 상태에 들어갑니다.
암 세포에 의해 내인적으로 생성되거나 화학 요법에 의해 외인적으로 생성된 ROS는 세포 증식을 정지시키고 세포 주기를 G0 상태로 유지할 수 있습니다.
이러한 방식으로 높은 수준의 ROS는 화학요법제가 증식하는 상태의 세포만 근절할 수 있기 때문에 화학요법제를 방해합니다.
항산화제는 잠재적으로 암세포에서 종양 기능, 혈관 신생 및 전이에 필수적인 높은 수준의 ROS를 억제할 수 있습니다.
반응성 산소 종 - 유도 화학 요법제
세포에서 발생하는 다제내성 및 약물의 부작용이 화학요법 실패의 주요 원인이 된다.
이러한 약물은 또한 단계 특이적 독성에 따라 세포 주기 특이적 또는 세포 주기 비특이적으로 분류됩니다.
첫 번째 범주의 약물은 주로 활발하게 분열하는 세포에 영향을 미치는 반면, 알킬화제 및 백금 유도체와 같은 두 번째 범주의 약물은 휴지기 또는 증식기에서 정상 세포와 종양 세포 모두에 동등하게 영향을 미칩니다.
높은 수준의 ROS를 생성하는 일부 제제에는 알킬화제, 안트라사이클린(예: 에피루비신 및 독소루비신), 에피포도필로톡신, 백금 배위 복합체(예: 옥살리플라틴) 및 캄프토테신(예: 토포테칸)이 포함됩니다.
이러한 제제와는 대조적으로, 빈카 알칼로이드(예: 빈크리스틴 및 빈블라스틴), 탁산 및 항대사물질(예: 항엽산)과 같은 일부 다른 약제는 낮은 수준의 ROS만 생성합니다.
이러한 항종양제가 ROS 생성을 넘어 다른 메커니즘을 통해 종양 세포에 영향을 미치지만 낮은 수준의 ROS가 생성됩니다.
세포증식억제제 및 세포독성제의 영향으로 생성된 과도한 ROS는 화학요법 사례에서 부작용의 주요 원인이다.
종양 부위의 자유 라디칼 생성은 암세포를 다루는 화학 요법 약물의 두 번째/대체적 역할을 의미합니다.
--자유 라디칼의 정확한 메커니즘과 ROS 신호 전달 경로는 다른 세포에서 신중하게 결정되어야 합니다.
(자유 라디칼이 화학요법 약물에 대한 암세포의 내성, 정상 세포의 세포자멸사 및 그에 따른 부작용 또는 화학요법 치료의 무효화를 유발하는지 여부)
화학 요법에 의해 생성되는 반응성 산소 종에 의한 약물 내성 유도
약물 내성은 이질적인 암세포에 내재되어 있거나 약물에 노출되었을 때 세포 반응으로 획득될 수 있는 약물 유도 종양 성장 억제에 대한 반응의 부족입니다.
약물 내성의 다른 메커니즘이 인식되었습니다.
세포 표면 수송 또는 수용체의 감소, 감소 된 약물 활성화, 상피 간엽 전이 종양 세포 이질성 , 약물의 특정 대사 증가, 글루타티온과 접합을 통해 약물의 불 활성화, 개선 DNA 수리 및 약물 암 휴면 원인 저항.
다제 내성에 기여하는 주요 분자 사건 중 하나는 산화환원 메커니즘에 의해 제어됩니다.
유기체가 생체이물(약물)에 노출되면 일련의 유전자와 분자 메커니즘이 활성화되어 약물의 부정적인 결과를 약화시키고 독소를 제거합니다.
화학적 방어의 첫 번째 라인으로서, 다제내성 단백질과 같은 유출 단백질은 세포에서 친유성 유기 생체이물을 직접 제거합니다.
1차 방어선에서 벗어나는 약물은 산화 단계 I 효소와 마주칩니다.
1상 반응의 부산물, 즉 생성된 ROS는 카탈라제(CAT), 글루타티온 퍼옥시다제(GPx), SOD, 퍼옥시레독신(PRx)과 같은 1상 항산화 효소 및 세룰로플라스민, 요산, 아스코르브산 및 환원 글루타티온(GSH)과 같은 비효소적 항산화제에 의해 무독성 수준으로 감소됩니다.
이렇게 세포 내 항산화 시스템은 생체이물에 대처합니다.
신호 전달은 과산화수소 및 알데히드와 같은 산화 환원 물질에 의해 유도됩니다.
이러한 물질의 중간 수준에서 단백질 키나아제 캐스케이드는 Nrf2, AP1, ARE 결합 단백질과 같은 전사 인자의 활성화 및 항산화 효소의 최종 발현을 통해 시작됩니다.
이와 같이 항암 화학요법은 다제내성 관련 단백질의 과발현, 산화제 센서 및 전사인자의 발현, 항산화 효소의 활성화를 유도한다.
따라서 종양 세포에서 화학 요법 약물 및 그 부산물(ROS)의 빠른 대사 및 제거가 관찰됩니다.
이 화학적 방어 시스템은 신체의 모든 장기에 중추 기능으로 존재하기 때문에 다제 내성을 약화시키기 위한 억제는 원치 않는 부작용을 초래하여 화학 요법 약물의 치료 효과를 차단할 수 있습니다.
이와 관련하여 산화 환원 활성 화학 예방 물질(직접 및 간접 산화 방지제)을 통한 산화 환원 조절 또는 화학 요법 약물의 세포 독성 영향과의 시너지 효과는 획득 된 다제 내성을 억제하거나 역전시킬 수 있으며 화학 요법으로 인한 세포 독성 효과로부터 정상 세포를 보호할 수 있습니다.
또한 급성 산화 스트레스는 세포 사멸 또는 괴사를 유발하는 반면 지속적인 산화 스트레스는 게놈 불안정성을 유발하여 종양 진행 및 약물 내성과 관련이 있는 것으로 나타났습니다.
이것은 화학 요법 약물에 의해 생성되는 산화 스트레스의 양이 약물 내성 경로에 영향을 미칠 수 있음을 의미합니다.
반응성 산소종에 의한 암 휴면 유도
약물 내성에 기여하는 또 다른 요인은 암 휴면입니다.
휴면 종양 세포는 증식이 부족하기 때문에 화학 요법에 내성이 있는 것으로 생각됩니다.
그러나 이것이 내화학성의 유일한 이유인지는 아직 불분명하다.
그림 2는 최근의 연구 결과, 암 유전자를 통해 스트레스 신호, P38의 SAPK 경로, ER 스트레스 신호 및 저산소증은 종양의 성장 체포 및 약물 내성의 유도와 협력 할 수 방법에 대한 기계적인 설명을 제공합니다.
그림 2
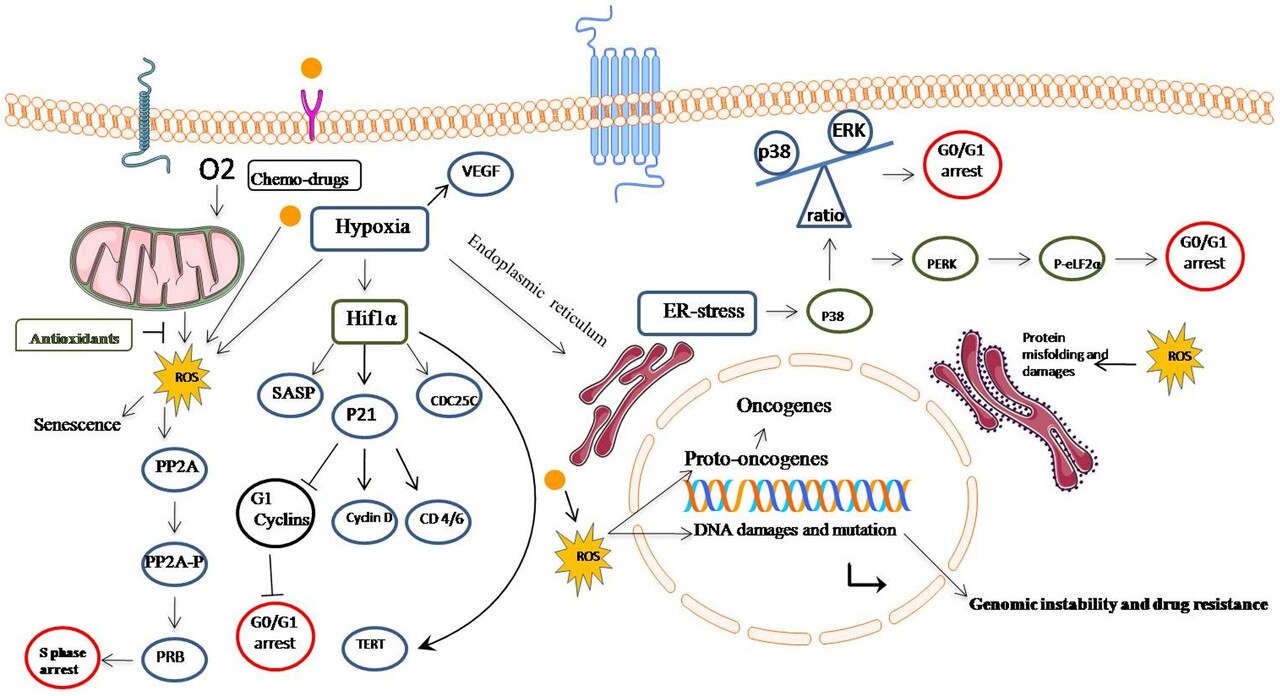
암세포의 지속적인 산화 스트레스는 세포 주기 정지와 약물 내성을 유발합니다.
활성 산소 종은 여러 경로를 통해 종양 세포를 휴면 및 약물 내성으로 이끌 수 있습니다.
종양 환경의 저산소 상태는 산화 스트레스를 유도하여 PP2A/PRB 및 hif1α/p21 경로를 통해 S-기 정지를 유도할 수 있습니다.
또한, 암세포의 소포체 스트레스는 P38/ERK 비율 및 p38/p-elF2α를 상향 조절함으로써 G0/G1 정지로 세포를 유도합니다.
암세포 내 활성산소종은 또한 약물 내성 및 면역 체계의 파악이 어려운 1가지 요인으로 종양유전자 및 게놈 불안정성을 유발할 수 있습니다.
산화 방지제는 지속적인 산화 스트레스를 억제하고 휴면 세포를 증식 단계로 깨워 화학 약물에 접근할 수 있게 합니다.
화학 요법 약물에 의해 생성되는 반응성 산소 종에 의한 부작용 유도
화학 요법의 또 다른 한계는 부작용의 발생입니다. 화학요법제는 암세포를 죽이지만 정상 세포와 조직에 악영향을 미칩니다. 크든 작든 ROS는 이러한 부작용의 병인과 관련이 있습니다.
그러나 이러한 모든 부작용이 모든 유형의 약물에서 관찰되는 것은 아닙니다. 즉, 특정 화학 요법 약물은 특정 유형의 부작용을 유발합니다.
예를 들어, 알킬화제의 하위 유형으로 시스플라틴으로 치료받은 환자는 신경독성, 신독성 및 이독성(청력 상실)의 징후가 나타나는 반면, 독소루비신은 심근병증을 유발하고 블레오마이신은 폐 손상을 유발합니다.
화학 요법 약물(잠재적인 병용 요법)과 천연 물질의 조합은 부작용을 줄일 수 있습니다.
또한, 항암제와 항산화제를 함께 투여하면 부작용을 완화하는 데 도움이 될 수 있습니다. 식이 보충제로 항산화제를 투여하는 장점은 보충제가 화학 요법 처방에서 ROS에 의해 유발된 독성을 감소 또는 예방할 수 있다는 것입니다.
그러나 부작용을 예방하는 효과는 불분명합니다.
D'Andrea의 연구에 따르면, 화학 요법 및 방사선 요법 중 항산화제의 사용은 피해야 하며 임상의는 유해할 수 있으므로 항산화제의 사용을 조언해서는 안 됩니다.
암, 심혈관 질환, 당뇨병 및 기타 질병의 예방에서 항산화제의 역할은 확인되었지만 화학요법과 병용 시 그 효과는 불확실합니다.
또한 Prasad의 연구에 따르면 대부분의 종양 전문의는 표준 요법 동안 항산화제 사용을 권장하지 않으며 일부는 치료 완료 후에만 낮은 용량의 항산화제 사용을 권장합니다. 그들은 항산화제의 사용을 유해한 것으로 간주합니다.
왜냐하면 내인적으로 생성된 항산화제인 글루타티온의 모든 수준에서 또는 외인성으로 투여된 항산화제 및 비타민 E, A, C 및 천연 베타카로틴과 같은 유도체를 낮은 수준으로 투여할 경우 치료 중 암세포를 보호하거나 잔류 암세포의 증식을 유도하여, 이는 암 재발 및 관련 부작용이 뒤따른다고 믿기 때문입니다.
탈모증 및 골수억제와 같은 특정 부작용은 항산화제로 예방할 수 없으며 연기(Smoke Components) 성분과 같은 다른 약제가 항산화제의 효과와 화학요법제의 항암 효과를 방해할 수도 있습니다
면역 체계-종양 경쟁에 대한 화학 요법 및 항산화제의 효과
과학자들은 암 환자의 면역 체계가 질병에 대해 강화되어야 한다고 믿습니다. 그들은 과도한 스트레스를 줄이는 것이 도움이 될 수 있다고 제안합니다.
화학 요법은 산화 스트레스를 유발하여 일시적으로 면역을 약화시킬 수 있습니다.
일상적인 화학 요법 사용에도 불구하고 면역 체계에 미치는 영향에 대한 지식은 부족합니다.
치료를 받는 암 환자의 면역 매개변수에 장기간 변화가 있는 림프구에 대한 화학요법의 효과가 보고되었습니다.
B, T, NK 세포의 수치는 화학 요법 후 2주에 감소했습니다.
여러 연구에서 화학요법이 순환 림프구의 모든 주요 하위 유형의 단기 고갈(3-6개월)과 B 및 CD4 + T 세포의 장기간(>9개월) 고갈을 유발한다는 것을 관찰했습니다 .
일부 연구에서는 면역 세포의 산화제에 대한 항산화제의 보호 효과를 조사했습니다.
이러한 스트레스 요인은 미토콘드리아 기능 장애를 일으켜 림프구 하위 집합의 카스파제 의존적 세포자멸사를 초래했습니다. 그러나 C 코엔자임 Q-10으로 세포를 전처리하면 세포 사멸이 현저하게 감소했습니다.
DNA 손상, DNA 교차 결합(티미딘 이량체), 단일 및 이중 가닥 DNA 파손은 면역계 세포에 대한 산화 스트레스 증가의 결과입니다.
이러한 손상이 복구되지 않은 상태로 남아 있으면 세포 사멸, 제어되지 않은 세포 증식 또는 노화와 같은 특정 세포 반응이 발생할 수 있습니다.
화학 요법 매개 면역 시스템 고갈 외에도 고형 종양은 ER 스트레스 유도를 통해 주변 면역 세포를 억제할 수 있습니다. 암세포는 불리한 조건에서 생존하기 위해 다양한 전략을 사용하는 동시에 항암 면역 기능의 발달을 방해합니다.
영양소 결핍, 저산소증, 높은 대사 요구 사항 및 산화 스트레스와 같은 종양 덩어리 내의 적대적인 미세 환경 조건은 ER의 단백질 접힘 protein-folding능력을 방해하여 "ER 스트레스"의 세포 상태를 시작합니다.
ER 스트레스 센서의 지속적인 활성화는 악성 암 세포에 추가 종양 형성, 전이 및 약물 내성 기능을 제공합니다.
또한, 최근 연구에 따르면 ER 스트레스 반응은 종양 미세 환경에서 골수 세포의 기능을 조작하여 방어적인 항암 면역의 발달을 방해한다는 것이 밝혀졌습니다.
놀랍게도 항산화 치료는 산화 스트레스를 줄이고 종양에 대한 면역 체계를 회복시킬 수 있습니다.
세포 배양 및 동물 모델 연구의 증거
아스타잔틴, 비타민 E, 비타민 C, 셀레늄, 실리비닌, 케르세틴 및 크로신을 포함한 일부 항산화제의 역할은 화학요법 부작용으로부터 보호하고 화학요법 약물 효율성에서 지원됩니다. 예를 들어, diazinon에 노출된 쥐의 간에서 지질 과산화를 감소시키는 crocin의 효과가 확인되었으며 및 silibinin이 암에 대한 유망한 치료제로 사용되었습니다.
세포 배양 및 동물 모델에 대한 일부 연구의 증거는 표 1에 요약되어 있습니다.
Table 1
Effects of antioxidants in the presence of chemotherapy drugs (animal and cellular studies)
Antioxidant Samples Chemotherapy drugResult (Success/Failure) Reference
| 루틴과 케르세틴 | 수컷 스위스 쥐 | 옥살리플라틴 | 후각신경세포의 산화적 스트레스 유발 손상을 통해 부분적으로 발생하는 옥살리플라틴 유발 통증성 말초신경병증 예방 | |
| 커큐민 또는 셀레늄 | 성인 남성 Wistar 쥐 | 시스플라틴 | 시스플라틴 유발 신독성 및 지질 과산화에 대한 보호 없음 | |
| 커큐민과 비타민 C | 수컷 Wistar 쥐 골수 세포 | 시스플라틴 | 전체 염색체 손상(시스플라틴 유발 염색체 형성) 및 비정상 중기 수의 놀라운 감소 | |
| 아스타잔틴 | 수컷 스위스 쥐의 골수 및 말초 혈액 림프구 | 시클로포스파미드 |
|
|
| 케르세틴 | B 세포 만성 림프구성 백혈병 환자로부터 분리된 세포주 및 B 세포 | 플루다라빈 | 사멸 수용체 및 플루다라빈 매개 세포 사멸에 내성이 있는 만성 림프구성 백혈병 환자로부터 분리된 B 세포의 세포자멸사 향상 | |
| Crocin 및 Crocus sativus 추출물(CSE) | MCF7 세포주 | — | Bcl-2 발현 감소 및 Bax 단백질 증가 | |
| 아스타잔틴 | 비소세포폐암 세포주(A459, H1703) | 미토마이신 C(MMC) | Rad51 발현 감소 및 AKT 활성화를 통한 미토마이신 C 유도 세포독성 강화 | |
| 나린긴 | 4명의 건강한 사람의 말초 혈액 림프구 | 블레오마이신 | 염색체 이상 및 소핵 형성 감소 | Yilmaz 외 (2016) 53 |
역학 및 임상 연구 및 결과
식이 항산화제의 항암 및 항-부작용 효과는 관찰 사례-대조군 연구뿐만 아니라 여러 무작위 임상 시험에서 조사되었습니다( 표 2 36 , 66-76 ). 그러나 결과는 신뢰할 수 없으며 추가 조사가 필요합니다. 불충분한 보충 기간은 주로 무작위 시험의 무효 결과에 대한 하나의 가능한 설명으로 언급되었습니다.
표 2
화학 요법 약물 존재 시 항산화제의 효과(임상 시험)
항산화제인구수화학 요법 약물결과(성공/실패)참조
| 아스코르브산염(비타민 C) | 난소암 환자 27명 | 파클리탁셀, 카보플라틴 | 아스코르브산염 치료는 화학요법과 관련된 독성을 감소시켰습니다. 그러나 생존의 통계적 개선은 보이지 않았습니다. | |
| 경구용 비타민 C, 비타민 E, 베타카로틴, 코엔자임 Q-10 | 진행성 상피성 난소암 환자 2명 | 파클리탁셀/카보백금 | CA-125가 정상화되어 항암화학요법의 효능이 향상되었습니다. | |
| 약리학적 아스코르브산 | 췌장암 환자 9명 | 젬시타빈 | 약물 조합과 관련된 부작용은 드물었고(설사, 구강 건조), 약물과 아스코르브산염의 조합은 내약성이 우수했습니다. | |
| 베타카로틴, 아스코르빈산, 알파토코페롤 | 구강 백반증 환자 79명 | — | 베타카로틴, 아스코르브산 및 알파-토코페롤의 혈청 및 조직 수치가 유의하게 증가했습니다. 그러나 이러한 변화는 임상 개선과 강한 상관 관계가 없었습니다. | |
| 송과체 호르몬 멜라토닌(MLT) | 비소세포폐암(NSCLC) 또는 위장관 종양 환자 370명 | NSCLC 환자를 위한 시스플라틴 + 에토포시드 또는 시스플라틴 + 젬시타빈; 위장관 종양 환자를 위한 옥살리플라틴+5-FU/CPT-11 또는 5-FU+엽산 | 종양 퇴행률은 화학요법 단독으로 치료받은 환자에 비해 MLT를 병용 치료한 환자에서 더 높았다. 2년 생존율도 병용 요법을 받은 환자에서 더 높았습니다. | |
| 알파리포산(ALA) | 화학요법으로 유발된 말초신경병증 환자 70명 | 시스플라틴 또는 옥살리플라틴 | ALA 투여는 시스플라틴 또는 옥살리플라틴 유발 신경독성 예방에 효과적이지 않았습니다. | |
| 생강 추출물 경구 보충제 | 고형암 신규 확진자 43명 | 중등도에서 고도의 구토 유발 보조 화학요법 | 생강 추출물은 항산화 효소 혈중 농도를 증가시키고 산화 스트레스 혈중 농도를 감소시킬 수 있습니다. 생강 추출물을 매일 보충제로 섭취한 후 심각한 부작용이 보고되지 않았습니다. | |
| 생선 기름 보충 | 유방암 환자 5명 | 아드리아마이신, 5-플루오로우라실, 시클로포스파미드, 독소루비신, 파클리탁셀을 포함한 화학요법 요법 | 오메가-3 지방산을 포함한 어유의 보충은 특히 증가된 수퍼옥사이드 디스뮤타제, 글루타티온 환원효소, 적혈구의 카탈라제 활성 및 환자의 총 혈장 항산화 상태를 증가시킵니다. | |
| 셀레늄 보충 | 31명의 난소암 환자 | 시스플라틴+시클로포스파미드 | 탈모, 헛배 부름, 복통, 쇠약, 권태감 및 식욕 감퇴의 상당한 감소가 관찰되었습니다. | |
| 비타민 C와 D, 셀레늄 보충제 | 고형 종양 환자 48명 | 시스플라틴 | 장기 독성, 즉 신독성 및 이독성에 대한 보호가 나타났습니다. | |
| 비타민 A | 만성골수성백혈병 환자 153명 | 부설판 | 부설판+경구 비타민 A군은 부설판 단독 투여군에 비해 생존율이 높았다. | |
| 멜라토닌 | 폐경 후 유방암 환자 95명 | 호르몬 치료 완료 | 멜라토닌은 우울증이나 안면홍조 측정에 상당한 차이 없이 주관적인 수면의 질을 흥미롭게 향상시킬 수 있습니다. |
시스플라틴 함유 화학요법으로 치료받은 고형 종양 환자 48명에게 비타민 C, 비타민 E 및 셀레늄 보충제를 경구 투여했습니다. 환자들은 항암화학요법 시작 7일 전부터 치료 중단 후 3주까지 항산화 미량영양소를 투여받았다. 연구 결과는 장기 독성, 즉 신독성 및 이독성에 대한 보호를 제공함에 있어 항산화제를 만족스럽게 보충할 수 있는 가능성을 강조했습니다.
10명의 지원자를 대상으로 실시한 임상 연구에서 블레오마이신 유도 돌연변이 유발에 대한 비타민 C의 예방 효과를 평가했습니다. 지원자의 림프구 샘플을 매일 100 또는 1000mg의 비타민 C를 투여하기 2주 전과 2주 후에 배양했습니다. 결과는 두 용량(100 또는 1000mg)의 비타민 C 투여가 블레오마이신으로 인한 염색체 손상을 감소시켰음을 보여주었습니다. 그러나 감소는 100mg에서는 눈에 띄지 않았지만 1000mg에서는 두드러졌습니다.
비타민 E 보충의 신경보호 효과는 시스플라틴 화학요법을 받는 환자에서 추가로 평가되었습니다. 비타민 E의 경구 투여는 화학요법 전 평균 4일에 시작하여 시스플라틴 치료 중단 후 3개월까지 지속되었습니다. 이 연구는 비타민 E 보충제가 시스플라틴으로 유발된 신경독성의 발병률을 감소시키는 것으로 나타났습니다.
저자는 전임상 연구를 수행하고 인간 흑색종-이종이식된 누드 마우스 모델에 대한 시스플라틴과 비타민 E의 항종양 효과를 평가했습니다.
전임상 연구 결과는 시스플라틴 단독으로 치료한 마우스와 비교하여 시스플라틴과 비타민 E로 치료한 마우스의 종양 중량 억제, 종양 성장 지연 또는 수명 연장에 차이가 없음을 보여주었습니다.
또한 비타민 E 보충이 시스플라틴 항종양 활성에 영향을 미치지 않는 것으로 확인되었습니다. 두 그룹 모두 시스플라틴 화학요법에 뚜렷한 속도로 반응하지 않았기 때문입니다.
수행된 파일럿 위상 1/2 임상 시험에서 항산화 제의 효과는 새로 진단 단계 III 또는 IV의 난소 암 환자 27 명에 조사 하였다.
기존의 파클리탁셀/카보플라틴 요법에 고용량 아스코르브산염을 정맥 주사하여 독성을 평가했습니다. 그들의 결과에 따르면 아스코르브산염 치료는 화학 요법과 관련된 독성을 감소시켰습니다. 참가자들의 5년 추적 관찰에 따른 생존율의 통계적 개선은 관찰되지 않았다.
Drisko et al 은 진행성 상피성 난소암 환자 2명에 대한 임상 연구를 수행했습니다. 경구 비타민 C, 비타민 E, 베타 카로틴, 코엔자임 Q-10 및 종합 비타민/미네랄 복합체는 파클리탁셀/카보플라티늄을 사용한 화학요법 중 및 전에 환자에게 투여되었습니다. 결과는 CA-125의 정상화가 관찰되었고 진단 후 3년 동안 환자에서 유지되었음을 보여주었다. 또한 항암화학요법의 효과가 향상되고 항산화제의 안전성 가능성도 보고되었다.
리소니 비소세포폐암(NSCLC) 및 위장관 종양의 퇴행률에 대한 송과체 호르몬 멜라토닌(MLA)의 효과를 평가하기 위한 임상 시험을 수행했습니다(370명의 환자 참여).
환자는 MLA와 화학요법 약물(NSCLC 환자의 경우 시스플라틴+에토포시드 또는 시스플라틴+젬시타빈, 위장관 종양 환자의 경우 옥살리플라틴 + 5-FU/CPT-11 또는 5-FU+엽산)과 병용하거나 화학요법 약물 단독으로 치료했습니다.
결과에 따르면, 종양 퇴행률은 화학요법 단독 치료 환자에 비해 MLT를 병용 치료한 환자에서 현저하게 더 높았다.
또 다른 이중 맹검 위약 대조 시험에서 Guo 등은 71 백금 기반 화학 요법을 받는 환자의 말초 신경병증 증상의 중증도 감소에 대한 알파 리포산(ALA)의 효과를 테스트했습니다. 243명의 암 환자가 모집되었으며 그 중 70명이 연구를 완료했습니다. 시스플라틴 또는 옥살리플라틴을 투여받은 환자들은 24주 동안 ALA 또는 위약으로 치료를 받았습니다. 저자들은 ALA의 투여가 화학요법 요법에 의해 유발된 신경독성을 예방하는 데 효과적이지 않다는 것을 발견했습니다.
Danwilai 등에 의한 파일럿 연구에서, 생강 추출물의 항산화 활성은 매일 보충 높은 구토 유발 보조 화학 요법에 적당한받은 43 명 암 환자 조사 하였다한다. 환자는 고형 종양으로 새로 진단되었습니다. 연구자들은 생강 추출물이 항산화 효소 혈액 수치를 증가시키고 산화 마커 수치를 감소시킬 수 있음을 발견했습니다. 또한 생강 추출물을 매일 보충제로 사용하여 심각한 부작용이 보고되지 않았습니다.
Mansara 등 73 어유 보충제는 이러한 환자에서 항산화 상태를 개선 할 수 있는지 여부를 조사하기 위해 유방암 환자 5 명에 대한 연구를 실시했다. 오메가 3 지방산을 함유한 어유 보충제가 화학요법 동안 투여되었습니다. 보충은 SOD, 글루타티온 환원효소, 적혈구의 카탈라아제 활성 및 환자의 총 혈장 항산화 상태를 엄청나게 증가시켰습니다.
Meyskens 등에 의한 연구에서, 만성 골수성 백혈병 (CML) 환자 153 경구 비타민 A는 생존율을 향상시킬 수 있는지 여부를 결정하기 위해 펄스 형 경구 술판 및 술판 플러스 경구 비타민 A로 처리 하였다. 그들의 결과는 비록 차이가 통계적으로 유의하지는 않았지만 부설판과 경구 비타민 A 그룹의 환자가 부설판 단독 치료 그룹의 환자에 비해 임상 생존 기간이 더 긴 것으로 나타났습니다.
다른 연구에서 Lee et al 83 은 비타민 E 보충이 39,876명의 건강한 여성을 대상으로 암의 위험을 감소시켰는지 여부를 조사했습니다. 참가자들은 10.1년 동안 추적 관찰되었습니다. 이 대규모 시험의 데이터에 따르면, 비타민 E를 복용하는 건강한 개인에서 암 예방에 대한 전반적인 이점이 관찰되지 않았습니다.
결론
활성 산소 종 항상성은 세포 및 분자 메커니즘에서 매우 중요하며, 그 고유 생성은 세포의 자연 신호 및 해당 조직의 활동에서 주도적인 역할을 합니다.
세포 및 조직 내의 ROS 수준은 신체의 정상적인 생리가 지속되고 산화 환원 항상성이 공급될 수 있도록 생성된 항산화제의 양과 균형을 이룹니다. 즉, 내적 요인이나 외적 개입으로 인한 ROS 수준의 감소 또는 증가는 다양한 유형의 장애를 초래합니다.
어떤 경우에는 식용 보조제로 항산화제의 외부 공급이 산화환원 균형을 조절하는 데 도움이 됩니다. 활성 산소 종 세포 신호 전달이 널리 연구되었습니다. 하지만, 모든 조직 내의 모든 암세포 유형과 정상 세포를 포괄적으로 비교한 것은 아닙니다. 다른 유형의 세포에서 ROS 신호 전달의 차이가 분명하지 않은 한, 항산화제가 이러한 세포에 미치는 영향은 불확실합니다.
효과와 비효과 외에도 산화 스트레스 억제에서 베타카로틴, 아스타잔틴, 비타민 C, 비타민 E, 셀레늄을 포함한 다양한 항산화제의 차이점은 무엇입니까? 의심할 여지 없이, 그들은 좋은 항산화제이지만 영양학적 관점에서 다양한 세포에서 다른 기능을 할 수 있습니다.
화학 요법이나 치료를 받고 있는 암 환자가 항산화제를 섭취해야 하는지 여부에 관해 확실한 결론이나 결정적인 합의에 도달하지 못했습니다.
또한, 항산화제에 의해 변형된 세포 신호전달은 모든 세포 유형에 대해 비교 연구되어야 하는 것으로 보이며, 이와 관련하여 임계값이 정의되어야 한다.
마찬가지로, 모든 항산화제의 영양유전체학을 철저히 연구하여 환자의 항산화제 섭취 여부에 대해 일정한 결론에 도달해야 합니다.
세포 내 ROS 생성은 정확한 메커니즘을 기반으로 발생합니다. 활성 산소 종은 신호 전달과 같은 세포의 생리 기능에서 주도적인 역할을 합니다. 그러나 ROS의 과잉 생성은 암 발병률, 암의 성장, 암 침습성 및 화학 요법 약물에 대한 내성과 관련이 있습니다.
정상 세포와 비교하여 암세포는 기능을 위해 증가된 수준의 ROS가 필요하고 게놈 불안정을 일으키는 약물에 대한 내성이 필요합니다.
항산화제의 사용은 암세포의 성장을 늦추거나 지속적인 산화 스트레스를 줄이거나 암 진행을 억제할 수 있습니다.
더욱이, 암세포에서 ROS 수준을 증가시킴으로써 화학요법제는 암세포를 휴면 상태로 전환시킬 수 있습니다. 항산화제를 사용하면 ROS 수치를 낮추고 암세포가 휴면 상태를 빠져나갈 수 있습니다. 그로 인해 화학요법제에 노출됩니다.
따라서 항산화제는 암 발병률을 감소시킬 뿐만 아니라 암의 성장을 멈추고 약물 내성을 극복할 수 있습니다.
그러나 현재의 임상 및 실험실 연구는 상반된 결과를 보여줍니다.
이러한 모순은 항산화제 수준, 다양한 항산화제 보충제의 구성, 세포에 의한 흡수 수준 및 세포 신호전달에서 이들의 기능과 관련될 수 있습니다.
결론적으로 각 암에 어떤 종류의 항암제와 어떤 종류의 항산화제를 처방해야 하는지를 결정하기 위해 식용 가능한 항산화제의 스크리닝, 다양한 종류의 암세포에 대한 비교 연구 및 암 화학 치료제의 비교를 수행하는 것이 좋습니다.
세포 및 동물 모델에서 항산화제의 기능적 메커니즘을 구별하는 것이 중요합니다.
매우 자주 동물 모델에 대한 생체 내 효과가 관찰되었지만 배양 세포에서는 그러한 효과가 나타나지 않았거나 그 반대의 경우도 마찬가지입니다.
마지막으로, 특정 암의 출현 및/또는 진행 및 부작용 예방에 대한 항산화제의 효과 또는 비효과를 확립하기 위한 역학 연구를 수행해야 합니다.
'정보' 카테고리의 다른 글
| 암 예방 및 치료에서 ROS의 양날 역할 (0) | 2021.11.07 |
|---|---|
| 암 치료와 ROS (0) | 2021.10.18 |
| 암 진행 및 예방에서 항산화제의 산화환원 잠재력 (0) | 2021.10.18 |
| 암에서 항산화제와 ROS 간의 상호작용 (0) | 2021.10.18 |
| 암 치료에서 양날의 칼로서의 항산화제 (0) | 2021.10.18 |