2020
Progress in Understanding Ferroptosis and Challenges in Its Targeting for Therapeutic Benefit
https://www.sciencedirect.com/science/article/pii/S2451945620301124
Progress in Understanding Ferroptosis and Challenges in Its Targeting for Therapeutic Benefit
Ferroptosis is an iron-dependent cell-death modality driven by oxidative phospholipid damage. In contrast to apoptosis, which enables organisms to eli…
www.sciencedirect.com
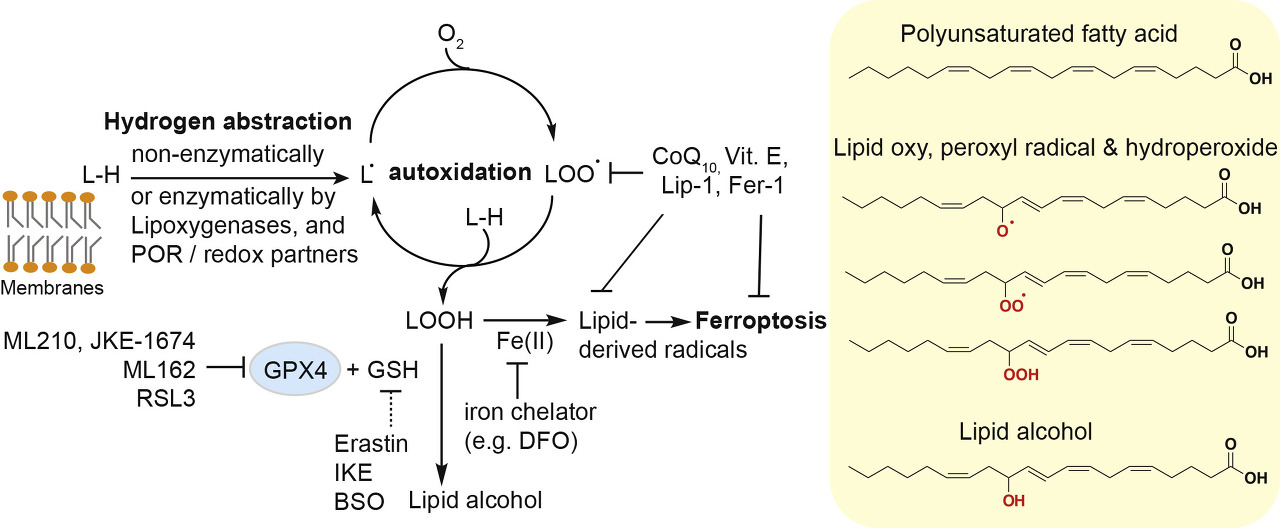
그림 1 . 지질 과산화 및 Ferroptosis의 화학적 기초
GPX4, 글루타티온 퍼옥시다제 4; LH, 다중불포화 지질의 상징; 비트. E, 비타민 E; 립-1, 립록스타틴-1; 페르-1, 페로스타틴-1; IKE, 이미다졸 케톤 에라스틴; DFO, 데페록사민; BSO, L-부티오닌-( S , R )-술폭시민; GSH, 환원된 글루타티온.
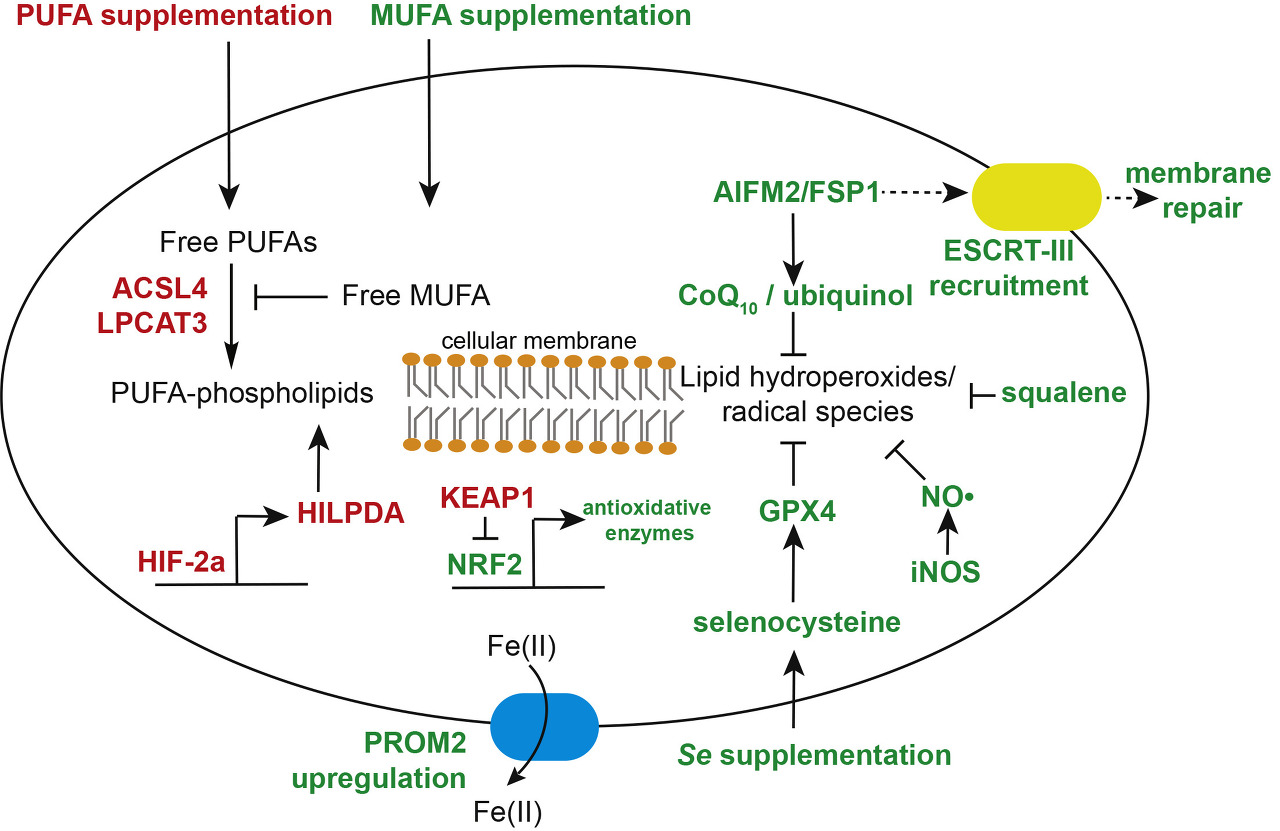
그림 2 . 세포에서 Ferroptosis 민감도 및 내성을 매개하는 메커니즘
빨간색: ferroptosis에 대한 세포 감수성을 증가시키는 유전자, 대사 산물 및 경로.
녹색: ferroptosis에 대한 세포 민감도를 감소시키는 유전자, 대사 산물 및 경로.
PUFA, 다중불포화 지방산; MUFA, 단일불포화 지방산; PROM2, 프로미닌2; AIFM2/FSP1, 세포자멸사 유도 인자, 미토콘드리아 관련 2(최근 페로프토시스 억제 단백질 1로 개명됨); HILPDA, 저산소증 유도, 지질 액적 관련 단백질; HIF-2ɑ, 저산소증 유발 인자 2ɑ; ACSL4, 아실-CoA 합성효소, 장쇄 패밀리 구성원 4; LPCAT3, 리소포스파티딜콜린 아실트랜스퍼라제 3; ESCRT, 운송 기계에 필요한 엔도솜 선별 복합체; iNOS, 유도성 산화질소 합성효소.
결론 및 미래 전망
지난 8년은 ferroptosis의 생화학적 기초를 정의하고, 새로운 화학적 도구를 개발하고, ferroptosis와 관련된 질병 상황을 식별하는 데 있어 급속한 발전의 시대를 나타냅니다. 이 세포 사멸 양식의 메커니즘에 대한 완전한 이해를 얻기 위해 다음 질문을 제기하여 페로프토시스 연구의 다음 단계를 자극할 수 있기를 바랍니다.
(1)
지질 과산화의 기초는 무엇입니까?
지질 과산화는 자가산화를 통해 비효소적으로 또는 효소적으로 발생할 수 있습니다.
과도한 비효소적 지질 과산화는 막 손상 및 비특이적 세포 사멸로 이어질 수 있지만, 이 과정이 특정 맥락에서 ferroptotic 세포 사멸에 대한 지배적인 경로인지 여부는 불분명하며, ferroptosis에서 이러한 두 지질 과산화 메커니즘의 상대적 기여도를 조사하기 위한 향후 연구가 필요합니다 .
반면에 지질 과산화를 직접 촉매하는 데 관여하는 세포 효소는 여전히 미스터리입니다.
이전 연구 는 입체 및 지역 특이적 방식으로 PUFA의 이산소화 를 촉매하는 비헴 철 함유 디옥시게나제인 lipoxygenase( 아라키도네이트 리폭시게나제 또는 ALOX에 의해 인코딩됨)의 활성 및 특이성을 특성화하는 데 주로 초점을 맞췄습니다 ( Kuhn et al., 2015 ).
그러나 최근에 ferroptosis 실행에서 lipoxygenase의 직접적인 관련은 소분자 lipoxygenase inhibitor의 본질적인 라디칼 포획 활성과 ferroptosis에 민감한 암세포의 광범위한 컬렉션에서 제한된 ALOX mRNA 발현에 의해 의문을 제기했습니다( Shah et al., 2018년 ,Zou et al., 2020 ).
한편, 시토크롬 P450 산화환원효소(POR)를 포함한 대체 효소가 여러 암 계통에서 중요하고 일반적인 프로페로프토시스 인자로 확인되었습니다( Zou et al., 2020 )( 그림 1 ).
PUFA 인지질과 직접 상호작용하는 POR 산화환원 파트너는 불분명하지만 리폭시게나제, POR 및 기타 지질 과산화 매개체의 상황별 기여는 추가 조사가 필요합니다.
또 다른 관련 질문은 ferroptosis에서 위치 선택적 대 비특이적 지질 과산화의 상대적 기여도입니다.
(2)
PUFA-지질 과산화로 인한 사멸 유발 분자의 정체와 특성은 무엇이며 세포 사멸을 유발하는 데 필요하거나 충분한 막 손상 유형은 무엇입니까?
하나의 그럴듯한 메커니즘은 세포 사멸이 하나 이상의 친핵성 단백질 표적과 친전자성 산화 절단된 지질의 부가물 형성에 의해 실행된다는 것입니다.
(3)
모든 다중불포화 지질은 지질 과산화를 시작하고 전파하는 데 동등합니까?
이전 연구에 따르면 동일한 측쇄를 가진 포스파티딜콜린(PC)이 아닌 아라키돈산(C20:4) 또는 아드레날린산(C22:4)을 함유하는 PE가 페로프토시스의 원인이라고 합니다( Kagan et al., 2017 ).
그러나 PE는 주로 세포막의 내부에 위치하는 반면(Yamaji-Hasegawa and Tsujimoto, 2006), PC는 세포막의 외부에 위치한다는 점을 고려하면 이러한 구분이 본질적인 화학 반응성 또는 물리적 접근성의 차이에서 비롯된 것인지는 아직 알려지지 않았습니다.
전반적으로, 각 지질 종류 내에서 산화를 겪을 수 있는 능력을 형성할 수 있는 화학적 및 생물학적 특성은 아마도 화학 반응성, 세포내 풍부도, 세포내 분포, 막 비대칭, 패킹 형태 및 밀도뿐만 아니라 인접한 지질 환경것을 포함하지만 이에 국한되지는 않습니다. .
(4)
지질 과산화는 세포에서 어디에서 시작되며, 시작을 지지하는 구조적 기초는 무엇입니까?
ER( Kagan et al., 2017 ), 미토콘드리아( Gao et al., 2019 ) 및 리소좀( Torii et al., 2016 , Gao et al., 2018 )을 포함한 여러 소기관이 페로프토시스와 관련이 있습니다.
지질 과산화가 세포 소기관 사이에 빠르게 퍼질 가능성이 있지만, 이러한 각 소기관의 정확한 기여와 사건의 순서는 여전히 불분명합니다.
(5)
ferroptosis의 생리학적 역할은 무엇입니까?
ferroptosis는 초기 포유류 발달에 필수적인 것으로 보이지만 조직 항상성, 뉴런 네트워크 형성 및 유지, 학습 및 기억, 면역 및 성인 생활에서의 정상적인 노화에서의 ferroptosis의 역할은 완전히 조사되기를 기다리고 있습니다.
(6)
ferroptosis에 대한 후천적 내성이 ferroptosis 유도제에 노출된 암 환자에서 발생하는지 여부는 크게 알려지지 않았습니다.
대부분의 표적 치료제로 치료한 후 높은 재발률과 암세포의 대사 가소성을 고려할 때 ferroptosis 내성도 나타날 가능성이 있습니다.
ferroptosis 저항을 얻는 분자 경로는 무엇입니까?
이 환자들을 위한 치료 옵션은 무엇입니까?
이러한 질문 외에도 ferroptosis-targeted 전략의 힘이 인간의 건강에 도움이 되도록 완전히 활용되기 전에 몇 가지 치료 과제가 남아 있습니다.
(1)
보다 강력하고 생체 내 사용에 적합한 Ferroptosis 유도제가 시급히 필요합니다.
현재 화합물은 동물 모델에 투여할 때 약하거나 불완전한 약리학적 특성을 나타냅니다 .
생체 이용 가능한 페로프토시스 유도제가 사용 가능해지면 인간의 치료 창과 독성 프로필은 어떻게 됩니까?
마우스 모델링과 제한된 인간 유전 결과에 기초하여 독성이 신장, 간 및 중추 신경계와 같은 조직에서 나타날 것이라고 생각할 수 있습니다.
약물 유발 독성의 시기와 정도를 평가하고 약물 투여 및 일정을 최적화하여 이러한 독성을 완화할 수 있는지 여부를 평가하려면 철저한 약리학적 분석이 필요합니다.
또한, 생체 내 ferroptosis 민감도 를 예측하는 더 나은 분자 마커는 ferroptosis 조절제 에 반응할 가능성에 대해 환자를 계층화하는 데 필요합니다.
(2)
ferroptosis 생물학의 새로운 요소를 표적으로 하는 효율적이고 생체이용 가능한 ferroptosis 억제제가 필요합니다. 지질 과산화 캐스케이드의 다른 부분을 표적으로 하는 여러 범주의 ferroptosis 억제제가 개발되었습니다.--(lipophilic RTAs including liproxstatin , ferrostatin and analogs , monounsaturated fatty acids that displace PUFAs from phospholipids, inhibitors of PUFA-lipid biosynthetic enzymes such as ACSL4 , and selenium supplementation, which augments GPX4 protein expression)
현재까지 생쥐에서 만성 ferroptosis 억제와 함께 독성이 관찰되지 않았다는 이전 보고서에도 불구하고, 장기 ferroptosis 예방을 받는 사람에서 독성이 나타날 가능성이 있는 것 같습니다.
인간에서 장기간의 지질 과산화 차단의 생리학적 효과는 특성화되어야 하며 조직 특이적으로 설계된 전략이 필요할 수 있습니다.
또한, thiazolidinediones온과 같은 현재의 ACSL4 억제제도 PPAR-γ(페록시좀 증식자 활성화 수용체 γ) 작용제이며 표적을 벗어난 효과를 나타낼 가능성이 높으며, 페로스타틴과 립록스타틴 의 생체 내 사용 은 약동학적 특성으로 인해 제한되었습니다.
임상적 사용에 적합한 페로프토시스 억제제를 개발하기 위해서는 향후 연구가 필요하다.
(3)
환자 및 생물학적 샘플에서 페로프토시스 발생을 보고하기 위한 보다 효과적이고 접근 가능한 바이오마커가 필요합니다.
현재 특정 세포 사멸 사건이 ferroptosis cascade를 포함하는지 여부를 확인하기 위해 ferroptosis 억제제를 사용하는 기능적 분석이 필요합니다.
이러한 문제의 해결로 우리는 세포가 어떻게 지질 과산화에 대처하고 병태생리학적 조건에서 산화 스트레스 하에서 생존하는지 더 명확하게 이해하게 될 것이며 새로운 페로프토시스 표적 요법에 더 가까워질 것입니다.
또한 복잡한 유기체에서 세포가 직면하는 다양한 환경적 스트레스 요인을 고려할 때 여기에 설명된 다중불포화 지질의 과산화와 같이 세포의 상태와 운명에 영향을 미치는 추가적인 대사 캐스케이드가 발견될 가능성이 있습니다.
'Ferroptosis' 카테고리의 다른 글
| 골육종의 ferroptosis 표적화 (0) | 2021.10.27 |
|---|---|
| ferroptosis의 분자 메커니즘과 암 치료에서의 역할 (0) | 2021.10.26 |
| 암 치료에서의 Ferroptosis: 로마로 가는 또 다른 방법 (0) | 2021.10.26 |
| Ferroptosis: 과거, 현재 및 미래 (0) | 2021.10.25 |
| ferroptosis의 메커니즘 (0) | 2021.10.25 |