https://ars.els-cdn.com/content/image/3-s2.0-B978032398367900010X-f13-03-9780323983679.jpg
https://ars.els-cdn.com/content/image/1-s2.0-B9780444641793000098-f09-01-9780444641793.jpg
https://www.knowledgedose.com/drugs-undergoing-extensive-first-pass-metabolism/
Drugs Undergoing Extensive First-Pass Metabolism | KnowledgeDose
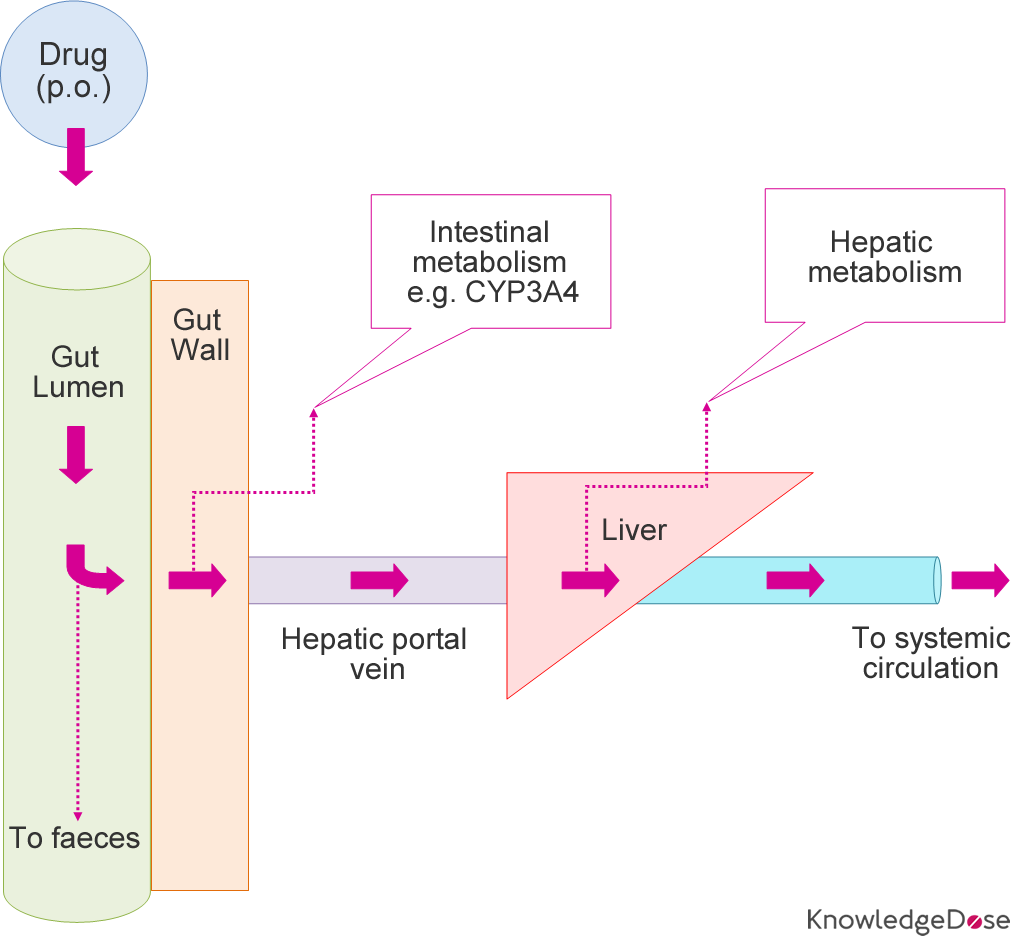
Some drugs that are administered via the oral route undergo extensive first-pass metabolism before reaching the systemic circulation. This first-pass metabolism can occur in the gut and the liver. Listed below are some drugs that undergo extensive first
www.knowledgedose.com
경구 경로를 통해 투여되는 일부 약물은 전신 순환에 도달하기 전에 광범위한 1차 통과 대사를 거칩니다.
이 1차 통과 대사는 장과 간에서 발생할 수 있습니다.
Listed below are some drugs that undergo extensive first-pass metabolism:
- Atorvastatin
- Budesonide
- Buspirone
- Chlorpromazine
- Clomethiazole
- Felodipine
- Hydralazine (rate of metabolism is dependent upon the acetylator status of the individual)
- Isosorbide dinitrate
- Labetalol
- Methylphenidate
- Morphine
- Nimodipine
- Oxprenolol
- Pentazocine
- Pethidine
- Propafenone
- Propranolol
- Raloxifene
- Salbutamol (the inhaled dose that is swallowed undergoes significant first-pass metabolism)
- Simvastatin
- Verapamil
https://socratic.org/questions/what-is-meant-by-the-first-pass-effect-of-drugs
What is meant by the First-Pass Effect of drugs? | Socratic
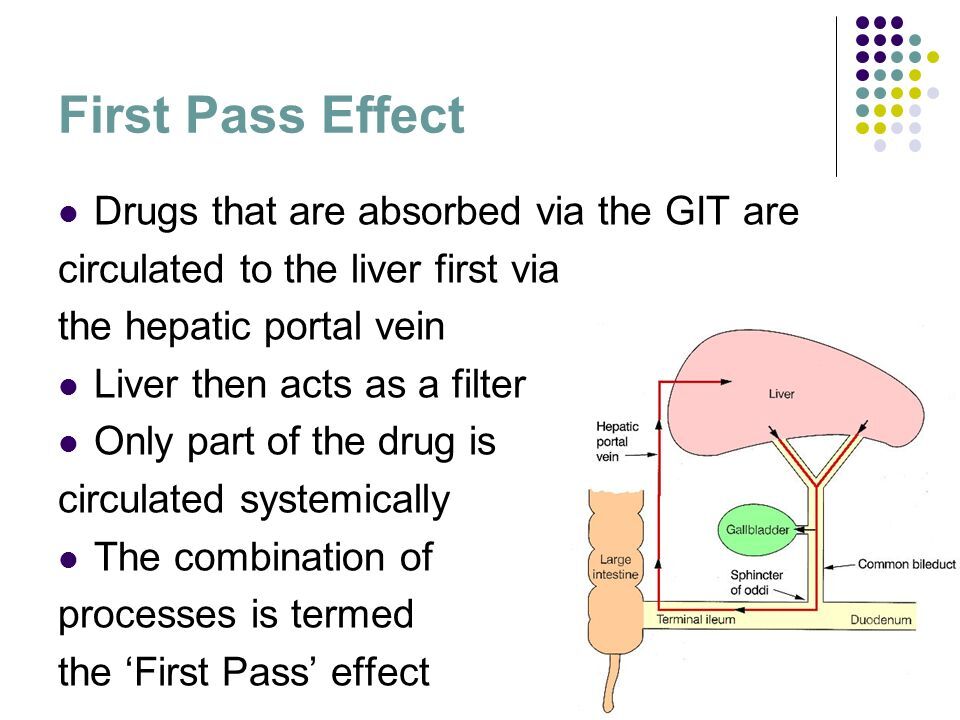
After oral administration, many drugs (morphine, pentazocine) are absorbed intact from the small intestine and trasported first via the portal system to the liver, where they undergo extensive metabolism. This process is called the first-pass effect. Altho
socratic.org
What is meant by the First-Pass Effect of drugs?
모든 조직은 약물을 대사하는 능력이 있지만 간은 약물 대사의 주요 기관입니다.
일부 다른 조직(예: 위장관, 폐, 피부, 신장 및 뇌)은 상당한 활동을 보입니다.
초회통과 효과는 경구 투여된 약물이 위장관에서 흡수되어 문맥을 통해 간으로 운반되어 대사되는 과정입니다.
결과적으로 일부 약물의 경우 활성 약물의 작은 비율만이 전신 순환 및 의도된 표적 조직에 도달합니다.
초회통과효과가 높은 약물의 경우 원하는 효과를 얻기 위해 경구투여를 피한다.
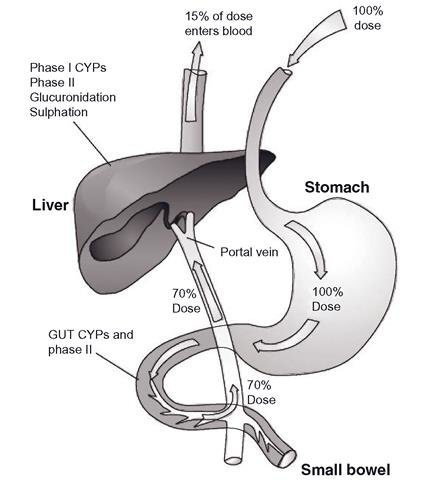
llustration of the "First Pass Effect"
https://tmedweb.tulane.edu/pharmwiki/doku.php/bioavailability_the_first_pass_effect
bioavailability_the_first_pass_effect [TUSOM | Pharmwiki]
Examples of Drugs with Significant First Pass Effect or Low Bioavailability Drug: Propranolol- ~26% Bioavailability because 75-85 % is metabolized by the liver before it can reach the circulation when taken orally. Drug: Morphine-~30% Bioavailability becau
tmedweb.tulane.edu
생체 이용률에 영향을 줄 수 있는 변수는 다음과 같습니다 .
-
GI 상피 P-450을 파괴할 수 있는 자몽 주스 의 소비
-
P-당단백질을 유도하는 약물(예: 리팜핀, St John's wort )
-
P-당단백질 또는 P-450을 억제하는 약물(예: 시메티딘, 플루옥세틴 )
-
간 조직을 파괴하는 간 질환(예: 간경변 )
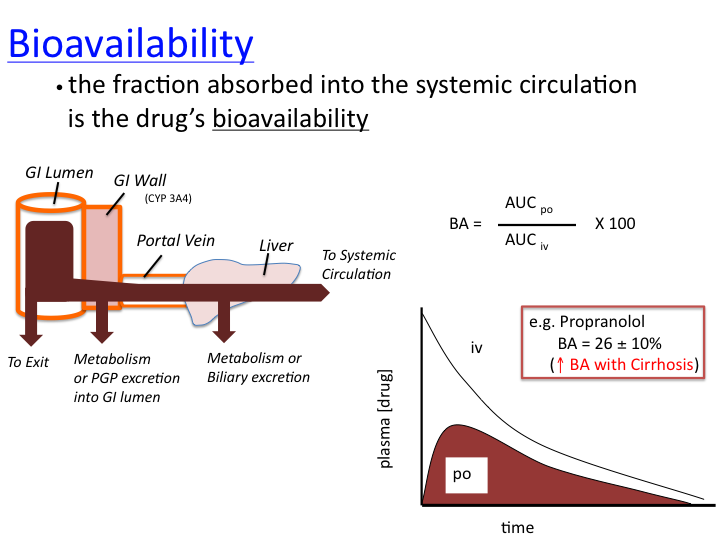
그림 1생체이용률은 약물이 경구 투여될 때 전신 순환으로 흡수된 약물의 비율을 반영합니다.
실험적으로 이것은 경구 투여 후 혈장 농도의 연속 측정이 이루어진 경우 약물의 곡선 아래 면적(AUC)을 정맥 주사(정의상 100% 생체이용률을 생성함)와 비교하여 측정합니다.
경구 투여 후 AUC의 감소는 GI관 내에서 약물의 pH 또는 박테리아 매개 대사,
GI관으로부터의 불완전한 약물 흡수,
GI 상피 내 대사(CYP3A4 포함),
GI 상피의 P-당단백질에 의한 GI 관, 간 대사 또는 GI 관으로의 담즙 배설.
" 첫 번째 통과 효과 " - 전신 순환에 도달하기 전에 GI 조직 및 간을 통한 첫 번째 통과를 통한 약물 손실을 반영합니다.
https://step1.medbullets.com/pharmacology/107006/phase-i-vs-phase-ii-metabolism
Phase I vs. Phase II Metabolism - Pharmacology - Medbullets Step 1
step1.medbullets.com
| Overview |
|
https://www.researchgate.net/figure/The-phase-concept-of-drug-metabolism_fig1_24242575
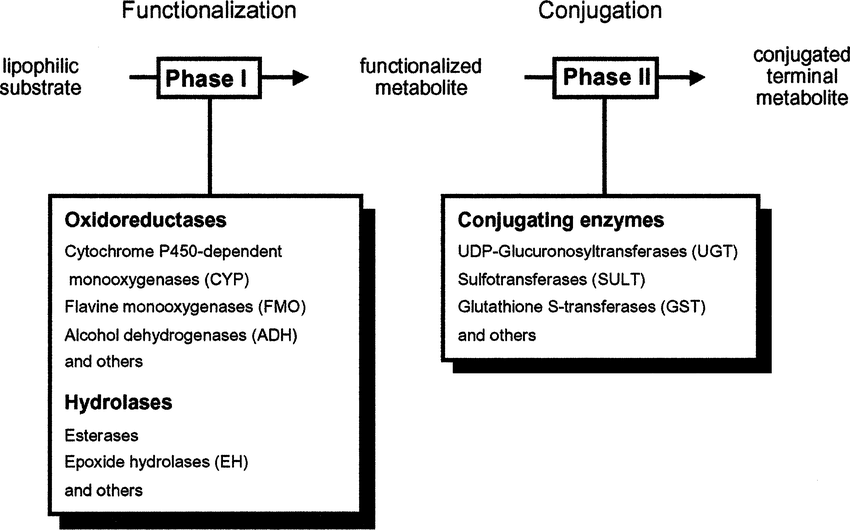
The drug-metabolic and elimination pathways.
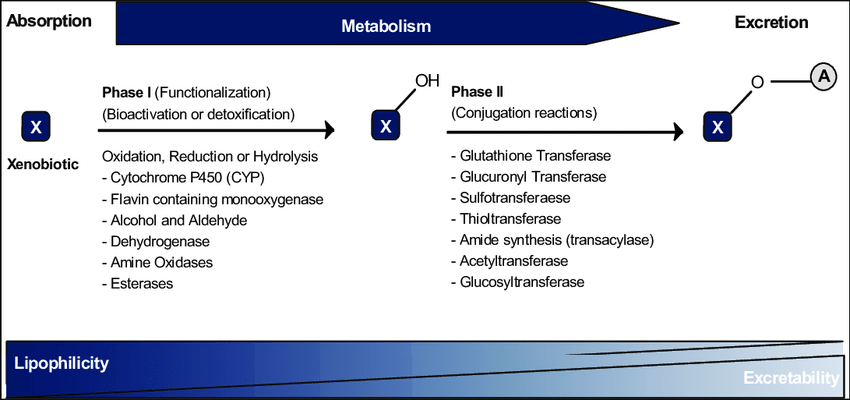
약물 대사의 두 가지 주요 단계에 대한 도식적 설명.
일반적으로 모 화합물은 중간 대사 산물로 전환되어 접합되지만 대사에는 이러한 반응 중 하나만 포함될 수 있습니다. 일부 대사 산물은 모 화합물보다 독성이 더 큽니다.
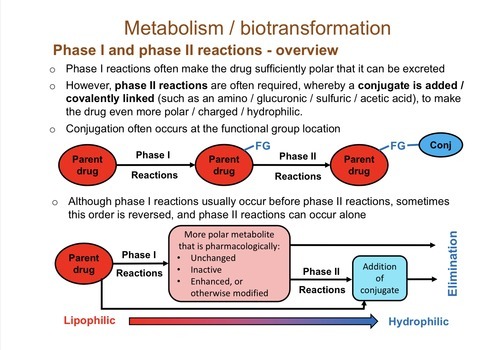
https://sites.google.com/site/kanikachoughule/postdoctoral-work/a-layman-s-guide-of-my-work
Drug Metabolism for Dummies... - Kanika Choughule
We all have taken or will take some form of medication during our lifetime. Have you ever wondered what is it that you are actually taking when you swallow a pill ? The medicine you take is usually given to you is in its inactive form so that it remains
sites.google.com
간은 약물 대사의 대부분이 두 단계로 일어나는 주요 부위입니다.
1단계에서 비활성 약물은 약물 대사 효소 세트에 의해 활성화됩니다.
이것은 약물 화합물에 작용기(여기서는 OH)를 추가하여 수행됩니다.
2단계에서 활성 약물은 불활성화되고 이제 소변과 담즙을 통한 배설에 적합한 방식으로 변형됩니다.
2단계는 다른 약물 대사 효소 세트에 의해 수행됩니다.
그들이 수행하는 반응을 접합이라고 합니다.
설포트랜스퍼라제는 약물에 황산염기를 결합하여 약물을 더 잘 녹게 만들고(물이나 수용액에 쉽게 용해) 소변이나 담즙을 통한 배설을 돕는 2상 효소 계열입니다.
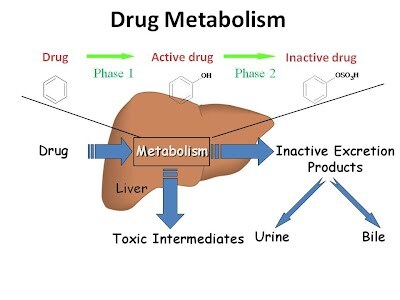
https://health.selfdecode.com/blog/the-science-of-detoxification/
The Science of Detoxification: How Phase I Relates to Health - SelfDecode Health
Your body has an amazing built-in detox system. Read on to learn what nutrients, foods, supplements, and lifestyle choices can help support it.
health.selfdecode.com
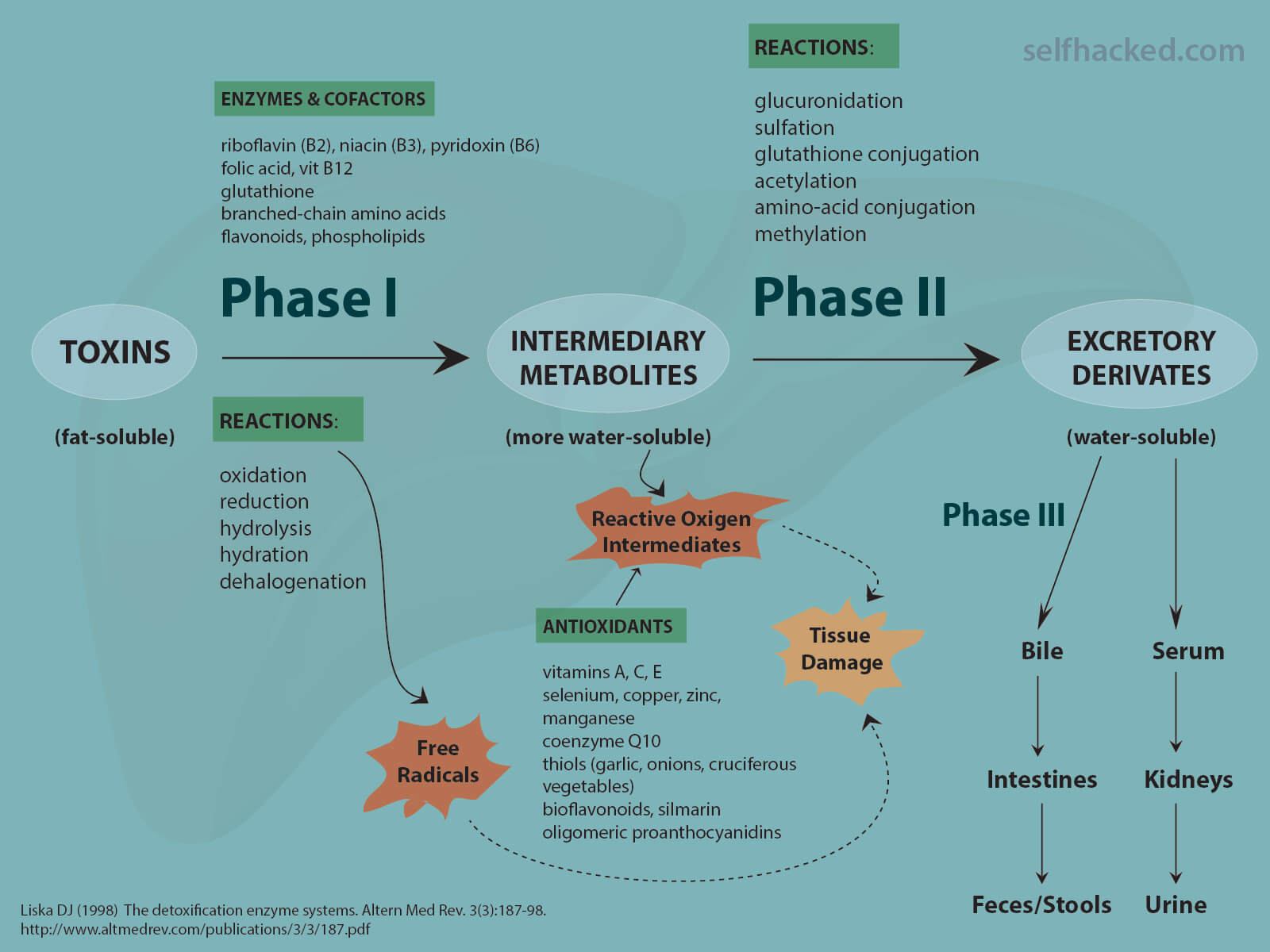
해독 단계
해독 과정은 크게 세 단계로 나눌 수 있습니다[ 3 ].
- 단계 I은 변형 효소 에 의해 관리됩니다 . 이 효소는 독소/약물을 산화, 환원 및 가수분해합니다.
- II 상은 접합 효소 에 의해 관리됩니다 . 이 효소는 I상 제품을 접합합니다.
- III 단계는 수송 단백질 에 의해 수행됩니다. 이 단백질은 세포에서 최종 물질을 수송합니다.
이 효소는 기질 범위가 넓습니다.
그들은 신체(간, 폐, 장 점막) 또는 특정 기관(뇌의 맥락막 신경총)으로 들어가는 주요 지점에 상대적으로 더 집중되어 있습니다.
많은 것들이 또한 유도될 수 있는 것으로 보입니다.
즉, 신체는 특정 독소에 노출되면 이를 분해하는 효소를 더 많이 생성하여 반응합니다
해독 기관
간은 장에서 직접 나오는 혈액을 걸러내고 몸에서 배출될 독소를 준비하기 때문에 주요 해독 기관입니다.
상당한 양의 해독은 장, 신장, 폐 및 뇌에서도 발생하며 I, II 및 III기 반응은 신체의 나머지 부분에서 덜 발생합니다.
해독 효소는 다른 효소에 비해 느리지만 매우 많은 양으로 존재합니다.
예를 들어, Phase II glutathione transferases는 간에서 전체 단백질의 10%를 차지합니다.
Phase I Detoxification: The First Step=1단계 해독: 첫 번째 단계
효소에 의한 변형으로 독소가 더 잘 녹게합니다.
I상 효소는 지용성 화합물을 수용성 화합물로 화학적으로 변형시켜 해독 과정을 시작합니다.
수용성 화합물은 쉽게 배설되는 반면 지용성 화합물은 신체의 해독 효소로부터 보호되는 지방 세포에 저장될 수 있습니다.
단계 I 반응에는 산화, 환원, 가수분해 및 cyclization=고리화가 포함됩니다.
이러한 반응은 아래와 같은 것들에 의해 매개됩니다.
- 다용도 시토크롬 P450(CYP) 효소
- 보다 선택적인 flavin-containing monooxygenases (FMO, 담배 연기에서 니코틴 해독 담당 )
- Monoamine oxidase(뉴런에서 세로토닌 , 도파민 및 에피네프린 을 분해하는 MAO )
- 알코올 및 aldehyde dehydrogenases(알코올 대사)
- Epoxide hydrolase(EH) 및
- 기타 I상 효소.
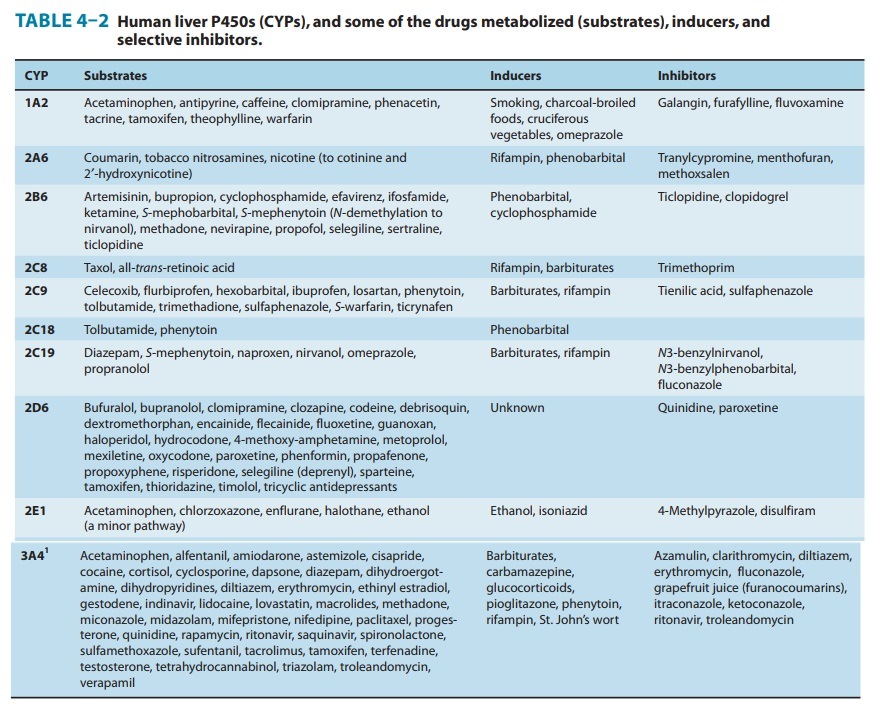
Cytochrome P450 monooxygenases-시토크롬 P450 모노옥시게나제(CYP)
독특한 산화 화학 작용을 통해 시토크롬 P450 모노옥시게나제(CYP)는 인체에서 대부분의 약물과 독소를 제거하는 촉매 작용을 합니다.
그러나 CYP는 내인성 생화학 물질도 대사합니다(예: CYP19A1 , 아로마타제라고도 하며 테스토스테론 을 에스트라디올 로 전환 ).
인간 게놈 프로젝트는 57개의 인간 CYP를 확인했습니다.
그러나 약 12개의 간 CYP가 대부분의 약물 및 기타 생체이물(약물 대사의 약 93%)의 대사를 담당합니다.
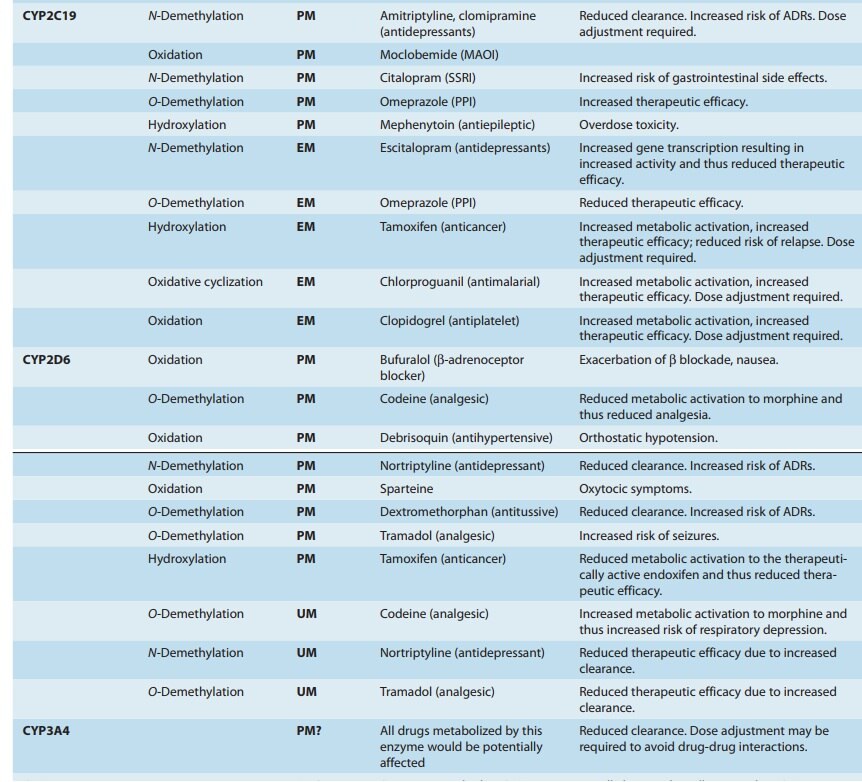
이 중 CYP3A4 , CYP1A2 , CYP2D6 , CYP2C9 , CYP2C19 는 약물 대사의 거의 60%를 담당합니다.
CYP는 해독 효소이지만 이러한 반응은 종종 독성이 덜한 분자를 더 독성이 강한 활성 제품으로 전환합니다.
그것이 2단계 해독이 시작되는 곳입니다.
예를 들어, CYP1A1 은 일부 발암물질을 활성화할 수 있는 반면 CYP2E1 은 여러 간 독소를 활성화하고 알코올성 간 손상을 일으킬 수 있습니다.
다른 CYP들
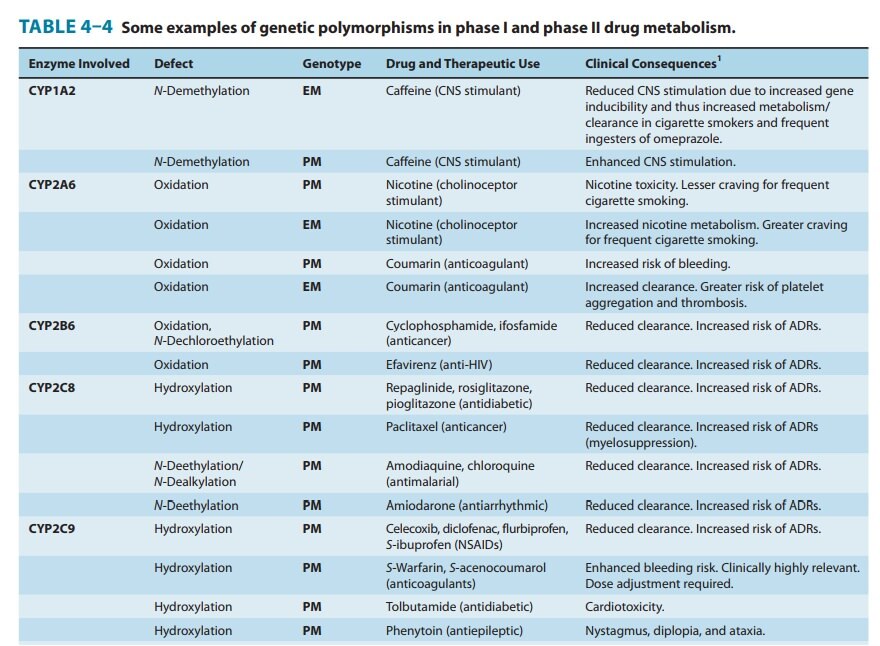
CYP 유전자의 2,000개 이상의 돌연변이가 설명되었으며 특정 single nucleotide polymorphisms (SNPs)은 CYP 활성에 큰 영향을 미치는 것으로 나타났습니다.
인종에 의존하는 것으로 밝혀진 유전적 다형성은 CYP(특히 CYP2D6 , CYP2C19 , CYP2C9 , CYP2B6 , CYP3A5, CYP2A6) 의 기능에 중요한 역할을 하며 , 뚜렷한 약리학적, 불량한, 중간, 광범위 및 초고속 대사제의 표현형으로 이어집니다..
CYP1A1 , CYP1A2 , CYP2C8 , CYP2E1 , CYP2J2 및 CYP3A4 의 다형성 은 일반적으로 덜 예측적이지만 데이터는 예측 변이가 존재함을 보여줍니다 .
한 연구에서 CYP2C19, CYP2C192의 다형성은 클로피도그렐 치료 중 주요 심혈관계 부작용 위험을 30% 증가시키는 것과 관련이 있었습니다.
한편, CYP2C1917은 클로피도그렐 치료 중 출혈 위험 증가와 관련이 있었습니다.
CYP에 영향을 미치는 요인(성별, 연령, 식단, 건강)
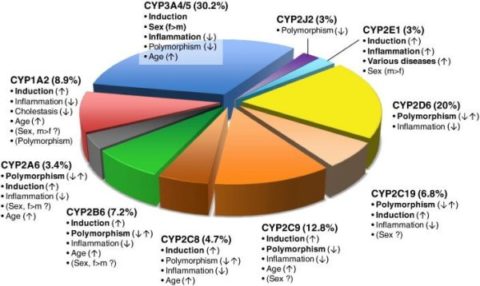
위의 그림은 CYP 효소 에 의해 대사되는 약물의 비율을 보여줍니다 .
중요한 변동 요인은 화살표로 표시된 영향의 가능한 방향과 함께 굵은 글꼴로 표시됩니다.
논란의 여지가 있는 요인은 괄호 안에 표시되어 있습니다.
성별: 대부분의 임상 연구에 따르면 여성은 남성보다 약물을 더 빨리 대사합니다.
이것은 특히 주요 약물 대사 CYP3A4 의 경우 입니다.
분석에 따르면 남성 간 조직에 비해 여성의 CYP3A4 단백질 수준이 ~2배 더 높습니다[ 15 ].
연령: 인간 간 연구에 따르면 일생 동안 대부분의 CYP, 특히 CYP2C9 의 발현과 활성이 약간 증가하는 것으로 나타났습니다.
질병: 질병 상태는 일반적으로 약물 대사 능력에 부정적인 영향을 미친다는 증거가 있습니다.
감염, 염증 및 암 동안 순환하는 전염증성 사이토카인(예: IL-1β , TNF-α 및 IL-6 )은 많은 약물 대사 효소의 심각한 하향 조절을 유도하는 것으로 보입니다.
만성 신장 질환(CKD) 환자는 사이토크롬 P450 (CYP) 효소 활성이 감소했습니다.
반면에 CYP2E1 은 당뇨병에서 상향 조절되며 일부 연구자에 따르면 당뇨병과 비만 에서 관찰되는 지속적인 세포 손상에 기여할 수 있습니다.
식단: 제한된 연구에 따르면 단백질 결핍은 억제하는 반면 단백질이 풍부한 식단은 CYP 활성을 증가시킵니다.
고탄수화물 식단은 한 오래된 연구에서 CYP 활성을 감소시키는 것으로 나타났지만 현재 연구에서는 이 연관성을 확인해야 합니다.
반면에 포화 지방이 많은 식단은 당뇨병에서 상향 조절되는 것으로 나타난 효소인 CYP2E1을 활성화하는 것으로 제안되었습니다.
CYP 활동을 낮추는 것은 무엇입니까?
주의 말씀
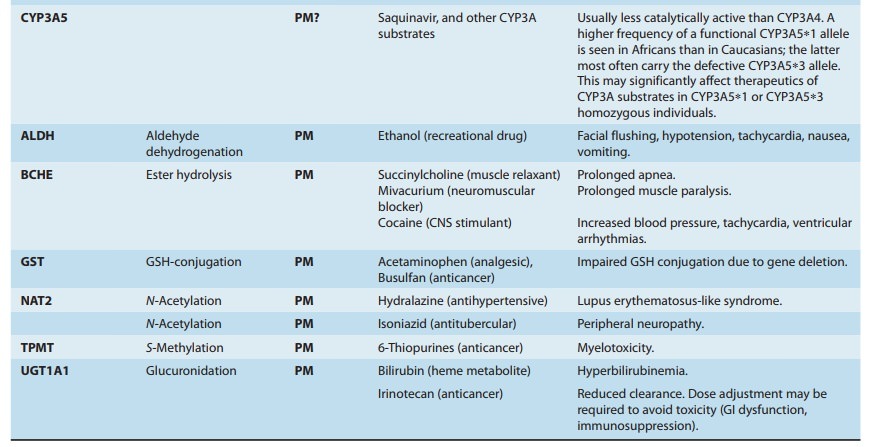
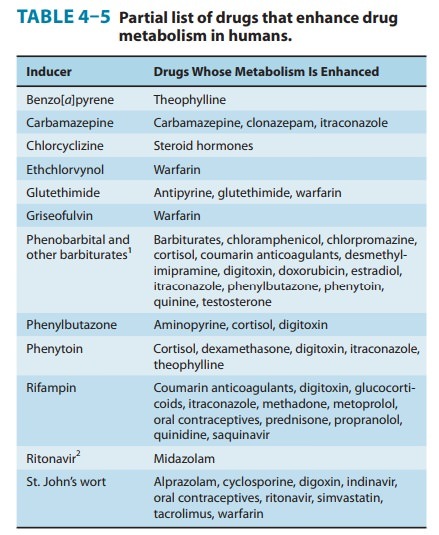
변경된(증가 또는 감소) CYP 활성은 대부분의 약물 상호작용의 기초가 됩니다.
이는 보충제-약물 상호작용이 위험하고 드물게 생명을 위협할 수 있는 이유 중 하나입니다.
CYP 효소는 대부분의 약물을 대사한다는 것을 기억하십시오.
이론적으로 CYP 활성을 낮추는 모든 물질 은 약물의 대사를 늦추고 혈중 농도를 높일 수 있습니다.
이것은 독성 또는 심각한 부작용의 위험을 증가시킬 수 있습니다.
반면에 CYP 활성을 증가시키는 물질 은 대사 및 약물 제거를 가속화할 수 있습니다.
이것은 약물의 혈중 농도를 낮추고 효과를 떨어뜨릴 수 있습니다.
허브, 식품 및 기타 화합물
아래에 설명된 많은 효과는 동물이나 세포에서만 연구되었습니다.
임상 데이터가 부족한 영양소의 경우 인간의 CYP 상호 작용은 알려져 있지 않습니다.
- 자몽 주스 및 기타 과일 주스(bergamottin, dihydroxybergamottin, and paradicin-A 포함)에서 발견되는 화합물 이 CYP3A4 를 억제하여 CYP3A4 매개 약물의 생체 이용률을 증가시키는 것으로 밝혀졌습니다.
- 스타프루트 주스는 CYP2A6 , CYP1A2 , CYP2D6 , CYP2E1 , CYP2C8 , CYP2C9 및 CYP3A4를 억제합니다.
- Watercress는 CYP2E1을 억제하여 특정 약물(예: 클로르족사존)을 복용하는 개인의 약물 대사를 변경할 수 있습니다.
- Goldenseal은 두 가지 주목할만한 알칼로이드 인 berberine and hydrastine을 함유하여 CYP2C9, CYP2D6 및 CYP3A4를 억제하는 것으로 나타났습니다.
- Eurycoma longifolia , Labisia pumila , Echinacea purpurea , Andrographis paniculata , Ginkgo biloba 는 CYP2C8 을 억제합니다.
- 프로폴리스 는 CYP1A2, CYP2E1 및 CYP2C19 를 억제합니다.
- 토마토, 당근, 수박에서 발견되는 붉은 색소인 리코펜 은 CYP1A1 과 CYP1 B1 을 억제 합니다 .
- 중국 전통 한방 감초 의 주요 화합물인 Licochalcone A는 CYP1A2 , CYP2C19 , CYP2C8 , CYP2C9 , CYP3A4를 현저하게 억제 하고 CYP2E1 과 CYP2D6 에 약한 억제 효과를 나타냅니다.
- 식물에서 흔히 발견되는 Caffeic acid and quercetin 은 CYP1A2와 CYP2C9 를 강력하게 억제 합니다.
카페인산은 CYP2D6을 추가로 억제하고 CYP2C19 및 CYP3A4를 약하게 억제합니다.
케르세틴 은 CYP2C19 및 CYP3A4 를 강력하게 억제 하고 중간 정도는 CYP2D6을 억제합니다.
- 생강 추출물은 CYP2C19 를 억제합니다.
- 케일 섭취는 다른 십자화과 야채와 달리 CYP3A4 , CYP1A2 , CYP2D6 , CYP2C19 를 억제할 수 있습니다 .
- 후추 의 성분인 피페린 은 CYP3A4 를 감소시킵니다.
- 올리브 오일 에서 추출한 Oleuropein 은 CYP3A4를 비활성화하고 CYP1A2 를 약간 억제합니다.
- 마늘 은 CYP2E1 을 억제합니다.
- 레스베라트롤 과 유채과 야채(garden cress)는 CYP3A4를 억제합니다.
- 베리와 그 구성 성분인 엘라그산은 CYP1A1 과잉 활성을 감소시킬 수 있습니다.
- Apiaceous vegetables는 과도한 CYP1A2 작용을 약화시킬 수 있습니다.
- 루이보스 차와 셀러리에 존재하는 Chrysoeriol은 CYP1B1 을 억제할 수 있습니다 [ 32 ].
- N-acetyl cysteine, ellagic acid, green tea, black tea, dandelion(민들레), chrysin, and medium chain triglycerides (MCTs)는 CYP2E1 을 하향조절할 수 있습니다.
- Saint-John's wort는 CYP1A1 , CYP1B1 및 CYP2D6 을 감소시킵니다 .
CYP 활동을 증가시키는 것은 무엇입니까?
허브와 식품
- 쥐오줌풀(Common valerian)은 CYP3A4 및 2D6의 활성을 증가시켰습니다.
- 은행나무 는 CYP1A2 와 CYP2D6 의 활성을 증가 시켰습니다.
- 브로콜리와 십자화과 야채(Broccoli and cruciferous vegetables) 는 CYP1A1 /1A2를 유도합니다.
- 레스베라트롤 과 레스베라트롤 함유 식품은 CYP1A1을 향상시킵니다.
- 커큐민 은 3A4 활성을 상향조절할 수 있습니다.
- Rooibos tea, garlic, and fish oil 는 CYP3A, 3A1 및 3A2의 활성을 유도하는 것으로 보입니다.
- Saint-John's wort는 CYP3A4를 증가시킬 수 있습니다.
독소
- 담배 연기는 CYP를 유발합니다.
호르몬
- 임신 중에 도달한 고농도의 17β-에스트라디올(E2)은 CYP2B6 발현을 증가시킵니다.
많은 식품이 농도 또는 구성(커큐민/강황, 홍차/ theaflavins , 대두)에 따라 CYP 효소의 유도제 및 억제제로 작용하는 것으로 보입니다.
다른 식품은 특정 CYP 효소를 증가시키는 반면 다른 CYP는 감소시킵니다.
1단계 활동이 증가하는 것이 항상 좋은 것은 아니라는 점을 아는 것도 중요합니다.
Phase I 효소는 독성 및 발암성 화합물을 생성하므로 Phase II 효소와 균형을 유지해야 합니다.
CYP 효소를 활성화하는 수용체
I상 유전자의 발현은 aryl hydrocarbon receptors (AhR), PPARα 및 constitutive androstane receptors (CAR) and pregnane X receptors (PXR) 와 같은 고아 핵 수용체(orphan nuclear receptor) 를 비롯한 다수의 핵 수용체에 의해 좌우됩니다.
이러한 수용체 상호작용은 고도로 실험적이며 적절한 인간 데이터가 부족합니다.
- Polycyclic aromatic hydrocarbons (PAH)는 Ahr 을 활성화하여 CYP1A 및 CYP1B 효소를 증가시킵니다. 이것은 CYP 1A와 1B가 PAH와 방향족 아민을 발암 물질로 산화시키는 예입니다.
- PXR 은 스테로이드, 리팜피신, 메티라폰과 같은 소분자에 결합하여 CYP3A를 증가시킵니다.
- CAR 은 페노바르비탈, 오르페나드린 및 CYP2B를 활성화하는 기타 약물에 결합합니다.
- Clofibrate 및 기타 화학적 퍼옥시좀 증식제 (chemical peroxisome proliferator)는 PPARα 를 활성화하여 CYP4A를 유도합니다.
를 지원하는 이유와 방법을 알아보세요.
Phase II Detoxification
요약: 해독 단계
우리의 몸 은 효율적인 해독 메커니즘 덕분에 이러한 외부 화학 물질( 제노바이오틱스 )을 처리하고 제거합니다.
이러한 메커니즘은 과잉 호르몬( 엔도바이오틱스 ) 과 같은 대사 산물도 처리 합니다.
"해독 효소"는 외래 화학 물질과 대사 폐기물을 더 쉽게 배설하거나 약리학적으로 덜 활성화시켜 변화시키는 효소의 큰 계열입니다.
효소 접합은 I상 제품의 독성을 감소시킵니다.
단계 I 변환을 통해 지용성 독소는 보다 수용성인 형태로 전환됩니다.
그러나 I상 반응은 항상 독소를 충분히 수용성으로 만들기에 충분하지 않으며 많은 경우에 생성물을 더 반응성으로 만들어 독소를 잠재적으로 더 파괴적으로 만듭니다.
이것은 단계 II 효소가 시작되는 곳입니다.
II상 효소는 I상 제품의 용해도를 증가시키고 독성을 감소시킵니다.
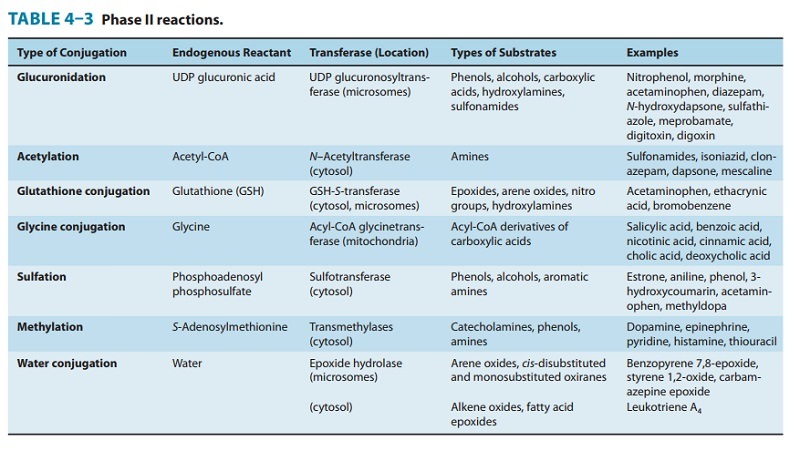
2상 효소 (Phase II Enzymes)
II상 효소는 접합 효소의 여러 슈퍼패밀리를 포함합니다.
가장 중요한 것은:
- UDP-glucuronosyltransferases (UGT)
- Glutathione S-transferases (GST)
- Sulfotransferases (SULT)
- N-acetyltransferases (NAT), and
- Methyltransferases (MT).
UDP-glucuronosyltransferases (UGT)
UDP-glucuronosyltransferases(UGTs)는 Phase II 변환의 가장 중요한 해독 경로 중 하나인 glucuronidation 반응을 담당합니다.
UGT 효소는 많은 생체이물(약물, 화학 발암 물질, 환경 오염 물질, 식이 물질)과 엔도바이오틱스( 빌리루빈 , 스테로이드 호르몬, 갑상선 호르몬 , 담즙산 , 지용성 비타민)의 대사를 담당합니다.
인간의 경우 모든 임상 약물의 약 40-70%가 UGT에 의해 대사됩니다.
모노아민 신경전달물질, 도파민 및 세로토닌도 UGT에 의해 처리됩니다.
UGT는 몸 전체, 장, 신장, 뇌, 췌장 및 태반에서 발견되지만 대부분은 간에서 발견됩니다.
뇌에서 UGT는 잠재적으로 유해한 물질의 침입에 대한 전반적인 보호에 적극적으로 참여합니다.
인간에는 18개의 기능성 UGT 효소가 있으며, UGT1과 UGT2의 두 유전자 패밀리에 속하며, UGT1A, UGT2A 및 UGT2B의 세 가지 하위 패밀리로 더 나뉩니다.
일부 연구에 따르면 UGT는 다음과 같은 독소를 처리하고 비활성화합니다.
- 벤조피렌을 포함한 암을 유발하는 다환 방향족 탄화수소(PAH), 담배 연기, 나무 연기 및 탄 음식에서 발견됨.
- 플라스틱에 사용되는 유비쿼터스 환경 독소인 비스페놀-A(BPA)는 제한된 연구에서 유방암을 비롯한 다양한 인간 질병과 관련이 있습니다.
- 담배 연기에서 발견되는 일부 니트로사민 .
- 붉은색 가공육에서 발견되는 Heterocyclic amines(HAC). 2-Amino-1-methyl-6-phenylimidazo(4,5-b)pyridine (PhIP)은 잘 익은 고기에서 가장 많이 발견되는 발암성 HA이며 UGT1A 단백질에 의해 광범위하게 글루쿠론화됩니다.
- 작물에서 발견되는 일부 곰팡이 독소.
- Aromatic amines.
UGT는 또한 신체에서 자연적으로 생성되는 에스트로겐 , T3 및 T4 와 같은 "사용된" 호르몬을 제거 합니다.
UGT1A1 은 빌리루빈 글루 쿠론산화를 일으키는 유일한 UGT입니다.
UGT2B7 은 오피오이드 의 글루쿠론산화를 담당하는 주요 효소입니다.
일부 추정치에 따르면 인구의 10% 이상이 유전적으로 UGT가 결핍되어 있습니다.
따라서 UGT는 화학적 발암성, 기형발생 및 신경변성에 대한 감수성의 중요한 결정 요인을 구성하는 것으로 가정되었습니다.
강화된 UGT 활성은 발암성 화합물의 보다 효율적인 해독으로 이어질 수 있습니다. 일부 과학자들은 이것이 위장 및 기타 암의 예방에 기여할 수 있다고 생각하지만 이는 인간에서 확인되지 않았습니다.
Glucuronidation(UGT)에 영향을 미치는 요인
- 진통제, 비스테로이드성 항염증제(NSAID), 항바이러스제, 항경련제, 항불안제/진정제는 약물 글루쿠론화를 억제할 수 있습니다..
- 또한 일부 약물(진통제, 항바이러스제, 항경련제)도 UGT 유도제로 작용할 수 있습니다.
- 십자화과 야채, 레스베라트롤 및 감귤류는 UGT 효소를 유도하는 것으로 보입니다. 그러나 효과는 성별 및 유전자 변이에 따라 다릅니다.
- 민들레, 루이보스 차, 허니부시 (honeybush )차, 로즈마리 , 대두, 엘라그산, 페룰산, 커큐민 및 astaxanthin 은 동물 연구에서 잠재적으로 UGT 활성을 향상시켰습니다[ 21 ].
- 토마토, 당근, 수박에서 발견되는 붉은 색소인 리코펜은 UGT 활성을 증가시킵니다.
Beta-glucuronidase
Beta-glucuronidase는 장내 세균 과 장 세포에서 생성되는 효소입니다 .
베타-글루쿠로니다제는 중화된 독소에서 글루쿠론산을 제거(분리)하여 UGT에 의해 촉매되는 반응을 역전시키고 독소를 이전 형태로 되돌립니다.
동물 실험 에 따르면 고지방식이는 베타-글루쿠로니다제 활성을 증가시킬 수 있습니다.
증가된 베타-글루쿠로니다제 활성은 제한된 연구에서 다양한 암, 특히 유방암, 전립선암 및 결장암과 같은 호르몬 의존성 암의 위험 증가와 관련이 있습니다. 더 많은 연구가 필요합니다.
특정 베리, 특히 딸기와 blackcurrant의 폴리페놀 추출물은 동물 연구에서 베타-글루쿠로니다제 활성을 억제합니다. 인적 데이터가 부족합니다.
많은 과일, 채소 및 콩류에서 발견되는 D-glucaric acid은 이 효소를 억제할 수 있지만 인간 연구에서는 이를 증명하지 못했습니다.
Glutathione S-transferases(GST)
글루타티온 S-트랜스퍼라제(GST)는 중요한 세포 항산화제인 글루타티온을 xenobiotics 화합물로 전달하는 것을 촉매합니다.
Xenobiotics를 처리하는 것 외에도 GST는 산화 스트레스로부터 보호하고 정상적인 대사 과정을 통해 발생하는 활성 산소 종(과산화수소 라디칼 및 과산화수소)에 대한 방어 역할을 합니다.
이들 중 다수는 CYP 및 기타 산화효소에 의해 촉매되는 단계 I 반응에 의해 형성됩니다.
이 효소는 또한 빌리루빈, 프로스타글란딘 , 글루코코르티코이드, 갑상선 및 스테로이드 호르몬의 결합 및 수송에 참여합니다.
GST는 몸 전체에 널리 분포되어 있으며 간, 신장, 뇌, 췌장, 고환, 심장, 폐, 소장, 골격근, 전립선 및 비장에서 발견될 수 있습니다.
많은 GST가 있으며 두 개의 별개의 슈퍼패밀리, 즉 막 결합 마이크로솜과 세포질 GST로 나뉩니다.
Microsomal GST는 류코트리엔 과 프로스타글란딘의 내인성 대사에 중요한 역할을 합니다.
인간 세포질 GST는 고도로 다형성이며 α, μ, ω, π 및 ζ(그리스 문자로 지정)의 6가지 클래스로 나눌 수 있습니다.
과학자들은 GST가 다음과 같은 독소를 처리하고 비활성화한다고 생각합니다 .
- α,β-unsaturated carbonyl, 그 중 다수는 독성, 돌연변이 유발성 및 발암성입니다.
- 담배 연기, 디젤 연료 및 구운 고기에서 발견되는 Polycyclic aromatic hydrocarbons(PAH).
동물의 수명 연장은 훨씬 더 높은 수준의 GST와 관련이 있지만 초파리에 대한 연구에서 장수와 관련된 결론을 도출할 수는 없습니다.
GST가 인간의 수명에 역할을 하는지 여부는 아직 알려지지 않았습니다.
GST에 영향을 미칠 수 있는 요소
- 합성 및 자연 발생 페놀, 퀴논, 도파민 또는 비타민 C 유도체는 GST를 억제합니다.
- 은행나무 추출물은 GSTP1을 유도하고 세포의 GST 활성을 증가시키는 것으로 밝혀졌습니다.
- 십자화과 야채 추출물(예: 브로콜리, 방울양배추, 양배추)과 자몽 추출물, 리모넨 (감귤류에서 발견)은 GST를 유발합니다.
- 부추속 채소 (Allium vegetable), 레스베라트롤, 어유, 검은콩, 자색 고구마 , 커큐민, 녹차, 루이보스 차, 허니부시 차, 엘라그산, 로즈마리, 버터 기름기 , 제니스테인도 GST를 유발합니다.
- GST는 또한 식물성 식품의 장내 미생물 발효 산물인 부티레이트 에 의해 유도됩니다.
- 인슐린 투여는 GST를 증가시키는 반면 글루카곤 은 GST 유전자 발현을 감소시킨다.
그러나 이러한 상호작용의 대부분은 동물이나 세포에 대한 연구일 뿐입니다.
더 많은 인적 데이터가 필요합니다.
GST 기능에 필수적인 글루타티온 생성을 증가시킬 수 있는 영양소에는 비타민 B6 , 마그네슘 , 셀레늄 , 커큐미노이드(강황에서 추출), 실리마린 ( 밀크 엉겅퀴 에서 추출 ), 엽산 , 알파 리포산 , 십자화과 야채 및 아티초크 가 있습니다.
Sulfotransferases(SULT)
설포트랜스퍼라제(SULT)는 설페이트를 엔도바이오틱스 또는 생체이물에 부착시키는 반응인 설폰화를 담당합니다.
SULT는 약물 및 화학물질과 같은 수많은 생체이물질의 생체 변형에 중요 하지만 스테로이드, 카테콜아민, 세로토닌, 요오도티로닌, 에이코사노이드, 일부 티로신 함유 펩타이드, 레티놀 , 6-히드록시멜라토닌, 아스코르브산염 및 비타민 D 와 같은 내인성 화합물의 대사에도 중요한 역할을 합니다 .
반면에 많은 화합물(전발암 물질)은 SULT에 의해 DNA 손상을 통해 화학적 발암 물질 및 돌연변이 유발 물질로 작용할 수 있는 반응성이 높은 중간체로 전환될 수 있습니다.
인간의 경우 SULT1, SULT2 및 SULT4의 세 가지 SULT 계열이 확인되었으며 최소 13개의 고유한 구성원을 포함합니다.
연구자들은 SULT가 다음과 같은 독소를 처리하고 비활성화한다고 제안합니다 .
- monocyclic phenols.
- naphtols.
- benzylic alcohols .
- aromatic amines.
- hydroxylamines (possible mutagens).
SULT는 또한 도파민 과 요오도티로닌을 처리하고 비활성화합니다.
SULT1A2에 의한 aromatic hydroxylamine의 Sulfonation는 히드록실아민의 sulfoconjugate가 화학적으로 반응성이고 돌연변이를 유발하므로 원래 화합물보다 더 독성이 강한 독성 반응의 한 예입니다.
SULT에 영향을 줄 수 있는 요인
- 자몽 주스, 오렌지 주스, 녹차, 홍차 및 우롱차는 SULT를 억제할 수 있습니다.
- 커큐민은 인간 간에서 SULT1A1의 강력한 억제제입니다.
- 케르세틴 은 SULT1A1을 억제합니다.
- 일부 비스테로이드성 소염제는 SULT1A1 및 SULT1E1을 억제할 수 있습니다.
- 와인 안토시아닌 및 플라보놀, 사과 및 포도 주스, 카테킨, 케르세틴, 커큐민, 레스베라트롤, 플라보노이드 (apigenin, chrysin, fisetin, galangin, kaempferol, quercetin, myricetin, naringenin, and naringin), certain phytoestrogens (daidzein, genistein) SULT를 억제하지만 인간 및 동물 연구에서 아직 입증되지 않았습니다.
- Retinoic acid은 SULT를 증가시킬 수 있습니다[ 3 ].
- 대두 제품에서 발견되는 천연 이소플라본인 제니스테인은 SULT1A1 및 SULT2A1 을 유도합니다.
인간에서 이러한 상호 작용의 범위와 관련성은 여전히 조사되지 않은 상태로 남아 있습니다.
N-acetyltransferases(NAT)
아릴아민 N-아세틸트랜스퍼라제(NAT)는 많은 아릴아민 및 히드라진 약물, 식단, 담배 연기 및 환경에 존재하는 발암 물질에 대한 주요 생체 변형 경로인 아세틸화를 담당합니다.
내인성 대사에서 NAT의 역할은 불분명하지만 엽산 대사와 관련이 있을 수 있습니다.
NAT는 다음과 같은 독소를 처리하고 비활성화하도록 제안되었습니다 .
- aromatic amine, 그 중 다수가 발암 물질입니다.
- 산업 및 약리학적 목적으로 사용되는 고독성 발포제인 hydrazine.
- isoniazid(항결핵제), hydralazine(항고혈압제) 및 sulphonamides(항균제)와 같은 약물.
NAT에 영향을 줄 수 있는 요소
- Caffeic acid, esculetin, quercetin, kaempferol 및 genistein은 NAT1을 억제합니다.
- Scopoletin과 coumarin은 NAT2를 억제합니다.
- 마늘의 주성분인 Diallyl sulfide (DAS) and diallyl disulfide (DADS)은 NAT 활성을 억제한다.
- 안드로겐은 NAT1을 유도합니다.
NAT1 및 인간의 건강에 대한 이러한 요인의 영향은 아직 알려지지 않았습니다.
Methyltransferases TPMT and COMT
다양한 메틸트랜스퍼라제가 있습니다. TPMT 와 COMT 는 해독에 관여하는 두 가지 중요한 메틸트랜스퍼라제입니다.
TPMT
티오퓨린 S-메틸트랜스퍼라제(Thiopurine S-methyltransferase=TPMT)는 항암제 및 면역억제제 티오퓨린(급성 림프모구성 백혈병, 자가면역 질환, 염증성 장 질환 및 장기 이식 환자를 치료하는 데 사용되는 약물)을 포함한 방향족 헤테로고리 설프히드릴 화합물 (heterocyclic sulfhydryl compound)의 메틸화를 촉매합니다.
TPMT의 손상된 활성은 thiopurine nucleotides 의 축적을 유발 하여 세포 독성과 혈액 세포 생산 실패(조혈)를 유발할 수 있습니다.
TPMT 수치는 간과 신장에서 가장 높고 뇌와 폐에서 상대적으로 낮습니다.
이 효소에 대한 내인성 기질은 알려져 있지 않으며 생물학적 역할은 아직 밝혀지지 않았습니다.
COMT
Catechol-O-methyltransferase( COMT )는 카테콜아민 전달물질( 노르에피네프린 , 에피네프린, 도파민) 의 메틸화 를 담당합니다 .
COMT는 인지, 심혈관 기능 및 통증 처리 와 같은 카테콜 의존 기능의 조절에 중요한 역할을 합니다 .
COMT는 또한 고혈압, 천식 및 파킨슨병 치료에 사용되는 카테콜 구조의 약물을 처리합니다.
TPMT 및 COMT에 영향을 줄 수 있는 요인
- TPMT 활동은 여성보다 남성에서 더 높습니다.
- Naproxen, mefenamic and tolfenamic acid, Olsalazine, 5-aminosalicylic acid and sulphasalazine 은 TPMT를 억제할 수 있습니다.
- 케토프로펜과 이부프로펜은 TPMT의 약한 억제제이다.
- 녹차에서 발견되는 플라보노이드 케르세틴은 COMT를 억제할 수 있습니다.
- 높은 자당 (sucrose)식단은 COMT를 억제할 수 있습니다.
이러한 영양소 보조인자와 메틸 공여체는 메티오닌 , 비타민 B12 , 비타민 B6, 베타인, 엽산 및 마그네슘과 같은 메틸화 과정 을 지원합니다.
인적 데이터가 많이 부족합니다.
Amino acid conjugating enzymes (아미노산 접합 효소)
아미노산 접합은 제한된 수의 생체 외 카르복실산에 대한 해독 경로입니다.
여기에는 Acyl-CoA 합성효소와 Acyl-CoA 아미노산 N - acyltransferase의 두 그룹의 효소가 포함됩니다.
그들의 해독 역할에 대해서는 아직 많이 알려져 있지 않습니다.
Glycine conjugation은 일반적으로 사용되는 방부제인 benzoate의 축적을 방지합니다.
2상/1상 활동 비율이 중요한 이유
1단계 해독은 독성 대사산물을 생성할 수 있습니다.
II상 효소가 잘 작동하는 경우에는 독성 I상 생성물이 형성될 때 이를 효율적으로 중화하기 때문에 문제가 되지 않습니다.
그러나 연구에 따르면 1상과 2상 활성 사이의 균형이 일부 경우에 분리될 수 있으며, 이는 적시에 해독될 수 없는 독성 대사산물의 생산으로 이어져 잠재적으로 세포 및 DNA 손상을 일으킬 수 있습니다.
2상 대사보다 1상을 증가시킬 수 있는 요인
이러한 해로운 요인은 다음과 같습니다.
- 흡연 - 담배 연기로 인한 PAH.
- 숯불에 구운 고기의 아릴 아민.
- 알코올 소비.
글루코코르티코이드 및 항경련제 또한 2상 효소에 비해 1상을 증가시킬 수 있지만 이러한 약물은 합당한 의학적 징후(염증성 질환 및 간질과 같은)를 가지고 있습니다.
Nrf2를 활성화하여 2상 활성을 증가시킬 수 있는 요인
Nrf2를 활성화할 수 있는 요인은 가설적으로 2상 활동을 증가시킬 수도 있습니다.
그러나 이는 대체로 이론적인 것이며 이 접근 방식을 뒷받침할 인적 데이터가 부족하다는 점을 염두에 두십시오.
Nrf2 (Nuclear factor erythroid 2 related factor 2)는 Phase II 효소의 주요 조절 인자입니다.
Nrf2는 산화 스트레스에 의해 활성화됩니다.
여러 암 예방제, GSH 고갈제, 친전자체 및 중금속 도 Nrf2의 발현을 유도하는 것으로 알려져 있습니다.
Nrf2 활성화제는 산화 스트레스와 관련된 광범위한 인간 질병을 제어하거나 예방할 수 있습니다.
항산화 활성이 있는 많은 식물 유래 화합물이 Nrf2 및 후속 2상 해독을 통해 유익한 효과를 달성하는 것으로 가정되었습니다.
- Isothiocyanates, such as sulforaphane found in broccoli , and 6-methylsulfinylhexyl isothiocyanate (6-HITC) found in Japanese horseradish.
- Resveratrol, found in peanuts, grapes, and red wines.
- Ellagic acid found in blackberries, cranberries, pecans, pomegranates, raspberries, strawberries, walnuts, wolfberries, and grapes .
- Curcumin found in turmeric.
- CAPE, caffeic acid phenethyl ester; from honeybee hives(벌통) .
- Epigallocatechin gallate, from green tea.
- Allyl sulfides found in garlic.
- Xanthohumol, a compound found in hops .
- Cinnamaldehyde found in cinnamon .
- Hydroxytyrosol from olives.
- Capsaicin, found in chili peppers.
- Apple polyphenols .
일부 과학자들은 2상 활동의 향상이 과일과 채소의 건강 증진 효과와 암 예방 특성을 적어도 부분적으로 설명할 수 있다고 생각합니다.
그러나 그들의 주장을 뒷받침하기 위해서는 인간 연구가 필요합니다.
이 보충제는 또한 동물과 세포에서 Nrf2 활성을 증가시키는 것으로 제안되었습니다.
- 알파 토코페롤( 비타민 E ).
- Chlorophyllin.
- 알파리포산.
- 유기황 암 예방 화합물인 Oltipraz와 같은 Dithiolethiones], 그리고 Chalcone[ 55 ] 와 같은 플라보노이드 .
인적 데이터가 부족합니다.
의 해독 균형을 회복하는 데 도움이 되는 영양소를 알아보려면 계속 읽으십시오.
Phase III Detoxification
트랜스포터는 세포에서 독소를 제거합니다
ABC 트랜스포터
해독의 3단계는 세포에서 독소와 대사 산물을 제거하는 역할을 합니다.
III상 수송체는 간, 장, 신장 및 뇌에서 발견될 수 있으며, 여기에서 약물 진입에 대한 장벽 역할을 하고 엔도바이오틱 및 제노바이오틱 흡수, 분포 및 배설을 관리합니다.
이러한 수송체를 ABC 수송체(ATP-binding 카세트 수송체)라고 하며, 세포막을 가로질러 광범위한 화합물을 수송하기 위해 ATP가 필요합니다.
이러한 수송체 중 일부는 다중 약물 내성에 관여하기 때문에 다중 약물 내성 단백질(MRP)이라고도 합니다.
담즙 분비
공식적으로는 3단계 해독 과정의 일부는 아니지만 담즙 분비 는 빌리루빈, 지질 박테리아 생성물질( 내독소 ) 및 여러 염증 매개체와 같은 독성 엔도바이오틱 및 생체이물질을 제거하는 데 필요합니다 .
이러한 제품은 내장을 통해 제거됩니다.
담즙 흐름이 손상되면 간 독소가 축적되고 간 손상이 발생할 수 있습니다.
담즙 흐름을 개선할 수 있는 식이 요인
Yarrow( Achillea millefolium ) 및 아티초크는 잠재적으로 cumin, ajowan, garlic and ginger 과 같이 담즙의 흐름을 자극할 수 있습니다.
중금속 해독
주거 또는 직업적 노출로 인해 인체 건강에 우려되는 23가지 중금속이 있습니다:
안티몬, 비소, 비스무트, 카드뮴, 세륨, 크롬 , 코발트, 구리 , 갈륨, 금, 철, 납, 망간 , 수은, 니켈, 백금, 은 , 텔루륨, 탈륨, 주석, 우라늄, 바나듐 및 아연 .
철, 구리, 아연 과 같은 금속은 소량으로 건강을 유지하는 데 필요하지만 다량으로 섭취하면 독성이 있고 위험해질 수 있습니다.
중금속 독성은 에너지 수준을 낮추고 뇌, 폐, 신장 및 간 기능을 손상시킬 수 있습니다.
제안된 손상 메커니즘
중금속 중독은 활성산소( ROS ) 생성을 증가시킬 수 있습니다.
향상된 ROS 생성은 세포의 고유한 항산화 방어를 압도하고 산화 스트레스를 유발할 수 있습니다.
산화 스트레스를 받는 세포는 지질, 단백질 및 DNA에 대한 ROS에 의한 병변으로 인해 다양한 기능 장애를 나타냅니다.
과학자들은 과량의 중금속이 글루타티온을 더욱 비활성화하여 항산화 활성을 억제할 수 있다고 생각합니다.
신체의 천연 킬레이터
우리 몸에서 금속을 결합하는 천연 킬레이터에는 metallothionein 과 글루타티온이 있습니다.
metallothionein
메탈로티오네인(MT)은 시스테인 이 풍부한 작은 금속 결합 단백질입니다.
MT는 아연 및 구리와 같은 필수 금속의 생리학적 균형(항상성)을 관리 하고 카드뮴 및 납과 같은 다른 독성 금속을 결합하고 산화 스트레스에서 생성된 자유 라디칼을 소거하여 이들로부터 보호합니다.
메탈로티오네인 분자 1개는 2가 금속(아연, 카드뮴)의 7개 원자 또는 1가 금속(예: 은)의 더 많은 수(12개 원자)에 결합할 수 있습니다[.
메탈로티오네인에 영향을 미치는 요인:
- 과민성 장 질환( IBD )과 같은 상태는 메탈로티오네인을 감소시킵니다.
- 아연 보충은 메탈로티오네인 농도를 회복시킬 수 있습니다.
- 크롬 은 아연 유도 메탈로티오네인 발현을 억제할 수 있습니다.
- 홉, 석류, 자두 껍질, 물냉이는 메탈로티오네인을 증가시킬 수 있습니다. 십자화과 야채, 케르세틴 및 히말라야 지역 고유의 버섯인 동충하초( Cordyceps sinensis )의 설포라판도 마찬가지입니다.
OTC 킬레이트화제 조심
FDA는 위험할 수 있는 처방전 없이 살 수 있는 킬레이트제를 사용하지 말라고 소비자에게 분명히 권고합니다.
중금속 중독 진단을 받은 사람들에서 킬레이트화의 목표는 중금속을 결합시켜 금속이 몸 밖으로 배출되도록 하는 것입니다.
식품
일부 식품은 독성 금속의 흡수 또는 재흡수를 줄이고 자연적인 해독 경로를 지원하도록 제안되었습니다.
- 곡물뿐만 아니라 과일의 겨를 포함한 식이 불용성 섬유 는 뇌와 혈액의 수은 수치를 감소시켰습니다. 그러나 아마씨(flaxseed) 와 같은 가용성 섬유는 카드뮴의 장 흡수를 증가시켰습니다.
- 납과 수은을 줄이기 위해 조류 다당류인 alginate and chlorella 가 연구되었습니다.
- 쥐에서 5%와 10%의 클로렐라 로 구성된 식단 은 글루타티온 수치에 영향을 미치지 않으면서 소변과 대변의 수은 배설을 증가시켰고 뇌와 신장의 수은 수치를 감소시켰습니다. 이 사용에 대한 인간 연구는 부족합니다.
- 부추속(양파과) 및 십자화과 채소 -alliums (onion family) and brassicas (cruciferous veggies)-와 같은 황 함유 식품이 풍부한 식단 은 글루타티온을 증가시키고 이론적으로는 중금속 해독을 증가시킬 수 있습니다.
- 마늘 은 카드뮴으로 인한 신장 손상을 예방하고 쥐의 납으로 인한 산화 손상을 줄입니다[.
인적 데이터가 부족합니다.
인기 있는 요리 및 약초인 고수=Cilantro(Coriandrum sativum의 잎)는 치과용 아말감 제거 후 수은 배설을 향상시키는 것으로 제안 됩니다 .
동물의 경우 뼈로의 납 흡수를 감소시킵니다
그러나 납에 노출된 부모가 있는 3~7세 어린이 32명을 대상으로 한 연구(RCT)에서 Cilantro 추출물을 14일 동안 투여한 결과 위약군에 비해 혈중 납 농도 또는 소변 배출이 감소하지 않는 것으로 나타났습니다.
실란트로는 다른 유형의 중금속 중독에 대해 테스트되지 않았습니다.
식품에 일반적으로 사용되는 양은 안전하지만 건강에 미치는 영향을 평가할 데이터가 충분하지 않습니다.
추가 임상 시험이 필요합니다.
보충제
보충제는 일반적으로 확실한 임상 연구가 부족합니다.
따라서 중금속 중독 환자에게 아래 나열된 보충제의 사용을 뒷받침하는 임상 증거는 없습니다.
다음은 추가 조사 노력을 안내해야 하는 기존 연구의 요약입니다.
그러나 아래 나열된 연구는 건강상의 이점을 뒷받침하는 것으로 해석되어서는 안됩니다.
또한 보충제는 약물과 상호 작용할 수 있습니다.
보충하기 전에 의사와 상담하십시오.
- 황 함유 아미노산인 Taurine and methionine 은 중금속 노출로 인한 산화 스트레스 마커를 감소시키는 것으로 가정되었습니다.
- 알파리포산 은 금속 킬레이트 활성을 가질 수 있습니다. 그러나 임상 경험에 따르면 금속이 재분배될 위험이 있으므로 주의해서 사용해야 합니다. 임상 시험이 부족합니다.
- 시스테인의 경구용 전구체인 N-아세틸-시스테인 (NAC)은 일부 사람들이 독성 요소의 킬레이터로 간주합니다. 또한 특히 비타민 C와 E가 있을 때 글루타티온 합성을 자극할 수 있습니다.
- 제한된 연구에 따르면 셀레늄은 수은과 함께 안정하고 불용성인 화합물을 형성하여 잠재적으로 수은 중독 증상을 완화할 수 있다고 합니다. 유기농 셀레늄 보충제는 셀레늄 효모 제품이 수은 배설을 증가시키고 산화 스트레스를 감소시킨 103명의 수은에 노출된 마을 사람들을 대상으로 한 대조 실험에서 유익했습니다. 더 많은 연구가 필요합니다
- 마그네슘과 아연 보충은 카드뮴의 흡수를 둔화시키기 위해 제안되었습니다.
- 칼슘 보충은 임신과 수유 중 산모의 뼈에서 납 이동을 감소시켜 신생아와 유아를 보호합니다. 동물에서 칼슘 결핍은 납과 카드뮴의 흡수를 향상시킵니다.
- 어린이의 경우 철분 보충이 납 축적을 둔화시켰습니다.
여기에서 알려진 다른 해독 보조제에 대해 읽어보십시오 .
해독에 필수적인 비타민, 미네랄 및 영양소
해독 반응이 원활하게 진행되기 위해서는 신체에 충분한 영양소가 있어야 합니다.
반응 자체나 해독 효소 생성에 많은 비타민과 미네랄이 필요하기 때문입니다.
연구원들은 비타민이 1 단계 해독 의 독성 생성물 제거에도 도움이 된다고 생각합니다.
미네랄과 비타민
필수 해독 비타민과 미네랄에는 비타민 A, B2 , B3, B5, B6, 엽산(B9), B12 , C 및 E, 철, 칼슘 , 구리, 아연, 마그네슘 및 셀레늄이 포함됩니다.
제한된 연구에 따르면 아연 , 칼슘 , 철 , 마그네슘 과 같은 영양소 도 독성 중금속의 흡수를 감소시킬 수 있습니다. 일부 연구에 따르면 고갈되면 장에서 독성 금속 흡수가 증가합니다.
"디톡스 식품" 요약
대부분은 일반적인 건강과 웰빙에 좋지만 해독에 미치는 영향에 대한 임상 데이터는 크게 부족합니다.
다음은 이러한 음식을 요약한 것입니다.
- Apiaceous vegetables (carrots, parsnips, celery, parsley)
- Apples
- Artichoke
- Berries (raspberries, blueberries)
- Black tea
- Black pepper
- Broccoli and other cruciferous vegetables (arugula, bok choy, Brussel sprouts, cabbage, kale)
- Caffeic acid (found in plants, with especially high levels in thyme, sage, spearmint Ceylon cinnamon, star anise, and yerba mate)
- Celery
- Chili peppers
- Cilantro
- Cinnamon
- Citruses
- Curcumin/Turmeric
- Dandelion
- Ellagic acid (found in blackberries, cranberries, pecans, pomegranates, raspberries, strawberries, walnuts, wolfberries, and grapes)
- Fish oil
- Garden cress
- Garlic
- Ghee
- Ginger
- Ginkgo
- Goldenseal
- Grapefruit
- Green tea
- Honeybush tea
- Kale
- Licorice
- Lycopene
- Olives and olive oil
- Pomegranate
- Propolis
- Purple sweet potato
- Quercetin (found in many plants, high in red kidney beans and capers)
- Resveratrol (found in peanuts, grapes, and red wines)
- Rooibos tea
- Rosemary
- Soybean/Black soybean
- Starfruit
- Watercress
- Yarrow
프로바이오틱스
일부 연구자들은 독소를 결합하여 독성을 감소시킬 수도 있다고 생각하지만 임상 시험은 수행되지 않았습니다.
동물에서 프로바이오틱스는 중금속을 결합하여 흡수를 방해하는 것으로 보입니다.
카드뮴, 납 및 구리 독성 을 예방하고 알루미늄 독성 을 잠재적으로 돕기 위해 제안되었습니다 .
또한 일부 과학자들은 프로바이오틱스가 유기인계 살충제의 흡수와 독성을 감소시킬 수 있다고 가정합니다.
동물에서는 튀긴 붉은 고기에 가장 풍부한 돌연변이 유발 인자인 헤테로고리 방향족 아민(HAC)에 결합하여 비활성화하는 것으로 보입니다.
시험관에서 프로바이오틱스는 곰팡이에 의해 생성되고 작물에서 발견되는 아플라톡신의 수준을 감소시킵니다.
또한, 프로바이오틱스는 2상 GST 효소를 유도할 수 있는 부티레이트를 생성합니다.
칼로리 제한 및 간헐적 단식
해독을 위한 칼로리 제한이나 간헐적 단식을 지지하는 임상 증거는 없습니다.
그러나 이러한 식이 수정은 대사 문제나 비만이 있는 일부 사람들에게 권장될 수 있습니다.
단식을 하기로 결정했다면 과일과 채소를 충분히 섭취하십시오.
또한 일부 사람들에게는 단식이 선택 사항이 아닙니다(예: 음식과 함께 약을 복용해야 하거나 특정 질병이 있는 경우).
금식이 유익한 이유는 무엇입니까?
한 이론에 따르면 대부분이 지용성이기 때문에 다양한 대사성, 미생물 군 유래 및 환경 독소가 지방 조직에 축적됩니다.
그런 식으로 이러한 독소는 일시적으로 해독 효소를 빠져 나옵니다.
결과적으로 지방 조직의 높은 수준의 독소는 독소로부터 다른 기관을 보호하기 위해 지방의 전환을 감소시킬 수 있습니다.
이것은 지방 조직에 축적된 독소가 체중 감량 을 더 어렵게 만들 수 있음을 의미합니다 .
지방(지방) 조직의 잔류성 유기 오염 물질(POPs) 함량은 마른 사람에 비해 비만인 사람이 2-3배 더 높은 것으로 보고되었습니다.
칼로리 제한의 효과, 연간 20-40%의 일일 섭취량 감소 또는 간헐적 단식 은 건강에 유익한 몇 가지 효과를 보여주었습니다.
Nrf2를 유도하기 위해 영양실조 없이 칼로리 섭취를 줄이는 것이 제안되었습니다.
그러나 인적 데이터가 부족합니다.
발한과 사우나는 어떻습니까?
전 세계적으로 열 및/또는 운동 으로 땀을 흘리는 것은 오랫동안 "세정"과 관련이 있습니다.
발한은 신체에서 독성 요소를 제거하는 데 도움이 된다고 제안되었지만 이 접근 방식을 뒷받침하는 증거는 부족합니다.
적당한 운동은 대부분의 사람들에게 좋습니다.
사우나는 아마도 평균적인 건강한 사람에게도 좋을 것입니다. 전반적인 건강을 지원합니다.
그러나 대중적인 주장에도 불구하고 열, 적외선 및 모든 유형의 사우나는 "독소를 배출하는" 데 도움이 되지 않습니다.
예를 들어, 연구자들은 사우나 사용이 피부 전체의 순환을 증가시키고 발한을 유도하여 피부로의 혈류가 5-10%에서 증가하고 안정 시 심장을 통해 펌프되는 혈액의 양이 60-70%로 증가한다고 믿습니다.
제한된 연구에 따르면 땀을 흘리면 아연, 구리 및 망간 과 같은 일부 미네랄 이 피부를 통해 배설됩니다.
그러나 운동 이나 사우나 사용 또는 기타 수단으로 인해 발생하는 발한이 중금속 제거를 증가시키거나 중금속 중독이 있는 사람들에게 도움이 되는 것으로 밝혀진 적이 없습니다 .
이것은 신화입니다
*******************************************************************
https://basicmedicalkey.com/drug-metabolism-2/
Drug Metabolism
Chapter 4 Drug metabolism 4.1 Overview In the last chapter, we have considered renal elimination of drugs. While some drugs are eliminated via the kidneys unchanged, most of them undergo metabolic …
basicmedicalkey.com
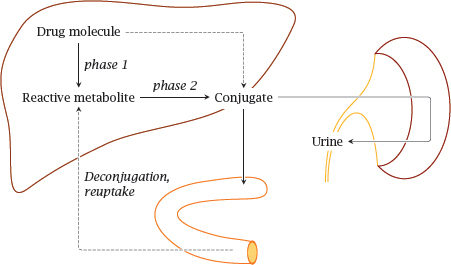
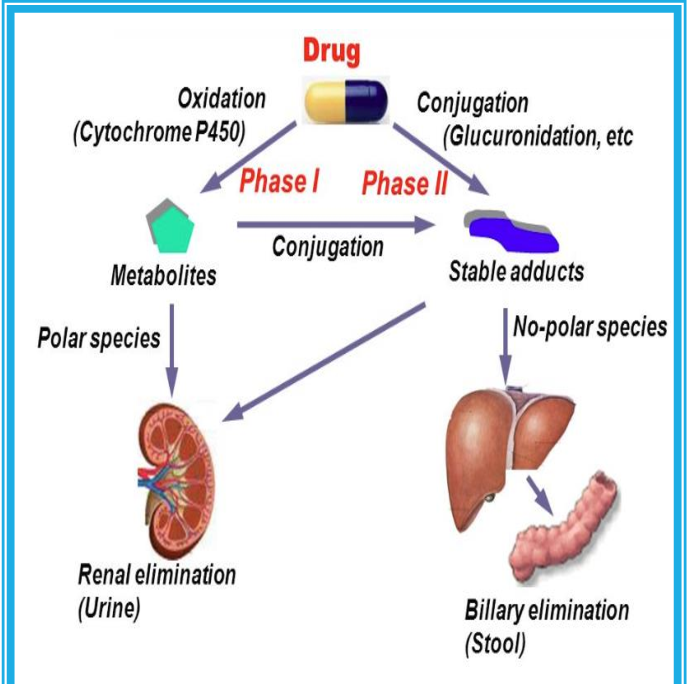
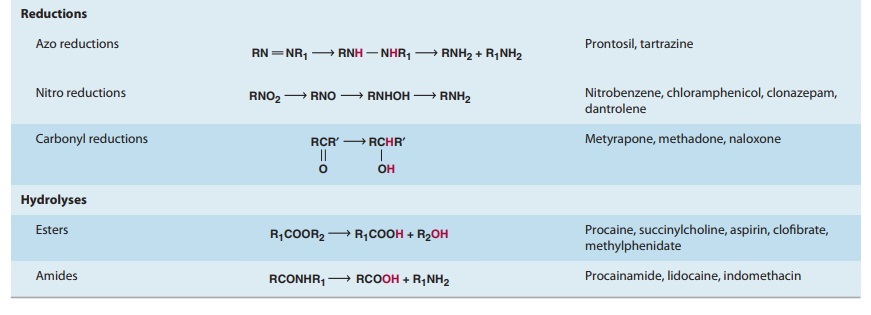
많은 약물에서 시토크롬 P450 또는 기타 I상 반응에 의한 하이드록실화는 글루쿠론산, 글루타티온 또는 기타 작용기와의 접합에 선행합니다.
이러한 접합을 집합적으로 II상 반응이라고 합니다. 결합 약물의 배설은 때때로 약물 제거의 III상이라고도 합니다.
*********************************************************************
Factors Affecting Drug Metabolism Including Stereo Chemical Aspects
A blog about pharmaceutical quality control, quality assurance, microbiology, production and regulatory updates provided by regulatory agencies.
www.pharmaguideline.com
Factors Affecting Drug Metabolism Including Stereo Chemical Aspects
간은 약물 대사의 주요 부위입니다.
추가 부위에는 신장, 장, 폐 및 혈장이 포함됩니다.
약물의 신진대사는 다음과 같은 결과를 초래할 수 있습니다.
비활성화: 대부분의 약물은 신진대사의 결과로 비활성화됩니다. 예를 들어, 이부프로펜과 파라세타몰.
약물의 활성 대사 산물: 예를 들어 코데인과 모르핀 또는 프리미돈과 페노바르비톤.
비활성 약물 활성화: 예를 들어, 레보도파 및 도파민, 또는 프레드니손 및 프레드니솔론.
Metabolic Enzymes
대사 효소 약물은 일반적으로 두 가지 유형으로 분류될 수 있는 다양한 효소에 의해 소화되어야 합니다.
Microsomal Enzymes - 이 효소는 매끄러운 소포체의 간, 신장, 폐 및 장 점막에서 발견됩니다.
시토크롬 p450, 모노옥시게나제, 글루쿠로닐 트랜스퍼라제 및 기타 효소가 그 예입니다.
산화, 환원, 가수분해 및 글루쿠론산화 과정을 촉매합니다.
Non-Microsomal Enzymes - 이 효소는 혈장뿐만 아니라 간 세포의 세포질과 미토콘드리아에서 발견될 수 있습니다.
플라보단백질 산화효소, 아미다제, 에스테라제, 접합효소가 몇 가지 예입니다.
모든 접합, 여러 가수분해 과정, 특정 산화 및 환원 반응이 이 효소에 의해 촉매됩니다.
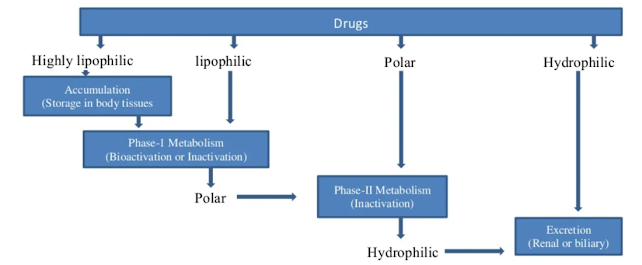
신진대사의 메커니즘
*******************************************************
https://doctorlib.info/pharmacology/basic-clinical-pharmacology-13/4.html
Drug Biotransformation - Basic and Clinical Pharmacology, 13th Ed.
Basic and Clinical Pharmacology, 13th Ed. Drug Biotransformation Maria Almira Correia, PhD CASE STUDY A 40-year-old woman presents herself to the emergency department of her local hospital somewhat disoriented, complaining of midsternal chest pain, abdomin
doctorlib.info
Basic and Clinical Pharmacology, 13th Ed.
Drug Biotransformation
약물의 생물학적 전환이 필요한 이유는 무엇입니까?
신장 배설은 일부 약물, 특히 생리학적 pH에서 완전히 이온화되는 작용기와 같이 분자 부피가 작거나 극성 특성을 갖는 약물의 생물학적 활성을 종결시키는 데 중추적인 역할을 합니다.
그러나 많은 약물에는 이러한 물리화학적 특성이 없습니다.
약리학적으로 활성인 유기 분자는 친유성인 경향이 있으며 생리학적 pH에서 결합되거나 부분적으로만 이온화된 상태로 유지됩니다.
이들은 네프론의 사구체 여과액에서 쉽게 재흡수됩니다.
특정 친유성 화합물은 종종 혈장 단백질에 강하게 결합되어 사구체에서 쉽게 여과되지 않을 수 있습니다.
결과적으로, 대부분의 약물은 작용 종료가 신장 배설에만 의존하는 경우 작용 기간이 연장됩니다.
생물학적 활성의 종료 또는 변경으로 이어질 수 있는 대체 과정은 대사입니다.
일반적으로 친유성 생체이물은 더 극성을 띠고 따라서 더 쉽게 배설되는 산물로 변형됩니다.
지용성 약물의 비활성화에서 대사가 하는 역할은 매우 극적일 수 있습니다.
예를 들어, thiopental 및 pentobarbital과 같은 친유성 바르비투르산염은 대사가 더 많은 수용성 화합물로 전환되지 않는 경우 극도로 긴 반감기를 가질 것입니다.
대사 산물은 종종 모약물보다 약력학적으로 덜 활성이며 심지어 비활성일 수도 있습니다.
그러나 일부 생체 변형 제품은 활성이나 독성 이 강화되었습니다 .
스테로이드 호르몬, 콜레스테롤, 활성 비타민 D 동족체 및 담즙산과 같은 내인성 기질의 합성은 생체이물 대사와 관련된 효소에 의해 촉매되는 많은 경로를 포함한다는 점은 주목할 만합니다.
마지막으로, 약물 대사 효소는 체내에서 활성 분자로 전환되는 약리학적으로 비활성인 전구약물의 설계에 활용되었습니다.
약물 처리에서 생물학적 전환의 역할
대부분의 대사성 생체 변형은 약물이 순환계로 흡수되는 것과 신장에서 제거되는 사이의 어느 지점에서 발생합니다.
장관 내강 또는 장벽에서 몇 가지 변형이 발생합니다.
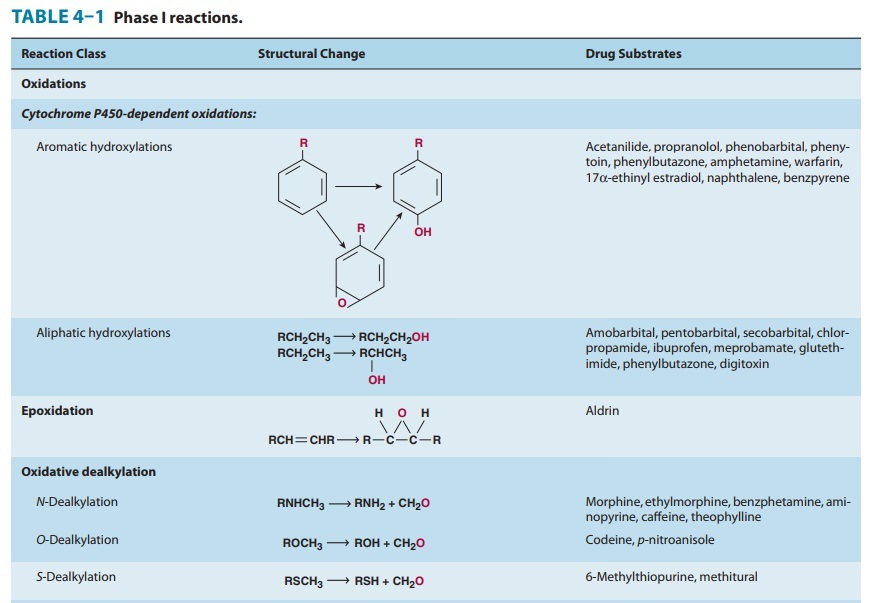
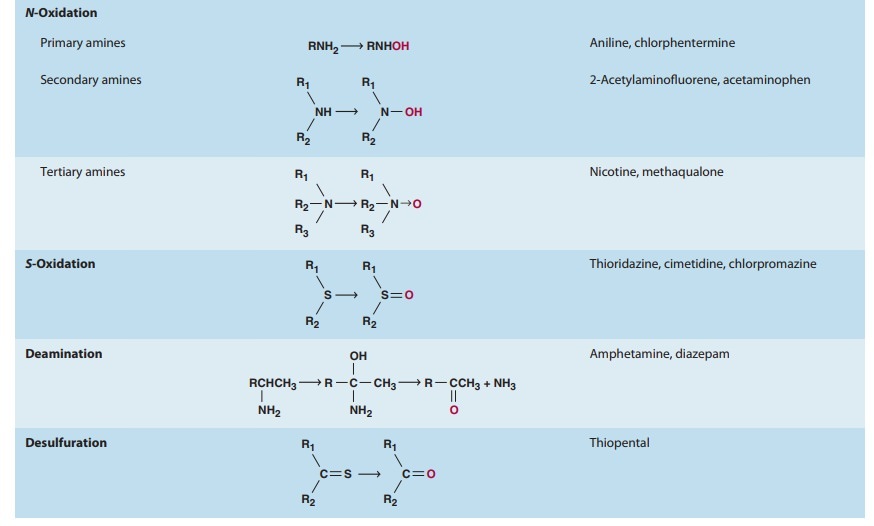
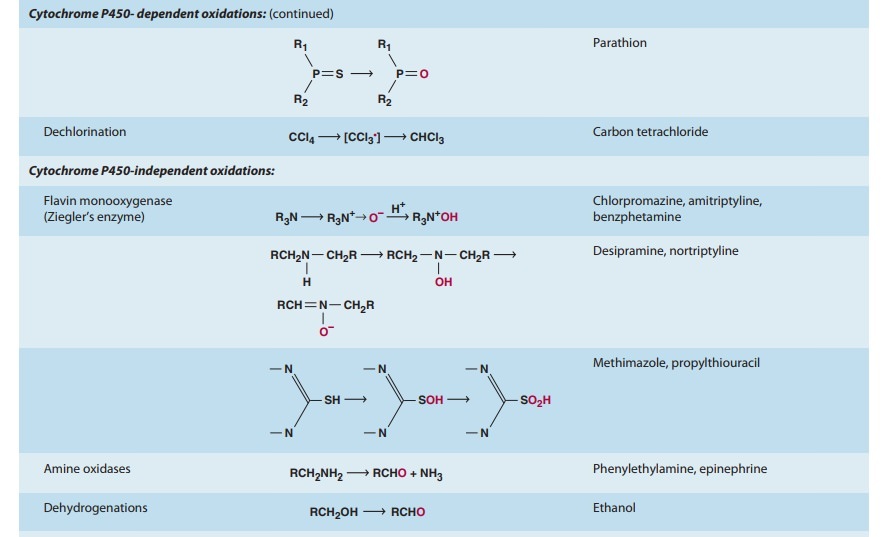
일반적으로 이러한 모든 반응은 I 상 및 II상 반응 이라는 두 가지 주요 범주 중 하나로 지정할 수 있습니다 ( 그림 4–1 ).
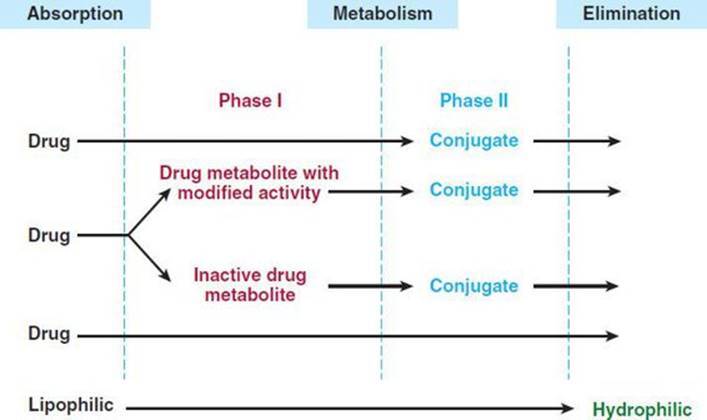
그림 4–1 약물 생물학적 처리에서 I상 및 II상 반응 및 직접 제거.
II상 반응은 I상 반응보다 선행할 수도 있습니다.
I상 반응은 일반적으로 작용기(-OH, -NH 2 , -SH)를 도입하거나 차폐 해제하여 모 약물을 보다 극성인 대사물로 전환합니다.
종종 이러한 대사 산물은 비활성 상태이지만 어떤 경우에는 활동이 수정되거나 향상되기만 합니다.
I상 대사산물이 충분히 극성이면 쉽게 배설될 수 있습니다.
그러나 많은 상 I 생성물이 빠르게 제거되지 않고 글루쿠론산, 황산, 아세트산 또는 아미노산과 같은 내인성 기질이 새로 도입된 작용기와 결합하여 극성이 높은 접합체를 형성하는 후속 반응을 겪습니다.
이러한 접합 또는 합성 반응은 2상 대사의 특징입니다.
매우 다양한 약물이 이러한 순차적인 생체변환 반응을 겪지만 일부 경우에는 모 약물이 접합체를 직접 형성할 수 있는 작용기를 이미 가지고 있을 수 있습니다.
예를 들어, isoniazid의 hydrazide 일부분은 II상 반응에서 N-acetyl conjugate 를 형성하는 것으로 알려져 있습니다.
이 접합체는 I상 반응, 즉 이소니코틴산으로의 가수분해를 위한 기질이 됩니다( 그림 4–2 ).
따라서 2단계 반응은 실제로 1단계 반응에 선행할 수 있습니다.
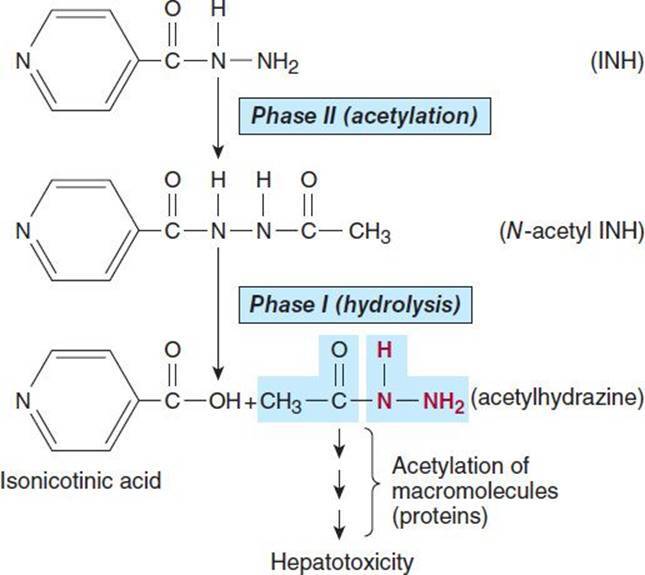
그림 4–2 간독성 대사산물에 대한 isoniazid(INH)의 II상 활성화.
약물의 생물학적 변형은 어디에서 발생합니까?
모든 조직은 약물을 대사하는 능력이 있지만 간은 약물 대사의 주요 기관입니다.
상당한 활동을 나타내는 다른 조직에는 위장관, 폐, 피부, 신장 및 뇌가 있습니다.
경구 투여 후 많은 약물(예: 이소프로테레놀, 메페리딘, 펜타조신, 모르핀)이 소장에서 그대로 흡수되고 먼저 문맥계를 통해 간으로 운반되어 광범위한 대사를 겪습니다.
이 과정을 1차 통과 효과 라고 합니다( first-pass effect).
일부 경구 투여 약물(예: 클로나제팜, 클로르프로마진, 사이클로스포린)은 간보다 장에서 더 광범위하게 대사되는 반면, 다른 약물(예: 미다졸람)은 상당한(~50%) 장 대사를 겪습니다.
따라서 장 대사는 전반적인 초회 통과 효과에 기여할 수 있으며 간 기능이 손상된 개인은 약물 제거를 위해 이러한 장 대사에 점점 더 의존할 수 있습니다.
특정 약물(예: 펠로디핀, 사이클로스포린 A)의 장 대사 장애는 혈장 수준의 상당한 상승 및 임상적으로 관련된 약물-약물 상호작용( DDI )을 초래할 수도 있습니다.,
초회통과 효과는 경구 투여된 약물(예: 리도카인)의 생체이용률을 크게 제한할 수 있으므로 치료적으로 효과적인 혈액 수준을 달성하기 위해 대체 투여 경로를 사용해야 합니다.
또한, 하부 장에는 많은 생체 변형 반응을 할 수 있는 장내 미생물이 있습니다.
또한, 약물은 위산(예: 페니실린), 소화 효소(예: 인슐린과 같은 폴리펩티드) 또는 장의 벽 효소(예: 교감신경흥분 카테콜아민)에 의해 대사될 수 있습니다.
생체 내 약물 생체 변형은 자발적인 비촉매 화학 반응에 의해 발생할 수 있지만 대부분의 변형은 특정 세포 효소에 의해 촉매됩니다.
세포 내 수준에서 이러한 효소는 소포체, 미토콘드리아, 세포질, 리소좀 또는 심지어 핵 외피 또는 원형질막에 위치할 수 있습니다.
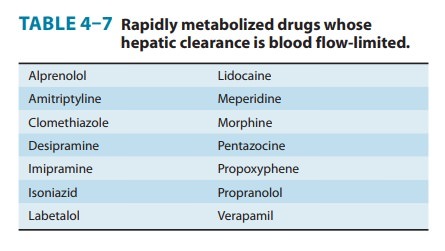
***************************************************************************
Difference Between Phase I and Phase II Metabolism | Compare the Difference Between Similar Terms
The key difference between phase I and phase II metabolism is that the phase I metabolism converts a parent drug to polar active metabolites while phase II
www.differencebetween.com
Difference Between Phase I and Phase II Metabolism
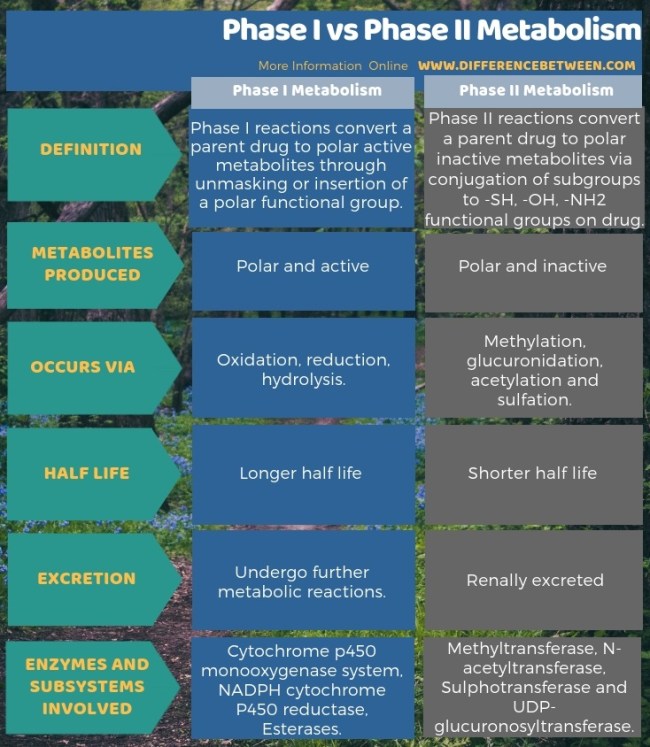
1 상 대사와 2상 대사 의 주요 차이점 은 1상 대사는 모 약물을 극성 활성 대사 산물로 전환하는 반면
2상 대사는 모 약물을 극성 비활성 대사 산물로 전환한다는 것 입니다.
대사(약물 대사)는 살아있는 유기체에 의한 약물 의 동화작용 및 이화작용 분해입니다.
그것은 효소 반응 을 통해 발생합니다 .
또한, 약물 대사는 3단계로 이루어집니다. 1단계(변형), 2단계(접합) 및 3단계(추가 수정 및 배설) 및 세 단계 모두 세포에서 생체이물을 해독하고 제거하는 데 적극적으로 관여합니다.
1상 대사란 무엇입니까?
I상 반응은 극성 작용기의 차폐 또는 삽입을 통해 모 약물을 극성 활성 대사물로 전환합니다.
따라서 1상 약물 대사에서는 산화(cytochrome p450 monooxygenase system), 환원(NADPH cytochrome P450 reductase), 가수분해(esterases) 등을 통해 반응이 일어납니다.
여기에서 다양한 효소가 반응하여 기질(약물)에 극성 반응성기를 삽입합니다.
따라서 수정이라고 하는 단계입니다.
가장 일반적인 변형은 수산화입니다.
이것은 시토크롬 P-450 의존성 혼합 기능 산화효소 시스템에 의해 촉매됩니다.
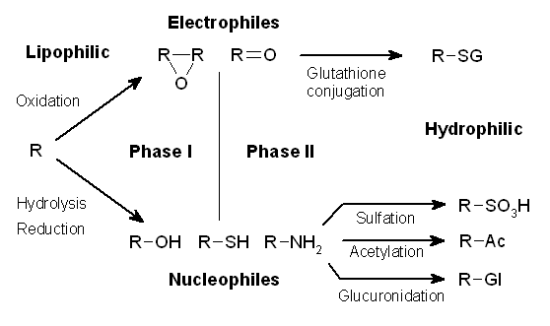
그림 01: 1상 대사
더욱이, 단계 I 동안의 일반적인 산화 반응은 CH 결합이 C-OH 결합으로 전환되는 것을 포함한다.
그리고 이것은 전구약물(약리학적 불활성 약물)을 활성 약물로 전환시키기 때문에 중요합니다.
또한 1단계 대사는 무독성 분자를 독성 분자로 전환할 수 있습니다.
그러나 1상 대사에 의해 대사되는 약물은 더 긴 반감기를 가지고 있습니다.
2상 대사란 무엇입니까?
II상 반응은 약물의 -SH, -OH, -NH 2 작용기에 대한 하위 그룹의 접합을 통해 모 약물을 극성 비활성 대사물로 전환합니다 .
따라서 2단계 대사는 메틸화(메틸트랜스퍼라제), 아세틸화(N-아세틸트랜스퍼라제), 황산화(설포트랜스퍼라제) 및 글루쿠로니드화(UDP-글루쿠로노실트랜스퍼라제)를 통해 발생합니다.
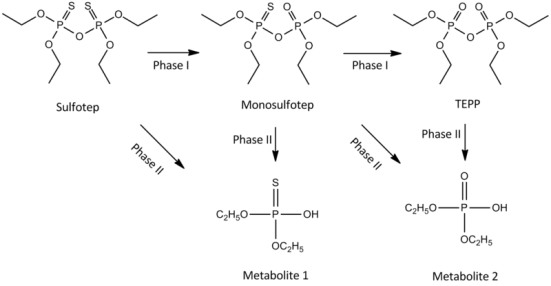
그림 02: 2상 대사
결합 대사 산물은 분자량이 증가하고 약물 기질보다 활성이 떨어집니다.
따라서 이러한 대사 산물은 신장으로 배설됩니다.
아세틸화 능력이 결핍된 개인은 낮은 수준의 대사율로 인해 정상적인 약물 용량에 대해 장기간 또는 독성 반응을 겪습니다.
1상 대사와 2상 대사의 유사점은 무엇입니까?
- 1상과 2상 대사는 모두 약물 동화작용과 이화작용을 수반합니다.
- 또한 두 단계 모두 극성 분자를 생성합니다.
- 그리고 그들은 살아있는 시스템에서 발생합니다.
1상 대사와 2상 대사의 차이점은 무엇입니까?
1상 및 2상 대사는 약물 대사의 3단계 중 2단계입니다.
1상 대사는 모 약물을 극성 활성 대사 산물로 전환하는 반면, 2상 대사는 모 약물을 극성 비활성 대사 산물로 전환합니다.
따라서 이것이 1상 대사와 2상 대사의 주요 차이점입니다.
또한, 1상 대사는 극성 작용기의 차폐 또는 삽입을 통해 발생하는 반면, 2상 대사는 하위 그룹의 접합을 통해 발생합니다.
따라서 이것은 1단계와 2단계 대사의 또 다른 차이점입니다.
또한 I상과 II상 대사의 또 다른 차이점은 I상 대사와 관련된 반응은 산화, 환원 및 가수분해이고 II상 대사와 관련된 반응은 메틸화, 글루쿠론화, 아세틸화 및 황산화입니다.
아래 인포그래픽은 1상 대사와 2상 대사의 차이점에 대한 자세한 내용을 나타냅니다.
요약 - 1상 대 2상 대사
대사(약물 대사)는 살아있는 유기체에 의한 약물의 동화작용 및 이화작용 분해입니다.
I상과 II상 대사의 주요 차이점은 I상 반응은 극성 작용기의 차폐 또는 삽입을 통해 모 약물을 극성 활성 대사 산물로 전환하는 반면, II상 반응은 약물의 -SH, -OH 및 -NH2 작용기에 대한 하위 그룹의 접합을 통해 모 약물을 극성 비활성 대사물로 전환합니다.
또한, 1상 대사에 의해 대사되는 약물은 2상 대사에 의해 대사되는 약물보다 더 긴 반감기를 갖는다.
/***********************************************************
https://www.frontiersin.org/articles/10.3389/fphar.2019.01586/full
Deep Learning Based Drug Metabolites Prediction
Drug metabolism research plays a key role in the discovery and development of drugs. Based on the discovery of drug metabolites, new chemical entities can be identified and potential safety hazards caused by reactive or toxic metabolites can be minimized.
www.frontiersin.org
Deep Learning Based Drug Metabolites Prediction
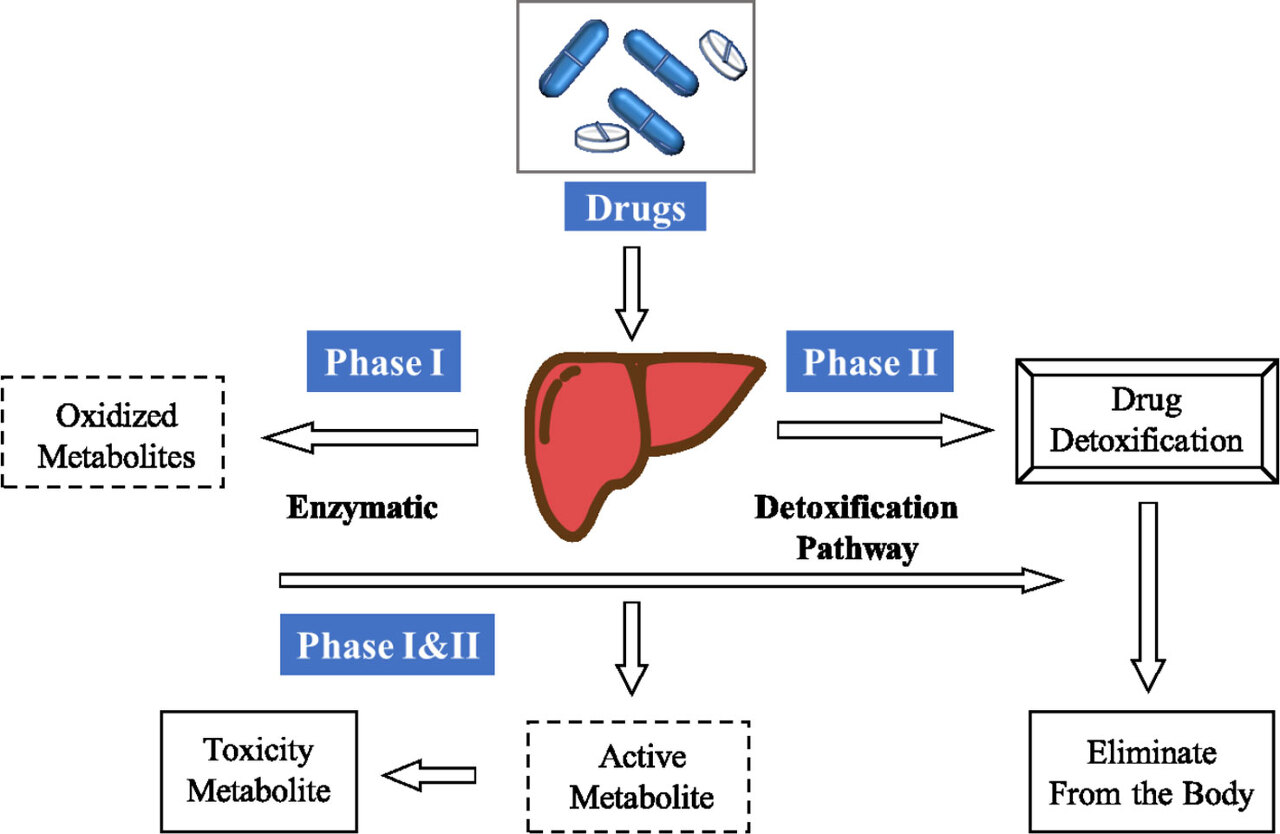
약물 대사는 물리화학적 및 약리학적 특성을 가진 대사산물을 생성할 수 있으며, 이는 모약물의 물리적 및 약리학적 특성과 상당히 다릅니다.
그림 1 과 같이 약물이나 기타 외인성 물질이 인체에 유입되면 약물 대사의 3단계에 의해 크게 조절됩니다.
첫 번째 단계에서 반응성 그룹은 산화, 환원 또는 가수분해에 의해 도입됩니다.
두 번째 단계에서는 생체 내에서 거대 분자와의 접합 반응이 발생합니다 ..
세 번째 단계에서는 동종 및 대사 산물이 간 및 장 세포에서 제거됩니다.
이 3단계를 거친 후 약물과 같은 외인성 물질은 비생리적 활성 물질이나 독성 대사 산물로 전환될 수 있습니다.
임상 약물의 70%가 신체의 대사 시스템에 의해 제거되므로 약물 개발의 일환으로 약물 대사에 대한 심층 연구도 수행해야 합니다..
***********************************************************************
https://drughunter.com/resource/phase-i-drug-metabolism/
Phase I Drug Metabolism
In Phase I drug metabolism, polar groups are added or exposed through reactions like hydroxylation. The most common types of phase I biotransformations involve oxidation, reduction, or hydrolysis.
drughunter.com
Phase I Drug Metabolism
1상 대사란 무엇입니까?
약물 및 기타 생체이물질의 대사는 종종 분자를 친유성이 덜하고 수용성이 더 높으며 더 빨리 제거되는 산물로의 생체 변형을 포함합니다.
이는 일반적으로 두 단계로 발생합니다.
- 1상 약물 대사: 극성기가 추가되거나 노출됨(예: 수산화)
- 2상 약물 대사: 분자를 극성 이온 그룹에 접합(예: 글루쿠론화)
1상 대사 생체 변형의 가장 일반적인 유형의 예
- 산화 반응(P450, FMO, ADH, AO, XO, MAO 매개)
- 환원 반응(NTR, GRX, TRX, GSH, AZOR, CBR에 의해 매개됨)
- 가수분해 반응(EH, CE 및 기타 다양한 펩티다아제, 엔도펩티다아제 및 프로테아제에 의해 매개됨)
1상 대사는 약물 제거를 증가시키지만 약리 활성의 증가 또는 감소, 약리 작용의 변화, 독성 증가를 유발할 수도 있습니다.
관심 화합물을 추구할 때 가능한 많은 1상 대사 경로를 고려해야 합니다.
아래의 1상 대사 예 목록은 독자에게 1상 대사가 약물에 미치는 영향과 I상 대사가 중요한 이유에 대한 일반적인 개요를 제공해야 합니다.
Aliphatic Hydroxylation: Norketamine
Epoxidation: Carbamazepine
Aromatic Hydroxylation: Diclofenac
Dealkylation: Codeine
S-Oxidation: Albendazole
N-Oxidation: Voriconazole
Alcohol Oxidation: Abacavir
Abacavir is a prodrug that is converted to the active metabolite carbovir triphosphate, an analog of dGTP.
Abacavir is prescribed to treat the retrovirus HIV.
Aldehyde Oxidation: Cyclophosphamide
Amine Oxidation: Tyramine
MAO 억제제를 복용하고 있을 때 많은 양의 티라민을 섭취해서는 안 됩니다. 티라민이 MAO에 의해 비활성 p-히드록시페닐아세트산으로 산화되지 않으면 높은 수준의 티라민이 축적되어 시냅스 소포에 저장된 모노아민 신경전달물질을 대체하고 고혈압 위기를 유발할 수 있습니다. 심각한 두통은 MAO 억제제를 복용하는 동안 숙성된 치즈를 섭취하는 것과 관련이 있습니다. 블루 치즈와 같은 냄새 나는 숙성된 치즈는 종종 티라민 함량이 높습니다.
Imine Oxidation: Famciclovir
Nitro Reduction: Nitrochloromethylbenzindoline (NitroCBI)
Disulfide Reduction: Inotuzumab ozogamicin
This drug is unique as the only example of a biologic discussed here. Inotuzumab-ozogamicin is used to treat CD22+ B-cell lymphoma.
Azo Reduction: Olsalazine
Olsalazine is an anti-inflammatory drug taken to treat inflammatory bowel disease. It is a prodrug consisting of two diazo-linked molecules of the anti-inflammatory compound mesalazine.
Carbonyl Reduction: Doxorubicin
Epoxide Hydration: Benzo[a]pyrene
Benzo[a]pyrene is a polycyclic aromatic hydrocarbon that is an environmental toxin encountered in cigarette smoke.
Ester Hydrolysis: Clopidogrel
Amide Hydrolysis: Midodrine
Midodrine is a prodrug administered to treat postural orthostatic tachycardia syndrome (POTS).
Phase II Drug Metabolism
2상 신진대사란 무엇인가
약물 및 기타 생체이물질의 대사는 종종 분자를 친유성이 덜하고 수용성이 더 높으며 더 빨리 제거되는 산물로의 생체 변형을 포함합니다.
이는 일반적으로 두 단계로 발생합니다.
- 1상 약물 대사: 극성기가 추가되거나 노출됨(예: 수산화)
- 2상 약물 대사: 극성 이온 그룹에 분자의 접합(예: 글루쿠론화)
가장 일반적인 2상 생체 변형의 예
- Glucuronidation – 우리딘 5'-디포스포(UDP)- 글루코실트랜스퍼라제(UGT) 에 의해 매개됨
- 설폰화 – 설포트랜스퍼라제 (SULT) 에 의해 매개
- 글루타티온 접합 – 글루타티온 S- 트랜스퍼 라제 (GST) 에 의해 매개
- 메틸화 – 메틸트랜스퍼라제 (MT) 에 의해 매개
- 아세틸화 - N- 아세틸 트랜스퍼라제 (NAT) 에 의해 매개
- 아미노산 접합 – 아미노산 N- 아실트랜스퍼라제 (AAT) 에 의해 매개
Glucuronidation
Ezetimibe
Gemfibrozil
Molidustat
Molidustat stimulates red blood cell proliferation by inhibiting HIF prolyl-hydroxylase.
Olanzapine
Nicotine
Malotilate
This compound is an early example of thiol S-glucuronidation, a major biliary metabolite of the intermediate dithiol formed by ring opening. This compound has been used in liver disease studies and has been shown to have a modest beneficial effect on the liver in cases of cirrhosis.
Sulfinpyrazone
Sulfinpyrazone (SFZ) is a uricosuric agent indicated for the treatment of gout.
Ethchlorvynol
Ethchlorvynol is a central nervous system depressant that is now rarely prescribed in favor of safer sedative-hypnotics.
Sulfonation
Apixaban
Apixaban is an orally bioavailable, direct inhibitor of activated factor X (FXa), a key serine protease in the coagulation cascade. It is used for the treatment and prevention of several thromboembolic disorders.
Minoxidil
Minoxidil is a hair growth promoter and antihypertensive.
Glutathione Conjugation
Aflatoxin B1-exo-8,9-epoxide
Aflatoxin (AFB1) is a highly potent carcinogen that is activated by CYPP3A4 to form Aflatoxin B1-Exo-8,9-epoxide (AFB1-Epoxide). The epoxide is highly reactive with DNA and protein nucleophiles.
Bromisoval
Bromisoval has been used as a probe drug to assess GSH conjugation activity in vivo.
Cisplatin
Acetaminophen
Methylation
Ethinylestradiol
Compounds that come to mind as COMT substrates are small endogenous catechol-amines like dopamine.
N-Acetylserotonin
N-Acetylserotonin (NAS), or normelatonin, is a precursor to melatonin and an endogenous substrate for the O-methyltransferase acetylserotonin methyltransferase (ASMT). Melatonin, an endogenous neurotransmitter, is commonly taken as an herbal supplement to aid in falling asleep. Abnormal melatonin synthesis, attributed to polymorphisms in the gene that codes for ASMT, is considered a risk factor for autism spectrum disorder and is associated with several other neuropsychiatric disorders.
Norepinephrine
Nicotine
Clopidogrel
6-Mercaptopurine (6MP)
Arsenic Trioxide
Acetylayion
Procainamide
Isoniazid
Amino Acid Conjugation
Salicylic acid
Mescaline
Mescaline, one of the main active constituents found in the peyote cactus, has been used by the indigenous peoples of the Americas for thousands of years in their religious, ceremonial, and medicinal rituals; it is used recreationally as a hallucinogenic drug.
Obeticholic acid
Obeticholic acid (OCA) is a first-in-class farnesoid X receptor (FXR) agonist developed for the treatment of various chronic liver diseases.
************************************************************************
'약물' 카테고리의 다른 글
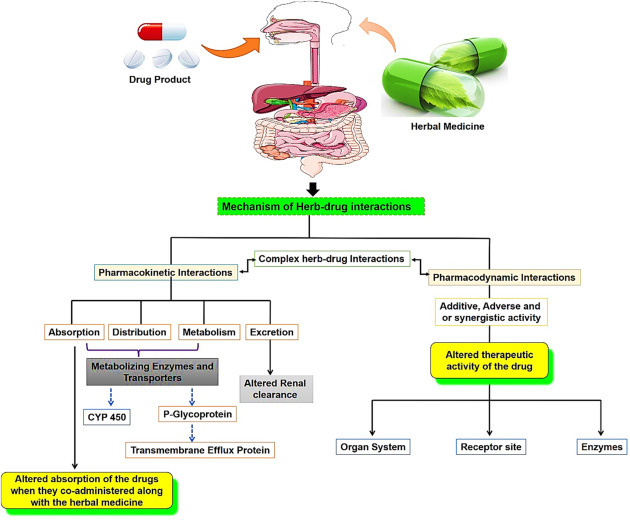
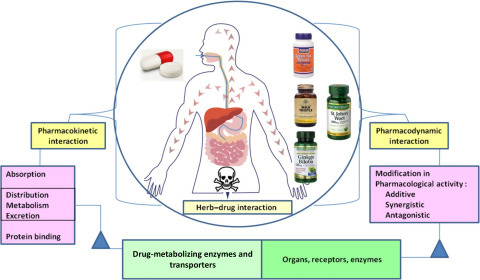
| 허브-약물 상호 작용: 메커니즘 및 임상 측면의 개요 (0) | 2022.09.14 |
|---|---|
| 허브-약물 상호 작용 (herb–drug interaction) (0) | 2022.09.12 |
| 약물대사(약동학, 약력학)-국내 (0) | 2022.09.09 |
| 허브-약물 상호작용 및 독성 (0) | 2022.09.08 |
| (링크) Checks for interactions between supplements and drugs only (0) | 2022.09.07 |