2021
https://www.hindawi.com/journals/jtm/2022/5794350/
Natural Products for Cancer Therapy: A Review of Their Mechanism of Actions and Toxicity in the Past Decade
The ethnopharmacological information gathered over many centuries and the presence of diverse metabolites have made the medicinal plants as the prime source of drugs. Despite the positive attributes of natural products, there are many questions pertaining
www.hindawi.com
Natural Products for Cancer Therapy: A Review of Their Mechanism of Actions and Toxicity in the Past Decade

2.1. Aristolochia baetica (A.baetica)
A. baetica 는 스페인, 모로코, 포르투갈의 남부 지역에 분포 하는 Aristolochiaceae 과 의 야생종 입니다.
A. baetica 는 aristolochic acid의 유도체 그룹을 포함합니다. 이러한 유도체 외에 알칼로이드, 안트라퀴논, 페놀 화합물, 스테로이드 및 테르펜이 포함됩니다.
MCF-7 유방암 세포주의 증식을 억제했습니다. 추출물에 있는 aristolochic acid I의 존재는 암세포 증식의 주된 억제제로 작용하는 것으로 여겨집니다
다른 연구에서 A. baetica 뿌리 의 메탄올 추출물은 T-24 방광암, HT-29 결장암 및 HepG2 간암 세포주의 증식을 억제했습니다.
2.2. Artemisia annua ( A. annua )
항말라리아 성분인 아르테미시닌으로 유명합니다.
A. annua 추출물은 항염 활성이 부여됩니다.
아르테미시닌은 TNF- α 유전자 발현 감소에 효과가 있는 것으로 나타났다.
아르테미시닌의 반합성 유도체인 아르테수네이트는 다양한 암 세포주에서 테스트되었지만 백혈병 및 결장암에 가장 효과적인 것으로 관찰되었습니다.
아르테미시닌은 치료 효과가 있는 지배적인 화합물이지만 이 식물의 가장 효과적인 항암제는 아닙니다 .
대신, 식물은 함께 존재할 때 항암 효과를 발휘하는 다양한 생물학적 활성 물질로 구성됩니다.
따라서 A. nua 추출물의 항암 효과에 대해 조사되었습니다.
2.3. Coptidis rhizome (동의어: C. rhizoma )=Huanglian-'황련
C. rhizoma 는 Coptis chinensis Franch., Coptis teeta Wall., Coptis deltoidea CY Cheng et Hsiao, Coptis japonica Makino 또는 Coptis japonica var. Ranunculaceae 계통 의 dissecta [ 48 ].
한방에서는 Huanglian-'황련(黃蓮)'이라고 하며 아시아 각국에서 널리 알려져 소비되고 있다.
수년에 걸쳐 C. rhizoma 는 당뇨병, 습진, 설사, 황달 및 고열을 포함한 여러 질병을 치료하는 데 사용되었습니다.
항바이러스, 항박테리아, 항진균, 항당뇨병, 항산화, 항염증 및 항암 효과와 같은 많은 약리학적 특성으로 인해 가장 다재다능한 천연 치료제 중 하나입니다.
C. rhizoma 는 알칼로이드, 휘발성 오일, 유기산, 리그난 및 플라본에 이르는 약 120개의 화학 성분을 구성합니다.
간세포 암종 치료에서 C. rhizoma 추출물은 HepG2 및 MHCC97-L 세포의 EEF2(진핵 신장 인자 2) 비활성화를 통해 VEGF를 하향 조절하여 혈관 신생을 억제하는 것으로 나타났습니다.
또한 MHCC97-L 세포의 이동을 방지하기 위해 Rho/ROCK 신호 전달 경로를 억제하는 것으로 나타났습니다.
또한, C. rhizoma 는 YES-2 세포에서 종양 IL-6 생성을 하향 조절하고 마우스 모델에서 이종이식편을 통해 식도암에 항악액제 효과를 나타냈다.
추출물은 또한 Bcl-2의 발현 증가와 카스파제 활성화를 통해 Hep3B 세포에서 세포 성장을 억제하고 세포 사멸을 유도할 수 있었습니다.
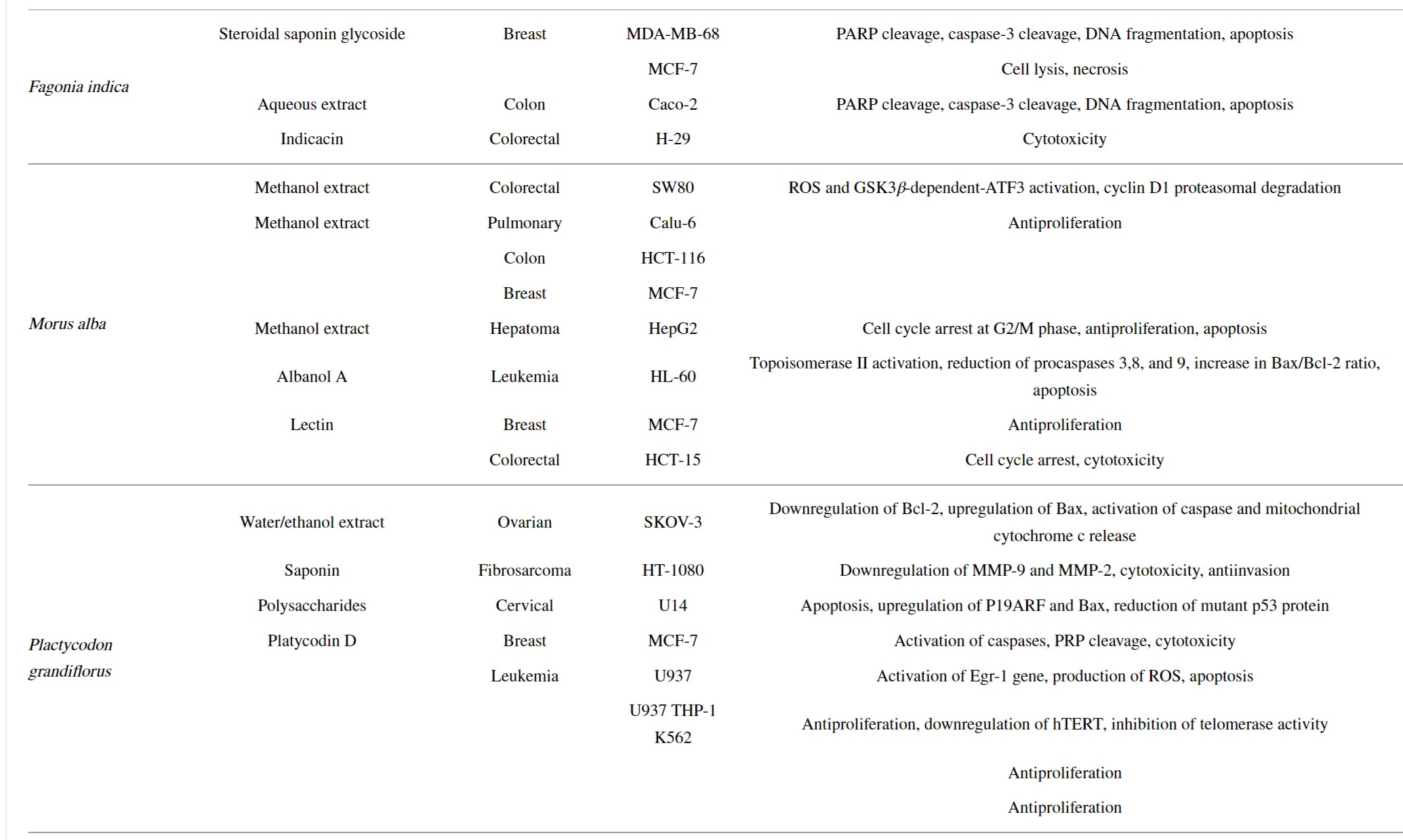
2.4. Fagonia indica(F. indica)-보충제 검색시 Dhamasa로 검색
F. indica 는 "Dhamasa"라고도 하는 Zygophyllaceae 계통의 꽃 피는 식물입니다
이 식물은 플라보노이드, 사포닌, 알칼로이드, 아미노산 및 테르페노이드와 같은 식물 화학 물질이 풍부하여 항염, 항산화, 항균, 항우울제, 항바이러스 및 간 보호 특성을 가진 약리학적으로 다재다능합니다.
암 연구에서 F. indica 수성 추출물은 많은 암에 대한 항암 효능을 입증했습니다.
F. indica 식물 성분은 돌연변이 표피 성장 인자인 티로신을 차단하여 암세포를 파괴하는 유망한 세포독성 특성을 가지고 있습니다.
F. indica 의 공중 부분에서 추출한 스테로이드 사포닌 배당체 는 MDA-MB-468 유방암 및 Caco-2 결장암 세포에 대한 세포 사멸 매개 세포 사멸을 유도했습니다.
MCF-7 유방암 세포주에서 화합물은 세포 용해를 통해 상당한 괴사 활성을 나타냈습니다.
또한, 수성 추출물 F. indica야생형 및 화학 요법 내성 RKO 및 H630 인간 결장암 세포에 대해 테스트되었습니다.
결과는 추출물이 암세포의 증식과 이동을 방지하고 Akt/MAPK 신호 전달 경로를 통해 세포 사멸을 유도한다는 것을 보여주었습니다. .
VEGF, NF-β 및 ICAM-1 발현의 감소도 관찰되었습니다.
다른 연구에서 F. indica 의 메탄올 추출물에서 분리된 indicacin 은 H-29 인간 대장암 세포주에 대해 6.25mM/mL 용량에서 51.40%의 세포독성을 나타내는 것으로 밝혀졌습니다.
2.5. Morus alba L. (M. alba)=White Mulberry
M. alba 는 뽕나무과 에 속하는 중간 크기의 뽕나무 로 인도, 중국, 일본이 원산지입니다.
누에가 자라는 곳에서 전 세계적으로 일반적으로 재배
전통적으로 그 추출물은 기침, 불면증, 천식, 상처 치유, 당뇨병 및 부종 치료에 사용됩니다.
잎은 케르세틴, 1-데옥시노지리마이신, 아피게닌 및 루틴의 공급원이고 뿌리는 다당류의 공급원입니다.
암 치료에서 M. alba 뿌리 껍질 추출물은 인간 대장암 세포주인 SW480에서 세포 성장 정지 및 세포 사멸을 개시했습니다.
이 연구에서 추출물은 ROS 및 GSK3 β- 의존성 ATF3 활성화와 cyclin D1 프로테아좀 분해를 입증했습니다.
또한 M. alba 잎의 메탄올 추출물은 Calu-6(폐), HCT-116(결장) 및 MCF-7(유방) 암세포주의 증식을 억제했습니다.
HepG2 인간 간암 세포주에 대해 수행된 또 다른 연구에서는 메탄올성 잎 추출물이 G2/M 단계에서 세포 주기를 정지시켜 세포 사멸을 유도하고 세포의 증식을 방지하는 것으로 나타났습니다.
알바( M. alba )에서 분리 한 식물 성분은 뿌리 추출물에서 알바놀 A(albanol A)를 분리하였다.
그것은 HL-60 인간 백혈병 세포주에 대한 세포 사멸 및 세포 독성을 유도했습니다.
그것의 작용 기전에는 토포이소머라제 II 활성화, 프로카스파제 3, 8, 9의 감소, 세포 사멸을 자극하기 위한 Bax/Bcl-2 비율의 증가가 포함됩니다.
또한, M. alba 잎 추출물에서 분리한 렉틴은 MCF-7 인간 유방암 세포주에 대한 항증식 효과가 있는 것으로 관찰되었습니다.
HCT-15 인간 대장암 세포주에서 렉틴은 세포 주기 정지와 세포독성을 촉진했습니다.
Lectin의 proapoptotic 효과는 caspase-3를 활성화하고 방출하는 능력에 기인합니다.
2.6. Platycodon grandifloras ( P. grandifloras )
Chinese bellflower, or balloon flower으로도 알려진 P. grandiflorus 는 Campanulaceae 계통의 다년생 허브 유형입니다.
동북아시아에 널리 분포하며 중국, 일본, 한국에서 식품 및 전통의학으로 사용되어 왔다[
전통적으로 가래 , 기침, 인후통 및 기타 질병을 치료하는 데 사용되었습니다.].
플라보노이드, 페놀, 사포닌, 다당류 및 안토시아닌에 이르기까지 다양한 활성 식물 성분이 중요한 항염증, 면역 자극, 간 보호 및 항암 특성을 담당합니다.
암 치료에서 P. grandiflorus 는 SKOV-3 인간 난소암 세포에서 Bcl-2 발현을 감소시키고 Bax 발현을 증가시키며 caspase와 미토콘드리아 사이토크롬 c 방출을 활성화하여 세포자멸사를 유도했습니다.
또한 MMP-9와 MMP-2의 용량 의존적 하향 조절을 보여 HT-1080 섬유육종 세포주의 생존과 침입을 억제했습니다.
또한, P. grandiflorus 다당류는 마우스 모델에서 U14 자궁경부 종양 성장의 억제에 상당한 효과가 있었습니다.
다당류는 세포자멸사를 유도하고 P19ARF와 Bax 단백질 발현을 증가시키며 돌연변이 p53 단백질 발현을 감소시켰다.
P. grandiflorus 뿌리 에서 추출한 주요 트리테르페노이드 사포닌인 Platycodin D 도 항종양, 항염증, 항비만, 항알레르기와 같은 약리학적 활성에 대해 광범위하게 연구되었습니다.
MCF-7 유방암 세포주에서 플라티코딘 D는 카스파제 및 PRP 절단을 활성화하여 용량 및 시간 의존적 방식으로 세포독성을 유발한다.
인간 백혈병 U937 세포에서 플라티코딘 D는 세포 사멸과 세포 사멸을 자극하는 ROS의 최종 생산을 위해 Egr-1 유전자를 활성화했습니다.
또 다른 연구에서 Platycodin D는 인간 텔로머라제 역전사효소(hTERT) 발현의 하향조절을 통해 텔로머라제 활성을 억제하고 백혈병 세포에 대한 세포독성 효과를 유도하는 것으로 밝혀졌습니다.
3. 몇 가지 유망한 식물 성분에 대한 항암 활성 보고
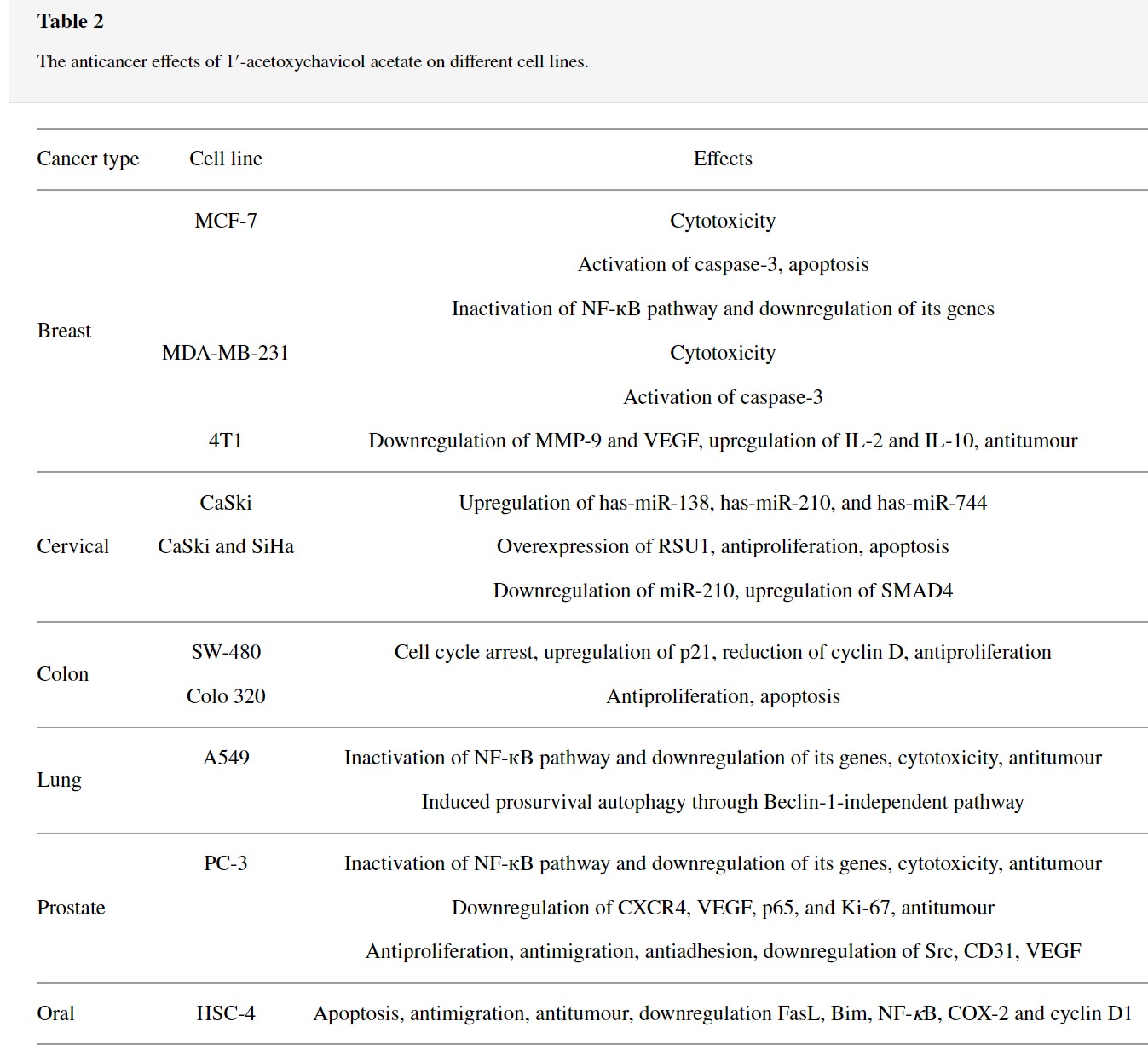
3.1. 1′-Acetoxychavicol Acetate-Swanson 에서 제품 판매 (Alpinia conchigera)
1'-Acetoxychavicol acetate(ACA)는 Zingiberaceae 계통 의 Alpinia conchigera 및 Alpinia galanga 에서 분리된 소수성 에스테르 유형입니다.
식물의 주요 식물 성분인 ACA는 항알레르기, 항염증, 항궤양, 항바이러스 및 항종양을 포함하는 약리학적 활성에 대해 널리 조사되었습니다.
ACA의 가장 많이 연구된 약리학적 활성은 항종양 활성을 나타내는 능력이었다(표 2 ).
아폽토시스는 NF- κ B 신호 전달 경로의 억제, 카스파제 3의 활성화 및 아폽토시스 유도 리간드 및 사멸 수용체의 발현을 통한 ACA에 의해 유발됩니다.
apoptosis의 시작은 미토콘드리아와 Fas 의존 경로 를 통해 발생합니다.
다른 연구에서는 ACA가 caspase-3를 증가시켜 세포자멸사를 유도하고 세포 주기 정지로 DNA 단편화를 유도한다고 제안합니다.
ACA는 또한 암 관련 골 손실에서 RANKL 유도 NF-κB 활성화 및 IFN-β mRNA 발현의 차단을 통해 파골세포 형성을 유발함으로써 골 관련 합병증을 완화했습니다.
또한 ACA는 시험관 내 연구 에서 Beclin-1 독립적인 경로를 통해 자가포식을 유도하는 것으로 보고되었습니다.
또한, 종양에서 전염증성 시클로옥시게나제-2(COX-2) 및 사이클린 D1 발현의 하향 조절이 관찰되었으며, 이는 시스플라틴과 함께 투여될 때 더욱 강화되었습니다.
3.2. 제니스테인
대두 및 대두 제품에 자연적으로 존재하는 이소플라본의 한 유형입니다.
합성 제니스테인은 1928년에 생산되었으며 그 이후로 항암 특성에 대해 광범위하게 연구되었습니다(표 3 ).
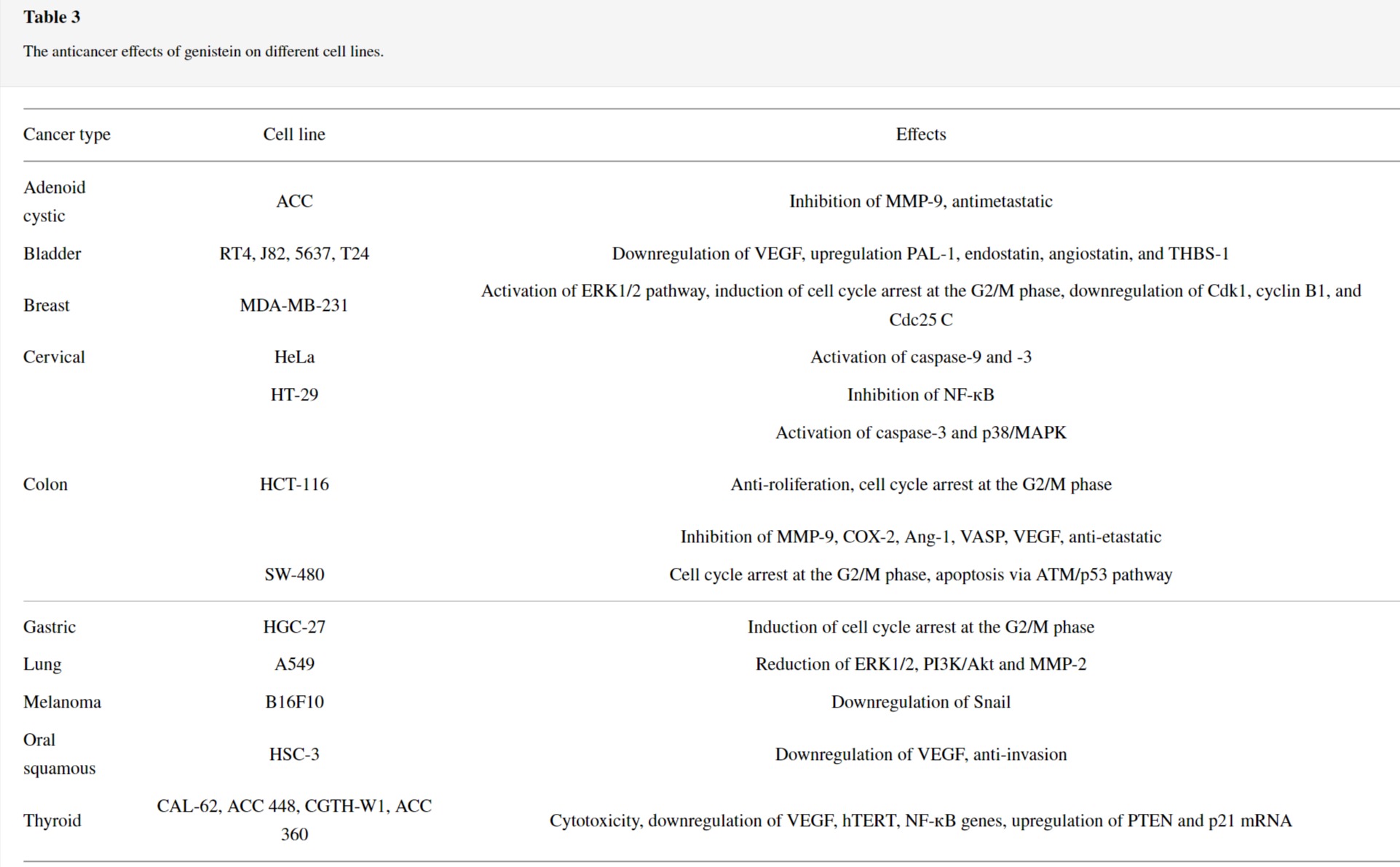
또한, 제니스테인의 항혈관신생 효과는 인간 방광암 세포, 구강 편평 세포 암종 및 갑상선암 세포에서 혈관신생 단백질인 혈관 내피 성장 인자(VEGF)의 하향 조절에서 입증되었습니다.
은 MMP-2 및 MMP-9를 포함한 여러 전이성 유전자 발현의 억제를 통해 침샘샘 낭포성 암종 세포(ACC), 폐암 세포(A549) 및 결장암 세포(HCT116)에 대해 상당한 항전이 특성을 갖는 것으로 나타났습니다.
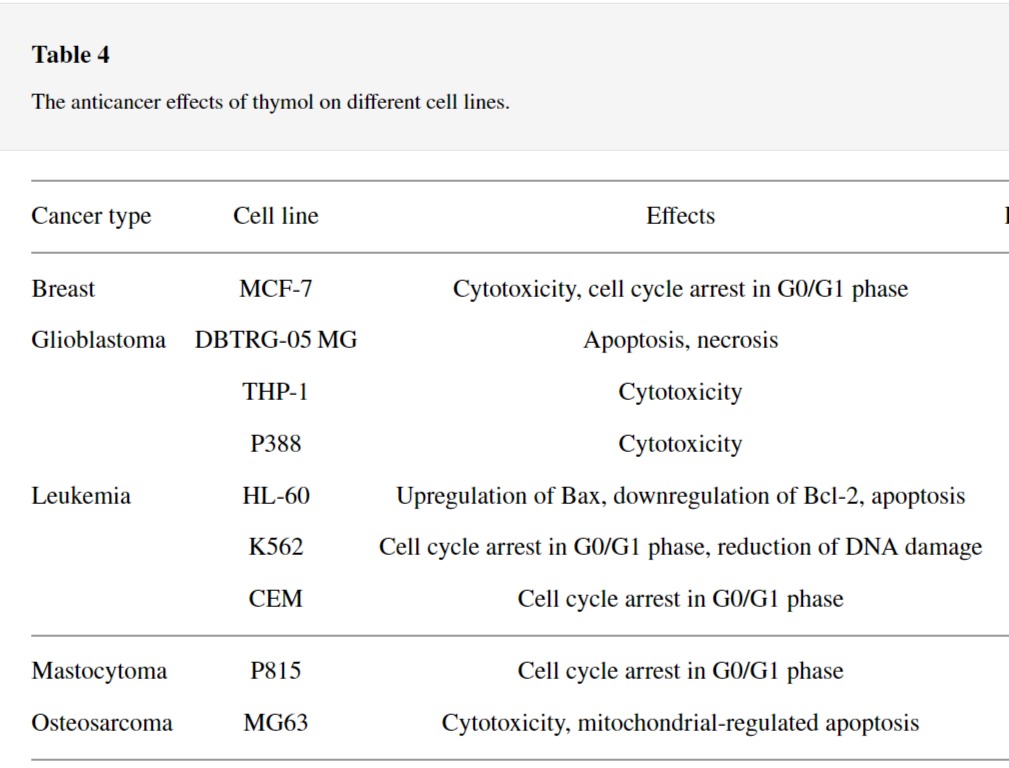
3.3. Thymol
티몰은 백리향 오일=thyme oil에서 얻어지는 페놀의 일종으로 화학적으로 2-이소프로필-5-메틸페놀로 알려져 있습니다.
Thymus vulgaris 및 Thymus zygis 와 같은 백리향 종에서 주로 발견되는 무색 천연 모노테르펜입니다.
19세기 후반에 티몰은 구충 전염병에 대한 치료 효과가 있는 것으로 더 발견되었습니다.
그 이후로 티몰은 항산화, 항염증, 항균, 항진균 및 항암 활성과 같은 유익한 약리학적 특성으로 활용되었습니다.
3.4. Thymoquinone
2-methyl-5-isopropyl-1, 4-benzoquinone으로도 알려진 티모퀴논은 Ranunculaceae과의 Nigella sativa L. 종자에서 추출된 모노테르펜 분자의 한 유형 입니다 .
티모퀴논, p-시멘 및 α- 피넨을 포함한 많은 생리 활성 성분은 항염, 항균, 항산화, 항천식, 항고혈압 및 항암 특성을 담당합니다.
N. sativa 종자 의 주요 에센셜 오일 성분인 티모퀴논 은 1963년에 처음으로 추출되었습니다.
많은 약리학적 활성에 더하여, 특히 많은 다른 암세포주에서 활성 산소종(ROS)의 생산을 개시함으로써 상당한 항암 효과를 나타내는 것으로 밝혀졌습니다(표 5 ).
티모퀴논은 또한 인간 결장암 세포 및 편평 세포 암종에서 JNK 인산화및 교모세포종 및 폐암 세포에서 ERK 인산화 감소를 입증했습니다.
세포 성장, 증식 및 혈관신생을 억제하는 PI3K/Akt 신호전달 경로의 티모퀴논의 감쇠는 HTB-9 방광암, MDA-MB-468 및 T47D 유방암 및; TFK-1 및 HuCCT1 담관암종에서 관찰됩니다.
NF-β 경로의 비활성화는 마우스 암세포, TFK-1 및 HuCCT1 담관암종, HEPG2 간암종 및 KBM-5 골수성 백혈병에서도 관찰되었습니다.
또한, 티모퀴논은 TWIST1 전사 인자의 발현을 감소시켜 BT549 인간 유방암 세포주의 침입 및 전이를 감소시킨다.
3.5. Ursolic Acid
화학적으로 3- β -hydroxy-urs-12-en-28-oic acid 로 알려진 Ursolic acid(UA) 는 Origanum vulgare (oregano) 잎 , Lavandula angustifolia (lavender), Eucalyptus (유칼립투스) 잎 및 Malus domestica (orchard apple)와 같은 다양한 약용 식물에서 분리된 pentacyclic triterpenoid의 한 유형입니다.
우르솔산의 분자량은 456.7g/mol이고 융점은 283~285°C입니다.
소수성 화합물로 아세톤, 메탄올, 피리딘과 같은 유기용매에는 녹지만 물에는 녹지 않는다.
Ursolic acid의 약리학적 기능에는 항염증, 항당뇨병, 항산화, 항고지혈증, 항암 활성이 있다.
항암 특성 측면에서 우르솔산은 유방암 세포주에 대해 광범위하게 연구되었습니다(표 6 ).

MCF-7 및 MDA-MB-231 인간 유방암 세포주에서 우르솔산은 STAT3, EFGR 및 사이클린 D1을 하향 조절하여 세포 주기를 정지시키고 세포 사멸을 유도하며 세포 증식을 방지하는 것으로 밝혀졌습니다.
이 화합물은 또한 c-Jun N-말단 키나제(JNK), 단백질 키나제 B(Akt) 및 라파마이신의 포유동물 표적(mTOR) 신호 전달 경로를 제어하여 MDA-MB-231 세포의 이동 및 침입을 억제합니다.
생체 내MMTV-Wnt-1 유방 종양 세포로 유도된 마우스에 대한 우르솔산의 연구는 또한 Akt/mTOR 신호 전달 경로의 조절, 세포자멸사 유도 및 종양 부피를 줄이기 위한 세포 주기 정지를 보여주었습니다.
SGC7901 위암 및 HepG2 간암 세포주에서 우르솔산은 COX-2의 발현을 하향 조절하여 세포 독성, 세포 사멸을 유도하고 암세포의 증식을 방지했습니다.
이들 세포에서의 세포자멸사 기능 외에도 우르솔산은 카스파제 3, 8, 9의 활성화와 Bcl-2 발현의 하향 조절을 통해 미토콘드리아 기능 장애를 촉진했습니다.
또한 우르솔산은 MMP-9(Matrix Metallopeptidase 9) 발현을 감소시켜 HeLa, HT1080(섬유육종) 및 C6(신경교종) 세포의 전이를 억제합니다
4. 선별된 항암 식물 추출물의 독성 내용
이 검토에서 설명된 식물 추출물의 독성은 다음 섹션에 나와 있습니다.
표 7 은 동물 모델에 대한 이러한 식물 추출물의 독성에 대한 요약이며, 평가 유형, 투여 경로, 연구 중 병리학적 변화를 자세히 설명합니다.
4.1. Aristolochia baetica
A. baetica 수성 추출물은 스위스 흰둥이 쥐 모델에서 안전성에 대해 스크리닝되었습니다. 급성 독성 시험에서는 경구 투여 시 사망이나 독성 징후가 나타나지 않았습니다.
아급성 독성 연구에서 임상 징후는 관찰되지 않았습니다.
간 표지자는 A. baetica생쥐에게 2g/kg/day 용량을 투여했을 때 AST 수준이 증가했습니다.
신장 표지자를 평가한 결과 대조군에 비해 대조군(1.5g/kg/day)에서 크레아티닌 농도가 증가한 것으로 나타났다.
신장 조직병리학적 검사에서는 변화가 없었지만 마우스에 1.5 및 2g/kg/day 용량을 투여했을 때 신장 괴사, 염증 침윤, 피질 괴사 및 세뇨관 변성이 기록되었습니다.
4.2. Artemisia annua
독성 증상이 없다는 것은 Artemisia annua 가 독성이 없고 내약성이 우수함을 시사합니다[ 142 ].
4.3. Coptidis rhizoma
C. rhizoma 추출물 을 투여한 마우스 모델에서 급성 독성 시험을 수행 하였다.
결과는 14일 급성 연구 동안 독성 관련 징후를 나타내지 않았습니다.
LD 50체중의 7000 mg/kg보다 높은 용량에서 확립되었습니다.
Sprague-Dawley 쥐에서 90일 동안 더 긴 독성 연구가 수행되었습니다.
추출물 투여로 인한 부작용이나 생존에 대한 임상 징후는 없었습니다.
조직병리학적 검사에서 3. 76g/kg은 간세포의 퇴화와 폐의 염증 세포 응집을 유발했습니다.
4.4. Fagonia indica
F. indica 의 14일 급성 독성 연구는 5 mg/kg 추출물 및 10 mg/kg 용량에서 수컷 알비노 마우스에서 수행되었습니다. 연구가 끝날 때 결과는 치료 그룹에서 이환율이나 행동 변화를 보여주지 않았습니다.
조직학적으로 결과는 간세포가 식물 추출물의 영향을 받지 않는 것으로 나타났습니다.
4.5. Morus alba
급성독성시험에서는 암컷 스위스 생쥐에게 M. alba 에탄올 추출물을 경구 투여하였다.
추출물은 마우스에서 낮은 수준의 독성을 나타내었고 2000 mg/kg의 용량에서 사망이 감지되었습니다.
최고 용량을 투여한 동물에서 MCV가 감소하고 혈청 알칼리성 인산분해효소가 증가했습니다.
백혈구 수의 감소가 300 및 2000 mg/kg 용량에서 관찰되었습니다.
4.6. Platycodon grandiflorus
P. grandiflorus 의 아만성 독성 연구에서는 유의한 차이가 관찰되지 않았습니다.
그러나, 혈청 크레아티닌은 대조군에 비해 처리군에서 유의하게 증가하였다.
조직병리학적 검사에서 추출물을 처리한 일부 쥐의 간에서 중심소엽 간세포 비대가 나타났습니다. 이 연구의 NOAEL은 쥐에서 3000 mg/kg/day 이상의 용량에서 설정되었습니다.
5. 항암 식물성분의 전임상 독성학적 스크리닝
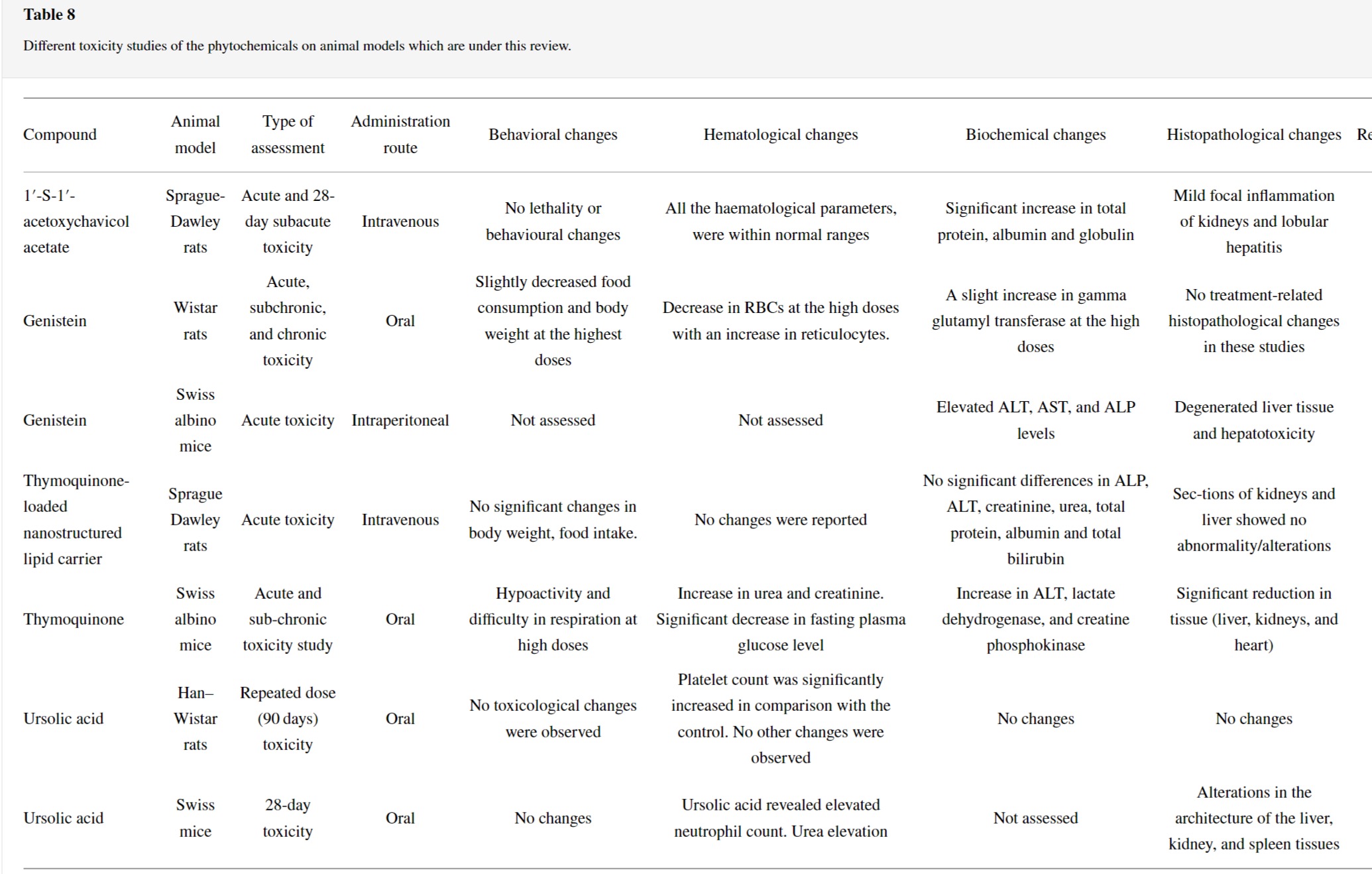
5.1. 1′-Acetoxychavicol Acetate
ACA를 사용하여 Sprague-Dawley 쥐에 대해 수행한 급성 독성 및 28일 아급성 독성 연구에서 ACA의 NOAEL이 2.22mg/kg인 것으로 나타났습니다.
0.66~6.66mg/kg의 비경구 용량에 노출된 경우 급성 및 아급성 연구에서 사망이나 체중 감소 및 형태학적 변화를 일으키지 않았습니다.
또한 아급성 연구 및 회복 기간 동안 대조군과 비교하여 장기 중량 또는 상대 장기 중량에 대한 ACA의 유의한 영향은 없었습니다.
조혈 및 생화학적 평가는 중용량 및 고용량 치료에서 급성 연구에서 백혈구의 상당한 감소를 보여주었지만, 이러한 매개변수는 아급성 연구에서 정상 범위 내에 있었습니다.
간독성 측면에서 ACA는 건강한 비종양이 있는 SD 쥐에서 경미한 소엽성 간염을 보였다.
또한, 처리된 그룹은 정상적인 처리되지 않은 쥐와 비교하여 정상적인 소변 배출 및 구성 요소에서 볼 수 있는 손상된 사구체 여과 또는 신독성을 나타내지 않았습니다.
조직병리학적 분석에서 중요한 장기의 현미경적 부분을 채취하여 이상 및 병리학적 징후를 찾습니다.
신장에서 사구체와 세뇨관은 경미한 간질성 신염과 함께 정상으로 나타났습니다.
폐 섹션에서 처리된 모든 쥐에서 다른 강도의 폐렴이 관찰되었습니다.
그러나 치료를 받지 않은 쥐도 비슷한 증상을 보였습니다.
5.2. 제니스테인
Genistein은 급성 독성 연구에서 낮은 수준의 독성을 보였고 반복 투여 독성 연구에서 내약성이 우수했습니다.
급성 및 아만성 독성 연구에서 음식 소비가 증가하고 이에 따라 쥐의 체중이 증가했습니다.
혈액학적 검사는 쥐에게 고용량을 투여했을 때 적혈구의 감소를 보여주었습니다.
생화학적 매개변수의 관점에서, 고용량에서 수컷 및 암컷 랫드에서 감마 글루타밀 전이효소의 약간의 증가가 관찰되었습니다.
수컷 랫트의 신장, 비장, 부신, 고환 등의 기관 중량이 증가하였고 암컷의 경우 간, 신장, 비장, 난소 및 자궁 중량의 증가가 관찰되었다.
이 연구에서 대부분의 결과는 500mg/kg/일(고용량)으로 제한되었으며 가역적이었습니다.
제니스테인의 NOAEL은 50mg/kg/일에서 설정되었습니다. [ 149].
쥐를 대상으로 한 제니스테인에 대한 또 다른 급성 독성 연구에서 알라닌 아미노전이효소(ALT), 아스파르테이트 아미노전이효소(AST) 및 알칼리성 인산분해효소(ALP) 수치가 상승했으며 500 및 1000 mg/kg 제니스테인 처리군에서 간 조직 변성이 두드러졌습니다.
5.3. Thymoquinone
쥐의 티모퀴논에 대한 급성 독성 연구를 수행했으며 결과적으로 행동 모양과 이환율에 유의미한 변화가 없었습니다.
또한 체중, 음식섭취량, 장기대체중비, 혈액학적, 생화학적, 조직병리학적 프로파일은 모든 변수가 정상 범위 내에서 유의한 변화가 없었다.
혈청 ALP, ALT, 크레아티닌, 요소, 총 단백질, 알부민 및 총 빌리루빈 수준의 유의미한 차이는 없었다.
다른 연구에서는 급성 경구 투여 후 티모퀴논의 LD 50 값이 2.4g/kg에서 발견되었습니다.
최고 용량의 티모퀴논을 투여한 동물에서 활동 저하 및 호흡 곤란이 관찰되었습니다.
결과는 마우스에서 티모퀴논의 급성 경구 독성이 낮고 화합물이 잘 용인된다는 것을 나타냅니다.
5.4. Thymol
티몰의 급성 및 아급성 독성 연구에서 혈액학적 및 생화학적 매개변수는 변경되지 않았습니다.
그러나 장기에 대한 조직병리학적 검사에서는 폐의 변화를 보였고 나머지 장기에서는 다른 변화가 없었다.
체중은 500mg/kg의 티몰을 투여한 수컷 쥐에서만 편차가 있었습니다.
장기의 상대적 무게는 크게 다르지 않았습니다.
NOAEL은 250 mg/kg/day 이상의 용량에서 설정되었으며,
Thymus vulgaris 의 에센셜 오일은 중등도의 경구 독성을 일으키는 것으로 나타났습니다.
5.5. Ursolic Acid
UA의 만성 경구 독성 연구에서 결과는 UA가 시험된 용량에서 사망, 비정상적인 체중 또는 비정상적인 병리를 일으키지 않음을 보여주었습니다.
또한, UA 투여 후 행동, 신경독성, 응고, 혈액학 또는 임상적 측면에서 다른 독성학적 변화는 관찰되지 않았습니다.
따라서 연속 90일 동안 UA의 경구 투여는 어떤 투여량에서도 독성이 없습니다.
UA에 대한 NOAEL은 1000mg/kg/day보다 높은 용량에서 설정되었습니다.
Mishra와 동료들이 수행한 최근 독성 연구에서 UA는 호중구, 혈액 내 요소 및 ALP 효소의 상승을 유발하는 것으로 보고되었습니다.
반대로, UA의 아급성 독성 연구에서는 혈소판 및 림프구와 같은 일부 다른 혈액학적 매개변수의 낮은 수준이 밝혀졌습니다.
조직학적 검사에서 UA는 일부 주요 장기, 특히 간, 비장 및 신장에서 회복 가능한 변화를 보여주었습니다.
따라서 UA는 장기간 사용하면 경미한 독성 부작용을 일으킬 수 있습니다.
6. 토론
검토는 또한 우리 연구실에서 광범위하게 연구된 분자인 ACA를 소개하고 설명하려고 시도합니다.
이 리뷰에서 연구된 식물 추출물은 A. baetica, M. alba, F. indica , P. grandiflorus, C. rhizoma 및 A. annua 의 수성 및 유기 추출물로 세포사멸 및 괴사를 유도하고 항증식, 항이동 및 시험관내 및 생체내 모두에서 여러 암 세포주에 대한 항-침습 활성.을 나타내는 것으로 밝혀졌습니다.
항신생혈관를 위한 VEGF를 하향 조절하고, 항이동을 위한 Rho/ROCK 신호 전달 경로를 비활성화하고, 항세포사멸의 Bcl-2 및 카스파제 활성을 상향 조절 하는 C. rhizoma 추출물 의 다양성에 주목해야 합니다.
F. indica 의 경우, 추출물은 Akt/MAPK 신호 전달 경로를 비활성화하고 VEGF, NF-β 및 ICAM-1과 같은 종양 유발 인자를 감소시키는 것으로 입증되었습니다.
그 외에도 M. alba 추출물은 ATF3 활성화, 사이클린 D1 프로테아좀 분해 및 세포 주기 정지를 유도했습니다.
반면에 P. grandiflorus 는 Bcl-2를 감소시키고 Bax를 증가시키며 caspase를 활성화하고 미토콘드리아 사이토크롬 c 방출을 유도하고 MMP-9, MMP-2 및 돌연변이 p53 단백질을 하향조절할 수 있습니다.
그러나 임상 연구를 위한 식물 추출물의 사용에는 몇 가지 제한 사항이 있습니다. 예를 들어, 추출 절차로 인한 다양한 대사 산물 프로파일, 다른 환경에서 자란 동일한 종의 효능 및 특성은 의약 화합물의 고유한 프로파일로 인해 다양합니다.
천연 제품의 이차 대사 산물의 구성에 대한 환경 요인의 영향은 부인할 수 없으며 문헌에 잘 기록되어 있습니다.
또한 식물의 지리적 위치, 토양 품질, 추출 방법 및 유전자형도 허브의 불일치를 유발할 수 있습니다.
따라서 천연물의 이질성은 치료 결과의 재현성을 제한하는 주요 과제 중 하나입니다.
최근 연구된 전임상 식물 성분인 ACA는 NF-β 경로, 미토콘드리아 및 Fas 의존 이중 경로의 비활성화 및 카스파제-3의 활성화를 통해 세포자멸사를 유도하는 것으로 밝혀졌습니다.
ACA 외에도 genistein은 caspase-9와 caspase-3를 활성화하여 세포자멸사를 시작하는 이소플라본입니다.
또한 티몰은 인간 교모세포종 세포에서 세포자멸사와 괴사를 모두 유도하는 페놀의 일종입니다.
많은 암세포에 대한 세포독성 효과를 유도하는 것 외에도 티몰은 세포막 붕괴와 DNA 손상을 일으키는 ROS 생성을 증가시킵니다.
티모퀴논은 ROS 생성의 활성화를 통해 p38 인산화를 유도하고 유방암 및 방광암에서 PI3K/Akt 신호 전달 경로를 약화시킵니다.
Ursolic acid 역시 세포 사멸을 유도하여 세포 증식을 방지하고 유방암 세포의 이동과 침입을 억제합니다.
초기 약물 개발에서 중요한 단계는 임상적으로 적절한 약물 투여 경로를 선택하여 동물 모델에서 장단기 연구를 통해 독성 프로파일을 평가하는 것입니다.
첫째, 행동 변화의 관찰은 초기 단계에서 독성을 예측하는 데 유용합니다.
예를 들어, 음식 소비와 체중의 상관관계를 평가하여 독성 효과를 해결할 수 있습니다.
이 리뷰의 모든 식물 추출물은 동물 모델에서 경구 투여 시 폐사를 일으키지 않았습니다.
또한, 이들 추출물은 Thymus vulgaris 의 에센셜 오일 추출물을 처리한 수컷 동물의 체중 변화를 제외하고는 음식/물 소비량 및 체중의 변화를 일으키지 않았습니다 .
제니스테인의 경우 고용량에서 음식 소비와 체중이 감소했습니다.
다른 화합물은 실험 중에 변경을 일으키지 않았습니다.
체중의 변화는 일반적으로 시험약물에 의해 유발된 독성 영향의 표시입니다.
유사하게, 유방암에 대한 이 화합물의 임상 시험 연구에서 환자들은 치료로 인해 체중 측정의 차이를 보여주었습니다.
이러한 임상적으로 부작용은 에너지 소비 및 신체 활동의 감소 외에도 대사 및 음식 섭취의 변화로 인해 발생합니다.
둘째, 혈액학적 매개변수의 평가는 많은 항암제가 골수에 영향을 미치고 결과적으로 혈액 생산에 변화를 일으키기 때문에 독성 연구에서 중요합니다.
위의 식물 추출물 중 M. alba 잎 추출물만이 MCV, MCHC 및 백혈구 수치를 감소시켰다.
식물 성분의 측면에서, 고용량의 제니스테인 처리는 적혈구 수를 감소시키고 망상적혈구를 증가시켰습니다.
또한, 우르솔산은 우르솔산 치료로 혈소판 수, 호중구 수 및 요소 농도의 상승을 입증한 다른 많은 연구에서와 같이 혈소판 수를 증가시켰습니다.
일부 식물 추출물 및 복합 분획의 세포 독성 효과는 혈구 생성에 변화를 일으켜 면역 체계를 억제할 수 있다는 것은 잘 알려져 있습니다.
많은 식물 추출물과 대사 산물이 적혈구에 직접 작용하는 것으로 보고되었습니다.
일반적으로 추출물과 대사 산물은 헤모글로빈을 감소시켜 조혈 작용에 영향을 줄 수 있습니다.
이러한 식물 추출물은 적혈구에 직접 작용하여 헤모글로빈을 감소시킬 수 있으며 때로는 세포를 파괴하여 더 나아가게 할 수도 있습니다.
상기 외에도 A. Baetica 추출물은 크레아티닌 농도를 증가시켰습니다.
유사하게, 티모퀴논 치료는 요소와 크레아티닌 농도를 증가시켰습니다.
증가된 크레아티닌 농도는 신장 기능의 감소 및 손상 진행과 관련이 있습니다.
크레아티닌 수치는 또한 근육량 감소와 약물의 영향을 받습니다.
그러나 이 측정은 독성과 직접적인 관련이 없으며 주로 신장의 사구체 기능을 측정하는 것입니다.
또한, 생화학적 매개변수는 새로운 화학 물질의 독성 프로파일을 평가하는 데 중요합니다.
간세포 손상을 평가하는 매개변수는 ALT, AST 및 ALP와 같은 간 트랜스아미나제입니다.
genistein, thymoquinone 및 A. Baetica, F. indica 및 C. rhizoma 추출물의 경구 투여 는 동물을 별도로 처리했을 때 ALT 및 AST 간 효소의 상승을 유발했습니다.
동물이 M. alba 로 처리되었을 때 반대 현상이 발생했습니다.잎 추출물(ALT 감소).
그러나 ACA 치료는 총 단백질, 알부민 및 글로불린의 상당한 증가를 초래했습니다.
또한, 고용량의 제니스테인은 감마 글루타밀 전이효소를 약간 증가시켰습니다.
간에서 genistein은 ATP 결합 카세트 수송체 P-당단백질의 발현과 활성을 유도했습니다.
이 화합물은 17- β -estradiol 과 구조적 유사성으로 인해 에스트로겐 수용체 α 및 β 를 활성화합니다 .
급성 간 손상은 일반적으로 ALT(알라닌 아미노전이효소)에 의해 나타나며 기준선 수준의 3배 이상으로 높게 상승합니다.
신장 기능을 평가할 때 고려해야 하는 생화학적 매개변수는 혈청 전해질, 크레아티닌 및 혈액 요소 질소 수준입니다.
사구체 기능을 평가하기 위해 가장 일반적으로 사용되는 비뇨기 변수는 혈청 크레아티닌입니다.
Thymoquinone과 P. grandifloras 추출물은 혈청 크레아티닌 수치를 증가시켰습니다.
그러나 혈청 크레아티닌은 연령, 성별, 근육량, 저단백 식이 등 크레아티닌 수치에 영향을 미칠 수 있는 다른 많은 요인이 있기 때문에 신장 기능을 평가하는 유일한 기초가 되어서는 안 됩니다.
크레아티닌 수치 외에도 혈액 요소 질소 수치는 종종 동시에 측정됩니다.
혈청 크레아티닌의 증가와 동시에 혈중 요소 질소 농도의 증가는 급성 신장 손상을 의미할 수 있습니다.
마지막으로 항암제에 의한 손상 여부를 확인하기 위해서는 조직병리학적 변화를 평가하는 것이 중요하다.
따라서 독성 연구 중에는 포괄적인 분석이 이루어져야 합니다.
리뷰에서 논의된 대부분의 식물과 화합물은 간에 변화를 일으켰습니다(표 7 및 8 ).
C. rhizoma 추출물은 간에서 간세포의 변성과 폐에서 염증 세포의 응집을 유발했습니다.
간에서 발생한 손상의 원인은 앞서 논의한 바와 같이 간세포 기능의 파괴 및 간 효소의 방출을 포함한다.
그 외에도 A. baetica신장 괴사를 일으키는 것으로 보고되었다.
이것은 독성 병변에서 자가면역 반응을 유발할 수 있는 추출물의 면역조절 특성 때문이었습니다.
Thymus vulgaris L. 에센셜 오일은 폐에서 중간 정도의 염증 침윤을 보였고 위장에서 가벼운 급성 염증을 보였습니다.
ACA는 염증성 NF- κ B 경로를 억제합니다.
ACA는 또한 동물 모델에서 폐 염증 유도에 의해 확인된 염증성 사이토카인(IL-6, IL-1 β 및 TNF- α )의 수준을 향상시켰습니다.
'약물' 카테고리의 다른 글
| 암 치료에서 전통 약초 사용과 관련된 잠재적 위험: 중동 (0) | 2022.10.10 |
|---|---|
| 천연화합물과 화학요법제의 시너지 효과 (0) | 2022.10.10 |
| 한약의 시너지 효과: 방법론 및 현재 연구에 대한 종합적인 검토 (0) | 2022.10.10 |
| 허브-약물 상호작용: 체계적인 검토 개요 (0) | 2022.10.09 |
| 허브과 약물 간의 약동학적 상호작용: 그 메커니즘과 임상적 관련성 (0) | 2022.10.09 |

