The Role of PPAR-δ in Metabolism, Inflammation, and Cancer: Many Characters of a Critical Transcription Factor
https://www.mdpi.com/1422-0067/19/11/3339/htm?utm_source=share&utm_medium=ios_app
The Role of PPAR-δ in Metabolism, Inflammation, and Cancer: Many Characters of a Critical Transcription Factor
Peroxisome proliferator-activated receptor-delta (PPAR-δ), one of three members of the PPAR group in the nuclear receptor superfamily, is a ligand-activated transcription factor. PPAR-δ regulates important cellular metabolic functions that contribute to
www.mdpi.com
PPAR-δ(Peroxisome proliferator-activated receptor-delta)는 핵 수용체 슈퍼패밀리에 있는 PPAR 그룹의 세 구성원 중 하나이며 리간드 활성화 전사 인자입니다.
PPAR-δ는 에너지 균형 유지에 기여하는 중요한 세포 대사 기능을 조절합니다.
PPAR-δ는 지방산 흡수, 수송 및 β-산화뿐만 아니라 인슐린 분비 및 감수성을 조절하는 데 특히 중요합니다.
정상 세포에서 이러한 유익한 PPAR-δ 기능은 비만, 이상지질혈증, 인슐린 저항성/2형 당뇨병, 간지방증 및 죽상동맥경화증과 같은 대사 증후군 관련 질병으로부터 보호하는 것으로 생각됩니다.
그러나 PPAR-δ 작용제의 임상 개발은 암세포가 영양 결핍 및 에너지 스트레스에 대한 방어 기전으로서 PPAR-δ 발현/활성을 상향 조절하여 생존을 개선하고 암 진행을 촉진한다는 여러 증거가 입증되었기 때문에 중단되었습니다.
소개
Peroxisome proliferator-activated receptor-delta(PPAR-δ, PPAR-β라고도 함)는 핵 수용체 슈퍼패밀리에서 PPAR 하위 그룹의 구성원입니다. PPAR은 중요한 세포 대사 기능을 조절하는 리간드 활성화 전사 인자로 작용합니다[ 1 ].
PPAR-δ는 어디에서나 발현되지만 조직마다 발현 수준은 세포 유형과 질병 상태에 따라 다릅니다
PPAR-δ에 대한 천연 리간드는 다중불포화 지방산(PUFA, 예를 들어 아라키돈산 및 리놀레산) 및 이들의 대사물(예: 프로스타사이클린/PGI 2 , 13 S -하이드록시옥타 데카디엔 산(13 S -HODE) 및 15 S -하이드록시에이코사테트라엔산)을 포함합니다. (15 S- HETE)).
PPAR-δ 리간드의 전달은 세포외 지질을 세포로 유입시키는 것을 돕는 지방산 수송 단백질(FATP) 및 지방산 트랜스로카제(FAT, CD36으로도 알려짐)과 지방산 - 세포 내에서 세포질 지질을 운반하는 결합 단백질(FABP) 의해 촉진됩니다.,
PPAR-δ와 관련하여 FABP5(K-FABP 또는 E-FABP라고도 함)는 지질 리간드를 핵으로 수송하는 데 중요한 것으로 보입니다. 흥미롭게도 FABP5 발현은 PPAR-δ의 발현과 대체로 유사하며, 둘 사이의 상호작용은 많은 암을 포함하여 정상 상태와 질병 상태 모두에서 중요한 것으로 보입니다
PPAR-δ 활성화는 유전자 발현을 전사적으로 조절하기 위해 핵의 다양한 파트너와의 상호작용을 필요로 합니다. 다른 PPAR과 마찬가지로 PPAR-δ는 레티노이드 X 수용체(RXR)와 이형이량체화되어 프로모터의 PPAR 반응 요소(PPRE)에 결합하여 다운스트림 표적 유전자의 발현을 활성화하거나 억제합니다[ 25 , 26].
리간드 결합이 없는 경우 PPAR-RXR 복합체는 전사 활성화를 방지하는 핵심억제 인자 및 히스톤 데아세틸라제와 연관됩니다.
PPAR-δ에 대한 활성화 리간드의 결합은 구조적 변화를 유도하여 공동억제제를 방출하고 보조활성화제의 결합을 허용합니다[ 8 , 27 ].
또한, PPAR은 다른 전사 인자의 전사억제에도 관여할 수 있습니다.
예를 들어, 리간드가 없는 상태에서 PPAR-δ는 BCL-6이 전염증성 사이토카인 유전자를 억제하는 것을 방지하는 전사 인자 BCL-6과 복합체를 형성하는 것으로 나타났습니다. 따라서 이 상호작용은 염증을 촉진합니다.
역으로, PPAR-δ 작용제의 결합은 복합체의 파괴를 초래하고, BCL-6은 유전자 발현을 억제하기 위해 유리된다
PPAR-δ는 또한 β-카테닌 또는 NF-κB와 같은 다른 전사 인자와 상호작용하여 유전자 발현을 조절하는 것으로 보고되었습니다[ 30 , 31 ].
축적된 증거에 따르면 PPAR-δ는 상황(예: 건강한 대 질병, 특정 유형의 질병)에 따라 뚜렷한 역할을 할 수 있습니다.
PPAR-δ는 정상 세포(예: 근육 세포 및 췌장 세포)가 불리한 영양 및 에너지 압력에 더 잘 대처할 수 있도록 하는 반면, PPAR-δ 과발현 또는 과활성화는 염증 및 종양 형성의 촉진으로 이어질 수 있습니다.
2. PPAR-δ에 의한 대사 조절
세포 에너지 소비의 조절은 PPAR-δ의 주요 기능입니다.
근육 세포에서 PPAR-δ의 리간드 활성화는 대체 에너지원으로서 해당 분해에서 지방산 산화로 에너지 생산을 전환하여 근육 지구력을 향상시킬 수 있습니다[ 32 ].
골격근 세포에서 지방산에 의한 PPAR-δ 활성화는 β-산화를 통한 지방산 흡수 및 이화작용을 증가시킵니다
골격근 세포에서 유전적으로 표적화되는 PPAR-δ 과발현은 강화된 지방산 산화 능력으로 숙시네이트-탈수소효소-양성 근육 섬유를 증가시키고 전반적인 체지방 감소로 이어집니다
지방산 산화에 대한 효과 외에도 PPAR-δ는 여러 메커니즘을 통해 혈당 항상성을 개선합니다.
PPAR-δ는 췌도 베타 세포에서 강력하게 발현되어 인슐린 분비를 촉진합니다[ 38 , 39 ].
또한 간 및 말초 에너지 기질 이용에 대한 효과를 통해 인슐린 저항성을 예방합니다[ 40 , 41 , 42 ].
정상 세포에서 이러한 유익한 PPAR-δ 기능은 비만, 이상지질혈증, 인슐린 저항성, 간지방증 및 죽상동맥경화증과 같은 대사 증후군 관련 질병으로부터 보호하는 것으로 생각됩니다[ 44 , 45 ].
그러나 열악한 대사 미세 환경에 대한 세포 내성을 개선하면 암세포의 생존도 촉진할 수 있습니다( 그림 1).
예를 들어, PPAR-δ의 과발현은 다양한 메커니즘(예: 향상된 항산화 신호 전달, AKT/단백질 키나제 B 활성화)을 통해 저포도당 또는 저산소 세포 배양 조건에서 유방암 세포 생존을 개선하는 것으로 나타났으며, 증가된 세포 생존은 PPAR-δ 길항제로 억제되었습니다.
다른 연구에서는 지방산 산화의 PPAR-δ 촉진이 ATP 생성을 증가시켜 유방암 세포[ 48 ]뿐만 아니라 만성 림프구성 백혈병 세포[ 49 ] 와 같은 다른 암세포 의 생존에도 기여할 수 있음을 보여주었습니다 .
PPAR-δ의 잠재적인 protumorigenic 효과에 대한 우려로 인해 PPAR-δ 효능제의 임상 개발이 중단되었습니다
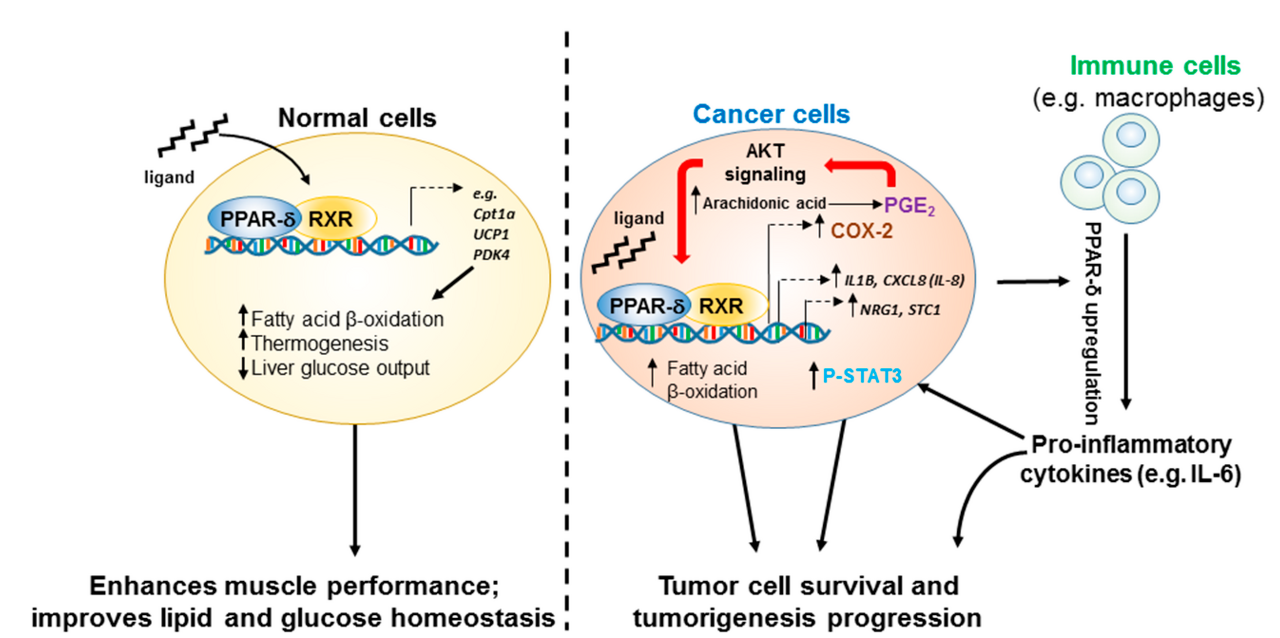
그림 1. 정상 세포 대 암세포에서 PPAR-δ의 리간드 의존적 작용.
정상 세포에서 PPAR-δ 작용제의 결합( 왼쪽 )은 지방산을 에너지원으로 사용하는 것으로의 전환(β-산화 증가)과 관련된 유전자의 상향 조절로 이어집니다.
또한 췌장, 지방, 간 및 근육을 포함한 여러 조직에 대한 효과를 통해 혈청 포도당 조절의 전신적 개선과 관련이 있습니다.
암세포에서( 오른쪽), 에너지원으로 지방산 기질의 사용을 촉진하는 PPAR-δ의 능력은 종양에서 자주 발견되는 가혹한 대사 조건에서 세포 생존과 증식을 향상시킬 수 있습니다.
또한 COX-2 및 PI3K/AKT 신호 전달 경로는 종양 세포에서 종종 상향 조절됩니다.
활성화된 PPAR-δ와 이러한 주요 신호 허브의 상호 작용은 암 세포 자체 및 비암 세포(예: 종양 관련 대식세포)에서 신생물 과정을 향상시키는 추가 인자의 상향 조절을 통해 암 발달 및 진행을 촉진하는 피드포워드 회로의 설정으로 이어집니다. ) 종양 미세 환경을 구성합니다.
암에서 PPAR-δ의 역할
1. 염증과 암 사이의 PPAR-δ 상호작용
종양 형성 촉진에서 만성 염증의 역할은 잘 알려져 있으며 암 발병의 특징으로 간주됩니다[ 68 , 69 ].
염증 촉진 종양 형성에 대한 PPAR-δ의 영향은 특히 프로스타글란딘 E2(PGE2)의 경우와 같이 지질 신호와
관련하여 다양한 그룹에서 연구되었습니다. PGE2는 사이클로옥시게나제(COX-1 및 -2)의 작용을 통해 생성된 에이코사노이드 지질 매개체입니다. COX-2/PGE2 신호전달은 종양에서 자주 상향 조절되며 염증 유발 종양 형성의 맥락에서 특히 중요합니다.
결장 종양 형성의 경우에 특히 잘 연구되었습니다[ 72 ]. PGE 2 는 PI3 키나제/AKT 활성화를 통해 PPAR-δ 전사 활성을 향상시켜 APC Min 마우스 에서 시험관 내 결장암 세포 생존 및 장 종양 형성을 촉진합니다
종합하면, 이러한 발견은 PPAR-δ와 COX-2 사이의 양성 피드백 루프가 종양 형성을 향상시키기 위해 전염증성 미세 환경을 조정한다는 것을 시사합니다.
PPAR-δ의 염증 및 종양 형성 촉진은 결장에만 국한되지 않습니다. 종양 형성은 종양 성장에 도움이 되는 미세 환경을 만들기 위해 염증 기계의 다양한 구성 요소의 용도를 변경합니다.
예를 들어, PPAR-δ는 난소암 관련 복수의 종양 관련 대식세포(TAM)에서 상향 조절되며[ 79 ], 추가 연구에서는 난소암과 관련된 대식세포가 원발성 특성(예: 면역억제, 성장 촉진)을 나타내는 경향이 있음을 보여주었습니다.
마찬가지로, PPAR-δ와 COX-2 신호전달 사이의 유사한 양성 피드백 루프가 간세포 암종 세포주의 생존을 향상시키는 것으로 입증되었습니다[ 82 ].
PPAR-δ는 특히 PPAR-δ와 COX-2 사이의 양성 피드백의 경우에 예시된 바와 같이 전염증성 및 전종양성 메커니즘의 향상을 통해 염증 유발 종양 형성 촉진을 강력하게 시행합니다.( 도 1 ).
2. 암의 PPAR-δ 촉진
암에 대한 PPAR-δ의 관계는 여전히 논란의 여지가 있지만, 더 많은 데이터가 계속 발표됨에 따라 종양 형성 과정에 대한 PPAR-δ의 특정 기여도가 더 명확해져야 합니다.
PPAR-δ는 결장직장암(CRC)을 비롯한 다양한 인간 암에서 과발현되며 , 이 경우 초기 단계(예: 선종)에서도 상향조절될 수 있습니다[ 84 ].
유사하게, PPAR-δ는 췌장암을 비롯한 다른 인간 악성 종양에서 상향 조절되며, 여기서 상향 조절은 더 높은 병리학적 등급 및 전이 위험 증가와 상관관계가 있습니다[ 87 ].
PPAR-δ는 인간 폐암에서도 발현되는 것으로 알려져 있습니다[ 88].
흥미롭게도, 면역조직화학에 의해 평가된 PPAR-δ 단백질 발현은 정상 세포의 핵에서만 관찰되었지만 암세포에서는 핵 및 세포질로 변합니다[ 85 , 86 ].
기능과 관련하여 PPAR-δ 분포에서 이러한 이동의 중요성은 알려져 있지 않습니다.
일반적으로 인간 암에서 높은 PPAR-δ 발현은 부정적인 생존 결과와 관련이 있습니다[ 67 , 86 ].
종양 형성에서 PPAR-δ의 역할에 관한 논쟁은 주로 다음 예에서 설명하는 전임상 연구에서 비롯됩니다.
PPAR-δ 하향 조절이 암 또는 비암 세포는 전이를 억제했지만 이 효과는 암세포에서 PPARδ 발현이 억제되었을 때 더 강력했습니다 [ 86].
전반적으로, PPAR-δ가 여러 조직/종양 유형에서 종양 형성의 시작 및 진행 모두에 크게 기여하는 시나리오가 등장하고 있습니다.
결론
PPAR-δ는 대사와 염증을 조절하는 중요한 세포 기능에 지대한 영향을 미치는 전사 인자입니다.
대사 스위치로 작용하는 PPAR-δ의 능력은 해당 작용에서 지방산 β-산화로 세포 에너지 이용을 전환하여 전신 혈당 조절 및 지질 대사를 개선하여 대사 증후군 관련 질병의 예방 또는 치료를 위한 매력적인 표적이 됩니다. 예: 비만, 이상지질혈증, 당뇨병).
그럼에도 불구하고 새로운 데이터에 따르면 정상 세포가 환경 대사 문제를 견디도록 돕는 이와 동일한 PPAR-δ 유발 메커니즘이 암세포가 생존을 촉진하고 궁극적으로 암 진행을 촉진할 수 있음을 시사합니다( 그림 1).
따라서, 대사 질환을 치료하기 위해 PPAR-δ 활성화를 표적으로 하는 미래 치료제는 의도하지 않은 전종양 또는 신생물 병변의 촉진을 포함하여 잠재적 위험 및 표적을 벗어난 영향에 대해 신중하게 설계되고 평가되어야 합니다.
'전사인자' 카테고리의 다른 글
| PPARs 와 암 치료 (0) | 2021.10.02 |
|---|---|
| PPAR: 암 치료의 양날의 검? (0) | 2021.10.02 |
| 암 줄기 세포를 표적으로 하는 대사 기반 치료 전략 (0) | 2021.09.25 |
| 세포 생존 신호 경로의 미세 조정을 통한 파이토케미컬로 암 표적화 (0) | 2021.09.13 |
| HIF-1α의 강력한 억제제로서의 천연물 (0) | 2021.09.09 |