PPARs: A Double-Edged Sword in Cancer Therapy?
PPARs Mediate Lipid Signaling in Inflammation and Cancer
https://www.hindawi.com/journals/ppar/2008/134059/
PPARs Mediate Lipid Signaling in Inflammation and Cancer
Lipid mediators can trigger physiological responses by activating nuclear hormone receptors, such as the peroxisome proliferator-activated receptors (PPARs). PPARs, in turn, control the expression of networks of genes encoding proteins involved in all aspe
www.hindawi.com
지질 매개체는 PPAR(peroxisome proliferator-activated receptors)과 같은 핵 호르몬 수용체를 활성화하여 생리학적 반응을 유발할 수 있습니다.
PPAR은 차례로 지질 대사의 모든 측면에 관여하는 단백질을 암호화하는 유전자 네트워크의 발현을 제어합니다.
또한, PPAR은 암세포의 세포 사멸, 증식 및 분화의 조절과 종양 세포 환경, 즉 혈관 신생, 염증 및 면역 세포 기능에 대한 작용을 통해 종양 성장 조절제입니다.
신호 지질은 전신 생리학적 반응을 유발하고 염증 반응을 조절하며 세포 에너지 대사, 세포 생존, 증식, 이동 및 분화와 같은 주요 세포 과정을 조절하는 것으로 알려져 있습니다[1].
이러한 지질 중 지방산, 다양한 지방산 유도체, 일부 에이코사노이드 및 스테롤 유도체는 핵 호르몬 수용체(NHR) 과산화소체 증식자 활성화 수용체(PPAR), 간 X 수용체(LXR) 및 파르네소이드 X 수용체의 결합 및 활성화를 통한 유전자 발현 조절제입니다.
이러한 전사 인자는 지질 항상성을 조절하는 유전자[2], 특히 PPAR의 경우 염증 반응[3]을 제어합니다.
지질 신호 및/또는 NHR 경로의 장애는 비만, 제2형 당뇨병, 만성 염증, 심혈관 질환, 암, 고혈압, 퇴행성 질환, 자가면역 질환 및 기타 몇 가지와 같은 불균형 및 질병의 긴 목록의 진행을 촉진합니다. 1, 2].
지질 신호와 NHR 경로 사이에 중요한 교차 조절이 존재하며, 이는 종종 조직 특이적 신호 네트워크에 따라 다양한 반응을 생성합니다
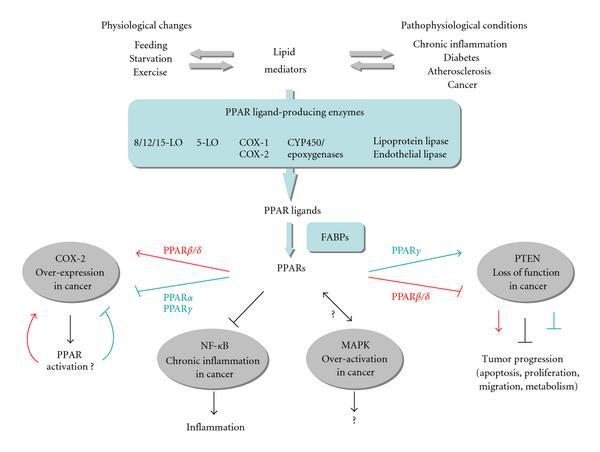
PPAR은 염증과 암에서 지질 신호 전달의 매개체입니다.
지질 매개체는 생리학적 및 병태생리학적 상황의 조절에서 비롯되고 참여합니다.
많은 지질 변형 효소가 PPAR 리간드의 생산에 관여합니다.
사이클로옥시게나제(COX), 리폭시게나제(LO), 에폭시게나제/사이토크롬(CYP)/P450s 효소 및 리파제는 지방산, 트리글리세리드 또는 인지질을 기질로 사용하여 PPAR 리간드를 생성하고, 이는 세포질 지방에 의해 수용체로 안내됩니다.
산 결합 단백질(FABP). PPAR은 이러한 지질 신호를 반응으로 변환하여 에너지 항상성을 유지하고 염증을 조절하며 종양 성장을 수정합니다. .
염증 및 암과 관련된 경로 중 PPAR은 COX2, NF- κ B, MAPK 및 PTEN과 상호 작용 합니다.
PPARα 와 γ 는 COX2 발현을 억제하여 그들 자신의 리간드 생성을 감소시킨다.
반대로, PPAR β / δ 는 COX2 발현을 활성화시켜 PPAR 리간드의 생성을 증가시켜 양성 피드백 루프를 생성하는 것으로 생각됩니다.
PPAR은 만성 염증과 암 촉진을 연결하는 주요 경로인 NF- κ B 를 억제하여 염증을 감소시킵니다 .
PPAR과 MAPK 사이의 여러 상호 작용 모드가 보고되었지만 이러한 누화의 관련성과 결과는 불분명합니다.
마지막으로, PPAR β / δ 및 γ종양 억제 인자 PTEN(염색체 10에서 결실된 포스파타제 및 텐신 상동체)의 발현을 각각 감소 및 증가시킨다.
PTEN의 PPAR γ 활성화는 종양 억제인자 기능을 강화하는 것으로 생각되는 반면, PPAR β / δ 는 반대 효과를 가질 것입니다
염증 및 암에서의 PPAR
급성 염증은 부상이나 감염 후 유기체를 보호하기 위해 필요한 과정이지만, 해결되지 않은 만성 염증은 종양 성장에 적절한 환경을 제공하여 암 형성을 촉진할 수 있습니다[ 33 , 34 ].
예를 들어, 간염 다음에는 간암이 발생하는 경우가 많고 궤양성 대장염은 결장암의 위험인자이며 헬리코박터 파일로리 감염으로 인한 염증 이 대부분의 위암에 선행합니다[ 34]. 폐에서도 천식이나 만성 기관지염을 앓고 있는 환자에서 폐암 발병 위험이 더 높습니다[ 37 , 38 ].
종양 발달에서 면역 세포의 역할은 아직 완전히 이해되지 않았습니다. 염증 매개체가 암 발병을 촉진할 수 있지만 면역 세포는 또한 종양 진행을 제한할 수 있는 사이토카인을 분비할 수 있습니다[ 33 – 35 ].
현재 지식에 기초하여, NF- κ B 및 COX2 경로는 염증과 암 사이의 중요한 연결 고리로 부상했습니다
염증 및 종양 발달을 촉진하는 COX2와 일치하게, NSAID의 장기간 사용은 비록 상대적으로 고용량이지만 결장직장 종양 발달을 예방합니다[ 43 ].
종양 발달에서 PPAR의 역할은 여전히 불분명하고 이들의 발암성 또는 항암 효과는 논의의 여지가 있습니다
PPAR 활성은 간, 결장, 피부, 전립선, 유방 및 폐와 같은 기관의 수많은 암 유형과 관련이 있습니다
지금까지 보고된 메커니즘은 PPAR의 항암 활성이 세포 주기의 억제, 세포 분화의 활성화 또는 세포 사멸과 같은 암세포 자체의 직접적인 영향 때문이라고 제안합니다([ 7 , 45 에서 검토됨]]).
그러나 이러한 기능 외에도 PPAR이 종양 환경에 작용하여 비세포 자율적 효과non-cell autonomous effects를 가질 수 있다고 추측할 수 있습니다.
사실, PPAR에 염증 과정 , 그리고 그것들은 면역 또는 내피 세포와 종양 기질의 중요한 구성 요소이다
'전사인자' 카테고리의 다른 글
| PPAR 매개 독성학 및 응용 약리학 (0) | 2021.10.02 |
|---|---|
| PPARs 와 암 치료 (0) | 2021.10.02 |
| 대사, 염증 및 암에서 PPAR-δ의 역할 (0) | 2021.10.02 |
| 암 줄기 세포를 표적으로 하는 대사 기반 치료 전략 (0) | 2021.09.25 |
| 세포 생존 신호 경로의 미세 조정을 통한 파이토케미컬로 암 표적화 (0) | 2021.09.13 |