2022
Natural products-based nanoformulations | IJN
We summarize the recent progress of NPNs targeting CSCs in cancer therapy & look forward to transforming preclinical research results into clinical applications
www.dovepress.com
Natural Products-Based Nanoformulations: A New Approach Targeting CSCs to Cancer Therapy
암 줄기 세포(CSC)는 강력한 종양 형성, 자가 재생 및 다방향 분화 능력으로 인해 암의 발생 및 진행을 유도합니다.
기존의 암 치료 방법은 암 줄기세포를 효과적으로 죽이거나 억제하지 못하고 오히려 증식, 침윤, 전이 능력이 강해져서 암 재발과 치료 저항성이 생겨 임상 치료에 어려운 문제가 되었습니다.
따라서 CSC를 표적으로 하는 것은 미래에 포괄적인 암 치료를 위한 가장 유망한 접근법이 될 수 있습니다.
다양한 천연물(NP)은 상당한 항종양 효과를 가지며 CSC를 표적으로 하고 억제하는 것으로 확인되었습니다.
그러나 약동학적 결함과 표적 외 효과는 임상 번역을 크게 방해했습니다.
NP 기반 나노제형(NPN)은 부위 특이적 전달을 통해 그리고 약동학적 매개변수를 개선함으로써 CSC에 대한 NP의 단점을 극복할 수 있는 엄청난 잠재력을 가지고 있습니다.
전이, 재발 및 다제내성(MDR)은 현재 암 치료의 주요 과제입니다.
기존의 암 치료는 건강한 조직의 손상, 심각한 부작용, MDR 등 여러 가지 단점이 있습니다.
암 줄기 세포(CSC)는 높은 자가 재생, 다방향 분화 가능성 및 종양 형성 능력을 가진 종양 조직의 특수화된 세포 하위 집합이며 악성 증식, 침습, 전이, 약물 내성 및 종양 재발의 원동력입니다.
CSC가 치료 저항성에 중요한 역할을 하기 때문에 기존 종양 요법의 전반적인 임상 효능을 현재 수준에서 크게 개선하기가 어려웠습니다. .
의심할 여지 없이, CSC를 표적으로 하는 새로운 치료 전략은 암 치료에 대한 새로운 접근 방식을 가져올 것입니다.
표면 마커, 신호 전달 경로, 미세 환경, 대사 기능 및 CSC의 분화를 표적으로 함으로써 전임상 연구 또는 임상 시험에서 CSC의 다양한 억제제가 조사되었습니다.
한편, 기존의 일부 억제제는 필연적으로 어지러움 및 위장 반응과 같은 특정 부작용이 있어 암 줄기세포를 표적으로 하는 암 치료제의 임상 약물 개발을 심각하게 제한합니다.
커큐민, 설포라판, 케르세틴 및 베르베린과 같은 많은 천연 제품(NP)이 CSC를 표적으로 하여 유망한 항암 활성을 갖는다는 증거가 증가하고 있습니다.
NP의 놀라운 건강상의 이점이 밝혀졌지만 암 치료에서의 광범위한 사용은 수용성, 흡수, 생체 이용률 및 표적화 측면에서 제한으로 인해 심각하게 제한됩니다.
종양 조직에서 약물 내성 및 공격적인 CSC를 구체적으로 표적화함으로써, 나노입자 로딩 약물은 부작용을 최소화하고 환자의 고통을 경감시키면서 환자의 생존을 향상시킬 수 있습니다
CSC
암은 매우 이질적인 조직이며 유전적 돌연변이, 미세 환경 및 CSC의 존재와 같은 다양한 메커니즘이 이질성에 기여합니다.
CSC는 불멸화 또는 악성 클론 방식으로 종양을 유지하고 이종 암세포로 분화하여 원발성 종양의 진행 및 새로운 종양의 발달을 유도합니다.
CSC는 성숙한 종양 세포의 돌연변이 또는 역분화로 인해 자가 재생 능력을 획득한 자가 재생 정상 줄기 세포 또는 전구 세포에서 유래할 수 있습니다.
연구에 따르면 정상 줄기 세포는 첫 번째 발암성 돌연변이 이후 점차적으로 전암성 줄기 세포 및 CSC로 발전한 다음 돌연변이원 및 미세 환경의 영향으로 돌연변이를 추가로 축적하여 종양의 이질성을 증가시켜 제어되지 않은 세포 성장 및 종양 발달, 전이, 치료 저항성 및 재발 을 촉진하는 것으로 나타났습니다. 20 , 21 ( 그림 1 ).
그림 1 CSC 및 종양 진행.
정상 줄기 세포는 multipotent progenitor cells, committed progenitor cells, and mature differentiated cells를 생성합니다.
발암성 돌연변이, 미세환경 변화 및 후성유전학적 변형은 CSC의 출현 및 비정상적인 증식을 유발하여 악성 종양의 발달 및 진행을 촉진합니다.

CSC의 가장 중요한 특징은 지속적으로 자가 재생하고 다방향 종양 분화를 유지하는 능력입니다.
정상 줄기 세포의 자가 재생 및 분화 경로는 Wingless-related integration site(Wnt), Notch, Hedgehog, Janus kinase-signal transducer and activator of transcription(JAK-STAT), Transforming growth factor-β(TGF-β) 및 기타 신호 전달 경로에 의해 엄격하게 조절됩니다.
그리고 이러한 경로는 CSC에서 크게 조절 장애 됩니다.
이러한 신호 경로는 개별적으로 단일 조절자로 작용하지 않고 CSC의 줄기를 함께 조절하는 얽힌 신호 네트워크를 형성하여 자가 재생, 증식 및 다방향 분화뿐만 아니라 종양 형성을 개시하는 CSC의 무한한 잠재력을 초래하며, 종양 이질성을 재구성하고 화학방사선 요법에 대한 내성을 제공합니다.
CSC는 Krüppel-like factor 4(Klf4), Nanog, Notch, CD24, CD26, CD44, CD133, CD166, 알데히드 탈수소효소(ALDH) 및 상피 세포 접착 분자(EpCAM)와 같은 다양한 줄기 관련 유전자 및 마커를 특이적으로 발현합니다.
이러한 줄기 세포 관련 유전자 및 표면 마커의 발현은 종양 형성을 크게 촉진하고 줄기 세포의 분리 및 식별을 용이하게 할 수 있습니다.
또한 CSC는 생물학적 특성(세포 주기 정지, DNA 손상 복구, 약물 유출, 상피-중간엽 전이(EMT) 등)과 종양 미세 환경(저산소 환경, 암 -관련 섬유아세포, 만성 염증 등)의 보호 효과로 인해, 줄기 특성을 협력적으로 유지하여, 이는 종양 치료의 어려움을 증가시킵니다.
더욱이, CSC는 효율적인 DNA 복구 시스템을 가지고 있으며 저항을 가능하게 하고 종양 미세 환경 줄기 틈새 내에서 보호되기 위한 코어-투-엣지 전환 프로파일을 나타냅니다.
또한 후성유전학적 기전은 CSC의 형성 및 기능, 종양 이질성, 종양원성, 종양 발달 및 전이에 중요한 역할을 합니다.
후성 유전적 변형과 종양 생존 미세 환경 간의 상호 작용은 CSC의 가소성을 조절하고 종양의 구조를 형성합니다.
따라서 CSC와 관련된 조절 모드는 상호 작용하고 CSC의 복잡한 조절 네트워크를 구성하여 암 치료의 어려움을 증가시킵니다( 그림 2 ).
그림 2 CSC 관련 악성 종양 행동.
CSC는 유방암 및 위암과 같은 이질적인 종양 세포를 생성하고 자가 재생될 수 있는 종양의 세포입니다.
CSC의 존재는 종양 형성, 성장, 전이, EMT, 약물 내성 및 재발을 촉진합니다.

위에서 설명한 CSC의 복잡한 특성으로 인해 기존의 암 치료 옵션은 제한된 증식 잠재력을 가진 암세포만 죽일 수 있는 반면 농축된 CSC는 종양 재건으로 이어집니다.
CSC의 존재는 CSC 제거를 목표로 하는 암에 대한 혁신적인 치료 전략의 설계에 영감을 주었습니다.
따라서 CSC를 표적으로 하는 것은 표면 항원에 대한 단일 클론 항체의 개발이든, CSC의 자가 재생 경로 또는 CSC 미세 환경의 분화 및 조절 유도이든, CSC를 표적으로 하는 가능한 새로운 치료 전략으로서 치료 결과를 개선하기 위한 보다 유망한 접근 방식으로 간주됩니다.
그림 3 NP에 대한 약물 전달 나노운반체.
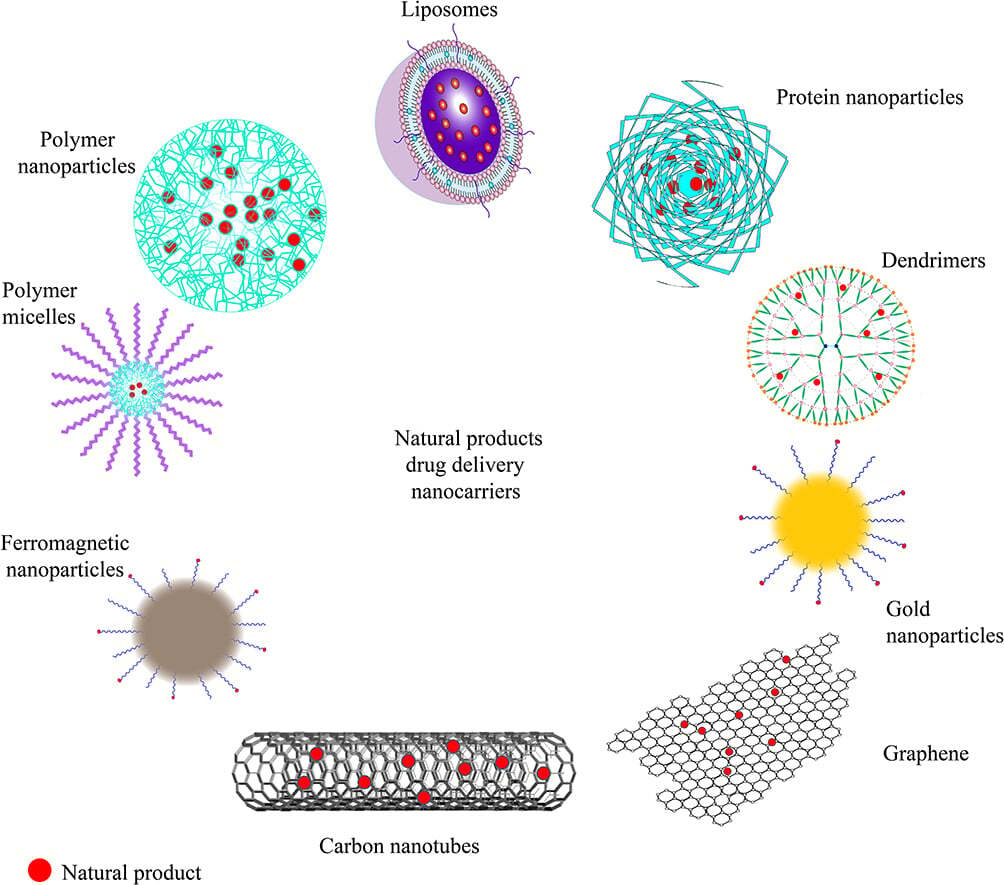
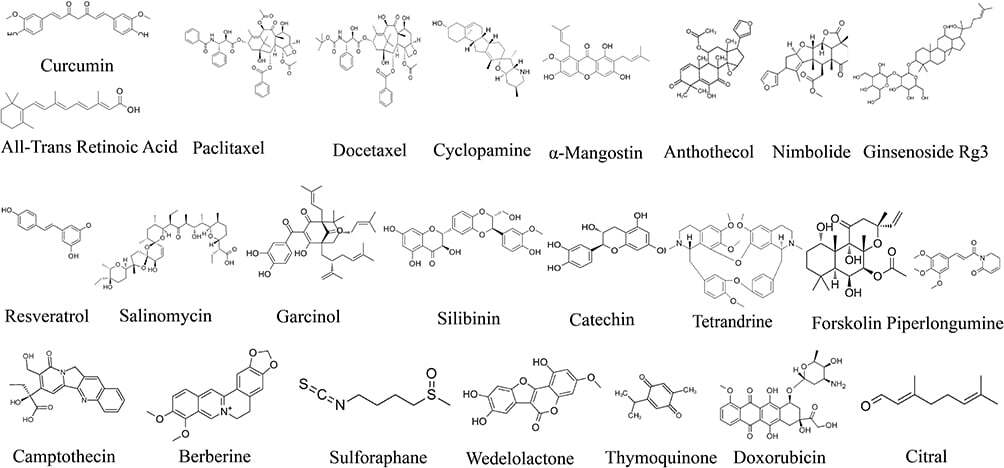
그림 4 CSC를 표적으로 하는 NP의 화학 구조.
CSC를 표적으로 하는 NPN
나노운반체는 커큐민, 파클리탁셀, 사이클로파민, 올-트랜스 레티노산, 레스베라트롤 및 실리비닌과 같은 NP가 표적 기관에 도달하기 전에 안정적인 형태를 유지하도록 하고 ( 그림 4 ),
CSC를 정확하게 표적화하기 위한 NP의 제어 가능한 방출은 종양에 대한 치료 효과를 상당히 향상시킨다.
커큐민
커큐민은 증식을 억제하고 세포자멸사를 유도하며 MDR을 역전시켜 탁월한 항종양 효과를 발휘합니다.
커큐민은 신경교종 및 유방암, 결장직장암, 췌장암, 뇌암 및 식도암과 같은 다양한 유형의 암에서 CSC를 억제할 수 있습니다.
그럼에도 불구하고, 그것의 치료 잠재력은 열악한 생체 이용률로 인해 제한됩니다.
나노입자 및 리포솜과 같은 나노기술 기반 약물 전달 시스템은 CSC를 표적으로 하는 커큐민을 촉진하여 생체이용률, 세포 흡수 및 항종양 활성을 향상시킬 수 있습니다( 그림 5 , 표 1 ).
표 1 커큐민을 포함하는 NP 기반 나노제형의 특성
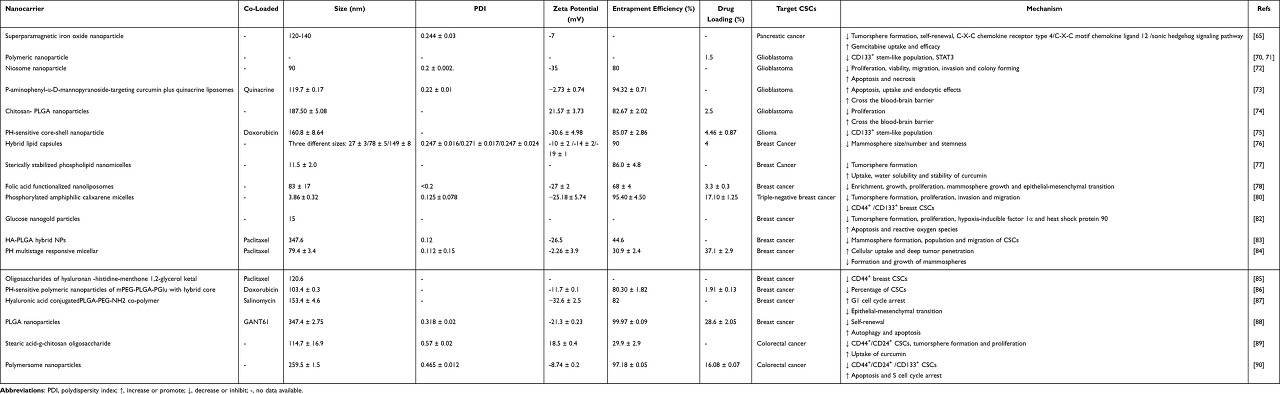
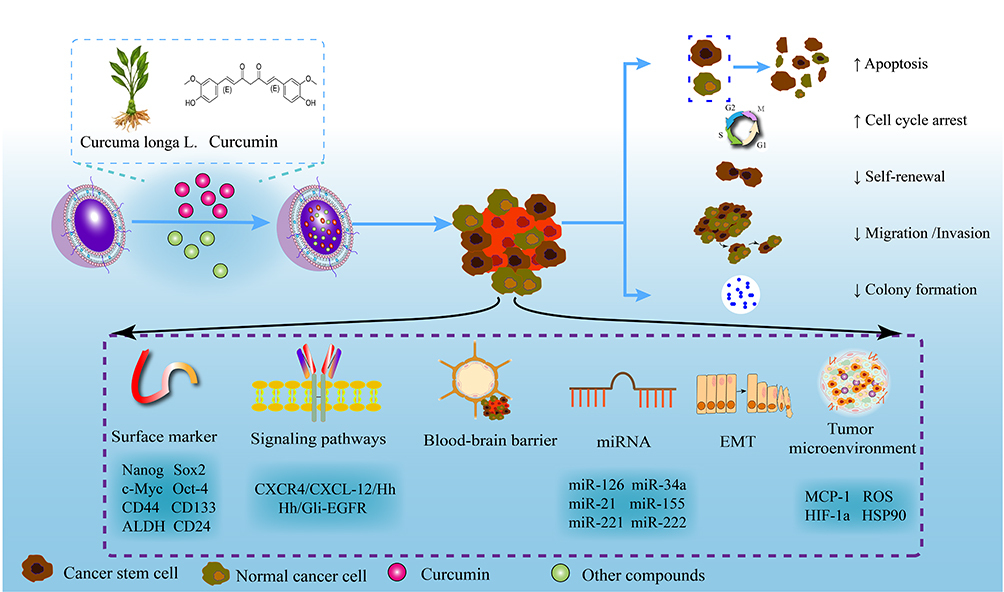
그림 5 curcumin nanoformulations에 의한 CSCs 표적화 메커니즘.
나노기술 기반 약물 전달 시스템은 커큐민의 생체이용률과 항종양 활성을 개선하고 CSC에 대한 커큐민의 표적화를 촉진할 수 있습니다.
표면 마커, 신호 전달 경로, 종양 미세 환경, EMT 및 CSC의 기타 메커니즘을 조절함으로써 커큐민 나노제형은 췌장암, 유방암, 결장직장암, 신경교종 및 기타 암에 대해 탁월한 효능을 보여주었습니다
파클리탁셀
Docetaxel
Cyclopamine
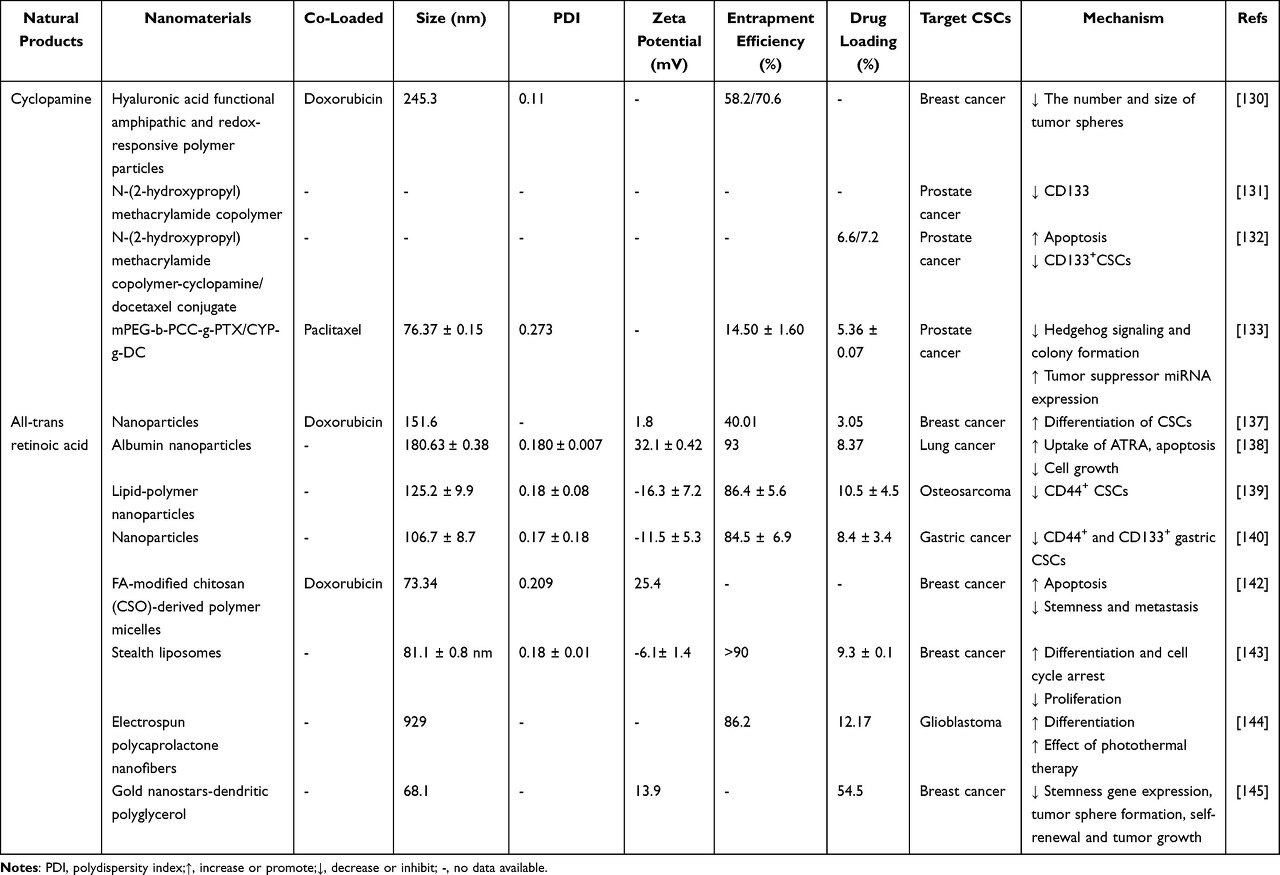
All-Trans Retinoic Acid
ATRA(All-trans retinoic acid)는 비타민 A의 주요 자연 대사 산물입니다.
ATRA의 항암 효능은 저독성 세포 분화제로서 다양한 악성 종양에서 광범위하게 연구되었습니다.
ATRA는 레티노산 수용체와 레티노이드 X 수용체를 활성화하여 유전자 전사를 조절하고, 줄기세포 분화를 유도하며, 줄기세포 유지와 관련된 신호전달 경로를 조절함으로써 CSC를 표적화하는 탁월한 능력을 보여주었습니다.
그러나 ATRA의 낮은 용해도와 안정성으로 인해 빠르게 제거되어 혈장 중 ATRA 농도가 급격히 감소하고 심각한 용량 의존적 부작용이 발생합니다.
나노 입자에 캡슐화된 ATRA는 분해로부터 보호할 것으로 예상되며 ATRA를 CSC로 표적화하면 CSC가 더 분화된 상태로 이동하도록 자극하여 화학 요법에 더 나은 반응을 보일 수 있습니다( 표 3 ).
암에는 종종 표현형이 다른 여러 CSC 집단이 있으며, 이는 단 하나의 CSC 집단을 표적으로 하는 것만으로는 CSC를 완전히 제거하기에 충분하지 않으므로 여러 CSC 하위 집단을 동시에 표적화하면 더 나은 결과를 얻을 수 있음을 시사합니다.
화학요법 약물인 독소루비신은 다양한 암을 치료하는 데 사용되어 왔지만 많은 고형 종양의 암 줄기세포는 이에 내성이 있어 치료 후 암 줄기세포를 더욱 풍부하게 하여 화학 저항성, 종양 재발 및 전이를 유발할 수 있습니다.
Sun 등은 ATRA와 독소루비신을 동시에 캡슐화하는 나노입자를 준비했는데, 이는 시너지 방식으로 종양 조직과 CSC에서 약물의 농축을 효과적으로 증가시키고 유방 종양에서 CSC를 감소시켰습니다.
ATRA와 독소루비신은 동시에 CSC에 전달되었습니다.
ATRA는 CSC의 분화를 유도하여 치료 후 CSC 농축을 유발하지 않으면서 종양 개시 능력을 약화시키고 후속적으로 독소루비신의 세포독성을 향상시켰다.
동시에, 생체 내 실험에서도 ATRA와 독소루비신의 병용 투여가 종양 성장에 대한 유의한 상승적 억제 효과를 확인했습니다
또한 ATRA와 온열 요법의 조합도 CSC 제거에 효과적인 전략입니다.
전기방사된 폴리카프로락톤(PCL) 나노섬유 시스템에서 수산화 다중벽 탄소 나노튜브(MWCNTs-OH)와 ATRA의 조합은 CSC의 줄기를 파괴하고 CSC의 효과를 개선하기 위해 온열 요법에 대한 내성을 감소시킬 수 있습니다.
생체 내 및 시험관 내 실험 모두에서 ATRA가 CSC 분화를 유도한 후 다중벽 탄소 나노튜브가 근적외선에서 열을 발생시키고 신경아교종 줄기 세포의 활성을 현저하게 억제하고 더 많은 CSC를 죽인다는 것을 보여주었습니다
RA는 줄기세포 유전자 발현, CSC 주도 종양 구체 형성, CSC 자가 재생 및 종양 성장을 억제하는 상승적 억제 방식으로 광열 요법과 결합하여 CSC 분화를 유도합니다.
이것은 특히 CSC를 제거하기 위해 광열 요법을 포함한 기존 암 치료법의 효능을 향상시키는 방법을 제시합니다.
플라보노이드
표 4 플라보노이드 또는 알칼로이드를 포함하는 NP 기반 나노제형의 특성
α-망고스틴은 가르시니아 망고스타나( Garcinia mangostana )의 생리활성 플라보노이드이며 우수한 항종양 특성이 있는 것으로 입증되었습니다.
α-망고스틴으로 코팅된 PLGA 나노입자(Mang-NPs)는 CSC와 암세포에 쉽게 흡수되어 정상 상피 세포에 영향을 주지 않으면서 세포 생존, 증식, 집락 형성, EMT를 억제하고 세포자멸사를 유도합니다.
더 중요한 것은 Notch, sonic hedgehog 경로 및 그 다운스트림 표적, 줄기 세포 마커(CD24, CD133, CD44, Musashi 및 Lgr5) 및 만능 유지 인자(Oct4, Sox-2, Klf-4, c-myc 및 Nanog)의 발현을 억제함으로써, Mang-NP는 CSC의 자가 재생 능력을 유의하게 억제하여 암 진행, 전이, 약물 내성 및 재발을 차단하는 CSC 신호 전달 경로를 표적으로 하는 나노기술의 큰 잠재력을 시사합니다.
마찬가지로, 가르시놀은 가르시니아 속에 매우 풍부한 폴리이소프레닐화 벤조페논 유도체입니다 .
저산소증 유발 인자(HIF-1α 및 HIF-2α)와 Notch 경로를 하향 조절하여 세포자멸사를 유도하고 CSC 증식을 억제함으로써 가르시놀 나노제형은 저산소 미세 환경에서 성장하는 CD44+ 유방 CSC를 억제할 수 있었습니다.
실리비닌은 밀크 씨슬 ( Silybum marianum L. Gaertn)의 열매와 씨앗에서 분리된 플라보노이드 화합물로 임상에서 간보호제로 널리 사용되어 왔습니다
또한, 다양한 암에서 microRNA(miRNA 또는 miR)의 비정상적인 상향/하향 조절이 확인되었으며 줄기 세포의 자가 재생 및 분화에 중요한 역할을 합니다.
따라서 항암 효과가 있는 NP에 의한 종양 억제인자 miR의 상향 조절 및 종양 miR 발현의 하향 조절은 표적 암 줄기세포에 대한 새로운 접근 방식일 수 있습니다.
Tehrani 등은 종양 miR(miR-21, miR-155 및 miR-221)을 억제하고 종양 억제인자 miR(miR-34a, miR-126 및 miR-let7b) 및 이들의 표적 발현을 유도함으로써 silibinin은 apoptosis를 유도하고 췌장 세포와 CSC의 이동과 증식을 억제했습니다.
이것은 줄기 세포와 관련된 miRNA의 기능을 조절하여 CSC를 표적화하는 것이 실현 가능하고 유망한 접근 방식임을 시사합니다.
녹차를 포함한 다양한 식물에서 발견되는 플라보노이드인 카테킨은 암 치료의 보조제로 널리 간주됩니다.
관련 전사인자와 조절인자(Nanog, Oct4, β-catenin 포함)의 발현을 억제하며, 시너지 효과를 통해 전립선 암 줄기세포를 박멸할 것으로 기대되는 암세포의 방사선 감수성을 크게 증가시킨다.
또한 레스베라트롤은 잘 알려진 천연 폴리페놀 유기 화합물로 세포자멸사(카스파제 3/7, P53 조절)를 유도하고, 염증성 사이토카인(예: TNF-α, IL-6, IL-1β 등)의 생성을 조절하고, 이종이식 마우스 모델 시스템에서 전이(CD133, ALDH1, CXCR4 등) 및 혈관신생 마커(기질 금속단백분해효소, 유도성 산화질소 합성효소, 혈관 내피 성장 인자 -A 등)의 발현을 억제한다.
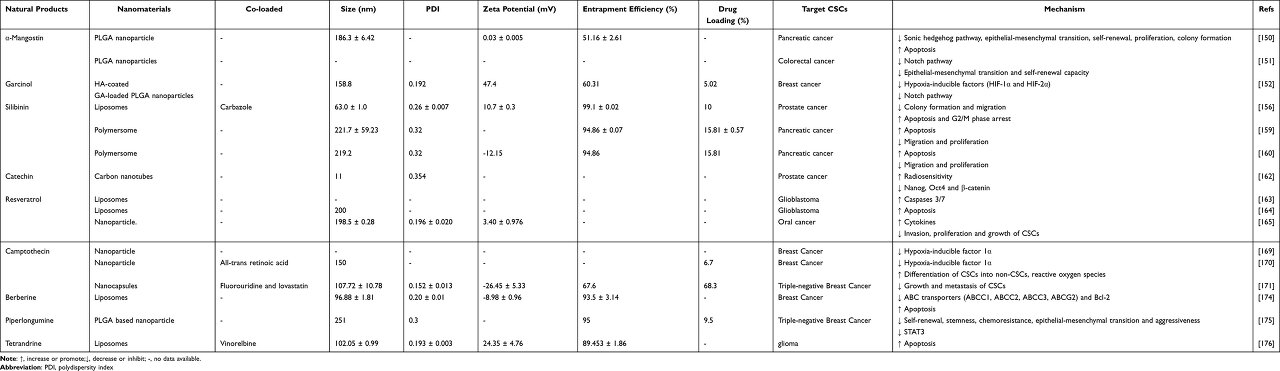
알칼로이드
최근에는 camptothecin, berberine, piperlongumine 및 tetrandrine과 같은 알칼로이드가 여러 유형의 암에 좋은 치료 효과를 나타내는 것으로 밝혀졌습니다.( 표 4 ).
캄프토테신과 항혈관신생 약물 및 분화 유도제의 조합은 CSC 유래 종양 이질성에 대한 효과적인 치료 전략입니다.
저산소증의 유도 및 수반되는 HIF-1a의 상향 조절은 종양 혈관신생, 침습, 전이, 항혈관신생 약물에 대한 내성 및 CSC의 자가 재생을 자극하고, 알칼로이드 캄토테신은 HIF-1a 활성의 강력한 억제제입니다.
Shen et al은 ATRA와 camptothecin의 결합 전달을 위해 나노 입자를 준비했습니다.
나노 입자는 두 약물을 차등적으로 방출하여 시너지 효과를 극대화하고 CSC와 벌크 종양 세포를 모두 제거합니다.
또한, Zhang 등은 상승적인 항암 및 항전이 가능성을 보여주는 종양 부위에 동시 약물 전달을 위해 lovastatin-camptothecin-fluorouridine 접합체가 탑재된 나노캡슐을 설계하기 위해 스타틴과 화학요법제를 혁신적으로 결합했습니다.
기존의 화학 요법 약물은 암 세포를 파괴하는 동안 CSC를 풍부하게 하고 약물 내성을 생성하여 암 재발 및 전이로 이어집니다.
세포막 ATP 결합 카세트(ABC) 수송체 단백질 및 미토콘드리아 세포자멸사 관련 단백질의 과발현은 CSC에서 약물 내성의 주요 원인입니다.
Berberine 리포솜은 CSC의 막을 가로질러 ABC 수송 단백질(ABCC1, ABCC2, ABCC3, ABCG2)의 발현을 하향 조절하고 미토콘드리아에 선택적으로 축적될 수 있으며, 이는 차례로 급성 세포독성 손상 및 아폽토시스 유도로 인해 CSC의 죽음을 유도합니다.
PLGA 기반 piperlongumine 나노입자(PL-NP)는 유사하게 미토콘드리아 경로를 통해 CSC에서 세포자멸사를 유도하고 STAT3를 하향 조절함으로써 CSC의 자가 재생, 줄기성, 내화학성, EMT 및 침습성을 억제했습니다.
비노렐빈과 테트란드린 리포솜의 다기능 표적화는 BBB를 가로질러 약물 표적화를 향상시켜 뇌종양 부위에 응집하고, CSC를 침투 및 파괴하고, 관련 세포사멸 단백질을 활성화함으로써 CSC에서 세포자멸사를 유도합니다.
이러한 결과는 CSCs apoptosis의 표적 조절이 화학 요법 약물 내성을 개선하고 암 재발 및 전이의 결과적인 위험을 감소시킬 수 있음을 시사합니다.
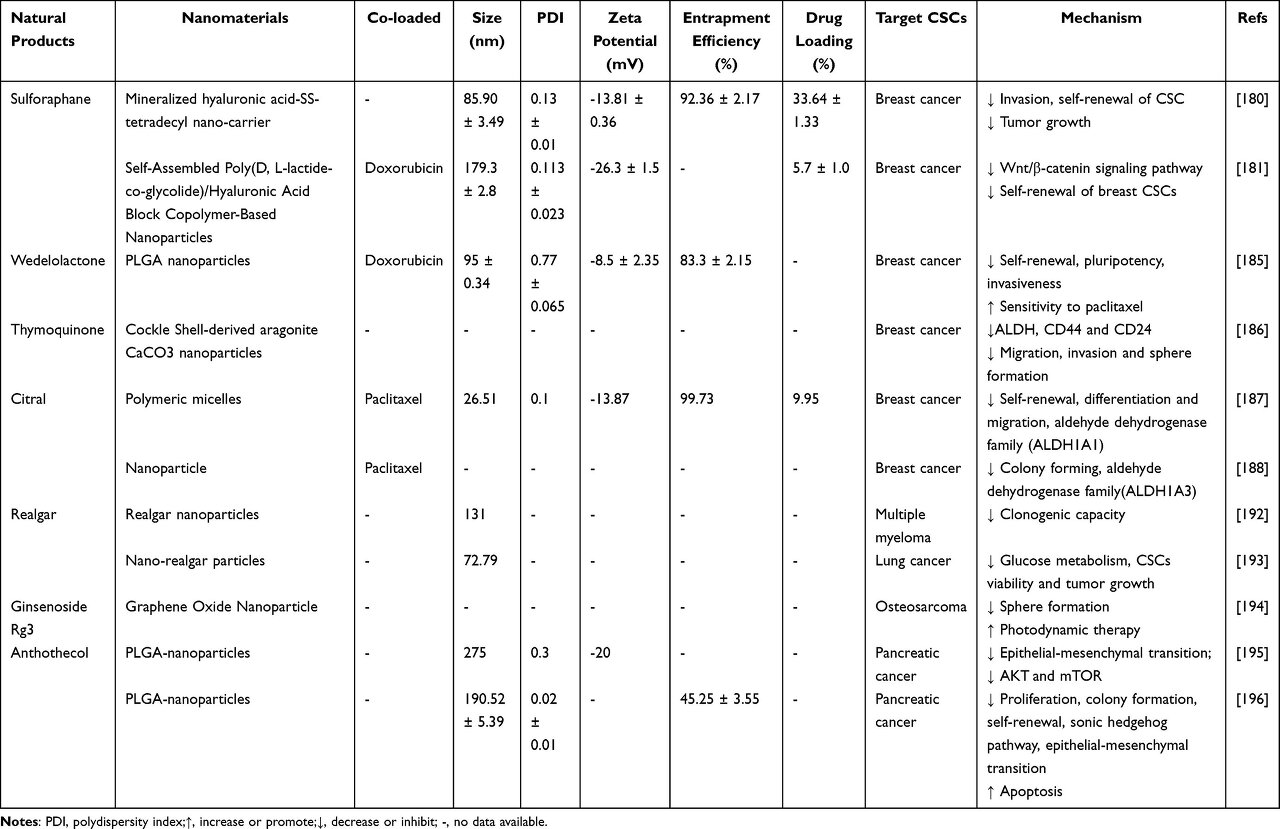
기타 NP
천연 이소티오시아네이트인 설포라판(SFN)은 자가 재생 신호(Wnt/b-catenin, Hedgehog 및 Notch 신호) 차단, 세포 사멸 및 자가 포식 경로 활성화 및 변경 miRNA(miR-140, 21 및 29)와 같은 다양한 메커니즘을 통해 CSC 및 CSC 유사 특성을 억제할 수 있습니다.
그러나, SFN은 소수성이 높고 빛과 산소에 대한 안정성이 좋지 않아 그 효능과 폭넓은 적용이 제한된다.
Gu et al은 고도로 환원되고 약산성인 종양 미세 환경에 반응하는 광물화된 히알루론산-SS-테트라데실 나노운반체를 개발했으며, HA를 통해 SFN 및 표적 CD44+ 유방 CSC를 신속하게 전달할 수 있어 CSC와 유사한 특성을 억제하는 SFN의 효능을 향상시키고 상당히 CSC 침습, 자가 재생 및 종양 성장을 억제합니다.
마찬가지로, Wnt/β-카테닌 신호전달 경로를 표적으로 함으로써 SFN이 로딩된 나노입자는 유방 암 줄기세포의 자가 재생을 유의하게 억제하고 화학 요법 감수성을 개선했으며, 독소루비신과의 조합은 유방암 암세포와 암 줄기세포를 모두 제거하여 효과적으로 박멸할 수 있습니다.
ALDH는 독성 알데히드를 정상 및 암 줄기 세포의 자가 재생을 유지하는 데 필수적인 무독성 카르복실산으로의 전환을 촉매함으로써 세포 내 환경 항상성을 유지합니다.
ALDH1A 계열의 구성원(ALDH1A1, ALDH1A3)은 암 발병, 전이 및 약물 내성과 밀접하게 관련되어 있으므로 CSC와 관련된 ALDH1A를 표적으로 하는 것은 효과적인 보조 암 요법일 수 있습니다.
천연 coumestan wedelolactone-encapsulated PLGA 나노입자는 약물 내성 유전자 SOX2 및 ABCG2의 발현을 하향 조절함으로써 CSC에서 약물 보유 및 지속 방출을 향상시켜 ALDH1A1에서 자가 재생, 다능성, 침습성을 상당히 감소시키고 PTX에 대한 유방 CSC(유방 CSC에 내성이 있는 것으로 알려져 있음)민감성을 증가시켰습니다.
CaCO3 나노입자는 ALDH 활성을 억제하여 유방 CSC를 유의하게 제거하기 위해 티모퀴논과 독소루비신을 암호화합니다.
또한, 레몬그라스 오일에서 추출한 citral은 ALDH1A1 및 ALDH1A3의 천연 억제제이며, 나노 전달 시스템은 시트랄의 안정성을 향상시키고 ALDH1A1 및 ALDH1A3 활성을 특이적으로 억제하는 능력을 유지하여 CSC의 자가 재생, 집락 형성, 약물 저항성, 전이 가능성이 있으며 PTX와의 조합은 강력한 시너지 효과를 나타냅니다.
Realgar는 3000년 이상 중국에서 사용된 광물이며 주 활성 성분은 tetraarsenic tetrasulfide(As 4 S 4 )입니다.
최근 많은 연구에서 As 4 S 4 가 백혈병 세포주 및 폐암 세포주와 같은 다양한 세포주에서 세포자멸사를 유도할 수 있음을 보여주었습니다.
anththecol, nimbolide 및 ginsenoside Rg3와 같은 트리테르페노이드를 전달하는 나노물질은 유사하게 CSC를 표적화하는 탁월한 능력을 보여주었습니다.
ginsenoside Rg3가 로딩된 나노입자 산화그래핀의 사용은 골육종의 악성 진행을 유의하게 억제하고, CSC의 구형 형성을 억제하고, 광역동 요법의 효과를 향상시켰다..
Anthothecol 코팅된 PLGA 나노입자(Antho-NPs)는 췌장 CSC의 증식, 콜로니 형성 및 세포자멸사 유도를 억제하고 소닉 헤지호그 경로와 세포 생존 및 세포 주기를 조절하는 유전자를 표적으로 하여 CSC의 자가 재생 능력을 억제했습니다. ( 표 5 ).
표 5 다른 천연 제품과 NP 기반 나노제형의 특성
결론 및 미래 전망
엄청난 건강상의 이점에도 불구하고 낮은 수용성, 낮은 흡수율, 낮은 생체 이용률 및 비특이적 표적화로 인해 임상 사용이 심각하게 제한됩니다.
나노운반체는 우수한 저장 안정성, 조직 투과성 및 생체 적합성으로 인해 생체 이용률을 개선하고 생체 내 약물 순환 시간을 연장하며 약물 효능을 향상시키기 위해 천연 기원의 생물학적 활성 화합물의 전달을 목표로 합니다.
또한 비 CSC는 자발적이고 무작위로 CSC로 변환될 수 있습니다.
따라서, 암 세포와 CSC를 동시에 제거하기 위해 기존의 화학 요법과 항종양 줄기 세포 제제의 조합을 사용하여 더 나은 치료 결과를 얻을 수 있습니다. .
두 개의 개별 나노제형을 사용하면 다른 용량과 시간으로 약물을 투여할 수 있는 유연성이 있지만 종양 부위에서 약물의 상승적 비율을 유지하기 위해 약물 동력학 및 생체 분포의 동기화를 달성하기가 어렵습니다.
대조적으로, NP(CSCs를 죽이는)와 기존의 화학요법제(암 세포를 죽이는)를 함께 로드하는 약물 전달 시스템은 상승적인 비율로 이들을 종양 부위에 동시에 전달할 수 있어 시간과 공간에서 종양 치료를 동기화하고 서로 다른 암세포를 제거할 수 있습니다. .
그러나 동일한 나노전달 시스템에서 약물마다 약물의 특성에 따라 방출 속도가 다르기 때문에 시너지 효과를 내는 약물 비율을 유지하는 것은 쉽지 않으며, 이는 나노전달 시스템 설계에 새로운 과제이기도 합니다.
**************************************************************************************
2022
https://www.frontiersin.org/articles/10.3389/fonc.2022.867655/full
Nano-Drug Delivery Systems Entrapping Natural Bioactive Compounds for Cancer: Recent Progress and Future Challenges
Cancer is a prominent cause of mortality globally, and it becomes fatal and incurable if it is delayed in diagnosis. Chemotherapy is a type of treatment that is used to eliminate, diminish, or restrict tumor progression. Chemotherapeutic medicines are avai
www.frontiersin.org
Nano-Drug Delivery Systems Entrapping Natural Bioactive Compounds for Cancer: Recent Progress and Future Challenges
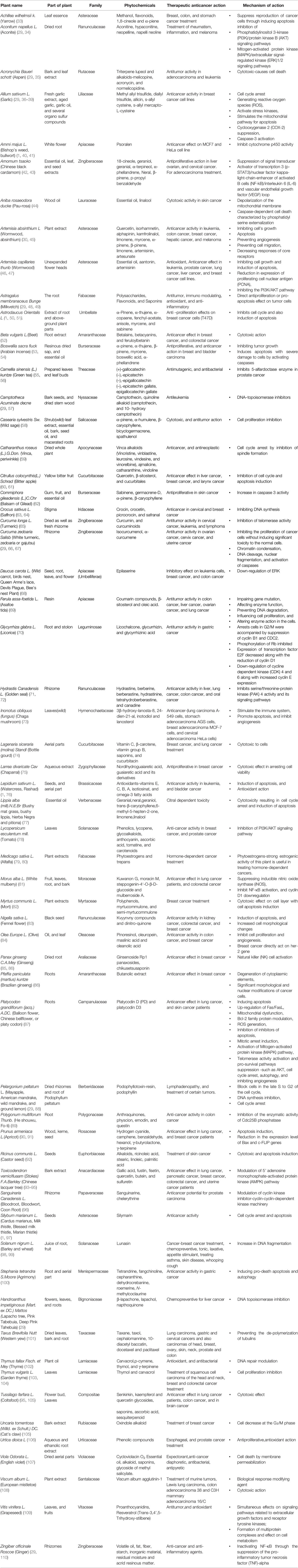
표 1 항암 특성을 가진 초본 식물.
한방항암화합물의 신약전달체계의 종류.
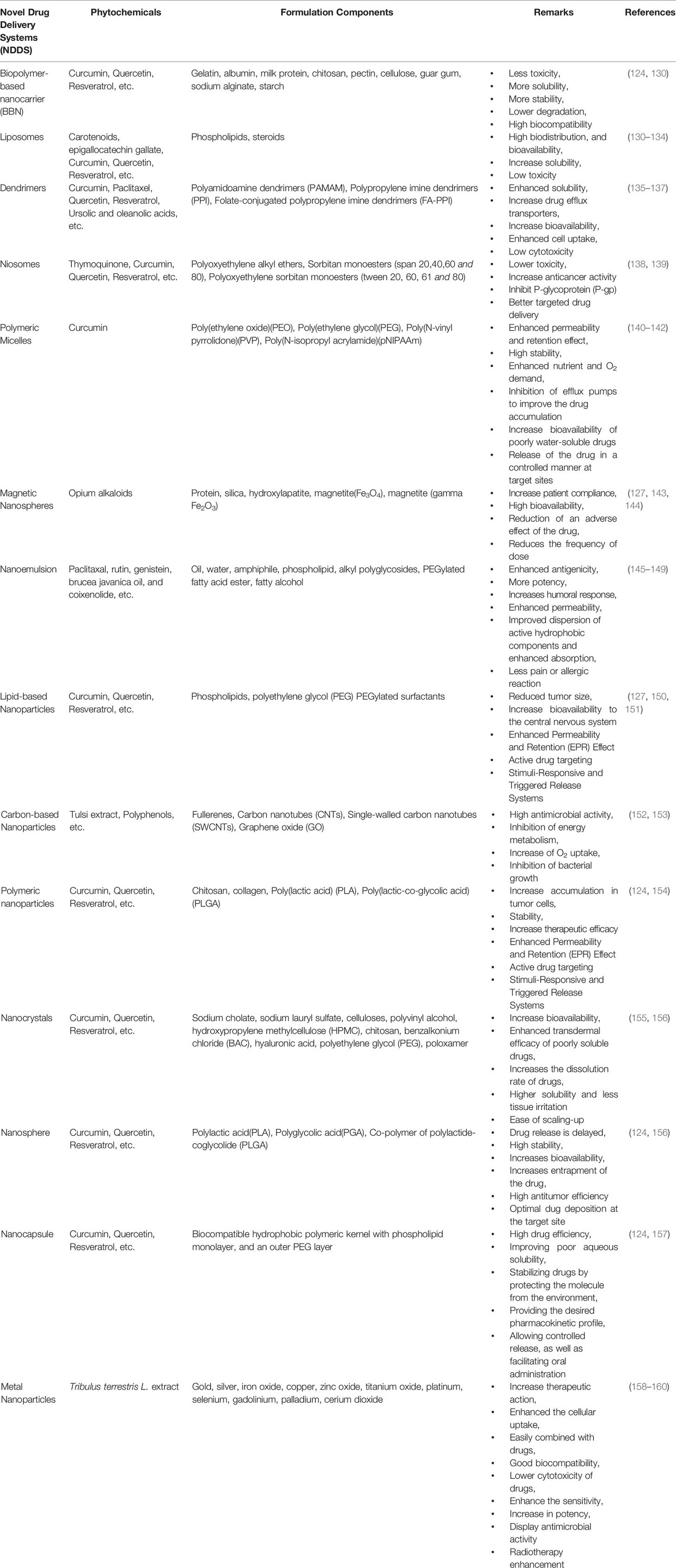
그림 2 항암 파이토케미컬의 효율적인 전달과 다양한 전달 메커니즘을 위한 다양한 나노기술 기반 운반체 플랫폼
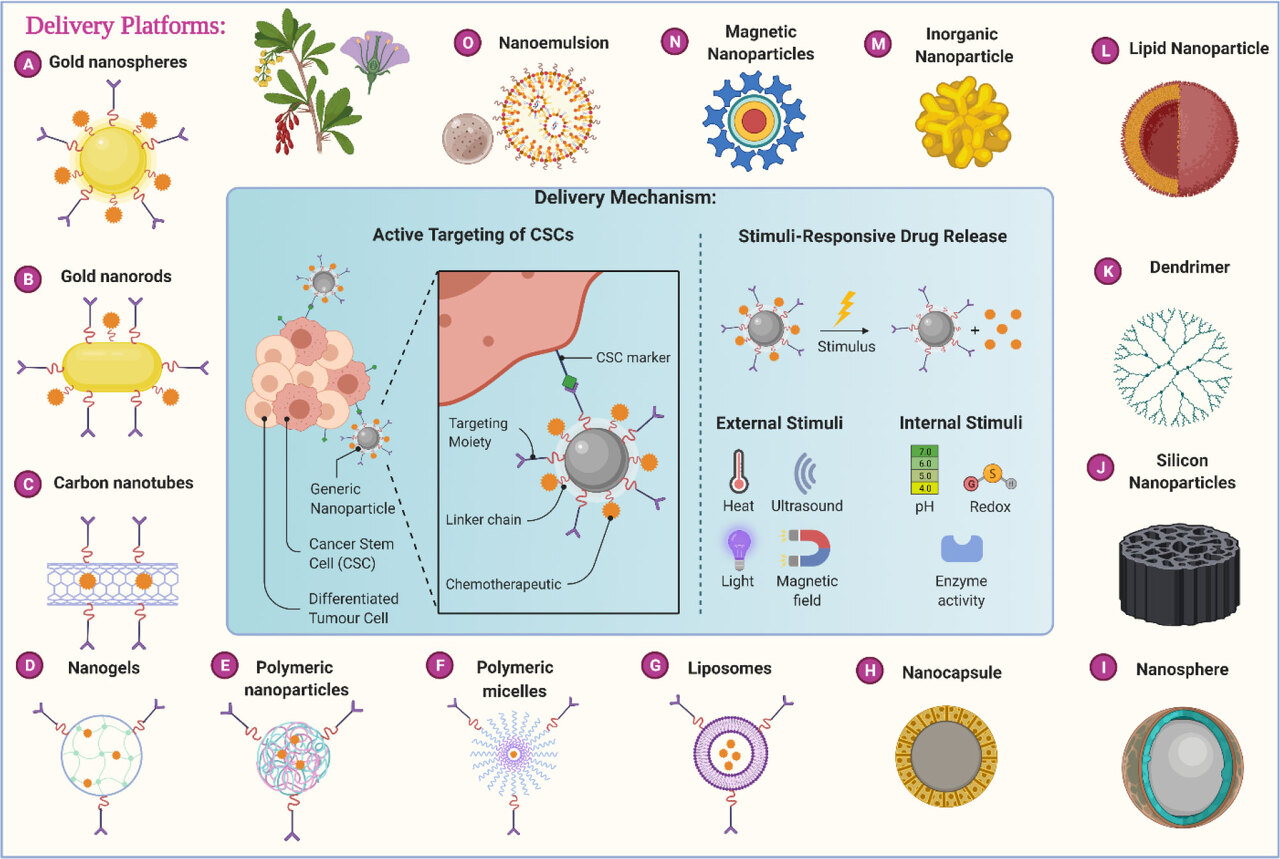
표 3 천연항암분자를 이용한 나노입자 제형 관련 최근 공개된 특허 요약
doxorubicin(DOX)과 curcumin 의 공동 전달 체계인 유방암에서 화학 내성을 극복하기 위해 약물을 사용
알부민 나노입자 를 통한 에토포사이드와 베르베린이 나노인 나노 접근법
********************************************************************************************
2015
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4592057/
Natural product-based nanomedicine: recent advances and issues
Natural products have been used in medicine for many years. Many top-selling pharmaceuticals are natural compounds or their derivatives. These plant- or microorganism-derived compounds have shown potential as therapeutic agents against cancer, microbial ..
www.ncbi.nlm.nih.gov
Natural product-based nanomedicine: recent advances and issues
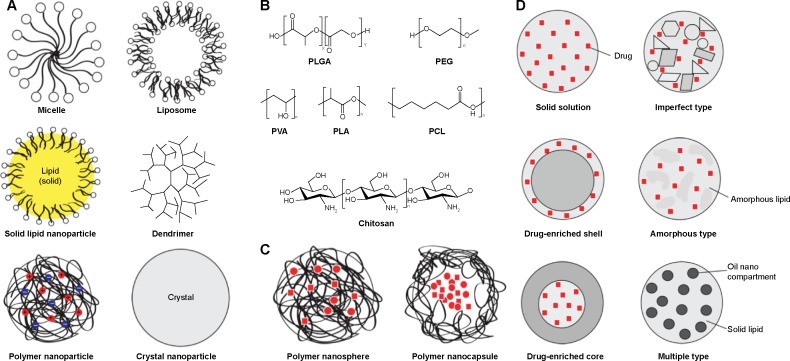
그림 1 나노 입자의 개략도.
(A) 나노 입자의 가장 일반적인 유형의 그래픽 표현.
폴리머의 전하는 일부 폴리머 나노 입자에 대해 빨간색과 파란색 원으로 표시됩니다.
(B) 고분자 나노입자에 사용되는 가장 일반적인 고분자 유형의 화학 구조.
(C) 두 가지 유형의 고분자 나노입자의 그래픽 표현.
포함된 약물은 빨간색으로 표시됩니다.
(D) 고체 지질 나노입자(왼쪽) 및 나노구조 담체 유형(오른쪽)의 약물 통합 모델.


*******************************************************************************************************************
'약물' 카테고리의 다른 글
| 암에 대한 비타민 C 경구복용 테스트 (0) | 2022.10.16 |
|---|---|
| 식이 폴리페놀 및 이들의 생물의약품 분류 시스템 (0) | 2022.10.10 |
| 암 치료에서 전통 약초 사용과 관련된 잠재적 위험: 중동 (0) | 2022.10.10 |
| 천연화합물과 화학요법제의 시너지 효과 (0) | 2022.10.10 |
| 암 치료를 위한 천연물: 지난 10년 동안의 작용 및 독성 메커니즘에 대한 검토 (0) | 2022.10.10 |